Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.24 n.3 Lima sep./dic. 2007
ARTICULOS DE REVISIÓN
Actualización para el médico no especialista en el tratamiento del VIH
Update for the General Physician in the treatment of the HIV
José Castro Danós1, Raúl Gutiérrez Rrodríguez2, Juan Villena Vizcarra3,4
1. Assistant Profesor of Clinical Medicine, Division of Infectious Diseases, Millar School of Medicine, University of Miami, Miami, Florida, United States
2. Médico Infectólogo Tropicalista. Profesor invitado Univiersidad Peruana Cayetano Heredia
3. Profesor Asociado Universidad Nacional Mayor de San Marcos
4. Médico Internista-Infectólogo Hospital Guillermo Almenara Essalud
RESUMEN
Despues de dos décadas de disponibilidad de medicamentos antiretrovirales el pronóstico de los pacientes infectados con el virus de la immunodeficiencias
adquirida (VIH) ha cambiado dramáticamente. El curso de esta infección ha pasado de ser una infección casi indefectiblemente fatal a una infección crónica con una esperanza de vida potencial casi normal. Eso se ha traducido en dramáticas reducciones en la tasas de mortalidad en países donde existe amplia disponibilidad a estos medicamentos. Con tasas de incidencias relativamente estables o en aumento y disminución de la mortalidad, la prevalenica de esta infección continua aumentando. Eso hace cada vez más probable que el médico no especialista encuentre en su práctica pacientes infectados con VIH. Es por eso que esta revisión esta dirijida principalmente al médico no especialista y tiene como objetivo su actualización dada la creciente complejidad del tratamiento de esta infección. Esta es una revisión superficial pero amplia del estado actual del tratamiento de la infección por el VIH, e incluye los esquemas principales, alternativos y una descripción de las dos nuevas clases de medicamentos recientemente disponibles.
Palabras claves: VIH, Terapia Antiretroviral
ABSTRACT
After two decades of availability of antiretroviral therapy, the prognosis of HIV-infected patients has changed dramatically. The curse of this infection has changed from a rapidly fatal infection to a more manageable, chronic infection with an almost normal life span. This has led to a dramatic reduction in the mortality rate related to HIV in countries where antiretroviral therapy is widely available. With incidence rates stable or increasing and lower mortality, the prevalence of this infection is increasing. This fact increases the chances of non-specialist physicians to encounter HIV infected patients in their practice. That is why this revision is directed to the non-specialist physician and its objective is to update their knowledge in the complex area of the management of HIV therapy. This is a broad but superficial revision of the current status of the management of HIV infection therapy, and includes the use of first line and alternative options of therapy as well as the description of two newly approved classes of antiretrovirals.
Key words: HIV, antiretroviral therapy,
1. ORÍGENES DEL VIH
El origen del VIH ha sido polémico y de interés desde que esta enfermedad fue identificada a principios de los años 80. Lo que se sabe es el VIH es un virus que pertenece a la familia lentivirus. Este tipo de virus se caracteriza por invadir el sistema inmune. El daño al sistema inmune se manifiesta mediante la destrucción de las células CD4 o células T y que a largo plazo se manifiesta por la susceptibilidad a enfermedades oportunistas. El grupo Lentivirus pertenece a un grupo más grande, el retrovirus. Estos virus se encuentran en diversos animales, tales como gatos, ovejas, caballos y ganado. Sin embargo, el lentivirus más interesante en términos de la investigación sobre los orígenes del VIH es el virus de la inmunodeficiencia de los Simios (SIV).
El VIH es un descendiente del SIV porque ciertos tipos de SIV son similares al VIH. En particular, en 1999 un grupo de cientificos descubrió que ciertos chimpancés tenían un tipo de SIV, en este caso llamado SIV-cpz que es casi idéntico genéticamente al VIH.
Cómo este virus saltó de una especie a otra, de los chimpancés a los seres humanos, no está claro, todavía. Sin embargo, es bien sabido que ciertos virus pueden pasar de una especie a otra. (un ejemplo común, actual es el virus de la influenza o gripe). Cuándo ocurrió este salto no está claro. Pero si está documentado que ya había casos de VIH/SIDA varias décadas antes de que la epidemia empezara. Por ejemplo hay un caso probado de infección con VIH en un hombre que vivió en lo que actualmente es la República Democrática de Congo en 1959. Hay cierta evidencia que apoya la hipótesis que estima que el primer caso de VIH sucedió en África occidental alrededor de 1930.
2. PERSPECTIVA
Los primeros años de la epidemia del VIH fueron caracterizados, entre otras cosas, por altos índices mortalidad. El primer avance, y que por varios años fue la única opción para mantener y prolongar la vida, era la prevención y el tratamiento de infecciones oportunistas. En 1987 hubo gran entusiasmo1 ya que por primera vez se emplearon tratamientos dirigidos específicamente contra el VIH. Fue durante estos años, entre 1987 y 1990, que la era antiretroviral comenzó. El primer tratamiento disponible contra el VIH fue la monoterapia con zidovudina o AZT.
A mediados de la década de los noventas y gracias a grandes estudios, fue demostrado que la terapia doble (con dos nucleósidos a la vez) era superior a la monoterapia secuencial (uno después del otro). La combinación de los medicamentos AZT+ lamivudina o 3TC fue muy usada debido a su efectividad, tolerancia y conveniencia. Fue también alrededor de ese tiempo que una nueva clase de antiretrovirales, en este caso llamada los inhibidores de proteasa (IP) era evaluada en varios estudios de investigación2,3. Entre diciembre de 1995 y marzo de 1996, tres IPs fueron aprobados (indinavir, saquinavir, ritonavir).
Poco después, quedaba claro que el uso combinado de tres drogas era necesario para alcanzar los mejores resultados; así la era HAART o terapia antiretroviral altamente activa o de gran actividad (TARGA) había nacido. La denominación TARGA se usaría desde entonces para describir un régimen de terapia contra el VIH compuesta por tres medicinas.
A mediados de 1996, la primera medicina de otra nueva clase (ITRNN) era aprobada, en este caso nevirapina. (ITRNNR viene de las siglas : inhibidor de la transcriptasa reversa del tipo no-nucleosido)
Unos años después, el miedo al VIH y la opinión de que esta infección era una sentencia de muerte ineludible era substituido por la percepción de que el curso de la enfermedad producida por el VIH podía ser alterado por estas nuevas medicinas (HAART) y convertirla en una enfermedad crónica con nuevos desafíos: efectos secundarios de las medicinas a largo plazo y el desarrollo de resistencia a las drogas antiretrovirales.
Posteriormente, las nuevas medicinas se han desarrollado teniendo en cuenta no solamente la potencia pero también los tipos y frecuencia de efectos secundarios y conveniencia. Inicialmente, cuando AZT fue investigada y utilizada para el tratamiento del VIH era administrada en forma de infusión intravenosa cada 6 horas. Al principio de la era de HAART, en 1995, los inhibidores de proteasa tenían que ser tomados cada 8 horas o 3 veces al día. Actualmente estos potentes medicamentos contra el VIH se pueden tomar una vez al día o cada 12 horas. Y estas drogas nuevas son más seguras, más tolerables, y tienen menos efectos secundarios.
Las actuales investigaciones están dirigidas a desarrollar medicamentos con mínimos efectos secundarios, administración más conveniente y el desarrollo de drogas con diferentes mecanismos de acción.
3. TRATAMIENTO CONTRA LA INFECCIÓN CAUSADA POR LA INFECCION DEL VIH Y ANTIRETROVIRALES
Actualmente, la infección por VIH puede ser vista como una infección crónica con una esperanza de vida casi normal, diferente de como era hace 20 años, cuando la infección para el VIH fue considerada como infección rápidamente fatal. La diferencia entre estos dos pronósticos tan diversos de una misma infección de un mismo virus la ha hecho la disponibilidad de tratamiento eficaz. Históricamente, este cambio sucedió en un tiempo relativamente corto y se ha asociado al creciente número de medicaciones y de clases de medicaciones disponibles. El desarrollo del tratamiento antiretroviral ha sido uno de los progresos más espectaculares de la Historia de la Medicina.
La meta del tratamiento es mantener la salud y prolongar la vida. En la sección siguiente hay información sobre las medicinas disponibles que se usan para formar regímenes efectivos contra el VIH. Posteriormente pasamos a discutir cuándo y con cuáles medicamentos comenzar el tratamiento y también se presenta una guía de los parámetros a tener en cuenta cuando se combinan
los medicamentos para la formación de los regímenes específicos. Sin embargo se debe de tener bastante claro que la selección de los medicamentos específicos que se van a usar en cada régimen se debe hacer teniendo en cuenta las características individuales de cada paciente y para ello, esta determinación se debe de hacer luego de una discusión amplia con el paciente. Consideraciones importantes adicionales incluyen la potencia, la tolerabilidad y la conveniencia del régimen.
3.1 Medicamentos Antiretrovirales
El objetivo de la terapia es reducir la carga viral del VIH a niveles imperceptibles (o indetectables) en la prueba de carga viral y mantener esta supresión a largo plazo. El mantenimiento de la carga viral indetectable por largo tiempo ha demostrado que da lugar a: restauración y a la preservación de la función inmunológica, también llamada reconstitución inmunológica, la mejora de la calidad de la vida, y la reducción de enfermedades oportunistas y/o muerte relacionados a la enfermedad por VIH.
El régimen estándar del tratamiento del VIH es una combinación de 3 medicamentos que consiste en un inhibidor de proteasa (PI) junto con 2 nucleósidos o un inhibidor no-nucleósido de la transcriptasa reversa (NNRTI) más 2 nucleósidos.
A los nucleósidos a menudo se les dice nukes en forma abreviada. El inhibidor de la proteasa (IP) es acompañado generalmente por una dosis baja de ritonavir (otro IP) para elevar (boost en inglés) sus niveles sanguíneos, lo que hace que el primer inhibidor de proteasa sea mucho más eficaz para suprimir la carga viral del VIH.
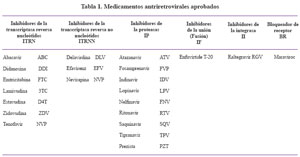
3.1.1. Medicamentos actualmente aprobados en los Estados Unidos (Ver Tabla 1):
Hay 6 clases de medicamentos antiretrovirales:
a. Inhibidores de transcriptasa reversa análogos de ....nucleósidos y nucleótidos (ITRNs)
b. Inhibidores de la transcriptasa reversa no ....nucleósidos (ITRNNs)
c. Inhibidores de Proteasa (IPs)
d. Inhibidores de la integrasa
e. Bloqueadores de coreceptores
f. Inhibidores de la entrada viral
Nucleósidos y nucleótidos análogos o Nukes
*Generalidades
En general, los nukes como clase son fáciles de tomar y la administración de una dosis una vez al día es suficiente para la mayoría de ellos. La tolerabilidad en general es buena. Algunos ocasionalmente pueden producir efectos secundarios gastrointestinales, sobre todo cuando se empiezan a tomar por primera vez (náusea, vómitos, diarrea), pero esto generalmente pasa rápidamente.láctica, Estas medicaciones ocasionalmente pueden también causar efectos secundarios a largo plazo.
El ejemplo de estos efectos secundarios a largo plazo incluye: toxicidad de la medula ósea, toxicidad mitocondrial, acidosis láctica, neuropatía, pancreatitis, y algunos tipos de lipodistrofia4-7
*Mecanismo de Acción
Estos medicamentos son estructuralmente bastante similares a los nucleósidos y nucleótidos naturales. En el proceso de reproducción viral estos NRTIs son incorporados temporalmente en el material genético del VIH que esta en proceso de reproducción y cuando esto sucede, se interrumpe la reproducción del VIH. La manera específica en que lo hacen es mediante la inhibición de la enzima viral llamada transcriptasa reversa. Esta enzima es vital para la reproducción y cuando se interrumpe su función, la reproducción viral se detiene.
Combinaciones de nucleósidos y nucleótidos
Los medicamentos nombrados a continuación son combinaciones de dos nucleósidos en una pastilla. Ese tipo de combinación es la forma más recomendable al empezar terapia antiretroviral cuando se inician estos medicamento por primera vez o de primera línea. Cuando por alguna razón esas combinaciones no se pueden usar, una alternativa es el uso de 3 nukes en una pastilla tomada dos veces un día llamado Trizivir®, que contiene AZT + 3TC + abacavir.
Epzicom®: Abacavir (600mg) + 3TC (300mg) en una tableta al día
Truvada®: Tenofovir (300mg) + FTC (200mg) en una tableta al día.
Combivir®: AZT (300mg) + 3TC (150mg) en una tableta dos veces al día.
Otra opción conveniente de tratamiento de primera línea que fue aprobada en Junio de 2006 es Atripla®, que contiene 3 medicamentos en una tableta : Efavirenz 600 mg (ITRNN) + Tenofovir 300 mg + FTC 200 mg (2 nukes).
Abacavir (Ziagen®)
Es uno de los ITRNs más potentes. Los estudios iniciales mostraron que esta medicina puede bajar la carga viral 1.4 logs en 4 semanas (potente para un nuke). Otras características importantes son: su buena penetración al sistema nervioso central al igual que su larga vida intracelular que permite su dosificación una vez al día (600 mg una vez al día). También se asocia menos frecuentemente a lipoatrofia que otros miembros de esta clase. Varios estudios han mostrado que pacientes que tenían pérdida de grasa mientras tomaban otros nukes vieron mejoría después de cambiarse con abacavir.
Por otro lado, es importante de mencionar que este medicamento puede causar un tipo de alergia llamado síndrome de hipersensibilidad que se puede presentar de 4 a 6% de los pacientes y cuando se presenta es casi exclusivamente en las primeras 6 semanas. Si este síndrome se presenta, el medicamento debe de ser suspendido rápidamente y de ninguna manera debe ser readministrado en el futuro porque podría tener consecuencias fatales.
Este medicamento esta disponible individualmente, o co-formulado con AZT + 3TC (trizivir®), o con 3TC (epzicom)10.
AZT (Zidovudina, Retrovir®)
Fue el primer antiretroviral aprobado para el tratamiento del VIH en 1987. Su eficacia ha sido demostrada en muchos estudios. Inicialmente se prescribía cada 4 a 6 horas, pero estudios posteriores demostraron que su vida media intracelular permitía su dosificación cada 12 horas.
Actualmente se prescribe 300 mg cada 12 horas sola, o como parte de Combivir® (junto a 3TC) o como Trizivir®
(junto con Abacavir y 3TC) en la misma tableta, como se menciona arriba.
Es importante recordar que AZT puede afectar la médula ósea, y producir anemia que ocurre en un pequeño porcentaje de pacientes. La anemia severa causada por este medicamento era más frecuente anteriormente cuando se usaban dosis más altas de AZT.
Los problemas gastrointestinales pueden ser importantes al inicio de su uso (náusea y vómito) y usualmente son pasajeros. Con las dosis altas usadas anteriormente se veían casos de toxicidad muscular. 1,9
ddC (Zalcitabina, Hivid®)
Fue el tercer ITRN en ser aprobado, en 1992. Su uso es muy limitado principalmente debido a su toxicidad (neuropatía periférica), resistencia cruzada con otros ITRNs y su dosificación 3 veces al día. La producción de este fármaco está siendo descontinuada y, en algunos países ya no se encuentra disponible.
ddI (Didanosina, Videx®)
Es una medicina potente. Uno de los problemas más importantes con este medicamento estuvo relacionado a su tolerabilidad (tamaño de la pastilla, sabor). En el año 2000 se introdujeron las tabletas resistentes al ácido, lo cual ha mejorado mucho su tolerabilidad. Los principales efectos colaterales están relacionados a efectos gastrointestinales (pancreatitis, hasta en 10%) y neuropatía periférica. Es también importante mencionar que los efectos colaterales pueden ser más frecuentes si se combina ddI con las siguientes medicaciones: d4T, hidroxiurea (no recomendado, actualmente) o Tenofovir. Entre las ventajas principales esta su dosificación una vez al día (debido a su larga vida intracelular), y su perfil de resistencia.
d4T (Estavudina, Zerit®)
La Estavudina es un nuke potente con un buen perfil de resistencia. En general la tolerancia inicial es mejor que la de AZT. Después de ser uno le los ITRNs más prescritos, su uso ha disminuido considerablemente debido a problemas relacionados a la toxicidad a largo plazo (lipodistrofia, neuropatía) y a la disponibilidad de ITRNs con efectos virológicos más favorables, mejor tolerabilidad y menos efectos colaterales. Lipoatrofia ocurre más frecuentemente con d4T que con la mayoría de los otros ITRNs. Se dosifica de acuerdo al peso y varía de 20 a 30 y 40 mg dos veces al día. La versión de larga duración (una vez al día) estuvo disponible temporalmente pero no comercialmente.
FTC (Emtricitabina, Emtriva®)
Químicamente es muy similar a otro INTR (Lamivudina). Se dosifica a 200 mg una vez al día (una tableta de 200 mg) y es bien tolerada.
Tiene una vida intracelular larga y también es destacable que esta droga tiene, además de su efecto anti-VIH, un efecto sobre el virus de la hepatitis B.
Este medicamento está disponible solo (para usarse dentro de los 3 medicamentos de algún régimen), o en combinación con Tenofovir (que es un nucleótido) dentro de la asociación conocida como Truvada ® (una tableta que tiene dos nukes: tenofovir + FTC que se administra una vez al día) o como Atripla ® (una tableta que se toma una vez al día que contiene 3 medicamentos: Efavirenz 600 mg (ITRNN) + Tenofovir 300 mg + FTC 200 mg). El efecto adverso más conocido de FTC, aunque poco frecuente, es la coloración oscura de las palmas de las manos.
3TC (Lamivudine, Epivir®)
Es un ITRN muy bien tolerado que tiene una vida larga dentro de las células al punto que puede ser dosificado 150 mg dos veces al día ó 300 mg una vez al día. Similar a FTC, tiene también efectos sobre el virus de la hepatitis B. Como se mencionó anteriormente se usa individualmente (como parte de un régimen) o con AZT (Combivir®) o con AZT + Abacavir (Trizivir®). Finalmente, y similar a FTC, una mutación única en el virus es suficiente para que el virus adquiera resistencia a este medicamento.
Tenofovir (TDF, Viread®)
Uno de los más recientes ITRNs en ser aprobado, ha ganado mucha popularidad debido a su potencia antiretroviral, facilidad de administración (se administra una tableta de 300 mg una vez al día), y su perfil de seguridad bastante noble4. Lipodistrofia es menos común con este medicamento comparado con otros nukes. Su potencia es similar a Abacavir. Abacavir y Tenofovir son los nukes más potentes. Entre los efectos colaterales importantes a mencionar destaca su toxicidad renal potencial (especialmente si no se ajusta su dosificación a la función renal del paciente) y la posibilidad de interacciones con otros medicamentos (algunas inesperadas), como por ejemplo con ddI y con Atazanavir (un inhibidor de proteasa). Como se menciona antes, se puede dosificar solo, o como Truvada® (cuando se combina en la misma pastilla con FTC).
Cuando se utiliza como parte de la asociación de nukes TDF+FTC y se ha decidido utilizar como tercer agente al Atazanavir (como IP), la recomendación es utilizar siempre el Ritonavir para garantizar una buena concentración del primer IP durante los intervalos de tiempo entre una administración y otra. Para ello deberá considerarse 300 mg de Atazanavir + 100 mg de Ritonavir4.
Inhidores de la transcriptasa reversa no nucleosidos (ITRNNs)
La similitud de estos medicamentos con los ITRNs reside en que inhiben la misma enzima, la transcriptasa reversa (TR). La diferencia es que estos medicamentos no poseen similitud estructural a los nucleósidos naturales que los ITRNs poseen. Este grupo de medicamentos se une a la TR, y al unirse produce un cambio conformacional en la enzima lo que la vuelve inactiva.
Los tres ITRNNs actualmente disponibles (nevirapine, delaverdine y efavirenz) entraron al mercado entre 1996 y 1998.
A pesar que su popularidad nunca llegó a ser similar a la de los IPs, los regímenes compuestos por un ITRNN + 2 ITRNs son por lo menos similares, o posiblemente superiores a los regímenes compuestos por un agente IP + 2 ITRNs en pacientes naïves al tratamiento HAART. En el último año se han publicado 2 estudios (independientes) grandes5,6 que han demostrado superioridad virológica del efavirenz sobre inhibidores de proteasa potenciados (o boosted).
Esto es, debido, en parte, a que la dosificación es simple y en general son bastante bien tolerados.
Por otro lado, el mayor problema de estos medicamentos, es la característica de tener resistencia cruzada entre todos los medicamentos de esta misma clase.
La resistencia a estos medicamentos se puede desarrollar después de la aparición de una mutación individual, mientras que para el desarrollo de resistencia a los inhibidores de proteasa se requieren, en general, varias mutaciones.
Nevirapina (Viramune®)
Fue el primer NNRTI aprobado. El esquema Nevirapine + AZT + ddI es probablemente el régimen HAART más antiguo de todos. La efectividad de regímenes que contienen Nevirapine ha sido demostrada en numerosos estudios 7,8, incluyendo evidencia de superioridad sobre algunos IPs. Los principales efectos colaterales de este medicamento incluye la posible elevación de las enzimas hepáticas, que pude llegar a hepatitis, que en casos extremos puede ser mortal. Recientemente se ha demostrado que el sexo femenino y un CD4 alto (mayor de 250 células/mL en mujeres) son los principales factores de riesgo para el desarrollo de hepatitis, al igual que la infección concomitante por el virus de la hepatitis C. El riesgo es mayor en las primeras semanas de tratamiento (primeras 8) donde se recomienda vigilancia cercana y cuidadosa. El otro conocido efecto colateral es la erupcion dérmica (rash), que ocasionalmente puede ser severo, e inclusive algunos pacientes pueden llegar a desarrollar el síndrome de Steven-Johnson. Es importante recordar que Nevirapina es un poderoso inductor del metabolismo de ciertas moléculas, incluyendo ella misma. Esa es la razón por la cual Nevirapina se administra en el periodo inicial de una vez al dia por 2 semanas y luego la dosificación se incrementa a 2 veces al día (200 mg cada 12 horas). Finalmente es importante decir que esta medicina produce menor alteración en los lípidos que la mayoria de los IPs, o sea que no es tan probable que incremente los triglicéridos y el colesterol. 8
Efavirenz (Sustiva®, Stocrin®)
Ha sido el tercer ITRNN en ser aprobado, pero el primero en que pudo demostrarse que un ITRNN era por lo menos tan efectivo y probablemente mejor que los IPs (como parte de un régimen HAART) en pacientes naïves.
Desde el estudio 006 de la casa farmacéutica Dupont (en que se comparó con ventaja sobre Indinavir), ha habido varios estudios grandes9-11 en los que los regímenes basados en efavirenz han probado ser altamente potentes y efectivos.
Los efectos colaterales más comunes incluyen síntomas del sistema nervioso central como mareos, somnolencia y sueños anormales (e.g. pesadillas). Por eso es que se recomienda, en general, administrar la dosis en las noches, antes de dormir. Además es importante advertir a los pacientes de estos síntomas para que eviten ciertas actividades potencialmente peligrosas como manejo de automóviles o maquinaria.
En general estos síntomas desaparecen en la mayoría de los pacientes después de pocas semanas de iniciado el tratamiento. Efavirenz es también un inductor del metabolismo, pero a diferencia de Nevirapine, su dosificación no necesita ser modificada. Sin embargo si puede interaccionar con otros medicamentos.
También comparte la posibilidad de alteración de las pruebas de función hepática y desarrollo de erupcion dérmica (rash), aunque probablemente con menor frecuencia. Este medicamento también afecta los lípidos sanguíneos, y en general en mayor grado que nevirapine. Este medicamento está contraindicando en el embarazo.
Delavirdina (Rescriptor®)
Fue el segundo ITRNN en ser licenciado por la FDA en 1997. Debido al alto número de pastillas necesarias y de ser administradas 3 veces al día, este medicamento es mucho menos prescrito actualmente a pesar que es probablemente tan eficaz como los otros dos ITRNNs. La erupción dérmicas o rash, es probablemente más común que con los otros dos ITRNNs. Finalmente, delavirdine también interacciona con muchos medicamentos 12 por lo que posibles interacciones deben de tenerse en cuenta antes de prescribir este medicamento.
Inhibidores de Proteasa (PIs)
La proteasa es una proteína viral que literalmente corta al pro-virus en puntos específicos para formar las piezas necesarias para su posterior ensamblaje. Con estudios de estructura
molecular hechos a comienzos de los años noventa, fue posible diseñar medicamentos que podían alojarse en el sitio activo de la proteasa, que es donde se corta la molécula viral. Al estar ese lugar activo ocupado, la función no puede realizarse. Así, los inhibidores de proteasa, como su nombre lo dice, previenen a la proteasa en cumplir su función, por lo que los nuevos virus no pueden ser ensamblados.
Desde 1995, los IPs revolucionaron el tratamiento de la infección por el VIH, y la nueva era HAART empezó con 3 estudios que probaron la eficacia de Indinavir, Ritonavir y Saquinavir.
Después de su uso generalizado se observó que, además de los problemas gastrointestinales comunes (náusea, vómito y diarrea) y del alto número de pastillas por día que tenían la mayoría de los IPs originales, se presentaban alguno efectos colaterales a largo plazo como la dislipidemia y lipodistrofia. Este grupo de medicamentos también se caracteriza por las interacciones con otros medicamentos. El caso extremo es el de ritonavir que se caracteriza por su gran cantidad de interacciones con otros medicamentos, a tal punto que actualmente se usa casi exclusivamente en ese rol, en combinación con otros IPs para aumentar sus niveles sanguíneos y ser más efectivos. En realidad actualmente muchos IPs se prescriben con una dosis baja adicional de ritonavir (uso potenciado llamado boosted). Este uso de dosis bajas de Ritonavir concomitantemente con los IPs mejora la efectividad del régimen al elevar los niveles sanguíneos del inhibidor de proteasa, lo que a su vez hace que se eleve la potencia del medicamento y mejora la conveniencia de la administración. Antes del uso generalizado de dosis bajas de ritonavir con los IPs (boosting), los IPs tenían que ser tomados 2 ó 3 veces al día para mantener niveles sanguíneos adecuados para suprimir la replicación viral. Sin embargo al hacer boosting con las dosis bajas de ritonavir, los niveles sanguíneos del IP aumentan al punto que sólo es necesario el uso de los IPs una a dos veces al día y con un número menor de pastillas. 9,11,18
Amprenavir y Fosamprenavir (Agenerase® y Lexiva®)
Fosamprenavir es un medicamento potente contra el VIH. fosamprenavir es la prodroga de amprenavir. De estas dos medicinas, amprenavir se licenció inicialmente, pero debido al alto numero de pastillas por dosis (8 pastillas dos veces al día) y la pobre absorción intestinal fue retirada últimamente del mercado. Antes del retiro de amprenavir del mercado, fosamprenavir fue licenciada por su mejor solubilidad y absorción intestinal. Estas últimas características permiten el menor número de pastillas al día (2 pastillas 2 veces al día).
Los niveles sanguíneos de fosamprenavir pueden ser incrementados substancialmente con la coadministración de ritonavir. Eso permite el uso de, aún menor cantidad de pastillas y aún mayores niveles sanguíneos de droga activa.
Así, fosamprenavir, al coadministrarse con ritonavir puede ser dosificado de la siguiente manera: 1 cápsula de fosamprenavir (700 mg) + 1 cápsula de ritonavir (100 mg), ambas dos veces por día; alternativamente, las 4 pastillas (2 pastillas de fosamprenavir + 2 de ritonavir) pueden administrarse juntas una vez al día. Ventajas adicionales de fosamprenavir incluyen relativamente menor cantidad de interacción con otros medicamentos y la posibilidad de tomarlo, antes o después de las comidas. Además es más benigno con los lípidos que muchos otros IPs. Finalmente, no se recomienda la administración simultánea con lopinavir/ritonavir (kaletra®) porque tienen una interacción farmacológica desfavorable. 20
Atazanavir (Reyataz®)
Fue el primero de los IPs dosificados una vez al día13, en ser aprobados (2004). Atazanavir es un agente potente contra el VIH y es apreciado porque se le considera tolerable y fácil de tomar y se administra una vez al día. Las características más importantes son: alteración mínima de los lípidos sanguíneos, administración una vez al día, y con pocas pastillas (dos cápsulas juntas, una vez al día), mínimos efectos secundarios gastrointestinales y el hecho de que puede ser boosted con ritonavir cuando se necesitan altos niveles de Atazanavir, como es el caso de pacientes en los que sea probable que se encuentre virus resistentes o, como recientemente se ha recomendado en las guías internacionales, su uso potenciado con RTV, en pacientes naïves para HAART14,15. Aunque la FDA no ha aprobado el régimen boosted para pacientes naïve, comúnmente se lo usa. Estudios recientes han mostrado que al tomar Atazanavir con la dosis baja de Ritonavir, se previene en forma más eficaz la resistencia a los medicamentos, lo que resulta en una terapia efectiva más duradera. Atazanavir se administra en una dosis de 400 mg (2 cápsulas) una vez al día, y 300 mg (2 cápsulas) una vez al día cuando se usa boosted con 100 mg (1 cápsula) de Ritonavir también una vez al día. El efecto colateral más común es la elevación asintomática de la bilirrubina total con predominio de la fracción indirecta (no conjugada o no hidrosoluble). En ocasiones esta elevación de la bilirrubina puede llegar a ser tan alta que puede producir ictericia. En esos casos, y exclusivamente por un efecto cosmético más que por hepatotoxicidad, la recomendación es cambiar el medicamento. La elevación de la bilirrubina es reversible cuando se para el medicamento. Un estudio comparó atazanavir y kaletra® y mostró que estos medicamentos tienen potencia similar, excepto cuando hay más de 5 mutaciones en el virus, en esos casos, Kaletra ® ha demostrado tener una barrera genética mayor entre los fármacos de su clase.
Al respecto, una ventaja adicional de atazanavir es que cuando se administra en un paciente naïve a agentes antiretrovirales y desarrolla resistencia a este agente en el tiempo, dicha resistencia excluye únicamente al atazanavir y preserva a los demás agentes de la familia16 como posibles integrantes de un nuevo esquema basado en IPs.
Atazanavir tiene un número significante de interacciones con varias medicaciones17. Entre las más importantes están los inhibidores de la bomba de hidrogeno, bloqueadores del receptor H2 y los antiácidos (todos ellos de gran disponibilidad al público en general al tener venta libre o sin receta). Esto significa que un paciente no debería tomar esos medicamentos junto con Atazanavir. También son importantes las interacciones con tenofovir, rifampicina. Cuando Tenofovir está incluído en un un mismo régimen HAART con atazanavir, es importatnte usar Atazanavir boosted con ritonavir porque debido a la interacción entre tenofovir y atazanavir, los niveles de atazanavir en la sangre bajan.
Indinavir (Crixivan®)
Es uno de los IPs más antiguos y más estudiados. Su efectividad esta fuera de duda, sin embargo últimamente su uso ha declinado significativamente a favor de los nuevos IPs que ofrecen mayor efectividad, conveniencia y menos efectos colaterales. Uno de los principales problemas asociados con Indinavir ha sido la nefrolitiasis que podría afectar hasta 25% de los pacientes. Indinavir es usado 3 veces al día, pero se puede usar boosted con dosis bajas de ritonavir. Si se usara hoy, sería usualmente boosted con dosis bajas de ritonavir. Sin embargo si se usa con ritonavir la frecuencia de los efectos adversos aumenta18, en particular los metabólicos y la aparición de cálculos renales9
Lopinavir/ritonavir (Kaletra®)
Se trata de un IP potente19. Fue el primer IP licenciado que incluye una dosis baja de ritonavir en la misma cápsula. Fue aprobado hace unos 7 años, por lo que ha sido estudiado y ha estado en uso por un tiempo relativamente largo. Sigue siendo el único IP disponible que está co-formulado (en la misma tableta o cápsula) con la dosis baja de ritonavir. Esta pequeña dosis de ritonavir (33.3 mg por cápsula) aumenta los niveles de lopinavir más de 100 veces. Anteriormente, la dosificación usual era de 3 cápsulas dos veces al día (total of 800/200 al día), pero recientemente se ha aprobado el uso de la tableta (200 mg/50 mg), que no necesita refrigeración a diferencia de la cápsula y, con mayor cantidad de medicamento activo, permitiendo la dosificación de 2 tabletas dos veces al día. Entre las ventajas de este medicamento, dado sus altos niveles sanguíneos, le otorga una alta potencia para pacientes que recién empiezan terapia por primera vez y también para pacientes que tienen virus con resistencia a IPs. Por otro lado, además de los problemas gastrointestinales iniciales (náusea, diarrea y vómitos), la principal preocupación es la posibilidad de desarrollo de diferentes grados de dislipidemia y resistencia a la insulina (con consiguiente disturbios metabólicos) después de cierto tiempo20.
Nelfinavir (Viracept®)
Fue el cuarto IP que entró al mercado y por muchos años fue el IP más frecuentemente usado. Inicialmente se aprobó para ser dosificado 3 veces al día, pero posteriormente se demostró que 5 pastillas (250 mg) dos veces al día eran igualmente efectivas. Últimamente ha sido reformulado con una nueva pastilla de 625 mg que permite administrar 2 pastillas dos veces al día. Este es, sin embargo, uno de los pocos IPs que no puede ser boosted con ritonavir, por lo que no se usa tanto como antes. El efecto adverso más considerable es la diarrea, que en algunos casos puede ser severa, pero además de la diarrea la droga es bien tolerada. Otro aspecto favorable es su perfil de resistencia que permite el uso de otros IPs en caso de falla virológica a este IP (en general, ausencia de resistencia cruzada) y relativa seguridad de su uso dentro del embarazo.
Es importante señalar que en Setiembre del 2006 se publicó un aviso de alerta por la presencia de un componente en las cápsulas de nelfinavir que contenía una sustancia mutagénica y teratogénica (metasulfonato), motivo por el cual la industria fabricante retiró una gran cantidad de sus lotes de productos de varios países en todo el mundo11,19
Ritonavir (Norvir®)
Uno de los primeros IPs en aprobarse. Como se mencionó líneas arriba, actualmente no se usa como IP debido a su pobre tolerabilidad (en particular diarrea y parestesia periorales). Es por eso que actualmente su uso esta prácticamente restringido a elevar los niveles sanguíneos de otros IPs (potenciador o booster) para lo cual se usa una dosis pequeña o baby dose. Esa dosis que varía de 100 mg al dia a 200 mg 2 veces al día es generalmente bien tolerada. La base de esas interacciones está en que Ritonavir inhibe el metabolismo de otras drogas, incluyendo el de ella misma, lo que hace que los componentes activos de las drogas tengan niveles sanguíneos más altos y por más tiempo. Esto permite que otros IPs se puedan tomar una o dos veces al día y además se reduce significativamente el riesgo de desarrollo de resistencia a los medicamentos19,20
Saquinavir (Invirase®, Fortovase®)
Fue el primer IP en entrar al mercado en 1995 para el tratamiento de VIH y actualmente es el único presente en varias formulaciones. La forma original fue de cápsulas duras (Invitase®), pero debido a su pobre absorción (y por ende pobre efectividad) fue mejorada por la de cápsulas blandas (Fortovase ®) con mejor absorción intestinal (y así mejores niveles en la sangre). Esta última presentación ha sido descontinuada por la nueva presentación de cápsulas de Invirase 500 mg con lo que la cantidad de pastillas a tomar por día ha disminuído (2 cápsulas dos veces al día más ritonavir 100 mg). Un régimen de una vez al día está en estudio. Este medicamento es bien tolerado excepto por problemas gastrointestinales moderados y parece ser potente. Hay actualmente estudios que comparan las cápsulas de 500 mg más ritonavir a otros regímenes de tratamiento más conocidos28
Tipranavir (Aptivus®)
Es el penúltimo de los IPs aprobados en el mercado norteamericano. Dadas sus características químicas, es coadministrado con ritonavir (500 mg tipranavir + 200 mg ritonavir dos veces al día). Su principal característica es que mantiene potencia contra el VIH aún en presencia de virus con un alto número de mutaciones que confieren resistencia22. Esto significa que es efectivo para un porcentaje significante de pacientes con resistencia a otros IPs que se usaron anteriormente. Tipranavir se usa cuando un paciente ha usado IPs anteriormente y ha desarrollado resistencia significativa. Cuando se usa tipranavir es importante que se incluyan otras medicinas a las que el virus del paciente no sea resistente. Debería haber por lo menos 2 medicinas en el régimen a la que el paciente no tiene resistencia.
Los resultados de uno de los estudios de esta droga fueron particularmente sorprendentes por su efectividad cuando se usó con pacientes que recibían por primera vez un inhibidor de fusión (T-20 o fuzeon®) en adición a tipranavir. Los principales efectos colaterales son gastrointestinales, y en parte pueden ser explicados por la relativamente alta dosis de ritonavir, y el potencial de daño hepático21, 23, 29
TMC-114 (Darunavir, Prezista®)
Este es el último IP en ser aprobado por la FDA (Junio 2006). Los estudios demostraron que es muy potente22 para los pacientes con VIH con resistencia a múltiples IPs. Los estudios conducidos hasta la fecha han encontrado que, en general, este medicamento es bien tolerado y seguro. Este IP también se co-administra con dosis bajas de ritonavir (600 mg de TMC-114 + 100 mg de ritonavir dos veces al día). Para los pacientes con resistencia al tipranavir o resistencia extensa a los demás IPs, se espera que TMC114 sea una nueva adición muy provechosa a las opciones de la terapia. Similar a lo mencionado arriba sobre tipranavir, es muy importante utilizar TMC-114 junto con por lo menos 1 y preferiblemente 2 medicinas adicionales a las cuales el paciente sea completamente sensible. Se han planeado estudios que van a comparar TMC-114 una vez al día con lopinavir/ritonavir en pacientes naïves a tratamiento22,29
Inhibidores de la entrada del virus: inhibidores de entrada
Para que el virus ingrese en las células es preciso que se cumplan 3 pasos:
El primero es la unión o el atraco del VIH a la molécula del CD4 que se encuentra en la superficie de la célula (macrófago a linfocito T), el segundo es la unión del VIH con uno de los dos co-receptores (llamados CCR5 o CXCR4), también presentes en la superficie la célula humana y, el paso final es la fusión del virus a la célula. Lo que resulta en la inyección del material genético que esta dentro del virus dentro de la célula, a partir de lo cual el virus va a poder reproducirse.
Cada uno de estos pasos puede ser inhibido, y las clases de drogas que lo logran se llaman: inhibidores de la unión o del anclaje, antagonistas de los co-receptores, respectivamente.
A los tres grupos de drogas, se les llama, como grupo: inhibidores de la entrada. Actualmente la única medicina disponible de este grupo es un inhibidor de la fusión (Fuzeon®). Un antagonista de los co-receptores llamado Maraviroc ha sido recientemente aprobado en Estados Unidos.
T-20 (Enfuvirtide, Fuzeon®)
Es el prototipo de los inhibidores de la fusión entre el virus y la célula y fue el primero en ser aprobado. Es una molécula relativamente grande, como la insulina, y similarmente, debe ser administrada en forma de una inyección subcutánea. Fue aprobada para uso comercial en los Estados Unidos y Europa en 2003 después de la conclusión de los estudios Toro I y II 23,24. Fuzeon es potente y efectivo en pacientes que han experimentado falla virológica y resistencia a regímenes anteriores. Los efectos adversos de Fuzeon están mayormente asociados a su administración subcutánea: aproximadamente 2/3 de los pacientes tienen reacciones locales, mayormente induración local leve pero en algunos pacientes estas reacciones pueden ser severas llegando a formarse nódulos subcutáneos dolorosos. Debido a su administración parenteral, el uso de este medicamento esta mayormente restringido a pacientes con pocas opciones terapéuticas, ya sea por alta resistencia viral o por múltiple intolerancia a medicamentos. Es importante mencionar que hay un nuevo tipo de jeringa que hace que la administración sea más fácil y cause menos reacciones en la piel.
Antagonistas del Co-receptor
Los más importantes de estos co-receptores se llaman CXCR4 y CCR5. El tipo de VIH que utiliza principalmente el receptor CXCR4 se conoce como X4 y el que utiliza CCR5 se llama virus R5. En general, la mayoría de VIH son R5 (aproximadamente 80% de todos los virus). El virus R5 es más común en pacientes con un CD4 relativamente más alto y con cargas virales más bajos. Los virus X4 son más comunes en pacientes con enfermedad avanzada. Las medicinas inhibidores de la entrada se llaman inhibidores o antagonistas del R5 si tienen actividad antiviral contra los virus R5. Las medicinas que inhiben el encaje co-receptor X4 se llaman los inhibidores o antagonistas X4. Tres inhibidores CCR5 estuvieron en desarrollo hasta hace poco tiempo pero los estudios de dos de ellos han tenido que detenerse por diferentes problemas: El estudio del inhibidor CCR5 de la Compañía GlaxoSmithKline fue parado porque se descubrió toxicidad hepática en un número pequeño de pacientes. El estudio de vicriviroc, (el otro inhibidor CCR5 de la Compañía Schering) en pacientes naïve al tratamiento fue parado debido a que el estudio fue mal diseñado. No hubo señales que causaran preocupación sobre la seguridad de la medicina, pero hubieron fallas virológicas y se pensó que esto pudo haber sido debido a la dosificación baja de la medicina. El estudio en pacientes experimentados con tratamientos continúa aunque se han encontrado algunos casos cáncer en un número pequeño de pacientes. Se espera que el estudio de esta medicina en pacientes naïves sea comenzado nuevamente pero esta vez con dosis más altas.
El tercer medicamento se llama maraviroc y ha sido recientemente aprobado en el mercado norteamericano. Se desarrolla con más amplitud líneas abajo. El desarrollo de un inhibidor X4 es más difícil técnicamente pero hay actualmente varios investigadores que están intentando su desarrollo.
No se espera que las drogas del inhibidor R5 sean eficaces para los pacientes con VIH X4. La prueba que informa sobre la presencia de virus X4 o R5 se llama análisis del tropismo y actualmente solo hay un laboratorio que la tiene disponible comercialmente. 28,29
Maraviroc
Es un inhibidor CCR5 que se ha demostrado que es potente 25,26 contra el VIH, y recientemente ha sido aprobado para el tratamiento de VIH en pacientes con virus que usen los receptores CCR5. No se han reportado toxicidades preocupantes del estudio de la fase III o de estudios anteriores. Se espera que al ser ésta una nueva clase de drogas en contra del VIH, por lo tanto que sea potente y eficaz para los pacientes muy experimentados en tratamientos así como para los pacientes naïves a tratamientos. Antes de usar este medicamento es necesario determinar el tipo de receptores que usan los virus que tiene el paciente. Esta determinación se hace mediante la prueba de tropismo (Trofile). Es importante destacar que este medicamento, a diferencia de todos los otros usados en el tratamiento del VIH, bloquea una proteína human (en este caso el receptor CCR5), en lugar de todos los demás que bloquean o interfieren con proteínas o enzimas virales.
Inhibidores de la integrasa
Raltegravir
El desarrollo de los inhibidores de la integrasa es un progreso mayor en el tratamiento para el VIH. La compañía farmacéutica Merck Sharp & Dohme, ha logrado desarrollar un inhibor de la integrasa a lo largo de 10 años. La integrasa es una de las enzimas más importantes que necesita el VIH para reproducirse dentro de las células humanas. Después que el VIH entra a las células es esta enzima, la integrasa, la que logra que el material genético del virus se una al material genético de la célula humana. Raltegravir o MK-0518 ha sido recientemente aprobado como un agente muy potente, seguro y tolerable27. Puede ser usado por pacientes experimentados (y con grados de resistencia) o naïves al tratamiento. En un estudio con pacientes que tenían mucha resistencia a los medicamentos para el VIH se observó que esta medicina fue muy efectiva; el promedio de reducción de la carga viral por paciente fue de 2 logs y un porcentaje alto de pacientes fue capaz de tener una carga viral indetectable. Dado que los inhibidores de la integrasa son una clase nueva de medicamentos, se espera que sean potentes y efectivos para aquellos pacientes que tengan resistencia a las 4 clases de medicamentos actualmente en uso para el tratamiento del VIH: Nukes, ITRNNs, inhibidores de proteasa e inhibidores de la fusión (fuzeon, T-20). Los inhibidores de la integrasa son óptimos para combinarse con las medicinas nuevas, tales como tipranavir, fuzeon, y TMC-114 (darunavir) en pacientes con mucha resistencia a las medicinas contra el VIH.
3.1.2 Medicaciones en desarrollo
Hay un buen número de medicamentos que están en diferentes fases de desarrollo.
ITRNs nuevos (nukes)
ACH-26,433 (Elvucitabine)
Es un nuevo nucleósido que es efectivo contra VIH y el virus de la hepatitis B (HBV). Algunos estudios han mostrado potencia aún en presencia de numerosas mutaciones de que confieren resistencia a los ITNRs, por lo que se espera que sea útil en pacientes que tiene resistencia a los nukes disponibles actualmente. Este medicamento tiene una vida intracelular tan larga, que permite dosificación menos frecuente, inclusive posiblemente una vez por semana. Estudios preliminares han mostrado menor toxicidad mitocondrial que los nukes disponibles actualmente. En estos estudios se ha visto que un efecto colateral importante con la dosis usada es leucopenia y rash. Hay estudios que van a estudiar si se podrían usar menores dosis para evitar esos efectos adversos.
Inhibidores del encaje
Esta es una nueva clase de medicinas contra el VIH, y por lo tanto podría ser eficaz para los pacientes con resistencia a las medicinas actualmente usadas y quizás también para ser usadas en regímenes que se usa para el tratamiento de pacientes naïves.
TNX-355
Es un inhibidor del post-encaje en el desarrollo. Esta medicina es tan potente que redujo la carga viral del VIH en 1.5 logs en un estudio de 14-21 días, y parece que por ahora es segura y bien tolerada. Desafortunadamente, esta medicina es administrada por inyección o infusión, lo que limitará su uso. Sin embargo va a poder ser útil para pacientes que han usado varios regímenes y tienen opciones muy limitadas de tener un régimen de HAART efectivo. La compañía farmacéutica Bristol-Myers Squibb tiene un programa de desarrollo de inhibidores del encaje y ha presentado resultados de varias medicinas estudiadas en pacientes con el objetivo de intentar desarrollar una droga con características óptimas. BMS-4588043 fue estudiado por 10 días en pacientes que recibían tratamiento por primera vez (naïve) y dió como resultado reducciones de 1 log de la carga viral. Sin embargo se necesitaron dosis tan altas como de 1 800 mg por lo que el estudio fue parado para evaluar otras medicinas potenciales con características mejores.
Nuevos inhibidores de integrasa
Otro inhibidor de la integrasa es GS-9317 de la compañía Gilead Sciences. Esta medicina también parece ser muy potente pero está en estadíos más iniciales de desarrollo que MK-0518. Recientemente se reportaron los resultados de un estudio de 10 días que mostró que la carga viral bajó dos logaritmos con esta medicina. Un estudio grande de fase 2 con esta medicina empezó en 2006. Esta medicina se puede usar con una dosis baja de ritonavir por lo que puede ser dosificada una vez al día y con mayor efectividad.
Inhibidores de la maduración
PA-457
Es el primer inhibidor de la maduración que es estudiado. En un estudio inicial y pequeño la droga redujo la carga viral del VIH y parece eficaz para los pacientes con resistencia a medicinas contra el VIH. Hay más estudios en curso, otros inhibidores de la maduración están en estadío inicial de investigación.
3.2 Guía del Tratamiento para pacientes con VIH
¿Cuándo empezar?
Cuándo empezar la terapia antiretroviral ha sido materia de debate desde el inicio de la era HAART en 1996. En general podemos decir que las recomendaciones de cúando empezar la terapia varían dependiendo de muchos factores. Indudablemete la disponibilidad de medicamentos es uno de los más importantes. Históricamente también ha habido variaciones en las recomendaciones. Cuando hubo gran entusiasmo con la la posibilidad de erradicación (cura) de la infección se recomendó el uso de medicamentos tempranamente. Posteriormente, después de que la comunidad científica aceptó que la posibilidad de cura de esta infección no era algo inmediatamente probable la preocupación se centró con la posibilidad de disminución de adherencia y desarrollo de resistencia y los efectos colaterales a largo plazo de los medicamentos y las recomendaciones han variado y sugieren empezar terapia más tardíamente.
Actualmente, de acuerdo a las recomendaciones del Departamento de Salud y Servicios Humanos de Estados Unidos (DHHS) 28-30, todos los pacientes con SIDA o con síntomas relacionados al SIDA deberían empezar terapia antiretroviral.
Para pacientes sin síntomas: Si la cuenta de CD4 es menor a 200 células/mm3 se recomienda empezar terapia. Para pacientes con CD4 entre 200 y 350 células/mm3 se recomienda ofrecer la terapia junto con una discusión completa sobre las ventajas y desventajas de empezar la terapia.
Para pacientes con CD4 > 350 células/mm3 si la carga viral es menor 100 000 copias/mm3 se recomienda deferir la terapia. Pero con pacientes con CD4 > 350 células/mm3 y carga viral > 100 000 copias/mm3 la recomendación dice algunos médicos tratan, pero la mayoría recomienda diferir la terapia.
Es importante tener en cuenta que las recomendaciones de la oficina federalde los Estados Unidos son sólo recomendaciones generales lo que significa que la decisión de cuándo empezar finalmente se hace entre el clínico y el paciente. Esta decisión no se debería de hacer sino hasta después de una discusión amplia con el paciente que tenga en cuenta sus ventajas y desventajas particulares de empezar la terapia. Sin embargo, es importante tener en cuenta que en los 2 últimos años muchos estudios han determinado que al empezar la terapia tempranamente, cuando la cuenta de CD4 se encuentra sobre 350 células/mm3 y aún más, sobre 500 células/mm3, la respuesta a la terapia es mejor y los pacientes mantienen un mejor estado de salud. Por otro lado hay otras varias consideraciones que se deben de tener en cuenta como costos, el desarrollo de efectos secundarios a largo plazo y la disminución de la adherencia.
La cuenta de CD4 generalmente se considera más útil para predecir la progresión de la enfermedad que la carga viral en el momento de hacer la decisión de cuándo empezar la terapia. Si hay duda, otra variable se puede tomar en consideración, es la relación CD4/CD8. En un estudio grande se encontró que un paciente tenía un mayor riesgo de muerte si empezaba la terapia cuando la relación de CD4/CD8 era de 15% o menor.
Actualmente, las guías del DHHS, así como las del EAS recomiendan el uso de pruebas de resistencia para pacientes que están por empezar terapia por primera vez. Aunque esta recomendación se basa en las tasas locales de prevalencia de resistencia a antiretrovirales, tiene una clara proyección a lo que constituirá el tratamiento futuro29,31
Indicaciones para el Inicio de Terapia Antiretroviral en Pacientes con Infección Crónica por VIH-1
La Guía de DHHS dice: El momento óptimo para iniciar terapia antiretroviral en pacientes con CD4 > 200 células/mm3 no es conocido. La guía más bien, brinda una información general en lugar de recomendaciones específicas para algún paciente de forma individual. Todas las decisiones que se refieren al inicio de la terapia deberían ser hechas en base al pronóstico según lo determinado por el conteo de CD4 y el nivel de la carga viral.
Un análisis de 13 estudios hechos en Europa y Norteamérica encontró que: CD4 bajo, cargas virales alta, uso de drogas endovenosas, y edad de más de 50 años fueron factores que predijeron progresión a SIDA o muerte en pacientes que empezaban por primera vez terapia antiretroviral.
¿Con que empezar?
Los principales objetivos del uso de HAART son:
1. Reducir la morbilidad
2. Reducir la mortalidad relacionado a VIH
3. Mejorar la calidad de vida,
4. Recuperar y preservar la funcion immunológica y
5. Mantenimiento máximo de la supresión viral.
Se ha visto que el régimen de tratamiento inicial es de crucial importancia para lograr los objetivos a largo plazo ya que el pacientes no ha tenido contacto previo con antiretrovirales y eso hace que no sea probable que tenga resistencia a las drogas antiretrovirales.Los estudios han mostrado que si el paciente es adherente a un buen régimen, este régimen puede ser efectivo por muchos años. Los estudios por el momento han sido de hasta 10 años, ya que este es el tiempo que el HAART ha estado disponible, y esos estudios muestran que los pacientes se mantinen indetectables y realidad muchos pacientes se mantienen indetectables por 10 años en el mismo régimen. Definitivamente, una adherencia completa y estricta es esencial para lograr esto. Una vez que se desarrolla la resistencia se vuelve mucho más difícil mantener el virus suprimido por largo tiempo. Como se mencionó anteriormente, las pruebas de reistencia pueden ser útiles al seleccionar la terapia inicial de los pacientes cuando éstos se infectan con virus de personas que tienen resistencia a las medicinas. En forma similar, también se ha demostrado, que las pruebas de resistencia también benefician en la elección de la terapia de un paciente cuando éste falla a un régimen en particular.
Por todo lo discutido en la sección anterior, es muy importante individualizar el regimen teniendo en consideración numerosos factores que incluyen: efectos adversos potenciales, interacciones entre los medicamentos (incluyendo medicamentos tradicionales y caseros), potencial del paciente de tener buena adherencia al regimen futuro, enfermedades concomitantes, seguridad en un posible embarazo y el grado de efectividad y potencia necesario para las situación de un paciente con una situación en particular.
Al seleccionar un régimen es importante considerar que éste régimen se acomode lo mejor posible a la rutina diaria del paciente, su estilo de vida y sus preocupaciones particulares sobre efectos adversos. Con el número disponible de antiretrovirales disponibles, las posibles combinaciones de medicamentos son grandes, sin embargo algunos regímenes han producido mejores resultados que otros en estudios grandes.
Tomando esa evidencia en consideración, una delegación del Departamento de Salud y Servicios Humanos de los Estados Unidos (DHHS) hace recomendaciones específicas sobre los regímenes iniciales sobre los cuales hay buena evidencia derivada de estudios controlados. Esas recomendaciones son actualizadas regularmente con nuevas informaciones de nuevos estudios y nuevos medicamentos. Después que un nuevo medicamento se hace disponible se hacen estudios y cuando los resultados están disponibles se evaúan y las recomendaciones se pueden cambiar.
Hay tres categorías regímenes iniciales potenciales:
Basados en ITRNNs, basados en IPs y triple ITRNs. Esa clasificación es debido a que esos regímenes son los que han generado mayor cantidad de información clínica significativa incluyendo resultados de estudios clínicos. Los regímenes de IP y ITRNN incluye dos ITRNs, y la razón de eso es porque combinaciones con 2 ITRNs han sido los componentes más usados en los regímenes y que han demostrado suficiente potencia para tener una larga duración. El régimen de triple ITRN es trizivir® e incluye 3 nukes en una sola pastilla: abacavir, AZT y 3TC. En las recomendaciones del DHHS se usa el término preferido para el tratamiento inicial de pacientes con infección por VIH cuando los estudios clínicos han demostrado eficacia óptima y durabilidad con tolerabilidad y facilidad de uso aceptable.
Alternativos son los regímenes recomendados para pacientes en los cuales los estudios clínicos han mostrado eficacia pero son considerados alternativos debido a desventajas en términos de actividad antiviral, durabilidad, tolerabilidad o facilidad de uso comparados con los regimenes preferidos. Las recomendaciones relacionadas a los 2 ITRNs de base como parte de los regímenes preferido o alternativo son hechas por el panel del DHHS basado en la potencia antiviral y durabilidad, toxicidades a corto y largo plazo, riesgo de interacciones entre drogas, probabilidad de desarrollo de resistencia y la conveniencia de la dosificación.
Las pautas de DHHS recomiendan como la terapia de primera línea para el tratamiento inicial:
*Si se usa un régimen ITRNN, entonces el medicamento preferido es efavirenz,
*Si se usa un régimen IP, los medicamentos preferidos son, atazanavir + ritonavir o fosamprenavir + ritonavir (dosificado dos veces al día) o lopinavir/ritonavir, kaletra®
Efavirenz es la opción más frecuente como terapia de primera línea dentro de la categoría de ITRNN debido a su potencia, administración una vez al día, y perfil de
seguridad. Los PIs tienden a tener un perfil preferido para la resistencia, en comparación a los ITRNN´s.
Mencionado como regímenes alternativos se encuentran la nevirapina, dentro del grupo de los NNRTI, y dentro del grupo de IPs : atazanavir (no boosted o no potenciado), fosamprenavir (boosted una vez al dia, o no boosted), kaletra ® una vez al día.
Regímenes antriretrovirales Recomendados como terapia inicial contra VIH-1
Estas son las recomendaciones del DHHS. Los pacientes junto a sus médicos o trabajadores de salud deben decidir cúal terapia podría ser la más efectiva para el paciente, y también decidir cúando empezar la terapia. Los pacientes deberían ser informados para que puedan discutir con sus médicos sobre sus casos individuales y así llegar a la mejor desición de cuándo y con qué régimen empezar. Al final esas son desiciones personalizadas que hay que hacer en casos individuales, a diferencia de las pauta generales del DHHS que son hechas por paneles de muchos médicos e investigadores considerados expertos que se reúnen para hacer esas recomendaciones.
¿Cuándo cambiar un régimen?
La definición de éxito o falla al tratamiento depende de varias circunstancias en cada paciente en particulary los objetivos de la terapia para ese individuo en particular. Por ejemplo, en pacientes en su primer regimen antiretroviral, los objetivos son más ambiciosos pero simples que en los pacientes muy experimentados en diversos regímenes. En los pacientes en su primer régimen, y probablemente en el segundo y aún quizás en tercer régimen, el objetivo usual es la supresión viral completa (lograr que la carga viral baje por debajo de 50 copias/ml) con el incremento correspondiente en CD4. En la medida que los pacientes van usando más y más regímenes con cada vez menos opciones terapéuticas, las opciones terapéuticas cambian de la supresión viral total a la protección contra eventos clínicos mediante el mantenimiento del CD4 al más alto nivel posible.
De acuerdo a lo anterior, la falla de un régimen se podria definir como la incapacidad de alcanzar esos objetivos.
En forma más operacional, se define falla a un tratamiento desde los siguientes puntos de vista:
A) Falla virológica: carga viral sobre 400 copias/ml después de 24 semanas de empezado el régimen, o sobre 50 copias/ml después de 48 semanas, or cargas virales repetidas sobre 400 copias/ml después de haber suprimido exitosamente el virus a menos de 400 copias/ml. La detección repetida de la carga viral sobre el nivel de detección, mientras se toma medicamentos en forma adherente, se define como rebote virológico. Algunos médicos o trabajadores de salud prefieren una definición más rigurosa de la falla virológica. Ellos requieren que la carga viral baje a menos de 50 copias/ml después de empezar la tarapia, y si no curre dentro de 8 semanas, se debería considerar un cambio en el régimen.
B). Falla immunológica: se define como la falla en incrementar el CD4 de 25 a 50 celulas/mm3 sobre el nivel basal durante el primer año, o una baja en el CD4 bajo el nivel basal mientras en medicamentos. En general, se espera que la terapia HAART eleve la cuenta de CD4 del paciente en varios cientos. Algunos pacientes han tenido una respuesta muy buena a la terapia al usar regímenes potentes y han tenido incrementos de 100 a 1,000 célules/mm3
C). Falla clínica: Se define como la ocurrencia o recurrencia de enfermedades oportunistas después de 3 meses de empezada la terapia antiretroviral, lo que significa que el sistema inmunológico no ha mejorado. Se excluye en esta definición el síndrome de immuno reconstitutción. Esta situación ocurre cuando el sistema inmunológico ha mejora tanto que está respondiendo a una infección latente que tiene el paciente.
Es importante puntualizar que en pacientes muy experimentados, un régimen que está fallando virológicamente puede continuar ofreciendo beneficios clínicos e inmunológicos por tiempo considerable, posiblemente debido a una disminución en la virulencia del VIH. También es posible, aunque no probable, que un paciente tenga éxito virológico (carga viral < 50 copias/ml), pero que el CD4 no aumente.
Entre las posibles causas de la falla al tratamiento se mencionan las siguientes: Uso previo de terapia no óptimas (por ejemplo uso de monoterapia en el pasado), pobre adherencia a los regímenes debido probablemente a pobre tolerabilidad a los medicamentos, o efectos colaterales de las medicinas, variación individual en el metabolismo de los medicamentos, interacciones negativas entre medicamentos, potencia inadecuada y resistencia pre-existente a las medicinas contra el VIH. 28,29,31
Opciones de tratamiento para pacientes con resistencia medicamentos
Si un paciente ha recibido uno o más regímenes, ¿cuáles son las opciones siguientes? Gracias a los avances en investigación actualmente hay varias buenas opciones de tratamiento.
Un inhibidor de proteasa pude usarse después que un paciente ha fallado un régimen que contenga NNRTIs, y hay varios IPs que se pueden usar. Terapia basada en un NNRTI se puede usar después que un paciente ha fallado IPs.
Si un paciente ha estado en varios regímenes y ha desarrolllado resistencia a varias medicinas, hay varias opciones posibles. Entre ellas esta el uso combinado de alguna de las siguientes drogas: T-20 (Fuzeon®), TMC-114, que como se ha descrito líneas arriba es un inhibidor de proteasa nuevo. Es muy potente aún en pacientes que usaron inhibidores de proteasa anteriormente y que tienen resistencia a medicamentos, además parece seguro y tolerable22,29
Tipranavir es también un inhibidor de proteasa muy potente que se puede usar en pacientes con resistencia a medicamentos. En algunos pacientes puede asociarse a hepatoxicidad21
También de mucha importancia como opción de tratamiento para pacientes con experiencia previa con varios regímenes y resistencia a medicamentos contra el VIH está el inhibidor del integrasa, Raltegravir. El TMC-125 es un NNRTI nuevo que parece eficaz para los pacientes con resistencia a otros NNRTIs actualmente disponible. Tibotec está abriendo un programa ampliado del acceso para los pacientes que necesitan TMC-125 para poder componer un régimen eficaz. Maraviroc es otra opción del tratamiento y como ya se ha descrito, pertenece a una nueva clase de medicamentos, así que los pacientes con resistencia a los agentes, actualmente en uso, deben ser sensibles a esta nueva droga. Antes de usar esta droga es necesario realizar la prueba de tropismo que determina si el virus es R5, lo cual predice si es que el medicamento tendrá actividad sobre el virus.
Adherencia: muy importante para el éxito del tratamiento contra el VIH
Los dos ingredientes más importantes del éxito del HAART son en primer lugar la selección de una terapia adecuadamente potente y tolerable que se adecúe al paciente, y en segundo lugar una adherencia completa y total. Con estos dos ingredientes satisfechos un paciente puede tener muchos años de éxito en el mismo régimen y alcanzar salud y longevidad. Una esperanza de vida normal es posible. Los estudios han seguido a pacientes por diez años en HAART, que es lo que HAART ha estado disponible, y han encontrado que los pacientes que alcanzan un nivel de replicación viral de < de 50 copias/ml rápidamente y luego lo mantienen por 2 años, son los que se van a mantener indetectables por 10 años. La clave está en los primeros meses de terapia. El objetivo es alcanzar < 50 copias/ml en las primeras semanas de terapia y mantener una adherencia completa por los 2 primeros años.
El éxito de todos los regímenes antiretrovirales se basa en la habilidad de los medicamentos de reducir la replicación viral al mínimo debajo del nivel de replicación. Los estudios han determinado que una adherencia casi perfecta (> 95%) es necesaria para mantener la replicación viral a ese nivel mínimo; una disminución mínima en la adherencia (de 95% a 90%) puede resultar en una reducción marcada en las tasas de supresión viral. Esta información haría parecer que los retos para el tratamiento antiretroviral son demasiado grandes, especialmente si consideramos que el tratamiento para el VIH es a largo plazo. Sin embargo es importante considerar que es esperable que los pacientes y sus médicos colaboren en identificar las barreras contra la adherencia y finalmente mantener los beneficios de la terapia.
Mejorando la adherencia
Algunos pacientes con esta infección además de tener que enfrentar la enfermedad misma se encuentran en un medio social y/o familiar desorganizado y caótico. Esas circunstancias son más frecuentes en aquellos con problemas de salud mental, aquellos que son adictos a drogas o sin hogar. No es sorprendente que la adherencia a los medicamentos en estos grupos sea percibida como no óptima.
La adherencia puede ser mejorada mediante la consejería antes y cuando los pacientes empiecen los antiretrovirales. Ese tipo de consejería debería incluir información sobre el uso correcto de los antiretrovirales, necesidad de restricciones en la dieta, manejo de los efectos colaterales mientras se sigue al paciente durante las semanas iniciales del tratamiento. Los grupos de apoyo para la adherencia son bastante comunes y pueden ser muy útiles.
Otra preocupación está cuando se detiene la terapia. Esto se conoce con el término interrupción del tratamiento o los feriados de medicamentos. Debido a que los pacientes pueden cansarse de tomar los medicamentos contra el VIH por días y años y de mantener adherencia completa, en algunas ocasiones los pacientes desean a veces parar la terapia o junto a su médico tratante, decidir por una interrupción. Es importante tener presente que resultados de varios estudios fueron divulgados en 2006 y encontraron que la estrategia de interrumpir la terapia puede dar lugar a serias consecuencias negativas incluyendo el desarrollo de resistencia y problemas asociados a infecciones oportunistas
El tratamiento antiretroviral en el Perú
El primer caso de SIDA en el Perú fue reportado en 1983, en el Hospital Nacional Cayetano Heredia. Actualmente la incidencia acumulada de infección por VIH se concentra en el departamento de Lima y la Provincia Constitucional del Callao (casi un 75% de todos los casos notificados de SIDA, en tanto el 27% se distribuye en el resto del país), siendo las ciudades con mayor incidencia de casos de VIH/SIDA: Ica, Loreto, La Libertad, Ancash, Piura, Arequipa, Junín y Lambayeque32.
Con la aparición de medicamentos contra el virus del VIH, debido a los altos costos, el uso en el Perú fue demorado, recien el año 2004 el Ministerio de Salud del Perú, a través del Fondo Global de Ayuda para el Control del SIDA, Tuberculosis y Malaria, facilita a las personas infectadas por VIH el acceso gratuito al tratamiento.
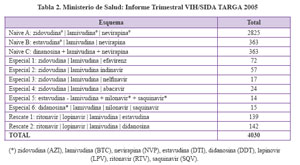
Un reporte inicial publicado el 2005 como se aprecia en la Tabla 2 detalla el número de pacientes incluidos a nivel nacional junto a los esquemas disponibles33
Los esquemas iniciales fueron diseñados basados en los principios de disponibilidad y de acceso a tratamiento en un sistema de salud pública. De allí, el concurso de la industria farmacéutica tradicional, así como la de medicamentos genéricos.
El backbone inicial fueron dos agentes análogos nucleósidos y el tercer agente fue la Nevirapina, este último se uso debido al bajo costo, ya que el Efavirenz para el 2004 era de alto costo y el programa no lo podía adquirir. Las recomendaciones establecían cambios cuando se registraban eventos adversos e inicialmente se disponía, como paso siguiente, de los agentes inhibidores de proteasa como Lopinavir/ritonavir y Saquinavir 33. Se ha generado así, una necesidad permanente de otorgar gratuitamente tratamiento anti-retroviral a los pacientes con criterios médicos e inmunológicos definidos34
A la fecha, existen alrededor de 11 000 pacientes en el Ministerio de salud (MINSA) que se encuentran recibiendo tratamiento antiretroviral (de ellos, aproximadamente, 8,000 solo en Lima). A nivel de la Estrategia de Control, existe una nueva revisión de las normas ministeriales que reglamentan la disponibilidad de esquemas de tratamiento, la misma que se espera esté disponible en el 2008. El esquema preferido incluye AZT+3TC y efavirenz. Así mismo, existe disponibilidad adicional de PIs como Atazanavir y de esta misma familia, el nelfinavir ha sido casi retirado de los esquemas propuestos. La excepción para este último, lo constituye un porcentaje de la población pediátrica infectada35.
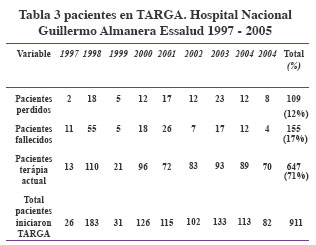
En el Perú, el tratamiento antirretroviral se inició en el sistema de salud de la seguridad social. El grupo del Hospital Nacional Guillermo Almenara fue pionero dentro de dicho sistema. Entre 1997 y el año 2005, hubo 911 pacientes que recibieron TARGA (71.6% era población
masculina). Ver Tabla 3. Un análisis interesante de esta cohorte, publicada recientemente, muestra una diferencia entre el uso de un esquema determinado (2 nukes + 1 NNRTI vs 2nukes + 1 IP) y el desarrollo de una infección oportunista después de un año de iniciado el TARGA. 35 Actualmente entre los esquemas del Programa de ETS-VIH/SIDA de EsSalud se contempla el empleo de 2 ITRNs + 1 ITRNN o 2ITRNs + 1 IP (boosteado o no). Los ITRNs aprobados y presentes en EsSalud son AZT, DDI, 3TC, D4T, abacavir, a puertas de ser aprobado: emtricitabina. Como ITR nucleótido se emplea tenofovir en pacientes seleccionados. De los ITRNNs el más empleado es efavirenz, y la segunda alternativa es nevirapina. Dentro de los agentes IP disponibles están saquinavir, ritonavir, indinavir, nelfinavir, atazanavir, y lopinavir/ritonavir.
La mayoría de los agentes discutidos en esta revisión están disponibles en el mercado peruano, con excepción de emtricitabina, fosamprenavir, raltegravir y maraviroc y, recientemente se empieza a comercializar el tenofovir. En general, la única diferencia es que se trata de medicamentos de origen genérico, con solo alguno de ellos en su presentación original (e.g. lopinavir/ritonavir o kaletra® y atazanavir o reyataz®).
REFERENCIAS BIBLIOGRÁFICAS
1.Fischl MA, Richman DD, Grieco MH, et al. The efficacy of azidothymidine (AZT) in the treatment of patients with AIDS and AIDS-related complex. A double-blind, placebo-controlled trial. N Engl J Med, 1987. 317(4):185-91. [ Links ]
2.Hammer SM, Squirres KE, Hughes MD, et al. A controlled tiral of two nucleosides analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimiter or less. N Engl J Med, 1997. 337(11):725-33.
3.Cameron DW, Heath-Chiozzi M, Danner S, et al. Randomised placebo-controlled trial of ritonavir in advanced HIV-1 disease. Lancet, 1998. 351(9102):543-9.
4.Schooley RT, Ruane P, Myers RA, et al. Tenofovir DF in antiretroviral-experienced patients: results from a 48-week, randomized, double-blind study. AIDS, 2002. 16(9):1257-64.
5.Riddler SA, Haubrich R, DiRienzo G, et al. A prospective, randomized, phase III trial of NRTI-, PI-, and NNRTI-sparing regimens for initial treatment of HIV infectionACTG 5142. XVI International AIDS Conference. August 13-18, 2006. Toronto. Abstract THLB0204.
6.Squires K, Thiry A, Giordano M, for the AI424-034 International Study Team. Atazanavir (ATV) QD and efavirenz (EFV) QD with fixed-dose ZDV+3TC: Comparison of antiviral efficacy and safety through wk 24 (AI424-034). Program and abstracts of the 42nd Interscience Conference on Antimicrobial Agents and Chemotherapy; September 27-30, 2002; San Diego, California. Abstract H-1076.
7.Van Leth F, Phanuphak P, Ruxurungtham K, et al. Comparison of first line antiretroviral therapy with regimens including nevirapine, efavirenz, or both drugs, plus stavudine and lamivudine: a randomized open-label trial, the 2NN Study. Lancet 2004. 363(9417):1253-63.
8.Nunez M, Soriano V, martin-Carbonero L, et al. SENC (Spanish efavirenz vs. nevirapine comparison ) trial: a randomized, open-label study in HIV-infected naïve individuals. HIV Clin Trials, 2002. 3(3):186-94. abstracts of the 42nd Interscience Conference on Antimicrobial Agents and Chemotherapy; September 27-30, 2002; San Diego, California. Abstract H-1076.
9.Staszewski S, Morales-Ramirez J, Tashima KT, Rachlis A, Skiest D, Stanford J, Stryker R, Johnson P, Labriola DF, Farina D, Manion DJ, Ruiz NM.
Efavirenz plus zidovudine and lamivudine, efavirenz plus indinavir, and indinavir plus zidovudine and lamivudine in the treatment of HIV-1 infection in adults. Study 006 Team. N Engl J Med. 1999 Dec;341(25):1865-73.
10.Gulick RM, Ribaudo HJ, Shikuma CM, Lustgarten S, Squires KE, Meyer WA, Acosta EP, Schackman BR, Pilcher CD, Murphy RL, Maher WE, Witt MD, Reichman RC, Snyder S, Klingman KL, Kuritzkes DR; AIDS Clinical Trials Group Study A5095 Team. Triple-nucleoside regimens versus efavirenz-containing regimens for the initial treatment of HIV-1 infection. N Engl J Med. 2004 Apr;350(18):1850-61
11.Albrecht MA, Bosch RJ, Hammer SM, Liou SH, Kessler H, Para MF, Eron J, Valdez H, Dehlinger M, Katzenstein DA; AIDS Clinical Trials Group 364 Study Team. Nelfinavir, efavirenz, or both after the failure of nucleoside treatment of HIV infection. N Engl J Med. 2001 Aug;345(6):398-407
12.Castro J and Guiterrez L. Rhabdomyolysis with acute renal failure probably related to the interaction of atorvastatin and delavirdine. The American Journal of Medicine, 202 112(6), 505.
13.Robinson BS. BMS-232632, a highly potent human immunodeficiency virus protease inhibitor that can be used in combination with other available antiretroviral agents.Antimicrob Agents Chemother. 2000;44(8):2093-9.
14.Murphy RL, Sanne I, Cahn P, Phanuphak P, Percival L, Kelleher T, Giordano M. Dose-ranging, randomized, clinical trial of atazanavir with lamivudine and stavudine in antiretroviral-naive subjects: 48-week results. AIDS. 2003 Dec;17(18):2603-14
15.Sanne I, Piliero P, Squires K, Thiry A, Schnittman S; AI424-007 Clinical Trial Group. Results of a phase 2 clinical trial at 48 weeks (AI424-007): a dose-ranging, safety, and efficacy comparative trial of atazanavir at three doses in combination with didanosine and stavudine in antiretroviral-naive subjects. J Acquir Immune Defic Syndr. 2003 Jan;32(1):18-29
16.Colonno R, Rose R, Cianci C, Aldrovandi G, Parkin N, Friborg J. Emergence of Atazanavir Resistance and Maintenance of Susceptibility to Other PIs is Associated with an I50L Substitution in HIV Protease. 10th Conference on Retroviruses and Opportunistic Infections, Boston, February 9-14, 2003. Abstract 597.
17.Tackett D, Child M, Agarwala S, Geiger M, Geraldes M, Laura B, OMara E. Atazanavir: A Summary of Two Pharmacokinetic Drug Interaction Studies in Healthy Subjects. 10th Conference on Retroviruses and Opportunistic Infections, Boston, February 10-14, 2003. Abstract 543.
18.Solas C, Basso S, Poizot-Martin I, et al. High indinavir C min is associated with higher toxicity in patients on indinavir-ritonavir 800/100 mg twice daily regimen. J Acquir Immune Defic Syndr. 2002. 29(4):374-7.
19.Walmsley S, Bernstein B, King M, Arribas J, Beall G, Ruane P, Johnson M, Johnson D, Lalonde R, Japour A, Brun S, Sun E; M98-863 Study Team.
Lopinavir-ritonavir versus nelfinavir for the initial treatment of HIV infection. N Engl J Med. 2002 Jun;346(26):2039-46
20.Eron J, Yeni P, Gathe J, Estrada V, DeJesus E, Staszewski S, Lackey P, Katlama C, Young B, Yau L, Sutherland-Phillips D, Wannamaker P, Vavro C, Patel L, Yeo J, Shaefer M; KLEAN study team. The KLEAN study of fosamprenavir-ritonavir versus lopinavir-ritonavir, each in combination with abacavir-lamivudine, for initial treatment of HIV infection over 48 weeks: a randomised non-inferiority trial. Lancet. 2006 Aug;368(9534):476-82
21.Hicks CB, Cahn P, Cooper DA, Walmsley SL, Katlama C, Clotet B, Lazzarin A, Johnson MA, Neubacher D, Mayers D, Valdez H; RESIST investigator group.Durable efficacy of tipranavir-ritonavir in combination with an optimised background regimen of antiretroviral drugs for treatment-experienced HIV-1-infected patients at 48 weeks in the Randomized Evaluation of Strategic Intervention in multi-drug reSistant patients with Tipranavir (RESIST) studies: an analysis of combined data from two randomised open-label trials. Lancet. 2006 Aug;368(9534):466-75
22.Katlama C, Esposito R, Gatell JM, Goffard JC, Grinsztejn B, Pozniak A, Rockstroh J, Stoehr A, Vetter N, Yeni P, Parys W, Vangeneugden T; the POWER 1 study group.Efficacy and safety of TMC114/ritonavir in treatment-experienced HIV patients: 24-week results of POWER 1. AIDS. 2007 Feb;21(4):395-402
23.Lalezari JP, Henry K, OHearn M, Montaner JS, Piliero PJ, Trottier B, Walmsley S, Cohen C, Kuritzkes DR, Eron JJ, Chung J, DeMasi R, Donatacci L, Drobnes C, Delehanty J, Salgo M; TORO 1 Study Group. Enfuvirtide, an HIV-1 fusion inhibitor, for drug-resistant HIV infection in North and South America. N Engl J Med. 2003 May;348(22):2175-85.
24.Lazzarin A, Clotet B, Cooper D, Reynes J, Arastéh K, Nelson M, Katlama C, Stellbrink HJ, Delfraissy JF, Lange J, Huson L, DeMasi R, Wat C, Delehanty J, Drobnes C, Salgo M; TORO 2 Study Group. Efficacy of enfuvirtide in patients infected with drug-resistant HIV-1 in Europe and Australia. N Engl J Med. 2003 May;348(22):2186-95.
25.Nelson M, Fatkenheuer G, Konourina I, et al. Efficacy and safety of maraviroc plus optimized background therapy in viremic, ART-experienced patients infected with CCR5-tropic HIV-1 in Europe, Australia, and North America: 24-week results. In: Program and abstracts of the 14th Conference on Retroviruses and Opportunistic Infections; February 25-28, 2007; Los Angeles. Abstract 104aLB.
26.Gulick RM, van der Ryst E, Lampiris H, et al. Efficacy and safety of once-daily (QD) compared with twice-daily (BID) maraviroc plus optimized background therapy (OBT) in treatment-experienced patients infected with CCR5-tropic-HIV-1: 24-week combined analysis of the MOTIVATE 1 and 2 studies. In: Program and abstracts of the 4th IAS Conference on HIV Pathogenesis, Treatmentand Prevention; July 23-25, 2007; Sydney, Australia. Abstract WEPEB116LB.
27.Cooper DA, Gatell J, Rockstroh J, et al. Results of BENCHMRK-1, a phase III study evaluating the efficacy and safety of MK-0518, a novel HIV-1 integrase inhibitor, in patients with triple-class resistant virus. In: Program and abstracts of the 14th Conference on Retroviruses and Opportunistic Infections; February 25-28, 2007; Los Angeles. Abstract 105aLB.
28.Panel on Clinical Practices for treatment of HIV infection. Guidelines for the use of Antiretroviral Agents in HIV-1 infected Adults and Adolescents. U.S. Department of Health and Human Services; October 10, 2006.
29.Panel on Clinical Practices for treatment of HIV infection. Guidelines for the use of Antiretroviral Agents in HIV-1 infected Adults and Adolescents. U.S. Department of Health and Human Services; December 1, 2007.
30.Hammer SM, Saag M, Schechter M., et al. Treatment for Adult HIV Infection 2006 Recommendations of the International AIDS Society–USA Panel. JAMA 2006;296(7):827-843.
31.Guidelines for the Clinical Management and Treatment of HIV Infected Adults in Europe. European AIDS Clinical Society (EACS), October 2007.
32.International Council of AIDS Service Organizations. Informe de Monitoreo y Evaluación de la Implementación del compromiso del UNGASS por el Perú. Diciembre, 2005.
33.CARE. Cuarto Informe Trimestral VIH/SIDA. En AISLAC, Beneficios y Riesgos de las iniciativas Público – Privadas orientadas a incrementar el acceso a medicamentos para el VIH-SIDA en el Perú 2005. II. La Implementación de TARGA en el Perú.
34.Gotuzzo E. La Epidemia del SIDA, Situación del Perú al 2005. Revista Medica Herediana 2004; 15(4): 179-180
35.Corey DM, Hyung KW, Salazar R., et al. J Acquir Immune Defic Syndr 2007;44:451–455.
CORRESPONDENCIA
José Castro Danós
jcastro2@med.miami.edu