Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.25 no.2 Lima Apr./jun. 2008
Situación y control de la hepatitis B y Delta en el Perú
Hepatitis B and Delta in Peru: Current Status and Control
César Cabezas Sánchez1,2
1 Instituto Nacional de Salud, Lima , Perú. Médico Infectólogo Tropicalista
2 Instituto de Medicina Tropical Daniel A Carrión, Facultad de Medicina de San Fernando Universidad Nacional Mayor de San Marcos, Lima, Perú.
RESUMEN
El virus de la hepatitis B es un virus DNA altamente infeccioso cuyo estado de portador crónico conlleva a la cirrosis y el cáncer de hígado y esto se da en plazos mas cortos si está asociado al virus D como ocurre en el Perú. Nuestro país tiene en promedio una endemicidad intermedia, aunque hay áreas de alta, mediada y baja endemicidad; sin embargo la migración de personas entre estas áreas, está dispersando la infección. Debe destacarse en el pais la transmisión horizontal en niños de áreas endémicas y la baja transmisión vertical, lo que es una ventaja para proteger tempranamente con la vacuna. La vacuna disponible contra HBV es eficaz y segura, y siendo la vacunación una de las intervenciones más costo efectivas, se han desarrollado programas de vacunación piloto en el país, con un significativo impacto sobre la tasa de infección; por lo que amerita ampliar la población objetivo a inmunizar, como son los adolescentes y jóvenes y grupos de riesgo de manera que se acorten los periodos para eliminar la infección por HBV y por tanto sus secuelas crónicas. Hay avances en la prevención, pero aun queda que hacer con los portadores crónicos. Habiendo perspectivas terapéuticas tanto para los HBeAg positivos y HBeAg negativos, será pertinente plantear programas de tratamiento y de otro lado evaluar todas las intervenciones efectuadas. Estos son los temas que se incluyen en esta revisión.
Palabras clave: hepatitis B/epidemiología, transmisión, prevención & control; Hepatitis D/epidemiología, transmisión, prevención & control; Perú.
ABSTRACT
Hepatitis B virus is a highly infectious DNA virus, and the chronic carrier status may lead to cirrhosis and liver cancer. These conditions may supervene in a short time period if there is coexistence of both hepatitis B and D viruses, as it usually occurs in Peru. Our country has an intermediate endemicity, although there are areas with high, medium and low endemicity; however, migration is spreading these infections. It is important to point out that there is horizontal transmission in children from endemic areas and a low level of vertical transmission, which is an advantage in order to achieve early protection using the hepatitis B vaccine. This vaccine HBV is efficacious and safe, and vaccination is still one of the most cost-effective interventions. Pilot hepatitis B vaccination programs have been implemented in Peru, achieving a significant impact on the infection rates; so it is advisable to expand the target population, particularly teenagers and other risk groups, so that the time period to eliminate hepatitis B infection may be shortened, as well as its chronic sequels. There have been some advances in prevention, but we still have to take care of chronic carriers. Knowing that there are therapy strategies available for subjects positive and negative for HBeAg, it is advisable to propose therapy programs and to assess all interventions performed. These are the topics included in this review.
Keywords: hepatitis B / epidemiology, transmission, prevention & control; hepatitis D / epidemiology, transmission, prevention & control; Peru.
EL VIRUS
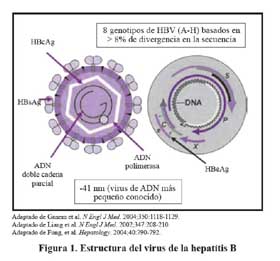
Este virus es de forma esférica y tiene 42 nm de diámetro con dos zonas, una interna de 27 nm denominada núcleo o core, donde se encuentra el genoma, y una más externa de composición lipoproteica. El VHB es un virus DNA y se clasifica dentro del género Hepadnavirus, en el grupo que infecta exclusivamente a los mamíferos1 y en que también se encuentra el virus de la marmota americana y el virus de la ardilla.
La estructura genómica del HBV está formada por dos cadenas de DNA de 3 200 nucleótidos, una negativa completa y otra incompleta, positiva. Dentro del genoma se distinguen cuatro fragmentos de lectura abierta (ORF) denominados S/pre-S, Core/pre-C, P y X. El primero de ellos codifica tres proteínas del antígeno de superficie la SHBs, MHBs y LHBs. El segundo, denominado Core/pre-C, sintetiza una proteína de 183 a 185 aminoácidos donde se identifican dos zonas la pre-C y C. Una transcripción parcial de este gen da lugar a la formación del llamado antígeno e (HBeAg). El ORF P sintetiza la DNA polimerasa y el ORF X sintetiza la proteína HBx, que es exclusiva de los Hepadnavirus que infectan a mamíferos, con función en la transcripcion2 . Figura 1.
La replicación viral se inicia con la adherencia del virus al hepatocito por medio de la proteína Pre-S1; tras penetrar en la célula, el DNA se convierte en DNA cerrado circular e inicia la replicación, completándose la cadena incompleta que se transcribe a RNA pregenómico y sintetizándose a través de la transcriptasa inversa una nueva cadena negativa de DNA viral para, posteriormente generarse la positiva3.
Los genotipos se identifican por una divergencia superior al 8% en la secuencia de nucleótidos y se han aislado siete diferentes, denominados con letras mayúsculas de la A a la G. La identificación se realiza con técnicas de PCR no comercializadas.
Los genotipos del HBV tienen una distinta distribución geográfica. El genotipo A se encuentra en Norte América, Norte de Europa y África. El genotipo B y C en Asia el genotipo D en el Sur de Europa, India y medio Oriente. El genotipo F y H en Sur y Centro-América y el genotipo G en EE.UU. y Europa4 .
En el Perú el genotipo en el Perú corresponde al F y ADW45.
El interés actual de los genotipos, aparte del epidemiológico, es su relación con ciertos aspectos evolutivos y terapéuticos del virus.
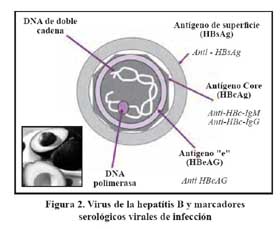
El diagnóstico de la infección se hace fundamentalmente utilizando la técnica de ELISA que permite detectar los marcadores serológicos sean antígenos del virus o anticuerpos generados por el sistema inmune como respuesta a la presencia del virus, como se muestra en la Figura 2 . Para no olvidar la estructura del virus y sus marcadores podríamos hacer una analogía un poco genérica con cada uno de los componentes de la palta, como se ve en la figura ya mencionada.
Para el diagnóstico de hepatitis B se utilizan los marcadores serológicos ampliamente disponibles en los laboratorios clínicos que utilizan la técnica de ELISA para la deteción de anticuerpos y antígenos y PCR para la determinación del DNA viral así como de la carga viral. La interpretación de los principales marcadores se muestra en la Tabla 1.
También se puede determinar el antígeno e (HBeAg) que permite definir a un paciente altamente infectante y con replicación del virus. No obstante se debe tener en cuenta la presencia de una variedad de hepatitis crónica B (mutación precore o del promotor del core), en donde no se expresa el HBeAg a pesar de haber replicación viral documentada por carga viral del HBV DNA. Esta variante es la que probablemente está presente en el Perú, como se ha mostrado en estudios realizado en gestantes portadoras de HBsAg de diferentes áreas geográficas 6,7. De otro lado esta variedad de hepatitis B HBeAg negativo cursa con mayor agresividad de la enfermedad y es más resistente a los tratamientos disponibles.
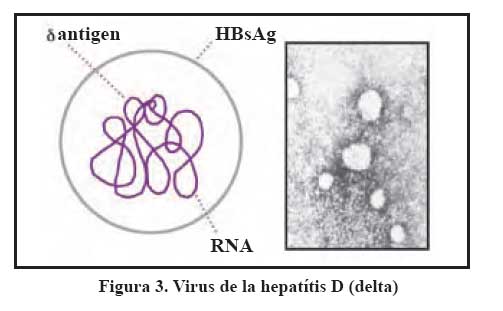
El virus de la hepatitis Delta, es un virus RNA, cuyo diámetro está entre 35-37 nm, siendo defectivo requiere para su multiplicación del HBV, siendo por tanto en el sentido estricto de la palabra es un parásito del virus B, pues requiere del antígeno de superficie de este para poder infectar al hepatocito. Esta infección puede hacerse bajo dos modalidades, como coinfección, cuando ambos virus B y D infectan simultáneamente y sobreinfección, cuando en un portador crónico del virus B ingresa el virus Delta. En ambos casos la presencia del virus Delta empeora el pronóstico de la infección, sea para acelerar la progresión a la cirrosis o al cáncer de hígado (coinfeción), como para desarrollar formas fulminantes (sobre infección), que son muy frecuentes en población joven de áreas hiperendémicas del Perú, como ocurre en población rural de la amazonía y valles interandinos en los valles de Huanta, Abancay, Andahuaylas, Río Pampas, Quillabamba 8,9,10. Para el diagnóstico de la infección también se recurre a la determinación de anticuerpos IgM para infección aguda y anticuerpos anti-Delta IgG que indican antecedente de infección.
PATOGÉNESIS E HISTORIA NATURAL DE LA INFECCIÓN
El HBV no es un virus patogénico en si mismo, la infección crónica por este virus es un estado dinámico de interacciones entre el virus, el hepatocito y la respuesta inmune. Este virus replica su DNA vía un RNA intermediario, una estrategia inusual que genera una población heterogénea de variantes genéticas durante el curso de la infección para evadir la respuesta inmune. Pero su economía genética extrema, lograda por el uso de cuatro fragmentos de lectura abierta (ORF), es su mayor limitante evolutivo, que podría explicar el desarrollo y mejoras de las terapias existentes11. El DNA circular cerrado covalente (ccc DNA) juega un papel clave en el mantenimiento de la infección. Existen cuatro formas de HBV importantes en la práctica clínica. El virus B tipo salvaje y tres virus mutantes que ocurren frecuentemente: el mutante precore, el mutante promotor del core y los mutantes YMDD. Otras mutantes serán identificados con la aparición de nuevos medicamentos, como el descrito recientemente, el mutante resistente al adefovir (N236T).
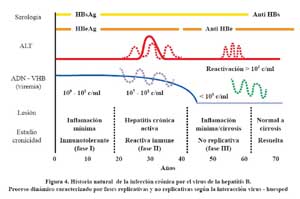
La infección adquirida perinatal o tempranamente en la infancia es generalmente asintomática, llegando a ser crónica en el 90% y 30% de los casos respectivamente. Aproximadamente 30% de los pacientes con infección aguda en los adultos se presentan como una hepatitis ictérica y solo 0,1% - 0,5% desarrollan hepatitis fulminante. La infección se resuelve en mas del 95% de los adultos con pérdida del HBsAg y la aparición de anti-HBs. La infección crónica se caracteriza por la persistencia del HBsAg, del antiHBc y por niveles de DNA –HBV detectables en suero por más de seis meses. La historia natural de la infección por el HBV puede ser dividido en tres fases consecutivas12
La fase inmunotolerante
La fase reactiva inmune
La fase no replicativa.
La fase inmunotolerante corresponde al período de incubación en la infección aguda adquirida en el adulto (2 a 4 semanas), mientras que esta fase dura décadas en la infección adquirida perinatalmente. En esta fase, los individuos son asintomáticos, tienen las aminotrans-ferasas normales o mínimamente elevadas, presentan altos niveles de HBV DNA >105 copias/ml y HBeAg (+) y no hay necroinflamación en la biopsia.
Se explica por falta o una débil respuesta contra los hepatocitos infectados. Durante el curso de la infección por HBV, por razones desconocidas los pacientes evolucionan a una forma más activa de la enfermedad, denominada fase reactiva inmune, caracterizada por elevación de las aminotransferasas, disminución del DNA viral y variables grados de necroinflamación reflejando la respuesta inmune de huésped con lisis de los hepatocitos infectados. La severidad y duración de la fase reactiva inmune determina el riesgo de complicaciones. En la infección aguda por el HBV esta fase corresponde al periodo de síntomas clínicos e ictericia (3 – 4 semanas), mientras que en los pacientes con infección crónica por el HBV puede durar de meses a años. La tercera fase, no replicativa, o de baja replicación, se inicia con la seroconversión del HBeAg a Anti-HBe, ya sea espontáneamente o con tratamiento, con declinación de los niveles de DNA VHB a menos de 105 copias /ml, normalización de las enzimas hepáticas y resolución de la necroinflamación en la histología hepática13 . Probablemente en las fases anteriores a la aparición del anti-HBe, tiene lugar la integración del VHB (la codificante del HBs Ag) en el genoma del hepatocito. Esta integración además de producir abundante HBsAg, causa un riesgo de carcinogénesis independiente de si se ha o no producido cirrosis por el proceso inflamatorio.
Para el estado de portador son neCésarias algunas definiciones como:
a) Hepatitis B crónica, la cual es una enfermedad crónica necroinflamatoria del hígado causada por infección persistente del VHB. Se divide en: hepatitis crónica HBe Ag (+) y hepatitis crónica HBe Ag (-). Los criterios diagnósticos incluyen, HBs Ag positivo > 6 meses, DNA –VHB > 105 copias/ml, Elevación persistente o intermitente de ALT/AST y biopsia hepática con hepatitis crónica (grado > o = 4)
b) Portador Inactivo del HBsAg (antes portador sano), que consiste en una infección persistente del hígado sin enfermedad necroinflamatoria significativa. Los criterios diagnósticos incluyen: HBs Ag positivo, HBe Ag negativo/ Anti-HBe positivo,DNA viral <105 copias/ml, ALT/AST persistentemente normales, biopsia hepática sin inflamación significativa (Score < 4).
Otros factores que pueden jugar un rol en la progresión de enfermedad hepática debido a HBV, están relacionadas a género, consumo del alcohol, e infección concomitante con otros virus de hepatitis. El resultado de infección de HBV crónica depende de la severidad de enfermedad hepática en el momento de la replicación viral 14.
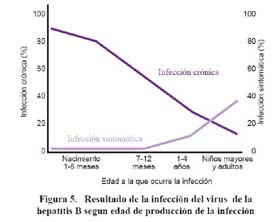
Como se puede apreciar en la Figura 5, la edad a la que ocurre la infección es determinante para el desarrollo de infección crónica. Si la infección ocurre al nacimiento la probabilidad de quedar como portador crónico es del 90%, si la infección ocurre entre 1 – 4 años esta probabilidad está entre 30-50% y si ocurre en la edad adulta se reduce a menos del 5% 15. Por otro lado la infección en niños pequeños cursa asintomática. De modo que sólo un 10% de niños menores de 10 años presentan síntomas que clínicamente orienten a una infección por hepatitis B16
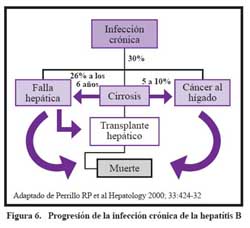
La infección crónica por HBV puede seguir el curso que se muestra en la Figura 6, la cual ha sido descrita en varios estudios en diferentes partes del mundo . La HBV aguda y la coinfección con el HDV tiende a ser más severa que la infección de HBV aguda sola más probablemente produce hepatitis fulminante17,18. La superinfección con HDV en los pacientes con la infección crónica por HBV crónica se acompaña por la supresión de la replicación de HBV19, La mayoría de los investigadores ha encontrado que la superinfección por HDV está asociada con la enfermedad hepática más severa y la progresión acelerada a cirrosis20,21.
Virus de la hepatítis B y enfermedad hepática
El hepatocarcinoma es la tercera causa de muertes por cáncer en los hombres en el mundo y la séptima causa más común de muertes de cáncer en las mujeres, reportándose aproximadamente 500 000 muertes cada año94 ,constituyendo la cuarta malignidad más común con una incidencia mayor en las áreas endémicas como China y Africa subsahariana donde la HBsAg portador proporción es 10 a 15%, a 150 casos de HCC por 100 000 por año 22 en contraste con los Estados Unidos donde la tasa de portadore de HBsAg es menor al 1%.
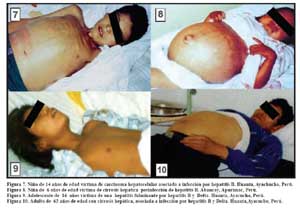
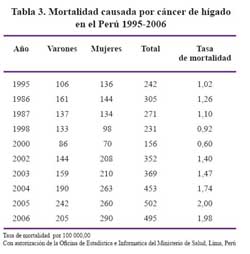
En las áreas hiperendémicas de HBV en el país también es prevalente la presencia de HCC, como ocurre en Quillabamba, Abancay y Huanta donde alrededor del 7% del total de fallecimientos corresponden a enfermedades hepáticas relacionadas a infección por el virus de la hepatitis B como HCC, cirrosis y hepatitis fulminante 8,9,23. En el caso de Huanta del 7% de fallecidos por enfermedades hepáticas 50% corresponden a hepatitis fulminante (asociado a infección por el virus Delta), 10% a cáncer de hígado y 40% a cirrosis hepática. (Figura 7) De otro lado el 73% de los que fallecen por hepatitis fulminante son menores de 20 años, en este mismo grupo de edad estan 18% de los que fallecen por cirrosis hepática y 35% del los que fallecen por cáncer de hígado y al igual que en otras series mas del 60% son varones. Las asociaciones de la HBV y cirrosis, en el Perú están entre 19,5 y 40% mientras que su asociación con hepatocarcinoma esta entre 53,3 y 74% como muestran estudios nacionales 24,25,26,27. En las Figuras 7,8,9 y 10 se observan secuelas de infección crónica por HBV en población infantil y adulta.
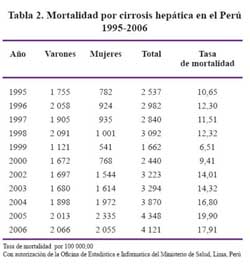
De acuerdo a información basada en los datos estadísticos del Ministerio de Salud y considerando el subregistro existente al hacer la corrección respectiva en base al documento técnico de la OPS/OMS (Estadísticas de Salud en las Américas, edic 1992), el promedio anual de casos de cirrosis sería de 4 399 casos y 419 casos de hepatocar-cinoma. Ver Tablas 2 y 3.
EPIDEMIOLOGÍA DE LA HEPATITIS B Y DELTA EN EL PERÚ
Distribución de la infección
La Organización Mundial de la Salud (OMS) estima que más de dos billones de habitantes en el mundo han sido infectados por el virus de la hepatitis B, de los cuales 350 millones serán portadores crónicos del antígeno de superficie (HBsAg) 28,29 y aproximadamente un millón de muertes en un año están relacionadas directamente a infección por el virus de la HBV 30.
En localidades donde el estado de portador del antígeno de superficie (HBsAg) excede al 10%, la infección por HBV produce hasta el 3% de la mortalidad total21, aunque en áreas hiperendémicas como Huanta (Ayacucho) y Abancay (Apurímac) en el Perú este porcentaje llega al 7% 24,25. El 30% de los portadores crónicos del virus que sobreviven hasta los 30 años, están expuestos a morir de complicaciones como hepatitis crónica, cirrosis o cáncer primario de hígado12,19,26.
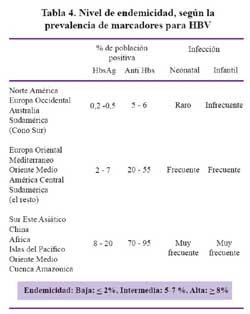
Para determinar los niveles de prevalencia y endemicidad la HBV, se utilizan marcadores serológicos de infección como el antígeno de superficie (HBsAg) y anticuerpos anti HBsAg o a los anticuerpos anti-HBcAg. De acuerdo a ello se pueden catalogar a las áreas de baja, intermedia y alta endemicidad como se muestra en la Tabla 4.
En Sudamérica el número de portadores de HBsAg se incrementa de sur a norte. Se ha observado elevada prevalencia en la zona central y oeste de la región Amazónica del Brasil y ciertas zonas adyacentes de Colombia, Venezuela, estimándose que entre 140 000 a 400 000 nuevos casos de hepatitis B pueden estar ocurriendo anualmente en Latinoamérica, dos tercios de ellos en América del Sur, incluyendo 440 a 1 000 casos de hepatitis fulminante, estimándose que anualmente las secuelas de infección por el virus de la HBV ascienden a 2 965 casos de hepatitis crónica, entre 12 782 a 44 737 casos de cirrosis, de 3 271 a 11 449 casos de hepatocarcinoma, además de reconocer la presencia del virus Delta en la cuenca Amazónica,31,32
Como describimos mas arriba, el virus de la hepatitis Delta (HDV), está asociado al de la HBV y se adquiere bajo dos formas, como una coinfección o sobre infección y ambas formas de asociación pueden estar relacionadas con hepatitis fulminante y las formas crónicas de hepatitis, además de la cirrosis y hepatocarcinoma 33. Esta infección tiene distribución mundial y se estima que la proporción de portadores del HBsAg, infectados por el virus Delta supera el cinco por ciento34. Los mecanismos de transmisión son similares al de la HBV. La infección por el virus Delta ha sido mostrada en el Perú tanto en población indígena y mestiza de la Amazonía, como en población de los valles de Huanta, Abancay y el localidades del Rio Pampas 35,
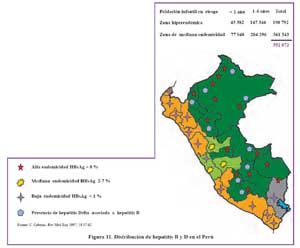
En promedio la endemicidad para HBV en el Perú es intermedia, sin embargo hay áreas hiperendémicas, como en áreas rurales de la amazonia, valles interandinos como Abancay, Andahuaylas,Quillabamba, Huanta, Valle del Río Pampas35,36,37, como se muestra en la Figura 9.
Igualmente hay áreas de baja endemicidad en ciudades de la costa 38, sin embargo La intensa migración interna en el país de áreas endémicas hacia áreas no endémicas y viceversa, debido a factores económicos y sociales a que viene ocurriendo en las últimas décadas, está cambiando de manera importante el patrón epidemiológico de la infección por HBV y Delta. Un ejemplo de ello es que en una población residente en una localidad periurbana de Lima, luego de 7 años de convivencia con migrantes de áreas hiperdendémicas, la prevalencia de portadores crónicos de HBsAg ascendió de 2% a 3,5%, indicando un importante cambio que muestra la dispersión de la infección39 de modo que para fines de control no es suficiente la inmunización en áreas endémicos, si no proteger a toda la población expuesta por el riesgo que significa la infección debido a su dispersión. Mecanismos de Transmisión de la HBV y Delta
Se consideran cuatro formas fundamentales de transmisión de la hepatitis B y Delta:
Percutánea: contacto con sangre o productos derivados sanguíneos, agujas, jeringas, instrumentos, contaminadas, hemodiálisis, uso de drogas intravenosas, cirugía oral, tatuajes, perforaciones (piercing), acupuntura con instrumentos no reusados.
Contacto íntimo o sexual con personas infectadas.
Transmisión perinatal de madres infectadas a sus niños.
Transmisión horizontal, por compartir objetos contaminados
Teniendo en cuenta estos mecanismos de transmisión, es recomendable investigar para hepatitis B a grupos de riesgo como: nacidos en áreas endémicas para hepatitis B, sexo hombre con hombre, trabajadore(a)s sexuales, drogadictos intravenosos, pacientes en hemodiálisis, pacientes VIH positivos, embarazadas, contacto familiar, íntimo o sexual con individuo HBV positivo.
Transmisión percutánea, transfusiones de sangre y derivados
Es evidente que desde la introducción del tamisaje de marcadores de infecciones a través de la sangre y derivados se ha reducido esta forma de transmisión,40,41 sin embargo se debe considerar la incidencia de infección de HBV asociada a transfusión en áreas de baja prevalencia donde sólo se usa el HBsAg como marcador de tamisaje42 y la necesidad de excluir más del 22% de la población de donantes en áreas hiperendémicas. Es neCésaria la evaluación de otros marcadores de infecciosidad como el DNA del virus, para definir los niveles reales del riesgo de infección por HBV pues hay hallazgos en áreas endémicas de nuestro país que en personas con anticuerpos anti HBc positivos y HBsAg negativos, hasta el 14,5 % de ellos pueden ser positivos para DNA (G Hijar comunicación personal).
Los niveles de prevalencia en donantes de sangre en nuestro país son coincidentes con los niveles de prevalencia en la población general, así en Chiclayo (Lambayeque) encontramos 0,5% de portadores de HBsAg, en Ica 2,2%, Arequipa 0,4%, Huancayo (Junín) 1,8%, Tarapoto (San Martín) 3,8%, Pucallpa (Ucayali) 3,2%43. En el caso de las áreas urbanas de las ciudades de la selva encontramos prevalencias intermedias, cabe destacar que Ica se ubica como área intermedia probablemente por la migración de personas de áreas endémicas, por ser un área de desarrollo por la agroexportación. Al respecto amerita un plan nacional para la disponibilidad de sangre segura en todas las áreas donde sea neCésario.
El compartir agujas como lo hacen los drogadictos endovenosos, son una ruta importante para la transmisión de hepatitis B, igualmente el reuso de agujas contaminadas para los tatuajes, extracciones y/o curaciones dentales, inyectables, acupuntura, e implantación de adornos a través de la piel. En poblaciones indígenas de la amazonía peruana, donde la prevalencia de HBV es alta, el tatuaje probablemente constituye uno de los factores que contribuye a la alta transmisión, además de las otras formas como el consumo de masato, mordedura por murciélagos, picadura de mosquitos y la transmisión horizontal34.
Transmisión sexual
La transmisión sexual de HBV corresponde a aproximadamente 30% de las infecciones agudas de HBV en los Estados Unidos , como ocurre en otros países desarrollados 44. Existe una elevada prevalencia de portadores crónicos de HBV en homosexuales y en heterosexuales con múltiples parejas e historia de enfermedad sexual previa, de modo que a fines de los 70 se estimó una tasa de incidencia anual de infección por HBV del 20% entre los homosexuales44. A fines de la década de los ochenta, esta proporción ha caído a menos de 10%, probablemente como resultado de la modificación de conducta sexual de alto riesgo.
Las tasas de infección en hombres que hacen sexo con hombres es mayor en comparación a la población general, llegando en promedio hasta el 9% de portadores de HBsAg en personas que con además HIV positivas45. Aunque siempre las trabajadoras sexuales constituyen un grupode riesgo, hay una tendencia a la disminución de la prevalencia de HBsAg probablemente debido a las medidas de prevención adoptadas por estos grupos contra las ITS y el VIH/SIDA46,47.
Transmisión perinatal
En las áreas hiperendémicas como China, la proporción de infección perinatal puede ser tan alta como 90%, particularmente cuando las mujeres embarazadas son HBeAg positivas o tienen DNA para HBV positivo en el suero. La transmisión de la madre al infante tiene lugar en el momento de la gestación por transfusión en la circulación materno-fetal o por exposición a la sangre materna durante el pasaje a través del canal del parto y posterior al nacimiento a través del contacto íntimo entre la madre y el niño. La transmisión intrauterina es rara porque la detección del HBsAg en los infantes frecuentemente es tardía 48.
La cesárea no ha mostrado eliminar el riesgo de adquirir infección perinatal por HBV49 y aunque el HBsAg puede encontrarse en la leche materna, no hay evidencia que la infección de HBV puede transmitirse a través de la lactancia materna50.
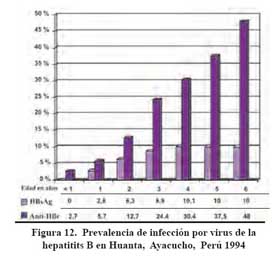
En nuestro pais hay dos observaciones importantes, por un lado la prevalencia de infección en menores de un año en áreas endémicas de HBV es muy baja 6 como se puede ver en la Figura 13, y de otro lado la presencia del HBeAg, un marcador de infecciosidad, es poco frecuente aun en las mujeres que son portadoras del HBsAg que fueron evaluadas en áres de alta, mediana y baja endemicidad51. Estos hallazgos, dentro de la tragedia de la infección, traen buenas noticias y es que al nacer los niños libres de la infección, aun cuando sus madres son portadores del HBsAg, brinda la gran oportunidad de protegerlos de la infección si se les aplica la vacuna contra HBV tan tempranamente como nacen o en las primeras 12 horas de nacidos, aun en carencia de la ganmagloibulina hiperinmune contra hepatitis B.
Transmisión horizontal
Un aspecto que siempre llamó la atención son los altos índices de infección por HBV y sus secuelas crónicas en población infantil de áreas endémicas. Una interrogante era saber como se infectan los niños si no son a través de los habituales mecanismos de transmisión como relaciones sexuales, transfusión de sangre, agujas contaminadas, drogas endovenosas o infección perinatal (Figura Nro 10). En esta situación surgió la alternativa de otra forma de transmisión denominada horizontal , la cual está en razón al contacto directo de portadores del virus de HBV con susceptibles, a través de solución de continuidad en la piel y/o mucosas, pudiendo ser la saliva un vehículo importante, pues se han encontrado el virus de la hepatitis B en concentraciones infectantes, siendo un mecanismo común en áreas endémicas52.
Este mecanismo también se ha podido mostrar por estudios epidemiológicos en Huanta y las áreas rurales de la Amazonía, e igualmente en población en áreas de baja endemicidad, receptoras de migrantes de áreas hiperendémicas53.
En la Amazonía se encontró una asociación significativa entre el consumo de masato y las tasas de infeccion por HBV y si a esto agregamos la costumbre en estas comunidades, que la madre ofrece directamente a la boca de los lactantes alimentos premasticados y la elevada prevalencia de lesiones en mucosa oral y el estado de portador del virus, este debe constituir un mecanismo de transmisión , siendo la saliva un vehículo donde se encuentra DNA del virus en cantidades infectantes34,54
Otros mecanismos de transmisión
Se han descrito otros mecanismos de transmisión para HBV como la mordedura por murciélagos hematófagos (Desmodus rotundus), como el hallado en población indígena y militar en la Amazonía Peruana 34,55, donde se asumen que estos murciélagos sería vectores mecánicos de la infección y hace falta complementar estudios. Por otro lado también se ha mencionado el rol que puede jugaren la transmisión por chinches (Cimex ectularius L), mosquitos (Anopheles stephensiy, O triseriatus) y triatominos (Rodnius prolixus), como vectores mecánicos56,57,58,59
Infección en grupos de riesgo
Se ha mostrado que la incidencia de infección por el virus de la hepatitis B es 55 veces mayor que la del virus de inmunodeficiencia humana (VIH), y 38 veces mayor que la del virus de la hepatitis C (VHC) 60., siendo el virus de la hepatitis B el agente más común responsable de las infecciones virales nosocomiales61.
Los grupos de trabajadores que están expuestos a un frecuente contacto con sangre, tienen una incidencia de nuevas infecciones del 1% por año en aquellos con contacto frecuente con sangre vs. 0% por año en aquellos con contacto limitado62. El sistema de rotación del personal auxiliar por los diferentes servicios, practica acostumbrada en nuestros hospitales, aumenta el número de personas expuestas63. En nuestro país los estudios también muestran que los trabajadores de salud de áreas con baja endemicidad par HBV tienen un mayor riesgo, particularmente los que manipulan material contaminado con sangre y secreciones así como aquellos que desarrollan procedimientos invasivos, sin embargo en áreas hiperendémicas, el ser trabajador, no es un riesgo adicional para contraer HBV, pues probablemente han adquirido la infección en edades tempranas de la vida64. También los estudiantes de áreas de la salud que tienen contacto con sangre y secreciones de pacientes, constituye un grupo de riesgo65.
Otros grupos de riesgo lo constituyen los hemodializados, politranfundidos, que en nuestro país pueden tener marcadores de infección entre 28 - 94%66,67,68
La población militar destacada a la Amazonía, siempre han constituido un grupo de riesgo, en los que se han reportado epidemias de HBV y Delta en diferentes épocas, incluyendo el conflicto con el Ecuador en 1996 , donde probablemente la mortalidad por la epidemia fue igual o mayor a las muertes por el conflicto mismo 36,55,69,70, Se ha reportado casos de infecciones secundarias a transplantes de órganos extrahepáticos, como riñones en personas portadoras de HBsAg. Esto puede relacionarse a sangre residual en los vasos sanguíneos que contiene partículas virales en los riñones. También puede ocurrir luego de transplantes de tejido avascular como córnea71. El rol del tamisaje de anticuerpos anti-HBc puede tener inconvenientes, debido a la posibilidad de resultados falso-positivos, la pérdida potencial del 5% de donantes72 y la incertidumbre sobre el infectividad de los órganos de donantes en los que se encuentra anti-HBc73. La incidencia de infección de HBV de los donantes varia de acuerdo a la endemicidad de la infección en el área, por lo que es imprescindible el tamisaje de infecciones en los donantes.
LA VACUNA
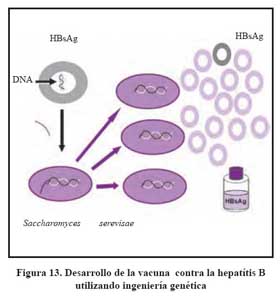
La vacuna se utiliza desde su comercialización en 1982. El principio activo de la vacuna es el HBsAg, en las llamadas vacunas de primera generación, estas eran obtenidas mediante procedimientos físico químicos a partir de portadores crónicos del HBsAg74 varios estudios han mostrado la seguridad y eficacia de esta vacuna75 . Posteriormente se desarrollaron las de segunda generación utilizando la tecnología del DNA recombinante., las cuales consisten de un gen S productor de la proteína HBsAg, utilizando genes de la levadura Saccharomyces cerevisae que sirve como promotor de la producción de HBsAg. Esta proteina es purificada para eliminar los remanentes de la levadura utilizando técnicas de filtración y cromatografía. Ver Figura 14.
Hay una tercera generación de vacunas que contienen antígenos preS1 y preS2 76 que podría tener una potencial aplicación en no respondedores a las vacunas habitualmente utilizadas77.
La vacuna de HBV también tiene presentaciones combinadas con la DPT-Hep B, DPT-Haemophilus influenzae tipo b - Hep B, conteniendo el componentes de pertusis celular y acelular; DPT-Hib –poliovirus inactivado-Hep B, asi como la combinación contra Hep A-Hep B. Todas estas combinaciones son suficientemente inmunogénicas y que inducen niveles protectivos anti HBsAg,78,79.
Dosis y vía de administración
La cantidad de la proteina HBsAg contenida en la vacuna varia de acuerdo a los productores y está entre 1.5 a 10 microgramos, debido a diferencias en el proceso de producción. Las personas que responden a la vacuna contra HBV desarrollan niveles de 10 mUI/mL o mas. El volumen estandar para la administración pediátrica es de 0.5 mL y para adultos de 1.0 mL. La administración debe ser por vía intramuscular, en la cara anterolateral del muslo en niños menores de 24 meses de edad y en el deltoides en niños mayores, adolescentes y adultos. La respuesta inmune si se aplica en el tejido celular subcutáneo es menor en comparación a la vía intramuscular 80. Si bien podria administrarse la vacuna por vía intradérmica lo niveles de anticuerpos son menores a la intramuscular 81.
Estabilidad de la vacuna
La temperatura recomendada es de 2 a 8º C. La vacuna es estable hasta por cuatro años a esas temperaturas, sin embargo se debe considerar las indicaciones del productor. Algunos estudios han mostrado una estabilidad entre 20º y 26º por un año o de 37º por 2 a 6 meses 82,83. Esta gran estabilidad y el mantener su inmunogenicidad permitiría su efecto aún con limitaciones de la cadenas de frío en áreas rurales y endémicas HBV, donde es imprescindible vacunar a loa recién nacidos. Evidentemente es mejor mantener la cadena de frío y por tanto a la temperatura óptima (2º-8ºC). Esta vacuna no debe congelarse, dado que su congelamiento disocia la proteína HBsAg del aluminio que es un adyuvante y por tanto hace perder su inmunogenicidad. El punto de congelación de la vacuna contra la hepatitis B es de unos -0,5º C84
Inmunogenicidad de la vacuna y esquemas de vacunación
Clásicamente se ha considerado el esquema de tres dosis aplicadas a intervalos de un mes entre la primera y la segunda y seis meses entre la primera y la tercera dosis, sin embargo hay otros esquemas alternativos como los adecuados a los programas de vacunación de niños, incluyendo primera dosis al nacimiento, segunda dosis al primer mes y tercera dosis a los 6 meses protección incluyen dosis administradas como 0, 1, 6 meses, 0, 2, 4 meses, 0, 12, 24 meses; esquema 2, 4, 6 meses de nacido y otros de acuerdo a los esquemas adoptados en estos programas de vacun nfantil 85,-87 .
En adolescentes los esquemas que han mostrado inmunogenicidad por encima de 95% de88,89,90, lo cual muestra una gran flexibilidad en la aplicación de esta vacuna; sin embargo los dos primeros esquemas son los recomendados en nuestro país, que en promedio es de mediana endemicidad pero con áreas de elevada endemicidad, con alto riesgo de transmisión.
Un curso de tres dosis de la vacuna induce niveles protectores de anticuerpos anti HBsAg por encima de 95% en infantes, niños y adolescentes y en mas del 90% en adultos menores de 40 años85,91. Después de los 40 años la inmunogenicidad puede ser menor a 90% y por encima de los 60 años estar entre 65% a 75%. Adicionalmente factores del huésped como la obesidad, el ser fumador, infección por VIH, factores genéticos y la presencia de enfermedades crónicas como insuficiencia renal crónica, pueden reducir la respuesta a la vacuna 80,92,93 .
Reactogenicidad a la vacuna
Pueden haber manifestaciones locales transitorias, como dolor en el lugar de la inyección (3% a 29%), elevación de la temperatura (37,7ºC) [1% a 6%] tanto en adultos como en niños94,95,96 .
Eventos adversos. Numerosos estudios han mostrado que la vacuna contra la HBV es una de las mas seguras. No se han observado efectos adversos serios en los estudios preclinicos incluyendo la vacuna derivada de plasma, que incluyen mas de 50 estudios clinicos97. También hubieron evaluaciones de gran escala en programas de vacunación infantil en Alaska, Nueva Zelanda, Taiwán y EEUU donde no se observó efectos adversos severos incluyendo síndrome de Guillain Barre o anafilaxis98. El estudio mase extenso fue el conducido por el Instituto de Medicina de los EEUU en 199397, en dicha revisión el único evento adverso serio fue la anafilaxis que cumplía con el criterio de causalidad. Hay una variedad de enfermedades crónicas que han sido reportadas como temporalmente luego de la vacunación contra HBV, sin embargo estudios posteriores no encontraron asociación con el uso de la vacuna recombinante contra HBV99,100 .
Contraindicaciones
La vacuna es solo antígeno de superficie que es una proteína, sin material genético, por lo que aun teóricamente no se puede replicar por loa que no podría producir hepatitis. Es contraindicación en personas que sean alérgicas a algún componente de la vacuna o aquellas que hacen reacción severa luego de la administración de una dosis, no debieran recibir la segunda. Un contraindicación sería la alergia a la levadura ( S. cerevisae), aunque esta posibilidad es muy poco frecuente, dado que la población está expuesta a la levadura que se usa en la producción del pan o la cerveza. Dado que hay limitada información sobre la vacunación en gestantes101, esta es una contraindicación relativa, y debe vacunarse al finalizar la gestación.
Vacunas y timerosal
Dado los comentarios respecto al uso de timerosal en las vacunas que pueden generar confusión en la población, es pertinente detenerse un poco en este punto . El timerosal es un compuesto orgánico que contiene etilmercurio, el cual ha sido utilizado como preservante en la producción de vacunas desde 1930, fundamentalmente, para evitar la contaminación bacteriana y fúngica durante la elaboración de las vacunas o en frascos de vacunas envasadas en multidosis 102,103. El etilmercurio es diferente del metil mercurio, este último si se conoce que es neurotóxico, sin embargo el metabolismo del etilmercurio es diferente del metilmercurio, siendo su eliminación rápida a través de la orina y heces, a diferencia del metilmercurio que si tiene un efecto acumulativo 104. A raíz de los temores respecto de los posibles efectos neurológicos que pudiera generar el timerosal presente en las vacunas, varios autores han investigado la probabilidad de esta asociación.
Un estudio publicado en JAMA el año 2003, basado en datos del Registro Civil Danés, evaluó una cohorte retrospectiva de niños nacidos entre los años 1991 al 1996, la cual reunió casi 500 000 niños, y a partir de registros psiquiátricos se identificaron 440 casos de autismo y 787 casos de desórdenes del espectro autístico. Hasta julio de 1992 en Dinamarca se había estado usando vacunas de pertusis con timerosal como preservante y después de esa fecha la vacuna pertusis no contiene timerosal , por tanto se tiene una cohorte de niños expuestos a timerosal y una cohorte de niños no expuestos a timerosal. Después de realizar una serie de ajustes para edad, calendario de inmunización, sexo, peso al nacer, apgar a los 5 minutos y otras variables, el riesgo relativo entre los vacunados expuestos con pertusis con timerosal y la misma vacuna pertusis sin timerosal, los autores concluyen que los resultados no soportan una relación causal entre niños vacunados con vacunas que contienen timerosal y el desarrollo de desórdenes del espectro autístico105.
El estudio también publicado por el grupo danés, utiliza el número de de niños de 2 a 10 años de edad con el diagnóstico de autismo en un periodo de tiempo que va desde 1971 al 2000, en este intervalo de tiempo se registró más de 900 niños con este desorden y se relaciona con el periodo de tiempo en que se usa vacunas con timerosal en Dinamarca (antes de julio de 1992) y el periodo posterior en que ya no se usa timerosal en las vacunas de dicho país.
De acuerdo con los resultados se puede observar que en el periodo en el cual se usaba las vacunas que contenían timerosal, la frecuencia de casos se mantenía relativamente estable y cuando se retira el timerosal de las vacunas en el año 92 comienza en todos los grupos etáreos ha incrementarse el diagnóstico de los casos de autismo. Los autores concluyen que la descontinuación de las vacunas conteniendo timerosal en Dinamarca en 1992 fue seguida por un incremento en la incidencia de autismo, por tanto los datos ecológicos no soportan la correlación entre vacunas conteniendo timerosal y la evidencia de autismo106.
Es decir, ya no hay timerosal en las vacunas, sin embargo el número de casos se sigue incrementando.
Otro estudio de tipo cohorte prospectivo realizado al sur de Londres, Avon en el Reino Unido107, en el cual se pudieron seguir a más de 14 000 niños, desde los 6 meses a 91 meses de edad, estimándose la cantidad de timerosal recibida en relación a las vacunas de 3, 4 y 6 meses de edad y se comparó con mediciones de nivel cognitivo y del desarrollo conductual en ese periodo de seguimiento. Empleando un modelo de análisis multivariado, el OR sin ajustes, sugirió un beneficio el recibir la vacuna que contenía timerosal en diferentes momentos del seguimiento, por ejemplo, había menos hiperactividad y problemas de conducta a los 47 meses de edad con la exposición a los tres meses, menos problemas del desarrollo motor a los 30 meses y exposición a los seis meses y otras relaciones similares. Cuando hacen ajustes citan hasta 69 estimaciones, solo en una de ellas después de hacer ajustes para diferentes variables ( peso al nacer, gestación, género, educación materna, paridad y otras) que supuestamente tengan que ver también con autismo, se encontró un resultado en la dirección de la hipótesis. Los autores de este estudio de cohorte prospectiva finalizan diciendo Nosotros no encontramos evidencia convincente que la exposición temprana a este derivado del mercurio timerosal, tenga un efecto deletéreo en un desorden neurológico o psicológico persistente.
El año 2004, Parker y colaboradores publicaron un estudio de metanálisis en el que revisan la calidad de la evidencia sobre una posible asociación entre las vacunas que contienen timerosal y la presencia de autismo u otras alteraciones del desarrollo neurológico. Se analizaron 14 artículos, 10 epidemiológicos y 4 farmacocinéticos, publicados en lengua inglesa entre 1966 y 2004. Se concluyó que los estudios epidemiológicos no apoyan una asociación entre autismo y el uso de vacunas con timerosal y que los estudios de farmacocinética demuestran esta relación poco probable108.
En el 2005, el Global Advisory Committee, basado en un estudio realizado en monos macacos, concluyó que el estudio del metilmercurio no es adecuado para evaluar el riesgo del timerosal y advirtió que estos resultados no pueden ser extrapolados al ser humano. Hasta no disponer de nueva evidencia, concluyó que no existe asociación entre timerosal y trastornos en el neurodesarrollo8 109.
Considerando que el riesgo teórico del timerosal es sobrepasado por los beneficios de la vacunación, la última declaración de la OMS recomendó mantener el uso de vacunas que contienen timerosal, especialmente en países en desarrollo, para así mantener el programa de control de las enfermedades inmunoprevenibles9 110.
En julio del 2006 el Global Advisory Committee on Vaccine Safety de la OMS concluyó que no hay evidencias de toxicidad en infantes, niños o adultos expuestos a timerosal (conteniendo etil mercurio) en vacunas 10 111.
En enero del 2008 se publicó un estudio hecho por Schechte en California USA, donde se muestra que pese a la eliminación del timerosal de las vacunas, los casos de autismo no se han reducido, lo cual evidencia que no hay sustento para la hipótesis de que exista una relación entre el uso de vacunas con timerosal y el desarrollo de autismo112.
El estudio ecológico de Dinamarca, en el cual se observa que al suspender la exposición (timerosal en las vacunas) no desaparece el efecto (autismo), todo lo contrario la frecuencia de autismo se incrementa, de lo cual se deduce que la exposición del timerosal en las vacunas no tiene una relación causal con el autismo, debe haber otras razones que permitan explicar este incremento de casos de autismo, que no se debería al timerosal. Respecto al criterio del tipo de diseño de estudios e interpretaciones de datos, los diferentes estudios: serie de casos, estudio ecológico, estudio caso control, cohortes retrospectivos y cohortes prospectivos, llevan a la misma conclusión: no existe asociación entre vacunación contra sarampión y autismo, ni existe asociación entre las vacunas con timerosal y autismo.
Es indudable que debemos ser defensores militantes de la seguridad de las vacunas y basados en las evidencias disponibles tomar la mejor decisión no solo técnica si no ética a fin de beneficiar a la población a la que nos debemos.
TRATAMIENTO DE LAS FORMAS CRONICAS DE HBV
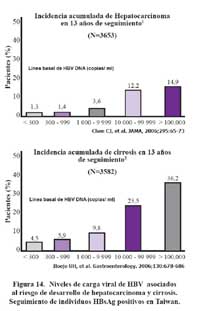
Estudios de seguimiento de la carga viral de portadores crónicos de HBV han mostrado que el riesgo de desarrollar cirrosis o cáncer de hígado, es significativamente mayor en aquellos portadores que tienen niveles altos de carga viral, de lo que podemos deducir que la disminución de estos niveles de carga viral puede mejorar la sobrevida de estos pacientes113, como se muestra en la Figura 15. De otro lado el desarrollo de antiretrovirales para el tratamiento del VIH/SIDA ha traído consigo la opción de tratar las formas crónicas de la HBV abriendo una importante perspectiva para los pacientes.
En hepatitis B no podemos hablar de curación de la enfermedad, debido a que el virus B no se puede erradicar en forma completa por su incorporación en el núcleo de hepatocito, principalmente en forma de cccDNA, contra el cual no se ha desarrollado un tratamiento específico. Por lo que, las metas terapéuticas para la infección por HBV están orientadas en primer lugar a la supresión sostenida de la replicación viral, a la remisión de la enfermedad hepática y a evitar la progresión a cirrosis, insuficiencia hepática y hepatocarcinoma114.
Para indicar el tratamiento de pacientes con hepatitis B crónica es neCésario considerar si es HBeAg positivo o negativo y también si el paciente está compensado o descompensado. En pacientes compensados HBeAg positivos y carga viral (HBV DNA) menor de 100 000 copias/ml o si son HBeAg negativos y HBV DNA menor de 10 000 copias/ml, se recomienda no tratarlos y observarlos periódicamente. De otro lado, si los HBeAg positivos tienen HBV DNA mayor de 100 000 copias/ml y los HBeAg negativos tienen HBV DNA mayor de 10 000 copias/ml, deben recibir tratamiento113,115. Si tienen las aminotransferasas elevadas, son de primera elección el interferón alfa estándar, la lamivudina, el adefovir, dipivoxil y el entecavir. Se debe tener en cuenta que en los pacientes HBeAg negativos la terapia debe ser prolongada. Los pacientes descompensados con cirrosis por virus B deben ser considerados para trasplante hepático. Si el HBV DNA no es detectable, puede no tratarse y observar mientras se trasplanta. Por otra parte, si el HBV DNA es detectable deberán recibir tratamiento. En estas circunstancias está contraindicado el tratamiento con interferones por el alto riesgo de descompensación y falla hepática. Están indicados los análogos nucleósidos-nucleótidos como la lamivudina, el adefovir dipivoxil y el entecavir. Se debe estar atento a la alta resistencia al tratamiento que se presenta con lamivudina por mutaciones en el locus YMD ya que se puede presentar descompensación hepática.
Los efectos secundarios del interferón y el costo hacen que este tratamiento sea menos atractivo, pero tiene la ventaja de no crear resistencias al tratamiento.
La lamivudina, el adefovir dipivoxil y el entecavir prácticamente no producen efectos secundarios, pero para el adefovir es recomendable ajustar la dosis si la depuración de creatinina está disminuida y eventualmente lograr la eliminación del virus, lo cual se logrará sin duda cuando se pueda controlar el desarrollo de cccDNA del virus.
La aparición de resistencia es variable, así la lamivudina presenta una resistencia de 41%-57% entre los 2 a 3 años de tratamiento, mientras que el adefovir 11%- 25%, la telbivudina 4%-22% y el entecavir menor a 1% entre los 3 a 5 años, 1 a 2 años y 3 a 5 años respectivamente117.
Están en fases de investigación y muy seguramente serán parte de las nuevas terapias en un futuro cercano diversos agentes antivirales, algunos con muy buen perfil de seguridad y con menor riesgo de desarrollo de resistencias. Entre estos están: emtricitabina,telbivudina, clevudina y tenofovir.
Es posible que el desarrollo de terapias combinadas con múltiples antivirales e inmunomoduladores permitan un mejor control de la infección por HBV, parecido al TARGA para VIH. Además, el uso de terapias combinadas, como en otras patologías mejora la eficacia y evita el temprano desarrollo de resistencia a los antivirales.
PREVENCIÓN Y CONTROL DE LA HEPATITIS B
Población objetivo y beneficios de la vacunación
En áreas hiperendémicas la prioridad para inmunizar contra HBV son los menores de 1 a 5 años, como ya se viene haciendo en el país: Sin embargo, teniendo en cuenta la alta tasa de migración interna en el país entre las diferentes áreas de alta, mediana y baja endemicidad, es importante considerar poblaciones de niños mayores, adolescentes y jóvenes , así como grupos de riesgo como trabajadores de salud, población militar y policial, estudiantes de áreas médicas, población sexualmente activa y enfermos sujetos a politransfuciones.
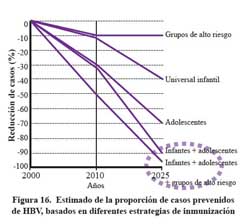
La justificación para incluir la mayor población susceptibleposible es que se reduce el número de infectados a través del tiempo y se reduce el periodo en el cual se eliminaría la infección en la población general. Así si quisiéramos reducir la tasa de portadores de HBV de 10% a 0,2%, si la estrategia fuera solo vacunar a los menores de un año, se requerirían 70 años para lograrlo116. Si se realiza una vacunación masiva a población susceptible el periodo neCésario para lograr la eliminación será mucho menor, dependiendo de la protección a la población de susceptibles. Figura 16 y 17.
Adicionalmente es neCésario tener en cuenta el costo beneficio de la vacunación, que ahorra al país una gran inversión en el tratamiento de personas con infección aguda o sus complicaciones crónicas como la cirrosis y cáncer de hígado, en comparación con la inversión que significa proteger a la población susceptible. Diferentes estudios118 muestran costos de por paciente de $ US. 142,24 para hepatitis crónica, $ US 185,11 para cirrosis compensada, $ US 1 701,58 para cirrosis descompensada y $US. 4 740,53 .
Si hacemos una aproximación a los portadores crónicos de HBV calculados en el Perú, tendríamos que 56 517 desarrollarían hepatocarcinoma, cuyo costo de tratamiento ascendería a US $ 96 132 015. De otro lado 169 546 portadores desarrollarían cirrosis hepática que si consideramos las cirrosis compensada el tratamiento tendría un costo de US $31 384 660.00 y si fueran estas cirrosis descompensadas, este costo ascendería a US $803 737 899.00.
La costo efectividad de la incorporación de la vacunación contra HBV en el Perú, comparada con otras vacunas como la de rotavirus y Haemophilus influenza B, se puede observar en la Figura 18.
EXPERIENCIAS DE INMUNIZACIÓN CONTRA HBV EN EL PERU
En 1991, se iniciaron estudios piloto para la incorporación de la vacuna contra HBV en el programa ampliado de inmunizaciones (PAI), como en Abancay119., localidad ubicada a 2 395 m.s.n.m, en la sierra del Perú, la cual es hiperendémica para HBV y HDV, donde el 7% de las defunciones son relacionadas a infección por HBV. Se vacunaron 4 789 niños menores de 5 años con tres dosis de vacuna recombinante de DNA contra HVB, integrando esta vacuna en el PAI. Se objetivó una mejora en las coberturas de vacunación del PAI en menores de un año.
Similar intervención se desarrolló en 1994, en Huanta120, considerada una zona hiperendémica de HVB y HDV, donde cerca el 7 % del total de fallecidos corresponden a enfermedades hepáticas como hepatitis fulminante, cirrosis o hepatocarcinoma. Se incluyeron 6 587 niños menores de 5 años, igualmente se utilizó la vacuna recombinante contra HBV. En 1997 se evaluó la vacunación contra HBV en esta provincia, lo cual mostró una significativa reducción de las tasas de infección en niños de 3-4 años en 1994 (24,4%-30,4%) comparado con las tasas de infección en niños de la misma edad en 1997 (2,3- 5,1%), concluyendo que la inclusión de la vacuna contra HVB en el PAI en una zonahiperendémica de HVB/HVD, es segura, eficaz y mejora las coberturas del PAI. Una posterior evaluación en el 2001, muestra que las tasas de infección permanecen tan bajas como en el 1997. Tabla 5.
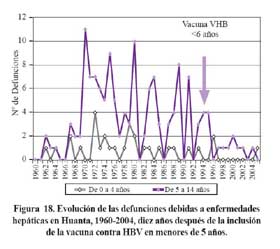
Al revisar las causas de defunción debidas a enfermedades hepáticas en menores de 14 años, beneficiados en 1994 con la inmunización contra HBV en un área hiperendémica como Huanta, se observa una significativa reducción, en comparación a años previos a la inmunización. Figura 19.
En base a estas dos experiencias nacionales y la experiencia internacional, el Ministerio de Salud en 1996 decidió incorporar la vacuna contra HBV en el Programa Ampliado de Inmunizaciones, para niños menores de 1 año residentes en áreas de mediana y alta endemicidad, que al inicio de lavacunación constituían alrededor de 120 430 niños menores de 1 año. Esta medida se tomó considerando el mayor riesgo de los niños de estas áreas y la disponibilidad de recursos en ese momento.
Al revisar las causas de defunción debidas a enfermedades hepáticas en menores de 14 años, beneficiados en 1994 con la inmunización contra HBV en un área hiperendémica como Huanta, se observa una significativa reducción, en comparación a años previos a la inmunización. Figura 19.
En base a estas dos experiencias nacionales y la experiencia internacional, el Ministerio de Salud en 1996 decidió incorporar la vacuna contra HBV en el Programa Ampliado de Inmunizaciones, para niños menores de 1 año residentes en áreas de mediana y alta endemicidad, que al inicio de lavacunación constituían alrededor de 120 430 niños menores de 1 año. Esta medida se tomó considerando el mayor riesgo de los niños de estas áreas y la disponibilidad de recursos en ese momento.
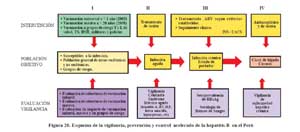
Hay información disponible de las intervenciones piloto en Abancay y Huanta. Posteriormente a estas el Ministerio de Salud, implementó la vacunación contra HBV para menores de un año de áreas de mediana y alta endemicidad en 1996, y desde el 2003 se ha universalizado progresivamente la vacunación a la población menor de 1 año de todo el pais. Actualmente se viene desarrollando una intervención masiva para menores de 20 años y grupos de riesgo. El impacto de todas estas intervenciones deben ser mensuradas, además de establecer la vigilancia especial según la historia natural de le infección, como se señala en la Figura20 121.
VIGILANCIA EPIDEMIOLOGICA Y EVALUACIÓN DE LAS INTERVENCIONES
La inmunización activa contra la HBV es una actividad que se viene realizando en el país y consideramos que tendrá un impacto importante en el mediano y largo plazo, para evidenciar este impacto es neCésario desarrollar actividades de vigilancia y evaluaciones específicas de estas intervenciones.
Adicionalmente es neCésario implementar un programa de intervención para los portadores crónicos de la infección por HBV, pues considerando los altos costos de las pruebas laboratoriales tanto de carga viral como pruebas de función hepática y otras complementarias debieran contar con un trato especial como ocurre para el tratamiento del VIH/SIDA.
REFERENCIAS BIBLIOGRÁFICAS
1.- Robinson WS, Clayton DA, Greeman RL. DNA of a human hepatitis B virus candidate. J Virol 1974;14:384-391.
2.Kosovsky M ,Quadri I, Siddiqui A. The regulation of hepatitis B virus gene expressión: An overview of the cis-and trans actino components:In Cosí R, Caselmann WH edsHpetitis B Virus: Molecular Mechanisms in Disease and Novel Strategies for Therapy. London. Imperial Collage Press;1998.
3.Seeger C, Mason WS. Hepatitis B Virus Biology. Microbiol Mol Biol Rev. 2000;64: 51-68.
4. Devesa M, Pujol FH. Virus Res. Hepatitis B virus genetic diversity in Latin America 2007;127(2):177-84).
5. Hijar G, Cabezas y col. Rev Med Exp y Sal Pub 2003;20 (Supl).
6. Cabezas C, Romero Y, Parihuaman R, Suarez M. Bajo riesgo de Transmisión vertical del virus de la Hepatitis B en un área hiperendémica del Perú. V Congreso Peruano de Enfermedades Infecciosas y Tropicales Boletin de la Sociedad peruana de enfermedades infecciosas y tropicales 1997,6: 5.
7.Vásquez S, Cabezas C, García B, Torres R, y col. Prevalencia de Portadores de HBsAg y Anti- HBs en gestantes residentes en áreas de diferente endemicidad de HVB en departamentos del Centro-Sur del Perú. Revista de Gastroenterología del Perú. 1999,19:23-27
8. Cabezas C, Miranda J. A 38 year evaluation of death causes related to liver diseases in Huanta – Peru. Am J Trop Med Hyg. 1999; 61(Suppl 3): 370.
9. Indacochea S, Gotuzzo E, De la Fuente J, Phillips I, Whignal S. Elevada prevalencia de marcadores de hepatitis B y Delta en el valle interandino de Abancay. Rev Med Hered. 1991; 2(4): 168-72.
10. Segovia G, Galván K, Garcia V et al . Prevalencia de marcadores sexológicos de hepattiis B y delta y transmisión intrafamiliar en el Valle del Río Pampas, Perú. Rev Per Med Exp y Salud Pública 2002; 19 (2): 57-62.
11. Lee JY. Locarnini S.Hepatitis B virus: pathogenesis, viral intermediates and viral replication. Clin Liver Dis. 2004;8:301-320.
12. Beltrán G, O, Rosas M, Garzón M Rev. colomb. Gastroentero 2005;20 (2):12-33
13.Fattovich G. Natural history of hepatitis B. Journal of Hepatology 2003;39:S50-S58
14,.Lai CL, Yuen MF. The natural history of chronic hepatitis B.J Viral Hepatol. 2007; 14(Suppl 1): 6-10. 15. Pearce N, Milne A, Moyes C. Hepatitis B virus: theimportance of age at infection. N Z Med J. 1988; 101(858):788-90.
16.- McMahon BJ, Alward WL, Hall DB, Heyward WL, BenderTR, Francis DP, et al. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis. 1985; 151(4): 599-603.
17.Smedile A, Farci P, Verme G, Caredda F, Cargnel A,Caporaso N, et al. Influence of delta infection on severity of hepatitis B. Lancet. 1982; 2: 945-47.
18.Lettau LA, McCarthy JG, Smith MH, Hadler SC, Morse LJ, Ukena, et al. Outbreak of severe hepatitis due to delta and hepatitis B viruses in parenteral drug abusers and their contacts. N Engl J Med. 1987; 317(20):1256-62
19.Pastore G, Monno L, Santantonio T, Angarno G, MilellaM, Giannelli A, Fiore JR, et al. Hepatitis B virus clearance from serum and the liver after acute hepatitis delta virus superinfection in chronic HBsAg carriers. J Med Virol. 1990; 31(4): 284-90.
20.Lok AS, Lindsay I, Scheuer J, Thomas HC. Clinical and histological features of delta infection in chronic hepatitis B virus carriers. J Clin Patho.l 1985; 38(5): 530-33.
21.Fattovich G, Boscaro S, Noventa F, Pornaro E, Stenico D, Alberti A, et al. Influence of hepatitis delta virus infection on progression to cirrhosis in chronic hepatitis type B. J Infect Dis. 1987; 155(5): 931-35. 22.Murray CJ, Lopez AD. Mortality by cause for eight regions of the world: global burden of disease study. Lancet. 1997; 349: 1269-76.
23.Bueno H, Indacochea S, Oberst R, Chauca G. Rol de los virus de hepatitis B y delta en la etiología del hepatocarcinoma y otras hepatopatías crónicas. Revista de gastroenterología del Perú 1994;14:135 -39 24 Arce R; León J, Cuellar L. Antígeno de superficie del virus de la hepatitis B causantes del hepatocarcinoma. Rev Gastroenterol Peru 1986; 6(1): 35-45.
25.- B ueno H, Indacochea S, Oberst R, Chauca G. Rol de los virus de hepatitis B y delta en la etiología delhepatocarcinoma y otras hepatopatías crónicas. Ver Gastroenterol Peru. 1994; 14(2): 135-39.
26.- Ruiz E, Almonte M, Pizarro R, Celis J, Montalbeti J, Urbano R. Infección con virus de la hepatitis B y hepatitis C como factores de riesgo para hepatocarcinoma en el Perú: estudio casos y controles. Rev Gastroenterol Peru. 1998; 18(3): 199-212.
27.- Barham WB, Figueroa R, Phillips IA, Hyams KC. Chronic liver disease in Peru: role of viral hepatitis. J Med Virol. 1994; 42(2):129-32.
28.- World Health Organization. Hepatitis B fact sheet Nº 204(revised October 2000). Geneva: WHO; 2000: http://www.who.int/mediacentre/factsheets/fs204/en/index.html
29.Kane A, Lloyd J, Zaffran M, Simonsen L, Kane M. Transmission of hepatitis B, hepatitis C and immunodeficiency viruses through unsafe injections in the developing world: model-base regional estimates. Bull World Health Organ. 1999; 77(10): 801-7.
30.World Health Organization. Expanded Programme on Immunization. Protocol for assessing prevalence of hepatitis B infection in antenatal patients. Geneva: WHO; 1990. WHO/EPI/GEN/90.6
31.Paraná R, Almeida D. HBV epidemiology in Latin America. J Clin Virol. 2005; 34(Suppl 1): S130-33.
32.Echevarría JM, León P. Epidemiology of viruses causing chronic hepatitis among populations from the Amazon Basin and related ecosystems. Cad Saude Publica. 2003; 19(6): 1583-91.
33 .Hsieh TH, Liu CJ, Chen DS, Chen PJ. Natural course and treatment of hepatitis D virus infection. J Formos Med Assoc. 2006; 105(11): 869-91.
34.Cabezas C, Suarez M, Romero G, Carrillo C, García MP, Reátegui J, et al. Hiperendemicidad de hepatitis viral B y delta en pueblos indígenas de la Amazonía peruana. Rev Peru Med Exp Salud Publica. 2006; 23(2): 114-22.
35.Segovia G, Galván K, Garcia V, Huamaní L, Gotuzzo E. Prevalencia de marcadores sexológicos de hepattiis B y delta y transmisión intrafamiliar en el Valle del Río Pampas, Perú. Rev Peru Med Exp Salud Publica. 2002; 19(2): 57-62.
36.Mendez R, Arce M, Kruger H, Sánchez S. Prevalencia de marcadores serológicos de hepatitis vírica en diversos grupos de población del Perú. Bol Oficina Sanit Panam. 1989; 106(2): 127-38.
37.Colichón A. Distribución seroepidemiológica de la hepatitis B y hepatitis delta en diferentes comunidades indígenas de la selva peruana. [Tesis doctoral] Lima: Facultad de Medicina, Universidad Peruana Cayetano Heredia; 1989.
38. Vildósola H, Farfán G, Colan E, Delgado G, Mendoza L, Pineda R, et al. Prevalencia del antígeno de superficie del virus de hepatitis B en población general de costa sierra y selva del Perú. Reporte preliminar. Rev Gastroenterol Peru. 1990; 10(3): 96-101.
39.Cabezas C, Anaya E, Bartalesi F, Sánchez J. Transmisión Horizontal de Hepatitis Viral B en población desplazada de un área Hiperendémica a sus contactos en un área de baja endemicidad del Perú. Revista de Gastroenterología del Perú. 1997; 17(2):128-34.
40.Alter HJ, Holland PV, Purcell RH, Lander JJ, Feinstone SM, Morrow AG, et al. Posttransfusion hepatitis after exclusion of commercial and hepatitis B antigen-positive donors. Ann Intern Med. 1972; 77(5): 691-99.
41.Chung HT, Lee STK, Lok AS. Prevention of posttransfusion hepatitis B and C by screening for antibody to hepatitis C virus and antibody to HBcAg. Hepatology. 1993; 18(5): 1045-49.
42.Lok ASF, Lai CL, Wu PC. Prevalence of isolated antibody to hepatitis B core antigen in an area endemic for hepatitis B virus infection: implication in hepatitis B vaccination programs. Hepatology. 1988; 8(4): 766-70.
43.Fuentes Rivera J, Roca V O, Maldonado F, Guillen M. Seroprevalencia de enfermedades hemotransmisibles en donantes de sangre. Rev Peru Enf Infec Trop. 2002; 2: 12-20.
44.- Neaigus A, Gyarmanthy VA, Millar M, et al. Injecting and sexual risk correlates of HBV and HVC seroprevalence among new drug injectors. Drug Alcohol Depend. 2007; 89(2-3): 234- 43.
45. Agurto H, Lama J, Suarez L, Montano S, et al. Epidemiología y factores de riesgo asociado para HBsAg entre hombres que tienen sexo con hombres en el Perú. En: X Congreso Peruano de Enfermedades Infecciosas y Tropicales. Lima: Sociedad Peruana de Enfermedades Infecciosas y Tropicales; 2007.
46.Colichón A, Slava M, Cantella R, Campomanes E. Estudio de marcadores de hepatitis B en meretrices registradas en el Hospital Regional base docente en Trujillo (Perú). Diagnóstico (Perú). 1986; 17(3): 60-63.
47.Hyams KC, Phillips IA, Tejada A, et al. Hepatitis B in a highly active prostitute population: evidence for a low risk of chronic antigenemia. J Infect Dis. 1990; 162(2): 295-98.
48.Wong VC, Ip HM, Reesink HW, Lelie PN et al. Prevention of the HBsAg carrier state in newborn infants of mothers who are chronic carriers of HBsAg and HBeAg by administration of hepatitis-B vaccine andhepatitis-B immunoglobulin. Double-blind randomized placebo-controlled study. Lancet. 1984; 1: 921-26.
49.Lees SD, Lo KJ, Tsai YT, et al. Role of caesarean section in prevention of mother-infant transmission of hepatitis B virus. Lancet. 1988; 2: 833-34.
50.Beasley RP, Stevens CE, Shiao IS, Meng HC. Evidence against breast-feeding as a mechanism for vertical transmission of hepatitis B. Lancet. 1975; 2: 740-41.
51.Vásquez S, Cabezas C, García B, et al. Prevalencia de portadores de HBsAg y anti-HBs en gestantes residentes en áreas de diferente endemicidad de HVB en departamentos del Centro-Sur del Perú. Rev Gastroenterol Peru. 1999; 19(2): 23-27.
52.Davis LG, Weber DJ, Lemon SM. Horizontal transmission of hepatitis B virus. Lancet. 1989; 1(8643): 889-93.
53.Cabezas C, Anaya E, Bartalesi F, Sánchez J. Transmisión horizontal de hepatitis viral B en población desplazada de un área hiperendémica a sus contactos en un área debaja endemicidad del Perú. Rev Gastroenterol Perú. 1997; 17(2): 128-34.
54.-Bancroft WH, Snitbhan R, Scott RM, Tingpalapong M, hepatitis B virus to gibbons by exposure to human saliva containing hepatitis B surface antigen. J Infect Dis. 1977; 135(1): 79-85.
55.Cabezas C. Miranda JJ, Romero G, et al. Factores de riesgo asociados a la transmisión de hepatitis B en población militar destacada al departamento de Amazonas, Perú. Rev Peru Med Exp Salud Publica. 2007; 24(4): 370-77
56.Cohen J, Mandolesi JF, Laszlo M, Illanes L. Triatoma infestans como vector del virus de la hepatitis B. Acta Gastroenterol Latinoam. 191; 11(1): 215-23.
57.Chen CC, Shou L, Hwang LL, Tang P, Tu WC, Lo HS. Persistence of hepatitis B viral antigens in Culex quinquefasciatus. Southeast Asian J Trop Med Public Health. 1987; 18(1): 44-51.
58.B low JA, Turrell MJ, Silverman AL, Walker ED. Stercorarial shedding and transtadial transmission of hepatitis B virus by common bed bugs. (Hemiptera: Cimicidae). J Med Entomol. 2001; 38(5): 694-700.
59.Silverman AL, Qu LH, Blow J, Zitron IM, Gordon SC, Walker ED. Assessment of hepatitis B virus DNA and hepatitis C virus RNA in the common bedbug (Cimex lectularius L.) and kissing bug (Rodnius prolixus). Am J Gastroenterol. 2001; 96(7): 2194-98.
60.Gerberding JL. Incidence and prevalence of human immunodeficiency virus, hepatitis B virus, hepatitis C virus, and citomegalovirus among health care personnel at risk for blood exposure: Final report from a longitudinal study. J Infect Dis. 1994; 170(6): 1410-17.
61.- Gerberding JL. The infected health care provider. N Eng J Med. 1996; 334: 594-95.
62. Gibas A, Blewett DR, Schoenfeld DA, Dienstag JL. Prevalence and incidence of viral hepatitis in health workers in the prehepatitis vaccination era. Am J Epidemiol. 1992;136(5): 603-10.
63.Deville J, Llanos A, Campos M, Phillips I, Gotuzzo E, Kilpatrick M. Factores de riesgo para infección por virus de hepatitis B en personal hospitalario. Rev Gastroenterol Peru. 1989; 9(1): 24-28.
64.Romero G. Prevalencia de marcadores serológicos de HBV en trabajadores de salud y profesores de Huanta (Perú). [Tesis para optar el grado de Biólogo]. Ayacucho: Universidad Nacional San Cristóbal de Huamanga; 1997.
65.Diaz LA, Afanador LP. Riesgo de infección por hepatitis B entre estudiantes de medicina peruanos luego de exposición a sangre y fluidos corporales. Rev GastroenterolPeru. 2003; 23(2): 107-10.
66.Bussalleu A, Cieza J, Colichón A, Berrios J. Prevalencia de hepatitis viral tipo B en pacientes y personal de tres unidades de hemodiálisis en Lima. Rev Med Hered. 1991;2(4): 160-67.
67.-Loza C, Depaz M, Suarez M, et al. Frecuencia de marcadores sexológicos de hepatitis viral B y C en pacientes que ingresan por primera vez al programa de hemodiálisis en el Hospital Cayetano Heredia. Rev Gastroenterol Peru. 2005; 25(4): 320-27.
68.Laguna-Torres VA, Pérez-Bao J, Chauca G, Sovero M, Blichtein D, Chunga A, et al. Epidemiology of transfusiontransmitted infections among multi-transfused patients in seven hospitals in Peru. J Clin Virol. 2005; 34(Suppl 2): s61-68.
69.Ruiz R, Jaimes A, Montejo G, Hinostroza-Sjogren M. Marcadores serológicos de hepatitis viral en la región amazónica del Perú estudio de una población representativa.Rev Diagnóstico. 1989; 24(1/2): 5-9.
70.Casey JL, Niro GA, Engle RE, Vega A, Gómez H, McCarthy M, et al. Hepatitis B virus (HBV)/hepatitis D virus (HDV) coinfection in outbreaks of acute hepatitis in the Peruvian Amazon basin: the roles of HDV genotype III and HBV genotype F. J Infect Dis. 1996; 174(5):920-26.
71.Hoft RH, Pflugfelder SC, Forster RK, Ullman S, Polack FM, Schiff ER. Clinical evidence for hepatitis B transmission resulting from corneal transplantation. Cornea. 1997; 16(2):132-37.
72.Turner DP, Zuckerman M, Alexander GJ, et al. Risk of inappropriate exclusion of organ donors by introduction of hepatitis B core antibody testing.Transplantation 1997; 63(5): 775-777.
73.Caldwell SH. Hard times and imperfect organs. Liver Transplant Surg. 1997; 3(2):181-84.
74.Sitrin RD, Wampler DE, Ellis RW. Survey of licensed hepatitis B vaccines and their production processes. In Ellis RW (ed). Hepatitis B Vaccines in Clinical Practice. New Cork, Marcel Dekker,1993, pp 83-101.
75.Francis DP, Feorino PM, McDougal S, et al. The safety of the hepatitis B vaccine. Inactivation of the AIDS virus during routine vaccine manufacture. JAMA. 1986; 256(7):869-72.
76.- Madaliñski K, Sylvan SP, Hellstrom U, et al. Presence of anti-preS1, anti-preS2, and anti-HBs antibodies in newborns immunized with Bio-Hep-B vaccine. Med Sci Monit. 2004 Jan;10(1):PI10-7
77. Rendi-Wagner P, Shouval D, et al. Comparative immunogenicity of a PreS/S hepatitis B vaccine in non- and lowresponders to conventional vaccine. Vaccine. 2006 Apr 5;24(15):2781-9. Epub 2006 Jan 19.) .
78.Diez-Delgado J, Dal-Ré R, Llorente M, González A, López J. Hepatitis B component does not interfere with the immune responseto diphtheria, tetanus and whole-cell Bordetella pertussis components of a quadrivalent (DTPw-HB) vaccine: a controlled trial in healthy infants. Vaccine. 1997 ;15 (12-13):1418-22.
79.West DJ, Hesley TM, Jonas LC et al. Safety and immunogenicity of a bivalent Haemophilus influenzae type b/hepatitis B vaccine in healthy infants. Hib-HB Vaccine Study Group. Pediatr Infect Dis J. 1997;16(6):593-9
80.Shaw FE Jr, Guess HA, Roets JM, et al. Effect of anatomic injection site, age and smoking on the immune response to hepatitis B vaccination. Vaccine. 1989;7(5):425-30.
81.Bryan JP, Sjogren MH, Perine PL, Legters LJ. Low-dose intradermal and intramuscular vaccination against hepatitis B. Clin Infect Dis. 1992; 14(3):697-707.
82.Melnick JL.Thermoestability of poliovirus, measles and hepatitis B vaccines. Vaccine 1995; Res 4:1-11.
83.Van Damme P, Cramm M, Safary A, Vandepapelière P, Meheus A. Heat stability of a recombinant DNA hepatitis B vaccine. Vaccine. 1992;10(6):366-7.
84.Galazka, A., Milstein, J., Zaffaran, M. Thermostability of vaccines. World Health Organization, Geneva. WHO/GPV/98.07.Geneva, WHO, 1998.
85.Hadler SC, Margolis HS. Hepatitis B immunization: vaccine types, efficacy, and indications for immunization. Curr Clin Top Infect Dis. 1992;12:282-308.
86.Courseget P, Kane M. Overview of clinical studies in developing countries. In Ellis RW (ed). Hepatitis B vaccines in Clinical Practice. New York, Marcel Dekker,1993.pp209-228.
87.- Goldfarb J, Baley J, Medendorp SV, et al.Comparative study of the immunogenicity and safety of two dosing schedules of Engerix-B hepatitis B vaccine in neonates. Pediatr Infect Dis J. 1994; 13 (1):18-22
88.- Halsey NA, Moulton LH, ODonovan JC, et al. Hepatitis B vaccine administered to children and adolescents at yearly intervals. Pediatrics. 1999 Jun;103(6 Pt 1):1243-7.
89.Jilg W, Schmidt M, Deinhardt F.. Vaccination against hepatitis B: comparison of three different vaccination schedules. J Infect Dis. 1989;160(5):766-9.
90.Milne A, Moyes CD, Allwood GK, Pearce NE, Krugman S. Antibody responses to recombinant, yeast-derived hepatitis B vaccine in teenage New Zealand children. N Z Med J. 1988;101(840):67-9.
91.André FE. Overview of a 5-year clinical experience with a yeast-derived hepatitis B vaccine. Vaccine. 1990;8 Suppl:S74-8; discussion S79-80.
92.Collier AC, Corey L, Murphy VL, Handsfield HH. Antibody to human immunodeficiency virus (HIV) and suboptimal response to hepatitis B vaccination. Ann Intern Med. 1988; 109(2):101-5.
93.Alper CA, Kruskall MS, Marcus-Bagley D, et al. Genetic prediction of nonresponse to hepatitis B vaccine. N Engl J Med. 1989;321(11):708-12
94.Zajac BA, West DJ, McAleer WJ, Scolnick EM. Overview of clinical studies with hepatitis B vaccine made by recombinant DNA. J Infect. 1986;13 Suppl A:39-45.
95.André FE.Summary of safety and efficacy data on a yeast-derived hepatitis B vaccine. Am J Med. 1989;87(3A):14S-20S.
96.McLean AA, Hilleman MR, McAleer WJ, Buynak EB. Summary of worldwide clinical experience with H-B-Vax (B, MSD). J Infect. 1983 Jul;7 Suppl 1:95-104
97.Institute of Medicine Vaccine Safety Comité.Stratton KR,Howe CJ, Johnston RB Jr (ed). Adverse events associated with childhood vaccines:evidence bearing on causality. Hepatitis B vaccines. Washington, DC 1994, National Academy Press, pp 211-235.
98.McMahon BJ, Helminiak C, Wainwright RB, et al. Frequency of adverse reactions to hepatitis B vaccine in 43,618 persons. Am J Med. 1992;92(3):254-6
99.Ascherio A, Zhang SM, Hernán MA, et al. Hepatitis B vaccinationand the risk of multiple sclerosis. N Engl J Med. 2001;344 (5):327-32
100.Confavreux C, Suissa S, Saddier P, et al. Vaccinations and the risk of relapse in multiple sclerosis. Vaccines in Multiple Sclerosis Study Group. N Engl J Med. 2001;344(5):319-26.
101.Levy M, Koren G. Hepatitis B vaccine in pregnancy: maternal and fetal safety.Am J Perinatol. 1991;8(3):227-32.
102.Zambrano B. Consideraciones generales sobre el mercurio, el timerosal, y su uso en vacunas pediátricas. Rev Med Uruguay 2004; 20: 4-11
103- Ball LK, Ball R, Pratt RD. An assessment of thimerosal use in childhood vaccines. Pediatrics 2001; 107: 1147-54.
104.Pichichero M E, Cernichiari E, Lopreiato J, Treanor J. Mercury concentrations and metabolism in infants receiving vaccines containing thiomersal: a descriptive study. Lancet 2002; 360: 1737-41.
105.Hviid A, Stellfeld M, Wohlfahrt J, et al. Association Between Thimerosal – containing Vaccine and autism. JAMA. 2003;290(13):1763-6
106.Madsen K, Lauritsen M, Pedersen C, et al. Thimerosal and Occurrence of Autism: Negative Ecological Evidence From Danish Population – Based Data. Pediatrics 2003; 112: 604 – 606
107.Heron J, Golding and ALSPAC Study team. Thimerosal Exposure in Infants and Developmental Disorders: A Prospective Cohort Study in the United Kingdom Does Not Support a Causal Association. Pediatrics 2004; 114: 577– 583.
108.-Parker, S, Schwartz B, Todd J, et al. Thimerosal Containing Vaccines and Autistic Spectrum Disorder: ACritical Review of Published Original Data. Pediatrics 2004; 114: 793 – 804.
109.World Health Organization. Global Advisory Committee on Vaccine Safety.Thimerosal: neurobehavioural studies in animal models. WER 2005; 80: 1-8.
110.World Health Organization. Meeting Report. Thimerosal in vaccines: A regulatory perspective. Geneva, 15-16 April 2002.111.WHO: http://www.who.int/vaccine_safety/topics/thiomersal/statement_jul2006/en/index.html
112.Schechter,R, Grether, J. Continuing Increases in Autism Reported to Californias Developmental Services System Mercury in Retrograde. Arch Gen Psychiatry. 2008;65:19-24
113.- Chung CJ, Hussain M, Lok ASF. Quantitative serum HBV DNA leveles during differents stages of chronic hepatitis B infection. Hepatology 2002; 36:1408-1415.
114.Liaw YF, Leung N. Guan R, Lau GKK, Merican I et al. Asian- Pacific Consensus statement on the management of chronic hepatitis B: a 2005 update. Liver International 2005;25:472-489
115.Keeffe EB., Dieterich DT., Hans SH. Et al. A treatment algorithm for the management of chronic hepatitis B virus infection in the United States. Clin Gastroenterol Hepatol . 2004;2:87-106.
116.Zhao S, Xu Z, Lu Y. A mathematical model of hepatitis B virus transmission and its application for vaccination strategy in China. Int J Epidemiol. 2000; 29(4): 744-52.
117. Keefe EB., Dieterich Pawlotsky J.M. et al. Chronic hepatitis B; preventing, detecting and managing. Viral Clin Gastr 2008; 6(5): 268-274.
118.Zhiqiang G, Zhaohui D, Qinhuan W, Dexian C, YunyunF, Hongtao L, et al. Cost of chronic hepatitis B infection in China. J Clin Gastroenterol. 2004; 38 (10 Suppl) S175-78.
119. Cabezas C, Echevarria C, Gómez G, Gotuzzo E. Programa piloto de inmunizacion contra hepatitis viral B, integrado al Programa Ampliado de Inmunización (PAI) en Abancay (Perú). Rev Gastroenterol Peru. 1995; 15(3): 215-22.
120.Cabezas C, Ramos F, Vega M, Suárez M, et al. Impacto del programa de vacunación contra hepatitis B integrado al PAI en Huanta Perú 1994- 1997. Rev Gastroenterol Peru. 2000; 20(3): 201- 12.
121. Cabezas C.. Hepatitis Viral B Y Delta en el Perú:Epidemiología y Bases para su control Rev Peru Med Exp Salud Publica. 2007; 24(4):378-397
CORRESPONDENCIA
César Cabezas Sánchez
salljaruna@yahoo.com