Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.25 no.3 Lima July/set. 2008
ARTÍCULO ORIGINAL
Efecto de Uncaria tomentosa (Uña de gato) sobre la población y activación de células dendríticas en sangre periférica de pacientes con artritis reumatoidea
Effect of Uncaria tomentosa (Cat´s claw) over dendritic cells population and activation in peripheral blood of rheumatoid arthritis patients
César Núñez Ponce1 ; Iván Lozada-Requena2 ; Isabel Akamine Panez3 ; Luz Carbajal Arroyo4 ; José Luis Aguilar Olano5
1 Médico Cirujano. Sección de Inmunología, Departamento Académico de Microbiología, Facultad de Ciencias y Filosofía Alberto Cazorla – Universidad Peruana Cayetano Heredia, Lima, Perú.
2 Biólogo. Sección de Inmunología, Departamento Académico de Microbiología, Facultad de Ciencias y Filosofía Alberto Cazorla – Universidad Peruana Cayetano Heredia, Lima, Perú.
3 Facultad de Medicina Humana, Universidad Peruana Cayetano Heredia, Lima, Perú.
4 MSc. en Administracion en Salud. Departamento Académico de Estadística - Universidad Peruana Cayetano Heredia, Lima, Perú.
5 Médico Reumatólogo-Inmunólogo. Consultorio de Reumatología - Hospital Nacional Cayetano Heredia, Lima, Perú. Departamento Académico de Microbiología, Facultad de Ciencias y Filosofía Alberto Cazorla – .Universidad Peruana Cayetano Heredia, Lima, Perú.
RESUMEN
Introducción: la artritis reumatoide (AR) es una enfermedad autoinmune caracterizada por un proceso inflamatorio crónico articular. En los últimos años se está resaltando la importancia de las células dendríticas en AR, debido a su capacidad de presentar autoantígenos y estimular a linfocitos T autoreactivos. En este estudio se ensayó la capacidad de Uncaria tomentosa (Uña de Gato, UG), una planta peruana con propiedades inmunomoduladoras, sobre la población de células dendríticas circulantes y sobre la expresión de sus moléculas de maduración y coestimulación.
Objetivos: determinar la población de células dendríticas (DC) de origen mieloide (DCm) y plasmocitoide (DCp) por citometría de flujo en pacientes con AR. Evaluar la variación en la expresión de moléculas HLA-DR y CD86 en ambas subpoblaciones celulares expuestas a diferentes concentraciones de un extracto hidroalcohólico de UG con 5% de alcaloides oxindólicos pentacíclicos (UG-POA).
Material y método: se evaluaron DC a partir de muestras de sangre periférica de pacientes con AR y adultos controles sanos, enfrentadas a diferentes concentraciones de UG. Las muestras fueron marcadas con anticuerpos monoclonales específicos, evaluadas por citometría de flujo y analizadas con el software Summit 4.3. El análisis estadístico fue realizado mediante Test de rangos de Friedman para muestras relacionadas, Test T de student y Prueba de Tendencias y Análisis de Medidas Repetidas.
Resultados: encontramos que UG-POA disminuyó de manera dosisdependiente la subpoblación de DCm de sangre periférica de pacientes con AR, sin afectar la subpoblación de DCp y aumentó la expresión de las moléculas HLA-DR y CD86 en DCm.
Conclusiones: la UG-POA disminuye la subpoblación de DCm, mientras incrementa la expresión de moléculas HLA-DR y CD86 en pacientes con AR definida. Estos hallazgos añadirían un mecanismo adicional al efecto inmuno-modulador de la UG en procesos inflamatorios crónicos.
Palabras clave: artritis reumatoide, células dendríticas, uña de gato.
ABSTRACT
Introduction: Rheumatoid arthritis (RA) is an autoimmune disease characterized by a chronic inflammatory process within the joints. Recently, the importance of dendritic cells (DC) has been emphasized in this condition due to their remarkable ability for presenting autoantigens and for stimulating auto-reactive T-cells. The ability of Uncaria tomentosa (Cats claw), a native Peruvian plant with immune-modulating properties on the circulating dendritic cell population and on their maturation and co-stimulation capacities was assessed.
Objectives: To determine subsets of myeloid and plasmacytoid dendritic cells (mDC and pDC, respectively) in patients with RA with the use of flow cytometry. To evaluate variations in the expression of HLA-DR and CD86 molecules in both subsets of DC in response to different concentrations of a hydro-alcoholic extract of Cat´s claw with 5% of pentacyclic oxindole alkaloids.
Materials and methods: Peripheral blood dendritic cells were taken from RA patients and healthy controls, and they were incubated with different concentrations of Cat´s claw. Then, cells were labeled with specific monoclonal antibodies and they were separated using flow cytometry and they were analyzed with a Summit 4.3. software. Statistical analysis was performed using Friedman´s, T-student, trends and repeat measure analysis tests.
Results: We found that Cat´s claw extract decreased in a dose-dependent fashion mDC population in the peripheral blood of RA patients without affecting pDC, and it also increased HLA-DR and CD86 expression on mDC.
Conclusions: Cat´s claw reduced the mDC subset, while it increased HLA-DR and CD86 expression in RA patients. This is an additional mechanism for the known immune-modulating effect of Cat´s claw in chronic inflammatory conditions.
Key words: Rheumatoid arthritis, Dendritic Cells, Cat´s claw.
INTRODUCCIÓN
La artritis reumatoidea (AR) es la enfermedad difusa del tejido conectivo (EDTC) más prevalente a nivel global1,2. En Perú, dos estudios poblacionales: uno en el distrito de San Juan de Miraflores estimó una prevalencia del 1%, y otro en el distrito de Villa El Salvador encontró una prevalencia menor de 1%2,3, similares a la prevalencia mundial. Otro estudio realizado por el Servicio de Reumatología del Hospital Guillermo Almenara el 2007, siguiendo pautas de la Organización Mundial de la Salud (OMS) y de la International League of Rheumatology Associations (ILAR), basado en 12 mil personas, encontró una prevalencia de 0,5% en Perú4.
La AR es una enfermedad autoinmune caracterizada por una inflamación crónica sinovial, que desde el punto de vista de la etiopatogenia inmunológica corresponde a una alteración del proceso de presentación de antígenos propios por parte de las células presentadoras de antígenos (CPA), quienes consecuentemente activan a linfocitos T autoreactivos y desencadenan la liberación de citoquinas proinflamatorias y la posterior destrucción del cartílago articular, con erosiones óseas y deformaciones articulares2. Las CPA más importantes y especializadas en la presentación de antígenos son las células dendríticas (DC), aunque también pueden cumplir esa función los macrófagos y linfocitos B5,6. Actualmenteexiste un gran interés en las DC en diferentes tipos de enfermedades humanas debido a su rol crucial en la activación de linfocitos T y B, células NK e incluso en el proceso de activación/desactivación de linfocitos T reguladores, siendo un importante condicionante de la activación o tolerancia hacia antígenos propios7.
Normalmente existen dos grandes poblaciones de DC: de tipo mieloide (DCm) y plasmocitoide (DCp). Las DCm se caracterizan por producir citoquinas proinflamatorias como IL-12, TNF-α e IL-6 y participar principalmente en respuestas antibacterianas; mientras que las DCp son productoras de grandes cantidades de IFN-α por lo que participan activamente en defensa contra infecciones virales canalizando la activación de LT CD8.Se han encontrado ambas subpoblaciones de DC presentes en el fluido sinovial de pacientes con AR, sin embargo, las DCp son menos frecuentes y presentan un fenotipo menos maduro que las DCm al igual que las DC de circulación sanguínea, por lo cual podrían ser menos importantes en la presentación de auto-antígenos y por lo tanto en la inmuno-patogenia de AR8,9. El reclutamiento de estas dos subpoblaciones esta condicionado a los receptores para quimioquinas que expresan cada una de ellas y a la producción de estas quimioquinas en el tejido blanco, en este caso, el tejido sinovial8,9. Al llegar al fluido sinovial las DC maduran no solo debido a la presencia de GM-CSF, TNF-α e IL-13, sino también gracias a la acción de otros precursores mielo-dendríticos presentes en la sinovia articular, como la fibronectina o los hialuronanos. Una vez maduras, las DC deben expresar moléculas accesorias como las moléculas HLA-DR, CD80 y CD86, necesarias para la activación e inducción de la maduración del linfocito T naive (virgen)8.
Efectivamente, se ha encontrado en el fluido y tejido sinovial reumatoides que entre el 20 al 45% de células mononucleares denominadas no T corresponden a células CD33+CD14dim las cuales por su morfología corresponderían a DC. Estas células en el tejido sinovial expresan constitutivamente HLADQ, ICAM-1 (CD54), CD58, CD40 y B7 (CD80/CD86) y cantidades incrementadas de HLA-DR y MHC-I a diferencia de las células CD33+CD14dim de sangre periférica, además que tienen mejor capacidad para la presentación de antígenos a los linfocitos T infiltrantes de sinovia7. O sea en el tejido y fluido sinoviales se encuentran más DC, maduras y con alta capacidad de activación de linfocitos T autoreactivos. Por lo antes indicado, las DC son piezas clave en el proceso de activación de los linfocitos T autoreactivos que a su vez permiten la progresión de enfermedades autoinmunes como la AR.
Actualmente existe una amplia gama de esquemas terapéuticos para AR incluyendo diferentes agentes inmunomoduladores que actúan bloqueando inespecíficamente las células en rápida replicación (como son los linfocitos T activados) como methotrexate y otros, o agentes más específicos como anticuerpos monoclonales dirigidos contra citoquinas que son críticas en el proceso etiopatogénico de la AR, como los anticuerpos anti-TNF-α o anti-IL-1. Sin embargo, estos productos con cierta frecuencia producen efectos colaterales, o algunos de ellos sus precios están totalmente fuera del alcance de la mayoría de los pacientes, por lo que es importante investigar el uso de tratamientos alternativos o de uso paralelo a las drogas remisivas ya conocidas, como es el caso de los productos naturales.
Recientemente nuestro grupo ha descrito efectos inmunomoduladores de extractos estandarizados de Uncaria tomentosa (Uña de gato, UG), demostrándose a nivel biológico su capacidad para la inhibición de procesos inflamatorios en animales de laboratorio, así como a nivel celular la inhibición en la producción de TNF-α en células animales o humanas en cultivo o la inhibición de la expresión de ICAM-1, una molécula de adhesión crítica en la quimio-atracción de las células inflamatorias hacia el tejido inflamado9-11. Así como a nivel molecular, varios autores han demostrado la inhibición de mecanismos intracelulares vía el factor de transcripción NF-kB 12. Otros autores también han mostrado actividad de extractos de UG en la inhibición de otras citoquinas claves en el proceso inflamatorio como IL-1, IL-613.
Un aspecto interesante es que coincidentemente los mecanismos inhibidos por los extractos de UG también están implicados en la etiopatogenia de la AR por lo que resulta importante su evaluación.
Algunos estudios nacionales y extranjeros han mostrado una buena respuesta clínica de pacientes con AR al uso de diferentes extractos de UG14. Castañeda y col en un estudio multicéntrico doble ciego evaluó un producto de UG en 70 pacientes peruanos con AR, encontrando una buena respuesta en la evaluación clínica en la mayoría de pacientes14. Un estudio de Mur y col en el hospital Universitario de Innsbruck, Austria, evaluó 40 pacientes con AR severa que estaban recibiendo sulfasalazina e hidroxicloroquina y que fueron aleatoriamente asignados a recibir placebo o un extracto estandarizado de UG adicionalmente. Los resultados mostraron que hubo una mejoría clínica significativamente mayor en el grupo UG comparado al grupo placebo15.
Dado el crítico rol de las DC en AR, nuestro estudio ha evaluado el efecto de un extracto estandarizado de UG sobre las subpoblaciones de DC y la expresión de sus principales moléculas de maduración y activación en pacientes peruanos con diagnóstico definido de AR. Es posible que además de actuar sobre algunos de los mecanismos previamente demostrados, la UG también pueda influenciar en el comportamiento de las DC en pacientes con AR.
Específicamente hemos determinado la cantidad de DC de origen mieloide (DCm) y plasmocitoide (DCp) por la técnica de citometría de flujo en pacientes con AR sin tratamiento previo y su efecto sobre la expresión de moléculas HLA-DR y CD86 en ambas sub-poblaciones celulares expuestas o no a diferentes concentraciones de un extracto hidro-alcohólico estandarizado de Uncaria tomentosa (UG).
MATERIAL Y MÉTODO
Personas
Se captaron pacientes que concurrieron al Consultorio de Reumatología de la Clínica Médica Cayetano Heredia y del servicio de inmuno-reumatología del Hospital Nacional Cayetano Heredia, que cumplían diagnóstico definido de AR según los criterios del American College of Rheumatology (ACR). Como criterio de inclusión adicional se tuvo en cuenta que el paciente con AR no hubiera recibido ningún tratamiento remisivo ni corticoesteroides por al menos seis meses previos a la toma de la muestra, ni presente alguna otra patología asociada. Personas adultas sanas de ambos sexos fueron incluidos en el estudio como controles normales.
Previa firma del consentimiento informado, los pacientes donaron 4cc de sangre periférica en un tubo vaccutainer con anticoagulante, según la técnica convencional de toma de muestra. Este estudio cumplió los principios éticos estipulados en la Declaración de Helsinki, 2000 acerca de la investigación médica que involucra a seres humanos y ha sido aprobado por el Comité Institucional de Ética de la Universidad Peruana Cayetano Heredia (Código No. 52185).
Extracto hidroalcohólico de Uncaria tomentosa estandarizado al 5% de alcaloides oxindólicos pentacíclicos (UG-POA)
Se utilizó un extracto hidro-alcohólico obtenido a partir de la corteza de UG, en forma de un polvo fino color marrón rojizo. Este preparado fue proporcionado cordialmente por CIFARMA SA (lote Nº 0008000345) y contenía 5% de alcaloides oxindólicos pentacíclicos (POA), cuantificados por cromatografía líquida de alta performance (HPLC).
Se preparó una solución stock de UG-POA a partir del polvo fino pesando 30 g del polvo, el cual se agregó a un matraz de 5L y se diluyó en 1L de agua bidestilada, dejando hervir la mezcla por 30 minutos. Se obtuvo entonces una solución de aspecto similar al vino tinto con restos sólidos visibles después de dejar en reposo la solución. Una vez enfriada se decantó la solución, luego fue filtrada dos veces en papel Whatman Nº 3 y finalmente microfiltrada en cabina de flujo laminar con filtro de 0,22 um. De este último filtrado se obtuvo una solución más transparente y de color amarillo pálido (solución stock), la cual fue conservada a –70ºC.
Tratamiento de las muestras de sangre con el extracto de UG-POA
Se establecieron los siguientes grupos de muestras:
Grupo 1: Muestra de sangre de paciente normal sin tratamiento con UG (control normal)
Grupo 2: Muestra de sangre de paciente con AR sin tratamiento con UG
Grupos 3 - 6: Muestra de sangre de paciente con AR con tratamiento con UG*
*Se prepararon cuatro concentraciones UG a partir de las soluciones stock, obteniéndose las siguientes concentraciones finales:
Se agregó 200 μL de sangre periférica (pipeteo reverso) en tubos para citometría según los grupos establecidos.
Seguidamente se añadió 100 μL de las concentraciones de UG a los tubos correspondientes a los grupos 3 a 6.

Luego los 6 tubos fueron incubados a 37ºC con 5% de CO2 por 4h.
Ensayo de citometría de flujo para la cuantificación de células dendríticas y determinación de HLA-DR y CD86 en sangre periférica humana
Se utilizaron anticuerpos monoclonales: Anti-HLA-DRPerCP (Código 347364 – BD), Anti-CD11c APC (Código 340544 – BD), Lineage cocktail 1 (lin 1) – FITC (Código 340546 – BD), Anti-CD86 – PE (Código 555658 – BD), Bovine Serum Albumin (BSA 1 %), FACS lysing solution (10x) (Código 349202 – BD), Cell Fix (Código 340181 – BD ), tubos para citometría, refrigeradora 2 – 8 ºC, incubadora de CO2, vortex, micropipetas, tips y gradillas.
Procedimiento para la citometría de flujo
La medición de citometría de flujo se realizó luego de transcurridas las 4h de incubación, momento en el que se agregó los anticuerpos monoclonales: Anti-Lin-1 (7μL), Anti-HLA-DR (5 uL), Anti-CD11c (5uL), Anti-CD86 (5μL).
Posteriormente cada tubo para citometría fue incubado por 30 min a 4Cº, luego se agregó 3mL de FACS LYSING (solución de lisado de glóbulos rojos) utilizando el vortex. Nuevamente se incubó por 5min a temperatura ambiente y en oscuridad, para luego centrifugar cada muestra a 1500 rpm por 10 min, descartándose el sobrenadante. Se lavó 2 veces con 2mL de CELL WASH a 1800 rpm por 5 min, también descartándose el sobrenadante. Finalmente el pellet fue resuspendido con 500 uL de CELL FIX y guardado a 4Cº hasta su lectura en el citómetro de flujo.
La adquisición y análisis de los datos, se realizó usando un citómetro de flujo FACSCalibur (BD Immunocytometry Systems, USA) y analizadas con el software Summit 4.3.
Análisis estadístico
El análisis estadístico comparativo de los datos se realizó utilizando el test de rangos de Friedman para muestras relacionadas y la prueba t-student , usando el software estadístico SPSS v10 y la prueba de Tendencias y Análisis de Medidas Repetidas, utilizando el software estadístico STATA v10. Se consideró un valor estadísticamente significativo si p<0,05.
RESULTADOS
Se evaluaron cinco pacientes adultos con diagnóstico definido de AR, con un tiempo de enfermedad promedio de cuatro años. Se tuvieron cinco voluntarios normales que sirvieron como controles sanos.
Efecto de UG-POA sobre la cantidad de las subpoblaciones de DC.
Tal como puede verse en la Figura1, analizando las sub-poblaciones de DC, se aprecia que los pacientes con AR presentan mayor número de DCm que el grupo control normal, sin embargo, esta diferencia no fue estadísticamente significativa. Para la población de DCp no se apreció diferencia entre pacientes y controles.
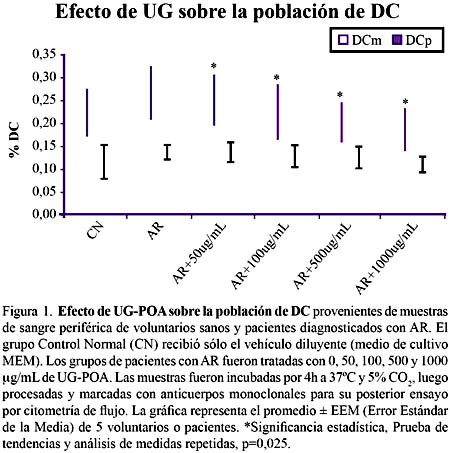
Analizando la población de DCm de los pacientes con AR se aprecia que con el tratamiento con UG-POA a las concentraciones de 50, 100, 500 y 1000 μg/mL existe una disminución del porcentaje de DCm, que muestra una clara relación dosis-dependiente (p=0,025).
En relación a las DCp la evaluación estadística indica que no existe diferencia significativa entre los grupos control, pacientes con AR y pacientes con AR tratados con la UGPOA, por lo que podemos indicar que la UG-POA no alteró a la subpoblación de DCp. Figura 1.
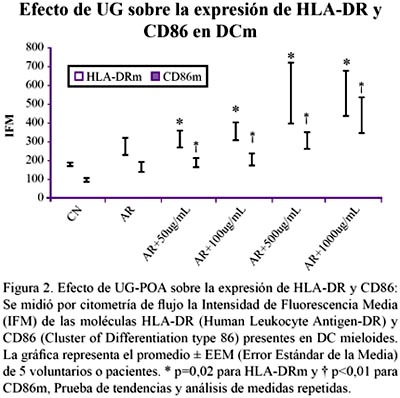
Efecto de UG sobre la expresión de las moléculas HLA-DR y CD86 en la superficie de DCm y DCp
Ambas moléculas de activación (HLA-DR y CD86) se expresan en mayor cantidad en el grupo de pacientes con AR que en el grupo control normal (p=0,037 y p=0,023, respectivamente). Además HLA-DR y CD86 presentan un incremento dosis-dependiente en su expresión a las concentraciones de UG-POA de 50, 100, 500 y 1000 μg/mL (p=0,02 y p<0,01, respectivamente), ambas comparadas con el grupo de pacientes con AR que no recibieron UG-POA. Figura 2.
Encontramos que las DCp expresan niveles de HLA-DR y CD86 similares en los grupos control normal, pacientes con AR sin y con UG-POA, por lo que se concluye que la UG-POA no tiene un efecto sobre estas moléculas en la subpoblación de DCp. Figura 3.
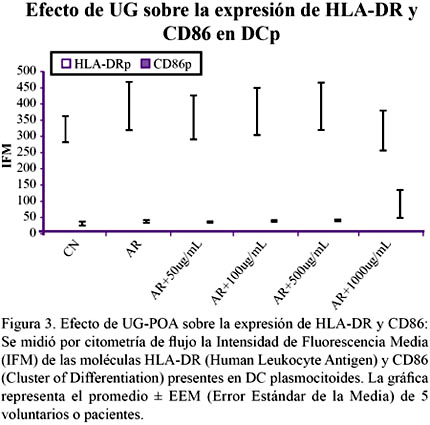
Además se observó que los niveles de CD86 en las DCp prácticamente se encuentran en cantidades basales y que a pesar que a la concentración de 1000 μg/mL se muestra un ligero incremento, éste no resultó significativo comparado con el control normal ni con el grupo de pacientes con AR.
DISCUSIÓN
Los resultados muestran que el extracto hidroalcohólico de Uncaria tomentosa estandarizado al 5% de alcaloides oxindólicos pentacíclicos tiene efecto sobre las DC de pacientes con AR, causando una disminución dosisdependiente en el porcentaje promedio de DCm de sangre periférica (p=0,025). Esta evidencia resulta muy importante porque justamente son estas células (DCm) las que migran al tejido y fluido sinoviales para ocasionar la activación de linfocitos T autoreactivos7. Este hallazgo podría interpretarse como una evidencia más del efecto inmuno-modulador a nivel celular de la UG sobre AR.
Adicionalmente, hemos demostrado que la UG-POA induce una sobre-expresión estadísticamente significativa de HLADR y CD86 en un efecto también dosis-dependiente.
Las DCm al expresar incremento en las moléculas de activación y coestimulación, estarían con mayor capacidad para la presentación de autoantígenos, y por lo tanto favorecerían la autoinmunidad. Este resultado podría interpretarse como un efecto contradictorio con el reportado efecto mejorador de la UG en pacientes con AR. Sin embargo, debe tenerse en cuenta que este efecto se está demostrando en DC de sangre periférica, no en DC de sinovia articular. Y esto es un mecanismo importante inmuno-patogénicamente, ya que si las DC maduran y se activan previo a su llegada al tejido blanco de ataque (o sea a la sinovia articular), entonces no podrán llegar a la sinovia articular, y de esa manera se inhibirá su efecto inductor de autoinmunidad. Este mecanismo de disminuir la capacidad del sistema inmune para activarse y tener un efecto nocivo ha sido previamente demostrado en la defensa contra enfermedades neoplásicas, donde células tumorales no son destruidas por el sistema inmune debido a una maduración anticipada de las DC que impide su llegada al tejido tumoral y la presentación eficiente de antígenos tumorales a los linfocitos T16.
Entonces, nuestro hallazgo está sugiriendo que la UG-POA produce una aceleración en la maduración y activación de las DCm ubicadas en sangre periférica, por lo cual estas DCm disminuirían o retardarían su llegada al tejido o fluido sinovial y evitarían el daño sinovial. En todo caso esta hipótesis requiere mayor comprobación.
La disminución de DCm dosis-dependiente no puede atribuirse a algún efecto citotóxico o pro-apoptótico de UGPOA; debido a que previamente hemos determinado que el IC50 (Concentración Inhibitoria al 50%) para este mismo extracto es de 16 000 ug/mL y que a las concentraciones utilizadas en este estudio no se induce apoptosis11.
El hallazgo de ausencia de efecto de la UG-POA en la subpoblación de DCp, es intrascendente, dado que estudios previos han mostrado que las que cumplen un rol crítico en pacientes con AR son las DCm y no las DCp8.
CONCLUSIONES
La UG-POA ha demostrado influir en varios mecanismos inmunológicos como la inhibición de la producción de citoquinas proinflamatorias (TNF-α, IL-1, IL-6), inhibición de la expresión de ICAM-1, inhibición de la activación de NF-kB, inhibición de la enzima COX y ahora la alteración y aceleramiento del mecanismo de maduración/ activación de la subpoblación de DC patogénicamente importantes (DCm). Todos estos mecanismos claramente son importantes en la inmuno-patogenia de AR, y por lo tanto se justifica la evaluación clínica del uso de extractos estandarizados de UG en esta patología, individualmente o en asociación con los agentes remisivos de uso actual.
REFERENCIAS BIBLIOGRÁFICAS
1. Aguilar J y Vega E. La uña de gato, un camino por recorrer. Rev. Perú Reum. 1998; 4(1): 5 – 6.
2. Quevedo H, Vidal L, Castañeda L. Artritis reumatoide: una enfermedad con prevalencia homogénea. Rev. Peru Reum. 1995; 1(1): 40 – 1.
3. Aguilar JL, Sánchez E, Salcedo F, Burneo G, Sánchez D, Proaño C. Estudio poblacional de la frecuencia de enfermedades reumáticas en adultos mayores de 50 años. Bol. Asoc Per Reum. Libro de Resúmenes del VIII Congreso Peruano y XIII Curso Internacional de Reumatología. Cusco. Perú Setiembre 1994:A21
4. Imágenes.rpp.com, Medicamentos biológicos detienen evolución de artritis reumatoide [sede Web]. Lima: Imágenes. rpp.com; 2007- [actualizada el 13 de febrero de 2008; acceso 15 de febrero de 2008]. Disponible en: http://images.rpp.com.pe/portada/agenda_empresarial/108286_1.php
5. Kasper, Braunwald, Fauci, Hauser, Longo, Jameson. Artritis reumatoide. trastornos del sistema inmunitario, tejido conectivo y articulaciones. Harrison, Principios de Medicina Interna. 2005. pg. 2166-2175. McGraw Hill.
6. Croft M, Duncan D, Swain SL. Response of naive antigenspecific CD4+ T cells in vitro: Characteristics and antigenpresenting cell requeriment. J Exp Med. 1992;176:1431-1437.
7. Thomas R, Davis L S, and Lipsky P E. Rheumatoid synovium is enriched in mature antigen-presenting dendritic cells. J Immunol 1994; 152:2613 – 2622.
8. Falgarone G, Jaen O, Boissier M-C and Breban M. Dialogue entre les lymphocytes et les cellules dendritiques au cours de linflammation rhumatoïde. Rev Rhum 2005; 72:297–302.
9. Le Bon A, Etchart N, Rossmann C, Ashton M, Hou S, Gewert D, Borrow P & Tough D F. Cross-priming of CD8+ T cells stimulated by virus-induced type I interferon. Nature Immunol2003: 4(10): 1009 – 1015.
10. Sandoval M, Charbonnet R, Okuhama N, Roberts J, Krenova Z, Trentacosti M, Miller M J S. Cat´s Claw inhibits TNF-α production and scavenges free radicals: Role in cytoprotection. Free Radical Biol Med 2000; 29 (1): 71-78.
11. Lozada-Requena I. Efecto inmunomodulador de capsaicina y Uncaria tomentosa (uña de gato) sobre la producción del factor de necrosis tumoral de tipo alfa e interleuquina 10 y sobre la inducción de apoptosis en células mononucleares de sangre periférica humanas [Tesis de Magister]. Lima-Perú: Biblioteca Central, Universidad Peruana Cayetano Heredia; 2006.
12. Aguilar J, Rojas P, Marcelo A, Plaza A, Bauer R, Reininger E, Cristoph A K, Merfort I. Anti-inflammatory activity of two different extracts of Uncaria tomentosa (Rubiaceae). J Ethnopharmacol 2002; 81:271-276.
13. Lemaire I, Assinewe V, Cano P, Awang D V C and Arnason J T. Stimulation of interleukin-1 and -6 production in alveolar macrophages by the neotropical liana, Uncaria tomentosa (Uña de Gato). J Ethnopharmacol 1999; 64:109-115.
14. Castañeda O, León G, León D, Calvo A, Chávez J, Escalante J, Luza A, Quevedo H, Sedano O y Vega E. Uña de gato en artritis reumatoide: Estudio doble ciego, en comparación con placebo. Rev Per Reumatol 1998; 4(1): 15-1
15. Mur E, Hartig F, Eibl G and Schirmer M. Ramdomized double blind trial of an extract from the pentacyclic alkaloid-chemotype of uncaria tomentosa for the treatment of rheumatoid arthritis. The J Rheumatol 2002; 29(4): 678 – 681.
16. Pinzon-Charry A, Ho CSK, Maxwell T, et al. Numerical and functional defects of dendritic cells in early- and late-stage breast cancer. Brit J Cancer 2007;97:1251-1259
CORRESPONDENCIA
Iván Lozada-Requena
ilr@upch.edu.pe
Recibido: 01/07/08
Arbitrado: Sistema por pares
Aprobado: 01/08/08













