Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.25 no.3 Lima July/set. 2008
ARTÍCULO ORIGINAL
Resistencia bacteriana en cuidados intensivos y tendencia actual: Departamento de Cuidados Críticos, Servicio de Cuidados Intensivos del Hospital Nacional Guillermo Almenara Irigoyen, Essalud, Lima, Perú, 2004-2006
Antimicrobial resistance in an intensive care unit and current trends: Critical Care Department, IntensiveCare Service of Guillermo Almenara-Irigoyen National Hospital, EsSalud, Lima. Peru, 2004-2006
Enrique Luis Paz Rojas1 ; Darío Ponce de León Pandolfi2 ; Rafael Ramírez Ponce3
1 Médico del Servicio de Cuidados Intensivos. Hospital Nacional Guillermo Almenara I., Essalud, Lima, Perú.
2 Médico asistente Servicio de Medicina Interna N03. Hospital Nacional Guillermo Almenara I., Essalud, Lima, Perú
3 Jefe del Servicio de Microbiología. Hospital Nacional Guillermo Almenara I., Essalud, Lima, Perú
RESUMEN
Introducción: se describe y analiza el comportamiento de los microorganismos más frecuentes en el Servicio de Cuidados Intensivos (UCI) del Hospital Guillermo Almenara Irigoyen, y su sensibilidad/ resistencia a los antibióticos.
Material y método: se identifica gérmenes y la técnica de susceptibilidad empleada, realizado mediante el sistema automatizado Micro Scan Walk Away 96 y paneles MIC Combo NUC entre el periodo 2004 y 2006 de los pacientes hospitalizados en el servicio de Cuidados Intensivos.
Resultados: el Acinetobacter spp. presentó frecuencia creciente, a través de los años de estudio con incremento de su resistencia a los carbapenem en el lapso de tres años desde un 0% en el 2004 hasta cerca del 40 % en el 2006. Los gérmenes más frecuente en vías respiratorias fueron el S. aureus, P. aeruginosa y Acinetobacter y en hemocultivos el S. aureus, Candida sp y el S. epidermides. S. aureus fue el germen más común en la UCI.
Las cepas de S. aureus oxacilino resistentes en la UCI, variaron del 93% al 100% en el ultimo año del estudio. P. aeruginosa y el Acinetobacter son bacterias con resistencia creciente tanto a los antibióticos tradicionales como a los modernos.
Conclusiones: la explosión de infección resistente a antibióticos continúa a nivel mundial y por otro lado la declinación en investigación y desarrollo de nuevos antibióticos hacen sombrío el futuro principalmente de las infecciones graves y más aun en el epicentro de la resistencia como es el área de cuidados intensivos.Ya que los pacientes de UCI tiene alta tasa de complicaciones infecciosas y son expuestos a antibióticos de amplio espectro, la emergencia de resistencia antimicrobiana ha hecho que el uso apropiado de antibióticos sea un objetivo.
Palabras clave: resistencia bacteriana.
ABSTRACT
Introduction: This is a description and analysis of the behavior of most frequently isolated microorganisms in the Intensive Care Unit (ICU) of Gullermo Alemnara-Irigoyen Hospital in Lima. Antimicrobial susceptibility/resistance patterns were also analyzed.
Material and method: Microorganisms were isolated and their antimicrobial susceptibility patters were assessed using a Micro Scan Walk Away 96 automatic system and Combo NUC panels for determining minimal inhibitory concentrations (MIC) in patients hospitalized in the ICU during the period between 2004 and 2006.
Results: Acinetobacter spp. were increasingly isolated, and their resistance to carbapenem antimicrobials rose in a three-year period, from 0% in 2004 to nearly 40% in 2006. Most frequently isolated microorganisms in the respiratory tract were: S. aureus, P. aeruginosa, and Acinetobacter spp.; and S. aureus, Candida spp., and S. epidermidis were the most frequently isolated pathogens in blood cultures. Overall, S. aureus was the most commonly isolated microorganism in the ICU. Oxacillin-resistant S. aureus strains in the ICU had a 93% to 100% frequency in the last year of the study. P. aeruginosa and Acinetobacter spp. have increasing resistance to both traditional and modern antibiotics.
Conclusions: The pandemic of antibiotic resistant infections all over the world, and the decline in research and development of new antibacterial compounds may lead us to a somber future, particularly in cases of severe infections, especially in places most affected by antibiotic resistance, such as the ICUs. Since ICU patients have a high rate of infectious complications and considering they are exposed to wide-spectrum antibiotics, this emergence of antibiotic resistance stresses the urgent need for the appropriate use of antimicrobial agents.
Key words: Bacterial resistance.
INTRODUCCIÓN
En el mes de marzo del 2006 la Sociedad Americana de Enfermedades Infecciosa (IDSA) publicó una lista de choque para enfatizar sobre la importancia de seis gérmenes de alto riesgo no sólo por su virulencia sino por ser resistentes a la mayoría de antibióticos que disponemos. Estos microorganismos multiresistentes son el Staphylococcus áureus resistente a oxacilina, Escherichia coli, Klebsiella spp, Acinetobacter baumanni, Aspergillus spp, Enterococcus faecium y Pseudomonas aeruginosa1.
Asimismo en enero del 2008, esta sociedad llamó la atención a la comunidad médica sobre la epidemia de infecciones resistente a antibióticos en numerosos patógenos como los señalados y la gravedad de las mismas2.
Está demostrado que la mortalidad se incrementa por un tratamiento antibiótico incorrecto3 por lo tanto el tratamiento empírico debe basarse en nuestro mapa epidemiológico de resistencia y susceptibilidad lista de choque que nos permita realizar una selección antibiótica empírica así como implementar las medidas preventivas correspondientes. Sin embargo, es común observar tratamientos equivocados por desconocimiento de las bacterias prevalentes5-7, tratamientos prolongados4, desconocimiento de conceptos farmacodinámicos y farmacocinético8,9 (como penetración tisular de los antibióticos), indicación por la gravedad del paciente y no por la posibilidad del germen causal y desconocimiento de los consensos de tratamientos de las enfermedades más frecuentes10,11. Este uso irracional de antibióticos ha generado un problema creciente a nivel nacional y mundial como es la multiresistencia antibiótica12,13.
Aunque es importante realizar el seguimiento de la resistencia antimicrobiana en una escala global, la información de patrones de resistencia local de los patógenos más prevalentes en regiones y unidades especificas es también necesaria para el desarrollo de guías locales.
A pesar de la importancia extrema de este problema, son pocas las investigaciones existentes sobre este tema tanto a nivel regional como nacional; desde este punto de vista nos proponemos hacer un estudio descriptivo sobre la microbiología y resistencia antimicrobiana en el Servicio de Cuidados Intensivos del Hospital Nacional Guillermo Almenara de las muestras clínicas de los pacientes hospitalizados con sospecha clínica de infección e infectados entre enero del 2004 a diciembre del 2006.
El objetivo del presente estudio fue el de determinar los microorganismos mas frecuentes de pacientes hospitalizados en el Servicio de Cuidados Intensivos del Hospital Nacional Guillermo Almenara Irigoyen en el lapso comprendido entre enero del 2004 – diciembre del 2006. Asimismo determinar su sensibilidad y resistencia a los antibióticos.
MATERIAL Y MÉTODO
Se realizó un estudio descriptivo microbiológico en el Servicio de Cuidados Intensivos del Hospital Guillermo Almenara I. la cual cuenta con 7 camas operativas durante un periodo de tres años (2004-2006) basado en la revisión de los resultados de laboratorio obtenidos de pacientes hospitalizados en la UCI. Se analizó todo tipo de muestra enviada al laboratorio cuyo cultivo fue positivo. Se clasifico como tal, el informado con crecimiento de algún germen, salvo en cultivos de orina o punta de catéteres. En el primer caso se considero positivo el crecimiento de 1 000 00 o más gérmenes (unidades formadoras de colonias).
En el segundo se tomo como positivo todo crecimiento de 15 unidades formadoras de colonias o más. Los gérmenes aislados pueden causar infección o pueden ser solamente colonizantes o contaminantes.
La identificación de especies y la técnica de susceptibilidad empleada se realizaron mediante el sistema automatizado Micro Scan Walk Away 96 y Paneles MIC Combo NUC 35, NC32, PC1A.
Los sitios de infección se definieron como el lugar de donde se aislaron los gérmenes patógenos tales como: vías respiratorias (aspirados endotraqueales, lavado bronquioalveolar, lavado bronquial y tubo endotraqueal), catéteres endovenosos, orina, sangre, fluidos (líquido cefalorraquídeo, líquido peritoneal, liquido biliar, liquido ascitico) y heridas, tejidos y abscesos.
Se calculó la frecuencia de los gérmenes en el Servicio de Cuidados Intensivos, así como la distribución porcentual de gérmenes por tipo de muestra cultivada y finalmente se analizó la sensibilidad/resistencia de los gérmenes.
RESULTADOS
Se aislaron en los tres años de estudio 1 322 bacterias; 490 en el año 2004; 426 en el año 2005 y 406 en el año 2006. El 47,1% de los gérmenes correspondieron a bacterias gram positivas y 52,9% a bacterias gram negativas. Esta proporción se ha mantenido desde los años 2004 a 2006.
Según el tipo de muestra, los hemocultivos, las vías respiratorias y cultivo de catéteres son los lugares con mayor aislamiento de gérmenes, representando el 29,7% 24,3% y 23,7% de las muestras respectivamente.
El germen más frecuentemente aislado en estos tres años, fue el S. aureus, que representó el 24,2%, otras bacterias encontradas fueron P. aeruginosa 14,8%, Acinetobacter spp 10,3%, S. epidermidis 9,9%, K. pneumoniae 8.,4%, E. faecalis 2,6%, E. faecium 3% . Figura 1.
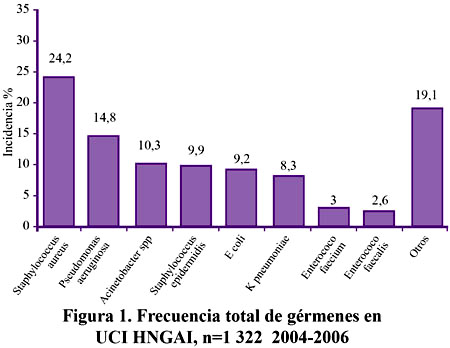
En los años 2004 y 2005, el tercer germen más frecuente fue el S. epidermidis, sin embargo ha sido remplazado en el año 2006 por el Acinetobacter spp, el cual es ahora, la tercera infección mas frecuente en la UCI. Tabla 1.
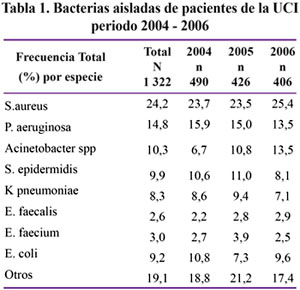
Los gérmenes más frecuentemente aislados de las vías respiratorias fueron el S. aureus (28,9 %), P. aeruginosa (28,5 %), Acinetobacter spp, (16,4 %), Enterobaterias (13,2 %) y otros (12,8 %). Figura 2.
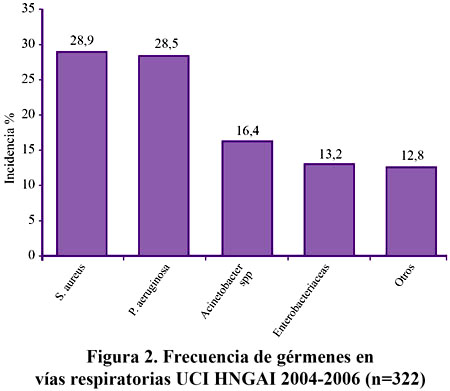
En el año 2004 el tercer grupo de gérmenes mas frecuentes en esta localización eran las enterobacterias, (K pneumoniae, Enterobacter, E.coli y Proteus) sin embargo han sido desplazadas por el Acinetobacter spp que ha aumentado desde un 13% en el 2004 a un 20% en el 2006. Figura 3.
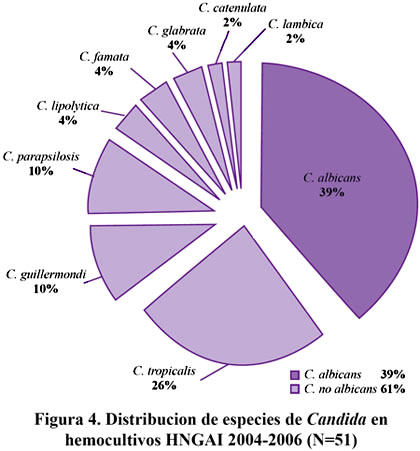
En las muestras de hemocultivos el S. aureus es el germen mas frecuente en el promedio de los tres años (23,9%) seguido por las especies de Candida sp (11,6%) las cuales en el año 2006 presentan una amplia predominancia de las Candida no albicans (80%) como se vé en la Figura 4. Del mismo modo el Acinetobacter spp pasó de una incidencia menor al 5% en el 2004 al segundo lugar de incidencia en el 2006(12,9%), superado sólo por el S. aureus (28,2%).
En la Figura 4 también se muestra la distribución de las especies de Candida en los hemocultivos en el lapso de tres años.
Del 2004 al 2006 de los urocultivos predominó la E. coli (33,9 %), P. aeurogiosa (17,5 %) K. pneumomiae (13,4 %), E. faecium (7,3 %), E. fecalis (6,1 %) y otros (16,6 %). En el caso de los hemocultivos el resultado observado fue S. aeureus (29,4 %), S. epidermidis (25,2 %), Acinetobacter (9,5 %) K. pneumomiae (6,9 %), P. aeuroginosa (6,6 %), E. fecalis (2,1 %) E. faecium (1,6 %) y otros (18,7 %).
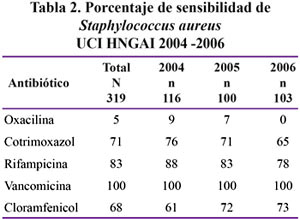
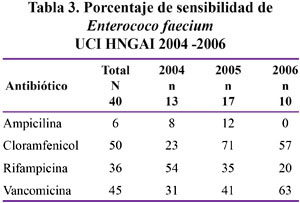
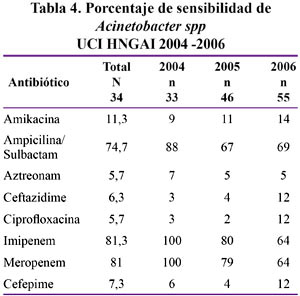
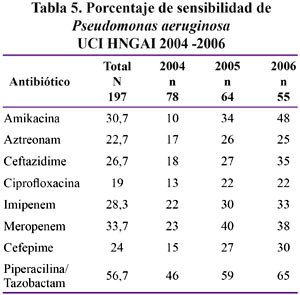
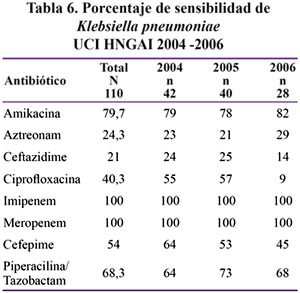
En las Tablas 2 al 6 se muestran los resultados de la sensibilidad a antibióticos, especificado por germen y por año, en el lapso comprendido entre los años 2004 y 2006.
DISCUSIÓN
El ingreso a un hospital representa un riesgo de contraer una infección nosocomial en 5 a 10% y la estancia en una Unidad de Cuidados Intensivos (UCI) incrementa este riesgo en 20 a 40%; por lo que el uso de antibióticos es un tratamiento habitual en el paciente hospitalizado4,14.
Entre el 25 al 40% de los pacientes hospitalizados reciben antimicrobianos, aumentando este porcentaje hasta un 80% en los pacientes ingresados en las áreas criticas (UCI, Unidades de Quemados, shock trauma)14,16.
Es necesario para toda UCI tener conocimiento de la flora que coloniza e infecta a sus pacientes y del nivel de resistencia, sensibilidad y patogenicidad de estas bacterias, mas aun si se conoce que estas varían entre instituciones de una misma región, ciudad o entre diversas áreas de una misma institución17,18
El inadecuado tratamiento antimicrobiano tiene implicancias en la aparición de gérmenes resistentes al igual que implicancias pronosticas de mortalidad6,3. Aunque debemos dejar en claro que la administración prolongada de antibióticos parece ser el factor mas importante en promover la emergencia de resistencia de antibiótico19.
Una de las bases para el tratamiento adecuado de las infecciones, es el conocimiento de la flora bacteriana prevalente y el espectro de resistencia y sensibilidad de estos gérmenes en cada ambiente hospitalario14.
El incremento de la resistencia antimicrobiana en los patógenos bacterianos viene observándose desde hace varios años a escala mundial. Inicialmente un problema predominante en los gramnegativos, la resistencia compromete cada vez más las bacterias grampositivas20.
Según el patrón microbiológico que presentamos, nuestra lista de choque incluye microorganismos multiresistentes como son Staphylococcus áureus resistente a meticilina (oxacilina), Acinetobacter baumanni, Enterococcus faecium y Pseudomonas aeruginosa.
Staphylococcus aureus meticilino resistente (MRSA)
En las cuatro ultimas décadas la aparición y diseminación del Staphylococcus aureus resistente a la meticilina (MRSA) ha convertido este agente patógeno en responsable de un gran numero de infecciones intrahospitalarias en todos los continentes21
Tal como lo evidencian diversos estudios de vigilancia, existe un incremento global de la prevalencia de MRSA.
La prevalencia de cepas MRSA en UCI en nuestro hospital fue de 95%, (cifra comparable con la hallada en la UCI del Hospital Loayza del 90%22 y del 95% en el Hospital 2 de Mayo23. Es alarmante la alta tasa de meticilino resistencia en este estudio, siendo en el año 2006 del 100%.
Debido al aumento de la prevalencia de los MRSA y otros grampositivos multiresistentes, la vancomicna, comercializada desde 1958, ha sido utilizada con mayor frecuencia en el tratamiento de infecciones severas. Sin embargo este antibiótico está lejos de ser perfecto. Los glicopeptidos en general, vancomicina y teicoplanina, poseen sólo una actividad bactericida lenta sobre los estafilococos y es frecuente observar entre los MRSA un fenómeno de tolerancia a estos antibióticos24.
Recientemente, la eficacia de vancomicina ha sido cuestionada debido al incremento de la concentración inhibitoria mínima (MIC) contra estafilococo25 y un aparente incremento de falla clínica a vancomicina lo que llevó a una publicación en el año 200326 a cuestionar su uso en infecciones del tracto respiratorio-el fin de una era- por pobre penetración al pulmón de la vancomicina.
Y esto se refleja en los estudios clínicos, donde se reportan tasas de falla de 40% o más en pacientes con neumonía por MRSA con vancomicina a dosis estándar (1g q12h)27.
La vancomicina es una molécula hidrofílica de gran tamaño (peso molecular: 1449)28 con una penetración limitada en varios tejidos29,30. Las concentraciones alcanzadas en el fluido de revestimiento epitelial del pulmón en pacientes en ventilación mecánica es de solo 18% de la concentración sérica31-34
Las guías ATS/IDSA33 recomiendan en neumonías por MRSA el uso de vancomicina o linezolid como terapia empírica inicial.
El linezolid tiene la ventaja de una excelente penetración intrapulmonar (100%), manteniendo concentraciones por encima de los valores de CIM90 para S aureus, Enterococcus y S. pneumoniae a través de todo el intervalo de la dosis32,34. Además, no es necesario ajustar las dosis en insuficiencia renal e insuficiencia hepática.
Tigeciclina es la nueva droga disponible en la actualidad con actividad sobre MRSA y ha sido demostrado no inferior a vancomicina en infección de piel. Sin embargo su real importancia en el tratamiento de neumonía nosocomial es aun incierta25.
Acinetobacter spp.
Las especies de Acinetobacter son organismos gram negativos que se encuentran con frecuencia en el medio ambiente y, hasta hace poco tiempo, se consideraban poco virulentas. Sin embargo, el complejo Acinetobacter calcoaceticus-baumannii se reveló como un patógeno tanto hospitalario como de la comunidad, multirresistente35.
La incidencia de infecciones graves por especies de Acinetobacter ha ido en aumento; la encuesta nacional de infección hospitalaria en UCI de los Estados Unidos indica que las cepas de Acinetobacter causaron 6,9% de las neumonías hospitalarias en el 2003, comparadas con 1,4% en 19751,36
En nuestro estudio la incidencia infecciones en vías respiratorias por Acinetobacter ha aumentado en 50%, de 13,2% en el 2004 a 20,2% en el 2006, desplazando al grupo de las Enterobacteriaceas del tercer lugar en incidencia como se observa en la Figura 3. A diferencia de la tendencia de las infecciones por S. aureus y P. aeruginosa que han permanecido constantes a través de los años de estudio.
Igual tendencia se observa en los hemocultivos en donde el año 2006 este germen es el segundo en incidencia (12,9%) desplazando al S. epidermidis (6,9%) e incluso a la P. aeruginosa (5,3%).
Igualmente los CDC (centros de control y prevención de enfermedades) reportan en base a resultados obtenidos en mas de 300 hospitales en Estados Unidos un incremento en la resistencia a carbapenems de 9% en 1995 a 40% en el 200436. Cifra muy similar a lo hallado en este estudio, donde el Acinetobacter es uno de los gérmenes con mayor porcentaje de resistencia, fundamentalmente para las cefalosporinas de tercera y cuarta generación (>80%), aminoglicosidos (>80%), aztreonam (>90%). Un hecho alarmante en nuestro servicio es el vertiginoso aumento de resistencia en el lapso de sólo tres años a los carbapenems, desde un 0% en el año 2004 a 20% en el 2005 y 40% en el 2006.
Ante este panorama desolador, las posibilidades terapéuticas se ven notablemente menguadas por la ausencia de nuevos agentes antiinfecciosos. Las infecciones por Acinetobacter sensibles han sido usualmente tratadas con cefalosporinas de amplio espectro, combinaciones de betalactámicos con inhibidores de betalactamasa (combinación que incluye sulbactam) o carbapenems, sin embargo, las tasas de resistencia van en aumento14. Para infecciones causadas por cepas multidrogoresistentes, como en nuestro hospital, las alternativas son limitadas y los agentes mas activos in vitro son las polimixinas (colistina) que son detergentes catiónicos que disrumpen la membrana bacteriana causando fuga del contenido citoplasmático37, sin embargo su neurotoxicidad y toxicidad renal es alta17. Estudios in vitro han demostrado sinergia o efecto aditivo cuando polimixinas fueron usados con imipenem, rifampicina o azitromicina contra Acinetobacter multidrogo resistente.
Sulbactam, una molécula beta lactámica sintética, inhibe irreversiblemente la actividad hidrolitica del betalactámico. Una ventaja particular de usar una combinación que tenga sulbactam es que éste por si mismo tiene actividad inherente contra Acinetobacter. Estudios in vitro han mostrado una actividad superior del sulbactam sobre el ácido clavulánico y tazobactam y representan una alternativa en el tratamiento de infecciones por especies de Acinetobacter multidrogo resistentes38.
Dos combinaciones están disponibles con sulbactam en forma parenteral, una con ampicilina y otra con cefoperazona. En este ultimo caso, se tiene la ventaja de una droga con actividad antipseudomona. Además esta droga no ha tenido una sobre exposición hospitalaria lo que reduce la probabilidad de resistencia con menor costo y mayor seguridad que los carbapenems.
Para infecciones serias por Acinetobacter las dosis de sulbactam de 6 a 8 gr/día en dosis divididas (hasta 12 gr/ día) puede ser recomendada asumiendo una función renal normal teniendo en cuenta que datos farmacocinéticas respaldan el uso de sulbactam en infecciones pulmonares.
La tigeciclina es otra droga con actividad in vitro contra Acinetobacter baumanii, sin embargo recientemente se viene reportando resistencia a este antibiótico37.
Enterococcus faecium
En los tres años de estudio en nuestro hospital en cuidados intensivos se observa una alta resistencia a la vancomicina por parte de las cepas de Enterococo faecium aislados, siendo en promedio 55% de resistencia a la vancomicina. Se han reportado tasas de resistencia a vancomicina tan altas como 70% en poblaciones de alto riesgo como lanuestra39. En estos casos el uso de vancomicina esta independientemente asociado con mortalidad y un reciente metaanálisis demostró un claro riesgo elevado de mortalidad por el uso de vancomicina (OR, 2,52; 95% IC 1,9-3,4)40
La emergencia de cepas de Enterococcus resistentes a la vancomicina es un problema mundial que ya ha sido descrito en las UCIs de nuestro país41.
Las oxazolidinonas son una nueva clase de antimicrobianos con una buena actividad sobre los gram positivos. La primera molécula de esta nueva clase de antibióticos aprobada por la FDA es el linezolid, que podría ser una alternativa terapéutica eficaz.
La detección en nuestro hospital de cepas de Enterococcus faecium resistentes a la vancomicina así como el uso extensivo de este glicopeptido nos hacen temer una posible diseminación de esta resistencia a los MRSA responsables de infecciones severas en nuestra institución.
Pseudomona aeruginosa
La P. aeruginosa es un patógeno nosocomial altamente adaptado y esta adaptación siempre incluye resistencia a antibióticos. El tratamiento óptimo consiste en una agresiva prescripción antibiótico en infecciones severas y evitar exposición innecesaria de antibiótico que lleve al desarrollo de resistencia futura y/o eliminación de microflora competitiva.
En nuestro estudio la infección por P. aeruginosa. ocupa el segundo lugar en la prevalencia total de gérmenes, infección preferente en vías respiratorias y urinaria y esta prevalencia se mantiene estable. A pesar de su alta resistencia su sensibilidad ha mejorado para los aminoglicósidos (amikacina).
Respecto a la combinación de terapia antibiótica recomendada ésta debe ser empleado para incrementar el espectro de actividad a niveles aceptables y es dudosa que sea importante para prevenir desarrollo de resistencia. Debe emplearse la combinación de un beta lactámico más un aminoglicósido en terapia temprana pero dicha combinación debe ser por poco tiempo42.
Candida spp.
La incidencia de las micosis invasivas ha aumentado significativamente en los últimos años, siendo las infecciones por Candida spp. responsables de 5% a 10% de sepsis nosocomiales43. En pacientes hospitalizados las especies de Candida ocupan el cuarto lugar en orden de frecuencia en las infecciones del torrente sanguíneo en los Estados Unidos44,50. En nuestro estudio las infecciones por cándida correspondieron al 11,6% de las infecciones del torrente sanguíneo, siendo la segunda infección mas frecuente en esta localización. Figura 5.
Si bien Candida albicans sigue siendo una causa común de candidemia, aproximadamente 61% de las candidiasis sistémicas en nuestro servicio de cuidados intensivos han sido reemplazadas por otras especies no albicans en los tres años de estudio. Datos reportados por el Instituto Nacional de Cáncer de Estados Unidos, revelan la importancia del fenómeno antes mencionado al evidenciar el aumento de la incidencia de las especies no albicans de 22% en 1992 a 52% en 199745.
Estas especies de candida no albicans generan dificultades terapéuticas, emergiendo con ellas nuevos patrones de sensibilidad a los antifúngicos.
CONCLUSIÓN
El Acinetobacter baumannii y la Pseudomona aeruginosa son considerados como el paradigma de las bacterias multiresistentes dado que se trata de microorganismos intrahospitalarios que en nuestro servicio su resistencia se ha incrementado a través del tiempo.
Lo que resulta alarmante es que el Acinetobacter ha incrementado su resistencia a los carbapenem en el lapso de tres años desde un 0% en el 2004 hasta cerca del 40 % en el 2006 siendo un problema de salud grave con impacto clínico y económico en nuestro hospital.
La explosión de infección resistente a antibióticos continúa como una plaga global a nivel mundial y por otro lado la declinación en investigación y desarrollo de nuevos antibióticos hacen sombrío el futuro principalmente de las infecciones graves y más aun en el epicentro de la resistencia como es el área de cuidados intensivos.Ya que los pacientes de UCI tiene alta tasa de complicaciones infecciosas y son expuestos a antibióticos de amplio espectro, la emergencia de resistencia antimicrobiana ha hecho que el uso apropiado de antibióticos sea un objetivo.
Idealmente la elección de antibióticos para el tratamiento de enfermedades infecciosas en pacientes críticos debe estar basada en resultados óptimos de ensayos clínicos controlados que generalmente no existen y la selección empírica debe tener una orientación etiológica y consideración epidemiológica que incluyan flora local, y la resistencia a antibióticos.
Estrategias para prevenir la infección nosocomial debido a bacterias resistente a antibióticos deben ser rutinariamente empleadas en todas las UCI como intervenciones especificas en la prevención primaria de infección nosocomial (ejemplo bacteriemia asociado a catéter, neumonía asociado a ventilador) y el uso de prácticas de control de infecciones para prevenir la transmisión horizontal de bacterias resistente a antibióticos.
REFERENCIAS BIBLIOGRÁFICAS
1. Talbot GH, Bradley J et al. Bad bugs no drugs : an update on the development pipeline from the antimicrobial availability task force of the Infectious disease Society of America. Clin Inf Dis 2006; 42: 657 -668
2. Spellberg B, Guidos R, et al. The epidemic of antibioticresistant infections: A call to action for the medical community from the infectious diseases society of america. Clin Inf Dis 2008; 46: 155-164
3. Kollef M. Inadecquate antimicrobial treatment of infections. A risk factor for hospital mortality among critically ill patients. Chest. 1999; 115: 462-474
4. Ambrose P. Antibiotic in the critical care unit. Crit Care Clin 1998; 14: 283-308
5. Mainardi JL. Antibiotic resistance problems in the critical care units. Crit Care Clin 1998; 14: 119-134
6. Howard G, Moellering R. Antimicrobial drug resistance. N Engl J Med 1996; 335: 1445-1453
7. Fridkin S, Gaynes RP. Antimicrobial resistance in intensive care units. Clin Chest Med 1999; 20: 303-316
8. Finland M, Jones W, Barnes M. Occurrence of serious bacterial infections since introduction antibacterial agents. J Am Med Assoc 1995; 170:188-197
9. Cuhan B. Antibiotic resistance: control strategies. Crit Care CLlin 1998; 14: 309-328
10. Giamarellou H. Empiric therapy for infections in the febrile neutropenic compromised host. Clin Med of North Amer 1995; 79: 559-580
11. OGrady Naomi. Practice guideline for evaluating new fever in critically iII adults patients. Clin Infect Dis 1998; 26: 1042-1059
12. Goldman D. Strategies to prevent and control the emergence and spread of antimicrobial resistance microrganism in hospitals. JAMA 1996; 275: 234-240
13. Watanabe J, Contardo M. Estudio de la flora microbiológica en la UCI del Hospital E. Rebagliatti Martins. Ciencia y tecnología. ESSALUD 1998; 7: 26-33
14. Dieckhaus K, Cooper B. Infection control concepts in critical care. Criti Care Clin 1998; 14:55-70
15.Vicent JL, Bihari DJ, Suter PM et al. The prevalence of nosocomial infection in the intensive care units in Europe. JAMA 1995; 274:639-644
16. Cortesía M, Cáceres A, Pineda M. Sociedad Venezolana de Infectología. Consenso de expertos: estrategias de control del uso de antimicrobianos en los hospitales.Barquisimeto octubre 2000
17. Jacoby G, Archer G. New mechanism of bacterial resistance to antimicrobial agents. N Engl J Med 1991; 324: 601-612
18. Harmut L. Nosocomial pneumonia in the critical care unit. Crit Care Clin 1998; 14: 119-134
19. Dennesen PJW, van der Ven AJ, Kessels AGH et al :Resolution of infectious parameters after antimicrobial therapy in patients with ventilator-associated pneumonia. Am J Respir crit care Med 2001:163 :1371-1375
20. Ronald N. Jones, MD. Resistance patterns among nosocomial pathogens.Trends over the past few years. Chest. 2001; 119: 397S-404S.
21. Vandenesch F, Naimi T, et al. Community-acquired methicillin-resistant Staphylococcus aureus carrying Panton- Valentine leukocidin genes:worldwide emergence. Emerg Infect Dis 2003; 9: 978-84
22. Velasquez J., Liaroso F., Zetola N., Pamo O., Sánchez L., Wong W., Hernández R. Vigilancia de la resistencia de Enterococcus sp. a la vancomicina y evaluación in vitro de nuevas alternativas terapéuticas. Rev Soc Per Med Int 2002; 15:2.
23. Oficina de Epidemiologia y Salud Ambiental. Hospital Nacional 2 de Mayo
24. Deresinski S. Vancomycin:does it still have a role as an antistaphylococcal agent?. Expert Rev Anti Infect Ther 2007; 5: 393-401
25. Tuerdek Frank. Hospital acquired infections an antimicrobial therapy. Criti Care Medi 24, (2) April 2008 page 249
26. Fisher-Hoch SP, Hutwagner L. Opportunistic candidiasis: an epidemic of the 1980s. Clin Infect Dis 1995; 21(4): 897-904.
27. Lam AP. Wunderink RG. Semin Respir Crit Care Med. 2006;27:92-103
28. Rybak MJ. The pharmacokinetic and pharmacodynamic properties of vancomycin. Clin Inf Dis 2006; 42: 35-39.
29. Massias L et al. Antimicrob Agents Chemother. 1992; 36: 2539-2541
30. Graciani Al et al. Antimicrob Agents Chemother 1988; 32: 1320-1322
31. Lamer C, de Veco B, et al. Analysis of vancomycin entry into pulmonary lining fluid by bronchoalveolar lavage in critically ill patients. Antimicrob Agents Chemother 2002; 46: 1475-80
32. Moise-Broder PA, Forrest A, et al. Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections. Clin Pharmacokinet 2004; 43: 925-42
33. American Thoracic Society and the Infectious Diseases Society of America. Guidelines for the management of adults with hospital acquired, ventilator associated and healthcare associated pneumonia. Am J Respir Crit Care Med 2005; 171: 388-416
34. Fernández de Gatta M, Revilla N,et al. Pharmacokinetic/ pharmacodynamic analysis of vancomycin in ICU patients. Intensive Care Med 2007; 33: 279-285
35. Prada G. Acinetobacter baumanii:problematico y ademas multiresistente. Asoc Col Infectol 2006;10:61-63
36. Carey RB, Banerjee SN, Srinivasan A.Multidrugresistant acinetobacter infections,1995-2004. Presented at the 46th Interscience Conference on AntimicrobialAgents and Chemotherapy, San Francisco,September 27–30, 2006.
37. Munoz-Price S, Weinstein R. Acinetobacter Infection. N Engl J Med 2008; 358:1271-81.
38. Levin AS. Clin Microbiol Infect 2002; 8: 144-153
39. National Nosocomial Infections Surveillance System report, data summary from January 1992 through june 2004, issued October 2004. Am J Infect Control 2004; 32:470-485.
40. Diaz Granados CA, Zimmer SM. Comparison of mortality associated with vancomycin-susceptible enterococcal bloodstream infections: a meta-analysis. Clin Infect Dis 2005; 41:327-333
41. Velasquez J, Lizaraso F. Vigilancia de la resistencia de enterococcus sp. a la vigilancia y evaluación in vitro de nuevas alternativas terapéuticas. Rev Soc Per Med Inter 2002; 15:3-7.
42. Jonathan R. Optimizing antimicrobial therapy for serious infections Semin Respir Criti care Med 2007:28,656.
43. Diekema DJ, Messer SA, et al. Epidemiology of candidemia: 3-year. Results from de emerging infections and epidemiology of Iowa organisms study. J Clin Microbiol 2002; 40(4): 1298- 302.
44. Jarvis WR (1995) Epidemiology of nosocomial fungal infections, with emphasis on Candida species. Clin. Infect. Dis.178: 792-802.
45. Pfaller MA, Diekema DJ. Role of sentinel surveillance of candidemia: trends in species distribution and antifungal susceptibility. J Clin Microbiol 2002; 40(10):
46. Hidayat LK, Hsu DI, et al. High-dose vancomycin therapy for meticillin-resistent Staphylococcus aureus infections: efficacy and toxicity. Arch Intern Med 2006;166:2138-44.
47. Wunderink RG, Rello J, Cammarata SK et al. Linezolid versus vancomycin: Analysis of two double-blind studies of patients with methicillin-resistant Staphylococcus aureus nosocomial pneumonia. Chest. 2003 ;124 : 1789 -97
48. Rubinstein E, Cammarata SK, Oliphant TH et al. Linezolid (PNU-1007 ) versus vancomycin in the treatment of hospitalized patients with nosocomial pneumonia: a randomized, doubleblind, multicenter study. Clin Infect Dis.2001; 32: 402-12
49. Kollef MH, Rello J, Camarata SK et al. Clinical cure and survival in Gram-positive ventilator-associated pneumonia: retrospective analysis of two double-blind studies comparing linezolid with vancomycin. Intensive Care Med. 2004 ; 30: 388 -394.
CORRESPONDENCIA
Enrique Luis Paz Rojas
epaz@clinicajavierprado.com.pe
Recibido: 01/07/08
Arbitrado: Sistema por pares
Aprobado: 01/09/08














