Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.25 no.3 Lima July/set. 2008
ARTÍCULO ORIGINAL
Estudio piloto de las alteraciones metabólicas y síndrome metabólico inducidas por la terapia antirretroviral en pacientes con VIH del Hospital Nacional Azobispo Loayza, Lima, Perú
Metabolic alterations and metabolic syndrome in HIV infected patients induced by highly active antiretroviral therapy from Arzobispo Loayza National Hospital - a pilot study
Braulio M. Valencia Arroyo1,2 ; Claudia P. Taramona Espinoza1,3 ; Helard Manrique Hurtado4
1 Médico Cirujano Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Instituto de Medicina Tropical Alexander von Humboldt – Grupo de Estudio de Leishmaniasis y Malaria, Lima, Perú.
3 Instituto de Medicina Tropical Alexander von Humboldt – Unidad de Tuberculosis, Lima, Perú.
4 Servicio Endocrinología Hospital Nacional Arzobispo Loayza. Lima, Perú.
RESUMEN
Introducción: la infección por el Virus de Inmunodeficiencia Humana (VIH) es unproblema importante de salud pública. Si bien la terapia antiretroviral de gran actividad (TARGA) ha mejorado la sobrevida de los pacientes, existen complicaciones metabólicas secundarias importantes.
Objetivos: describir las características epidemiológicas, alteraciones metabólicas y frecuencia de síndrome metabólico en los pacientes infectados con el Virus de Inmunodeficiencia Humana (VIH) en terapia Antiretroviral así como la existencia de asociación estadística entre estas alteraciones y el esquema que reciben.
Material y método: se realizó un estudio piloto de corte transversal entre noviembre del 2006 y julio del 2007 en pacientes del Servicio de Infectología del HNAL tanto varones como mujeres entre los 18 y 40 años, con diagnóstivo de infección por VIH confirmado (ELISA + Western blot), con conteo de CD4 y carga viral de no más de 6 meses de antigüedad y al menos seis meses de TARGA con esquemas definidos. Se valoró el peso, talla y perímetro abdominal, dosándose además niveles séricos en ayuno de colesterol total, HDL, LDL, triglicéridos, glicemia e insulina.
Resultados: se estudiaron 36 pacientes, el 5,6 % de ellos presentaba síndrome metabólico; la hipertrigliceridemia y niveles bajos de Lipoproteína de alta densidad fueron las alteraciones metabólicas más frecuentes. Se encontró diferencia estadística al evaluar los valores de trigliceridemia y glicemia con respecto al esquema TARGA (p = 0,0094 y p = 0,0019 respectivamente) encontrándose los más altos en el Esquema III (p = 0,01 y p = 0,002 respectivamente) que incluía estavudina, lamivudina y nevirapina.
Conclusiones: a hipertrigleridemia y el colesterol HDL disminuido fueron las alteraciones más frecuentes, encontrándose diferencia estadística al relacionarlos con TARGA. Es importante el hallazgo de que dichas alteraciones son mayores en pacientes recibiendo algún esquema conteniendo nevirapina, dado que este fármaco se ha usado ampliamente como sustituto de los inhibidores de la proteasa debido a los efectos metabólicos desfavorables.
Palabras clave: dislipidemia, hiperglicemia, SIDA, TARGA.
ABSTRACT
Introduction: Human immunodeficiency virus (HIV) infection is an important public health problem. Even though highly active antiretroviral therapy (HAART) has improved patient survival, there are some important secondary metabolic complications.
Objectives: To describe epidemiological features, metabolic alterations, and metabolic syndrome rates in HIV-infected patients receiving HAART, as well as to determine whether there is any statistical association between such alterations and the therapy they are receiving.
Material and Method: This is a pilot cross-sectional study carried out between November 2006 and June 2007 in male and female patients between 18 and 40 years of age from the Infectious Disease service of Arzobispo Loayza National Hospital, with a confirmed diagnosis of HIV infection (ELISA + Western Blot), with CD4 cell and viral load counts no more than 6 months old and who are receiving HAART during at least six months using well defined schedules. Weight, height and abdominal circumference were measured, and also fasting serum levels of total cholesterol, HDL cholesterol, LDL cholesterol, triglycerides, blood sugar and insulin were determined.
Results: 36 patients entered the study. 5.6% of them had metabolic syndrome; hypertriglyceridemia and low levels of HDL cholesterol were the most frequent metabolic alterations. There was a statistically significant difference when triglycerides and blood glucose values were measured according to the HAART schedule (p= 0.0094 and P= 0.0019, respectively), and the highest values for the aforementioned parameters were found in those patients receiving scheme III (p= 0.01 and p= 0.002, respectively) including stavudine, lamivudine, and nevirapine.
Conclusions: Hypertriglyceridemia and low levels of HDL cholesterol were most frequently found metabolic alterations, statistically significantly different according to different HAART schedules. It is important that the aforementioned alterations are more frequent when using nevirapine containing regimens, since this drug has been widely used as a replacement of protease inhibitors because of unfavorable side effects.
Key words: Dyslipidemia, Hyperglycemia, AIDS, HAART.
INTRODUCCIÓN
La infección por el Virus de Inmunodeficiencia Humana (VIH) es un problema importante de salud pública y compromete a hombres y mujeres por igual, siendo éstos cada vez más jóvenes1. Si bien la instauración de la terapia antiretroviral de gran actividad (TARGA) ha mejorado la sobrevida de los pacientes, existen repercusiones a corto, mediano y largo plazo como son las complicaciones metabólicas de lípidos y carbohidratos2,3. Estas alteraciones se han asociado al uso de inhibidores de proteasa (IP), siendo el mecanismo más probable la homología de la región catalítica de la proteasa del VIH–1 y dos proteínas que intervienen en el metabolismo los lípidos: CRABP-1 (cytoplasmic retinoic acid-binding protein type 1) y LRP (low-density lipoprotein-receptor-related protein)4.
Los valores exactos para la incidencia y prevalencia de dislipidemia en el contexto de la infección por VIH no se encuentran disponibles, por lo que la prevalencia de hipertrigliceridemia variaría entre un amplio rango de entre 8 % (con incidencia acumulativa a los 31 meses del 9%)5 y 47 %6; de la misma manera se conoce que el hallazgo de niveles bajos de la lipoproteína de alta densidad (HDL) es de 22 %7. La hiperglicemia es otra alteración frecuentemente observada y se reporta intolerancia a la glucosa en 46% de los pacientes en TARGA que incluye algún IP8. Esto ha motivado la realización de ensayos clínicos de diversa complejidad en los que se busca un sustituto de los IP sin poner el riesgo la supresión viral. La nevirapina (NVP) ha resultado ser una buena opción en situaciones en las cuales las alteraciones metabólicas son considerables9-11. Si bien los datos mostrados revelan información importante, éstos incluyen a población que recibe antihipertensivos, hipolipemiantes o antidiabéticos orales y que debido a la edad (mayores de 40 años) podrían presentar dislipidemia o hiperglicemia inclusive antes de haber iniciado TARGA.
La presente investigación busca describir las características epidemiológicas, alteraciones metabólicas y frecuencia de síndrome metabólico (SM), así como si existe asociación estadística entre estas alteraciones y el esquema TARGA que reciben.
MATERIAL Y MÉTODO
Se realizó un estudio piloto descriptivo de corte transversal entre el periodo de noviembre de 2006 y julio de 2007 en pacientes del Servicio de Infectología del Hospital Nacional Arzobispo Loayza (HNAL) con infección por VIH quienes recibían TARGA. El proyecto de investigación fue aprobado por el Comité de ética del Hospital Arzobispo Loayza (HNAL) y por el Comité de ética de la Universidad Peruana Cayetano Heredia.
Los pacientes fueron incluidos al estudio si cumplían los siguientes criterios: varones y mujeres entre los 18 y 40 años de edad con diagnóstico de VIH confirmado (ELISA + Western blot), aquellos con conteo de CD4 y carga viral con un máximo de seis meses de antigüedad, que hayan firmado el consentimiento informado y que tengan al menos seis meses de TARGA en los siguientes esquemas:
-
Esquema I (con IPs): Estavudina + Lamivudina + Lopinavir/Ritonavir (d4T+3TC+RTV/LPV); Didanosina + Lamivudina + Lopinavir/Ritonavir (ddI+3TC+RTV/LPV) y Zidovudina + Lamivudina + Lopinavir/Ritonavir (AZT+3TC+RTV/LPV)
-
Esquema II (sin IPS): Zidovudina + Lamivudina + Nevirapina (AZT+3TC+NVP)
-
Esquema III (sin IPS): Estavudina + Lamivudina + Nevirapina (d4T+3TC+NVP).
Fueron excluidos los pacientes con enfermedades oportunistas coexistentes o síndrome de reconstitución inmunológica, aquellos que adquirieron el virus por transmisión vertical, con alteraciones metabólicas diagnosticadas previamente al inicio de TARGA, pacientes gestantes y los que no aceptaron participar en el estudio.
No se estimó un tamaño muestral, se incluyeron a todos los pacientes que cumplían con los criterios inclusión/exclusión.
Los pacientes fueron contactados durante sus consultas en el Servicio de Infectología del HNAL. Luego de recibir una clara explicación de los objetivos del estudio aceptaron participar firmando el consentimiento informado respectivo.
Se concertó una nueva cita para la cual los pacientes acudieron en ayunas (al menos 8 horas). Durante la entrevista se completó una ficha consignando edad, género, tiempo de diagnóstico, tiempo y esquema de TARGA, antecedentes patológicos y familiares de importancia. Dicha información fue corroborada revisando las historias clínicas de los participantes la misma que sirvió para recolectar información referente a últimos conteos de CD4, carga viral y adherencia al tratamiento.
Se realizó un examen físico dirigido para determinar el peso, talla, perímetro abdominal y presión arterial. Posteriormente se tomó una muestra venosa para medir el colesterol total, colesterol HDL, colesterol LDL, triglicéridos, glicemia e insulinemia. Los valores y categorización de las variables dependientes se basaron en los consensos ATPIII e IDF de acuerdo a la Tabla 1.
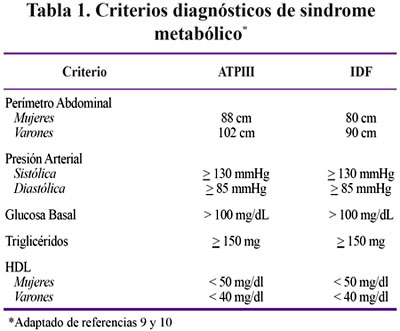
La valoración del peso y talla fue realizada por los investigadores quienes usaron la misma balanza calibrada y cinta métrica para la determinación del peso, talla y perímetro abdominal respectivamente. Los pacientes fueron pesados y tallados únicamente con ropa interior. La medición del perímetro abdominal se realizó según la técnica determinada por el estudio NHANES III: el plano horizontal determinado por la unión de los puntos en cada cresta iliaca en el cual se intersecta perpendicularmente con la línea medioclavicular. Los valores de colesterol total, HDL, colesterol LDL, triglicéridos y glicemia basal fueron obtenidos en condiciones de ayuno. El método usado para el dosaje de triglicéridos, colesterol total y colesterol HDL fue enzimático-colorimétrico. El valor de colesterol LDL se calculó usando la ecuación de Friedewald. En cuanto al dosaje de insulina se uso el método de electroquimioluminiscencia. No hubo consumo de alcohol ni tabaco en las 24 horas previas. Los únicos fármacos ingeridos regularmente por los pacientes fueron los correspondientes al TARGA.
Para el análisis de las variables continuas se empleó el coeficiente de correlación de Spearman, para comparar medias (variables no paramétricas) el test de Wilcoxon – Mann Whitney. Las variables categóricas fueron evaluadas usando el test de Chi-cuadrado. Los datos fueron almacenados y analizados usando el programa estadístico STATA (Versión 9.0).
RESULTADOS
Características generales de la población
De un total de 600 pacientes, 42 se encontraban recibiendo alguno de los esquemas con IP previamente definidos y 495 en esquema II y III. Usando los criterios de inclusión, se obtuvieron 19 pacientes en el grupo IP (esquema 1) y 75 en los otros esquemas. De los 19 pacientes, 8 no acudieron a la cita; de los 75 pacientes restantes 20 no acudieron a la cita y otros 30 retiraron el consentimiento informado.
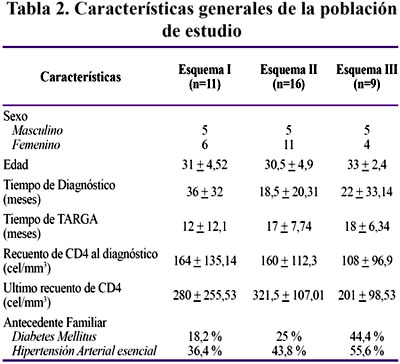
Finalmente, 36 pacientes participaron en este estudio, los cuales fueron agrupados según los esquemas TARGA que recibían como se observa en la Tabla 2 sin haber diferencia estadísticamente significativa en las características de cada uno de los esquemas, lo cual los hace comparables. Todos los pacientes acudían regularmente a sus evaluaciones trimestrales o semestrales y su adherencia al tratamiento era del 99-100% según se indica en su historia clínica.
Evaluación metabólica:
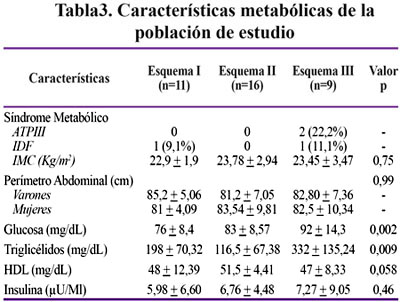
La Tabla 3 muestra las características metabólicas según cada esquema de TARGA. El diagnóstico de SM sólo fue cumplido por 2 pacientes. Respecto a los triglicéridos, 19 pacientes (52,8%) presentaron hipertrigliceridemia estando 9 de estos en esquema I y 5 en los esquemas II y III respectivamente, siendo sus valores estadísticamente significados entre cada esquema (p=0,0094) y encontrándose los más elevados en el esquema III (p=0,01). El colesterol total estuvo elevado en 9 pacientes (25%) y su componente HDL disminuido en 11 (30,6%) sin existir diferencias entre los esquemas (p=0,13 y 0,058 respectivamente). Se encontraron 2 pacientes con glicemias elevadas, habiendo diferencia entre cada esquema (p=0,019) y niveles más elevados de glicemia en el esquema III (P=0,002). Solamente un paciente presentó hiperinsulinemia.
DISCUSIÓN
Los resultados de este estudio muestran que la prevalencia de SM es 5,6%. Aun cuando este diagnóstico fue poco frecuente, la presencia de sus componentes hipertrigliceridemia y HDL disminuidos sí lo fueron, prevaleciendo sobre las otras alteraciones metabólicas.
Si bien la hiperglicemia no fue frecuente tal vez con el uso de pruebas diagnósticas más sensibles se hubiera encontrado intolerancia a la glucosa en un mayor número de pacientes. Estos hallazgos son importantes ya que se conoce que por sí solos son factores ampliamente relacionados con un riesgo cardiovascular incrementado11-13.
La prevalencia de SM en la población general es variable dependiendo de la latitud en la cual se estudie sin embargo desde los años 90s es bien conocida la existencia de la relación que ésta guarda el con VIH y TARGA5,14,15. En nuestro estudio se encontró que en relación con la prevalencia en población no infectada, el SM es menos frecuente en pacientes que sí lo están y reciben TARGA16. Se conoce que los criterios que más contribuyen al diagnóstico de SM son la hipertrigliceridemia y los niveles bajos de HDL17,18, lo cual concuerda con los datos obtenidos en este estudio. Se conoce también que la hipertensión, obesidad abdominal e hiperglicemia son frecuentes en pacientes mayores de 40 años, lo cual explica la baja frecuencia en los nuestro.
La asociación entre TARGA y las alteraciones metabólicas ha sido ampliamente descrita en la literatura internacional3-8; de la misma manera se conoce su relación con ciertos medicamentos como los IP, así por ejemplo la serie de Carr y col que estudió pacientes recibiendo este medicamento por un periodo promedio de 13,6 meses, encontró niveles de triglicéridos significativamente altos en comparación con aquellos que no lo recibían17, por otro lado Walli y col evaluaron valores de lípidos en ayunas observando un incremento promedio de 160 mg/dl en los triglicéridos en aquellos pacientes que recibían IP18. Otras drogas, sin embargo, también guardarían relación con las alteraciones ya descritas. En este estudio se encontró que el esquema III fue el que tuvo niveles significativamente más altos de trigliceridemia y glicemia en comparación a los otros, éste contiene d4T, 3TC y NVP siendo el primero nucleósido inhibidor de la transcriptasa reversa más asociado a trigliceridemia severa19 explicando esto el hallazgo ya descrito. Resulta llamativo que este grupo reciba también NVP ya que este fármaco se ensayó en varios estudios como alternativa que permita una supresión viral contínua y con menores tasas de toxicidad metabólica9-11.
Tales estudios en general comparan la evolución metabólica y virológica en dos grupos: a) comprendidos por pacientes que continúan con IP y b) aquellos que cambian a NVP. Si bien todos muestran una mejoría del componente metabólico y virológico, este último componente podría ser subvalorado dado el inadecuado seguimiento y las importantes tasas de abandono de los esquemas IP.
Por ultimo los estudios prospectivos que incluyen pacientes sin TARGA previo realizando la misma comparación (IP vs. NVP) solamente consideran los cambios metabólicos y no valoran la evolución clínica y virológica20-21.
La búsqueda de pacientes con características específicas ha sido un factor que ha limitado de manera importante el poder y nivel de evidencia del presente estudio. El hecho de buscar pacientes jóvenes ya ha sido sustentado y quizá no habría sido un limitante de no haberse perdido tantos participantes ya sea por retiro del consentimiento informado como por falta de asistencia a las citas posteriores. De esta manera se perdieron 58 pacientes los cuales hubieran permitido encontrar información adicional a la presentada o consolidar lo encontrado, ésto en caso de que los pacientes perdidos hayan tenido características similares a los de este estudio. Por otro lado, esta pérdida tan importante también pone en cuestionamiento la validez de los datos de prevalencia y frecuencia de las alteraciones y datos epidemiológicos mostrados debido a que los 58 pacientes perdidos podrían tener características epidemiológicas o clínicas muy discordantes con las encontradas y por ende dar un giro a las conclusiones. El no haber valorado adecuadamente la ingesta calórica y la actividad física constituye una debilidad ya que éstos son los pilares del balance energético y en consecuencia su repercusión es parcialmente evaluada por las alteraciones descritas. Hubiera sido muy provechoso haber contado con estudios basales previos al inicio del TARGA ya que permitiría realizar una valoración más exacta del impacto metabólico. Muchos factores igualmente asociados a dislipidemia e hiperglicemia no fueron excluidos completamente ya que esto implicaba la realización de estudios adicionales y se concluyó que no estaban presentes por la simple negación de éstos durante la entrevista.
En conclusión, la hipertrigleridemia y el colesterol HDL disminuido fueron las alteraciones más frecuentes, encontrándose diferencia estadística al relacionarlos con TARGA, siendo el esquema III el que tuvo niveles significativamente más altos en relación a los otros.
AGRADECIMIENTOS
Al Laboratorio Aventis Pasteur por su colaboración con la realizacion del perfil lipídico, a Merck Sharp & Dohme por facilitar los reactivos necesarios para el dosaje de insulina, al Laboratorio San Marcos del HNAL por su colaboración con la realizacion del perfil lipidico, al Laboratorio del HNAL: Dr. Jose León, Dra. Aurora Torres, a la gentil tecnóloga Delia Malca quien estandarizó y realizó el dosaje de insulina y de manera especial a los miembros del grupo de apoyo de pacientes conviviendo con VIH así como al personal médico del Servicio de Infectología del HNAL
REFERENCIAS BIBLIOGRáFICAS
1. Oficina General de Epidemiología. Situación del VIH/SIDA en el Perú. Boletín Epidemiológico Mensual – Junio 2007.
2. Leonard EG, McComsey GA. Antiretroviral therapy in HIVinfected children: the metabolic cost of improved survival. Infect Dis Clin North Am. 2005 ;19(3):713-29.
3. Sweet DE. Metabolic complications of antiretroviral therapy. Top HIV Med. 2005;13(2):70-4.
4. Leonardo C, Manfredi R, Chiodo F. Hyperlipidaemia in patients with HIV-1 infection receiving highly active antiretroviral therapy: epidemiology, pathogenesis, clinical course and management Int J Antimicrob Agents. 2003;22(2):89-99.
5. Gkrania-Klotsas E., Angelos-Emmanouil K. HIV and HIV treatment: effects on fats, glucose and lipids Brit Medi Bull 2007 84(1):49-68
6. Jevtovic D, Dragovic G, Salemovic D. The metabolic syndrome, an epidemic among HIV infected patients on HAART. Biomed Pharmacother. 2008 Oct 23. (Epub por imprimir)
7. Saves M, Raffi F, Capeau J Factors related to lipodystrophy and metabolic alterations in patients with human immunodeficiency virus infection receiving highly active antiretroviral therapy. Clin Infect Dis 2002;34:1396– 405.
8. Behrens G, Dejam A, Schmidt H, et al. Impaired glucose tolerance, beta cell function and lipid metabolism in HIV patients under treatment with protease inhibitors. AIDS 1999;13:63 - 70.
9. Martinez E, Lozano L, Conget I, et al. Reversion of lipodystrophy after switching HIV-1 PI to nevirapine. AIDS 1999;13(7):805-10.
10. Dieleman J, Sturkenboom M, Ferdinand W, et al. Low risk of treatment failure after substitution of nevirapine for PI among HIVinfected patients with virus suppression. Inf Dis 2002;185:1261-8.
11. Ruiz L, Negredo E, Domingo P, et al. Clinical, virologic and immunologic benefit of switching the PI by nevirapine in HAARTexperienced patients suffering lipodystrophy: 48-weeks follow-up. JAIDS 2001;27(3):229-36.
12. Grundy SM, Brewer B Jr, Cleeman JI et al. Definition of metabolic syndrome. Circulation 2004;109:433-8. 2004 www.nhlbi.nih.gov/guidelines/cholesterol/atglance.pdf ( Acceso 18 de marzo 2007)
13. The IDF consensus worldwide definition of the metabolic syndrome. 2006. http://www.idf.org/webdata/docs/MetS_def_update2006.pdf (Acceso 03 de febrero)
14. Mikhail NE Lipid abnormalities in patients infected with human immunodeficiency virus. Endocr Pract 2008;14 (4): 492 – 500.
15. Rose H, Hoy J, Wooley I HIV infection and high density lipoprotein metabolism, Atheroesclerosis 2008; 199(1): 79 – 86.
16. Miller GJ, Miller NE: Plasma high density lipoprotein concentration and development of ischemic heart disease. Lancet 1975. 1:16 –19.
17. Jacobson D, Tang AM, Spiegelman D. Incidence of metabolic syndrome in a cohort of HIV-infected adults and prevalence relative to the US population (National health amd nutrition examination survey). J Acquir Immune Defic Syndr 2006:43(4); 458-466
18. Mondy K, Overton ET, Grubb J, et al. Metabolic syndrome in HIV-infected patients from an urban, midwestern US outpatient population. Clin Infect Dis. 2007 Mar 1;44(5):735-8.
19. Pajuelo J, Sanchez J. El síndrome metabólico en adultos, en el Perú. An Fac Med Lima 2007; 68(1):38-46.
20. Petit JM, Duong M, Masson D et al. Serum adiponectin and metabolic parameters in HIV-1-infected patients after substitution of nevirapine for protease inhibitors. Eur J Clin Invest. 2004; 34(8):569-75.
21. Fisac C, Fumero E, Crespo M, et al. Metabolic benefits 24 months after replacing a protease inhibitor with abacavir, efavirenz or nevirapine. AIDS. 2005;19(9):917-25.
CORRESPONDENCIA
Claudia Patricia Taramona Espinoza
claudiataramona@gmail.com
Recibido: 01/06/08
Arbitrado: Sistema por pares
Aprobado: 01/09/08













