Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.25 n.3 Lima jul./set. 2008
ARTÍCULO DE REVISIÓN
Aplicación clínica del epiplón en el sistema nervioso central
Clinical uses for omental tissue in the central nervous System
Hernando Rafael1
1 Médico Neurocirujano, Universidad Nacional Autónoma de México. México, Distrito Federal México.
RESUMEN
Desde 1978,el epiplón tiene aplicación clínica en el sistema nervioso central, para pacientes con isquemia y/o penúmbra isquémica .El omento, una forma de presentación del tejido adiposo blanco (TAB ) tiene algunas características que la distinguen de los otros depósitos de TAB localizados en otras zonas del cuerpo. Es el mejor tejido adiposo para desarrollar conexiones vasculares con los tejidos adyacentes y a través de éstos neovasos arteriales, el parénquima nervioso recibe nutrientes, oxígeno ,neurotransmisores ,factores neurotróficos y células madre. Por otro lado, la cantidad de cicatriz adherente en la interface omento-sistema nervioso es mínimo.
Palabras clave: cuerpos linforeticulares, factores neurotróficos, hormonas, omento, revascularización.
ABSTRACT
Since 1978, clinical uses within the central nervous system have been found for omentum tissue, particularly in patients with ischemic conditions and/or ischemic penumbra. Omental tissue, one form of white adipose tissue (WAT), has some features that distinguish it from other WAT depots in other areas of the body. It is the best adipose tissue for developing vascular connections with surrounding tissue, and through these newly formed arterial blood vessels, nervous parenchyma may receive nutrients, oxygen, neurotransmitters, neurotrophic factors and stem cells. Moreover, the amount of adherent scar tissue in the omentalnervous system interface is minimal.
Key words: Lymphoreticular bodies, neurotrophic factors, hormones, omentum, revascularization
INTRODUCCIÓN
El epiplón u omento, es un tejido adiposo blanco (TAB) localizado en la cavidad abdominal y rodeado por repliegues peritoneales. Es utilizado en lesiones isquémicas del sistema nervioso central, con la finalidad de revascularizarlo y así, mejorar la función del tejido nervioso residual en isquemia y penumbra isquémica (neuronas con ausencia eléctrica, pero con casi integridad celular )1,2 .
En 1978, usando el método de transposición ,el omento fue colocado por primera vez sobre la corteza cerebral de dos pacientes con infarto isquémico3 y en 1984,a la medula espinal con daño crónico4. Posteriormente, el implante de epiplón al sistema nervioso ha sido realizado en varios países por numerosos investigadores5-10.
En Latinoamérica, el omento fue utilizado por primera vez en 1987, en pacientes con secuelas cerebrovasculares y medulares crónicas, mediante transplante2,11. A partir de entonces hemos usado la misma técnica para pacientes con lesiones medulares crónicas11-13 y en el cerebro, a pacientes con enfermedades neurodegenerativas14-16.
Por ésta razón, presento una revisión de las características anatómicas e histológicas del epiplón y de su inmensa capacidad funcional en el sistema nervioso isquémico.
ANATOMÍA BÁSICA DEL EPIPLÓN
Los epiplones, en número de cuatro, llevan su nombre según las estructuras abdominales donde se localizan17 :1) epiplón gastrohepático o epiplón menor; 2) epiplón gastrocólico o epiplón mayor ;3 ) epiplón gastroesplénico, y el 4) epiplón pancreaticoesplénico. De las cuatro, el que utilizamos para los implantes al sistema nervioso y otros tejidos, es el epiplón mayor, que de ahora en adelante lo denominaremos simplemente, epiplón.
En adultos, el epiplón parte de la curvatura mayor del estómago (lámina anterior ) y desciende en la cavidad abdominal(como un delantal ) hasta la región pélvica ,adherido al colon transverso. Su peso varía de 300 a 2 000 gramos, sus dimensiones de 14 a 36 cm de largo por 20 a 46 cm de ancho y su área, de 300 a 500 cm2 o más18,19. Sin embargo, en el 16% de las personas adultas normales y sin antecedentes de trauma o cirugía abdominal ,la superficie del omento es menor12. Estos parámetros están en relación directa con el peso corporal. Entre las dos láminas peritoneales (lámina descendente o posterior y la lámina ascendente o anterior ),el omento está constituido por un armazón travecular de vasos sanguíneos ( arterias,venas y linfáticos ) y una cantidad variable de tejido adiposo17,19.
El omento recibe aporte sanguíneo desde las arterias gastroepiploicas derecha e izquierda, las cuales se anastomosan a lo largo de la curvatura mayor del estómago, para formar el arco arterial gastroepiploico17,19 .La derecha es ramo de la arteria gastroduodenal y la segunda, ramo de la arteria esplénica. El calibre promedio de la arteria gastroepiploica derecha es de 2,8 mm, mientras que la izquierda, de 2,2 mm. Ahora bién, los ramos mayores (arterias omentales) que se distribuyen por todo el omento, nacen desde el arco gastroepiploico. La arteria epiploica derecha nace de la arteria gastroepiploica derecha; la arteria epiploica media, nace del arco gastroepiploico y la arteria epiploica izquierda, es ramo de la arteria gastroepiploica izquierda. Además, la arteria epiploica accesoria nace casi inmediatamente del origen de la arteria gastroepiploica derecha. El calibre de las arterias epiploicas, a nivel de su tercio medio, oscila entre 1 a 1,5 mm. El extremo distal de la arteria epiploica media, se bifurca en dos ramos derecho e izquierdo, los cuales se anastomosan con ramos de las arterias epiploicas derecha e izquierda. Finalmente, desde el arco gastroepiploico, nacen una serie de arterias pequeñas que se distribuyen por la curvatura mayor del estómago y el epiplón.
Por otro lado, un estudio en 136 cadáveres adultos reveló, que hay 5 tipos anatómicos, según el calibre, longitud y distribución de las arterias epiploicas dentro del omento20:
-
Tipo 1: la arteria epiploica media se bifurca al mismo nivel de las otras dos .Es el patrón vascular más común y representa el 85,29% de los casos.
-
Tipo 2: la arteria epiploica media se bifurca o trifurca a nivel del tercio medio de su recorrido. Representa el 10,29% de los casos.
-
Tipo 3: la arteria epiploica media se bifurca o trifurca en el tercio proximal a su origen (2 a 3 cm del arco gastroepiploico). Representa el 2,94 % de los casos.
-
Tipo 4: ausencia de la arteria epiploica media. Las otras dos arterias omentales forman una arcada vascular, Está configuración representa el 0,74 % de casos.
-
Tipo 5: la rama terminal de la arteria esplénica no participa de la formación del arco gastroepiploico y la arteria epiploica media se origina desde la arteria gastroepiploica derecha. Esta variante anatómica representa también el 0,74 % de casos.
Estos hallazgos anatómicos tienen importancia quirúrgica cuando realizamos implante de omento, ya sea mediante la técnica de transposición3,4,21 o de transplante2,5,7,9,12.
HISTOLOGíA DEL EPIPLÓN
Hay dos tipos distintos de tejido adiposo que difieren uno del otro, por su distribución, color, vascularidad y actividad metabólica22-24. El tejido adiposo marrón en adultos, es escaso y se localiza alrededor de las glándulas adrenales, del riñon, aorta, mediastino y cuello. Su color es debido a su rica vascularidad y a la presencia de citocromos intracelulares. Mientras que el tejido adiposo blanco (TAB), es abundante y está distribuido en el tejido subcutáneo y en el epiplón; con menor cuantía, en las glándulas mamarias. ovarios, área cardíaca y órbitas, entre otras zonas.
Actualmente el TAB es considerado un órgano endócrino ,productor de numerosas proteínas con amplia actividad biológica. Los productos secretados por este tejido adiposo, son denominados colectivamente como adipocitoquinas o simplemente, adipoquinas24,25.
Dentro del omento y en los extremos distales de los vasos colaterales y terminales de las arterias y venas epiploicas, se forman glomus capilares omentales (comunicaciones arteriovenosas)19,26 que infiltrados por células, toman el nombre de órganos linfoides omentales o cuerpos linforeticulares (Milky spots)19,27,28. Estructuras redondeadas u ovoides que varían grandemente en número, tamaño (0,5 a 3,5 mm) y composición celular, dependiendo de muchos factores tales como la especie animal, raza, sexo, edad y estado funcional26.Un órgano linforeticular está integrado por arteriolas, venulas, linfáticos, células mesoteliales, células endoteliales, macrofagos, infocitos, monocitos, granulocitos, células plasmáticas, fibroblastos y adipocitos19,26,28. Además, recientemente han sido aislados células madre (stem cells) desde el omento29,30.
FUNCIONES DEL EPIPLÓN
El epiplón, a diferencia del resto del TAB, tiene algunas funciones que la diferencian2,19,27.
-
Inmunológica: esta función lo realiza a través de la composición celular de los cuerpos linforeticulares. Se calcula que cerca del 90% de la actividad fagocitaria del peritoneo es debido al omento.
-
Absorción: esta capacidad se demuestra cuando el edema vasogénico producido en el sistema nervioso, es reabsorvido al colocar omento sobre dicha área por medio de la técnica de transposición. Asi mismo puede mejorar la hidrocefalia ,mediante una derivación lumbo-omental. Esta reabsorción, los realiza a través del drenaje venoso y linfático existente dentro del omento.
-
Inhibición fibrótica: estudios experimentales y clínicos han demostrado que en la interfase omento-sistema nervioso, hay escasa o nula formación de tejido cicatricial11,31. En otras palabras, el epiplón no permite la formación de fibrosis en el tejido subyacente y por tanto, no lesiona al sistema nervioso, duramadre u otro tejido en el área donde se implanta.
-
Angiogénica: esta capacidad se conoce desde 1906. Años después ,se observó que áreas isquémicas inducen al omento a formar nuevos vasos sanguíneos desde las 6 horas y hacerse más evidente, después de las 24 horas del implante. Los eventos angiogénicos siguen una secuencia iniciada con la degradación de la membrana basal de los capilares omentales y finalizan, con la formación y maduración de los capilares que penetran dentro del tejido subyacente. Actualmente se sabe que éste poder angiogénico se debe a dos factores de crecimiento angiogénico23,28: 1) factor de crecimiento de los fibroblastos (FGF) y 2) factor de crecimiento del endotelio vascular (VEGF ).
-
Liberadora de neurotransmisores: el epiplón es capaz de sintetizar y liberar aminas biógenas, endorfinas y acetilcolina, entre los principales.
-
Liberadora de factores neurotróficos: el omento es fuente de una serie de factores de crecimiento tales como: 1) Factor de crecimiento nervioso; 2) FGF; 3) factor neurotrófico ciliar; 4) gangliosidos; 5) factor de crecimiento insulínico, y 6) VEGF. De este modo, basado en estos hallazgos ,grupos neuronales pueden regenerarse o formar nuevas neuronas similares a las existentes, por influencia de las células madre, hormonas y citoquinas sobre las neuronas nodrisas del área lesionada.
-
Facilitadora de la regeneración neuronal: no hay ninguna duda, de que el tejido nervioso isquémico puede ser regenerado. Para lo cual, es indispensable revascularizar el área lesionada y después, el tejido nervioso residual recibe neurotransmisores ,factores neurotróficos y células madre.
HORMONAS SECRETADAS POR EL TEJIDO ADIPOSO
En general, el TAB es un órgano endócrino productor de numerosas hormonas tales como leptina, factor alfa de necrosis tumoral (TNF-alfa), interleucina-6 (IL-6 ), factor beta de crecimiento transformador (TGF-beta), inhibidoractivador- 1 del plasminogeno (PAI-1), angiotensinogeno, adipsina, proteína de acetilación activadora (ASP), melationina, adiponectina, resistina, apelina y visfatina, entre otras24,25,32,33. Por lo menos, dos de estas hormonas (TNF-alfa y resistina) son responsables de la resistencia a la insulina, por interferir con el receptor a la insulina a nivel de membrana celular, en especial en neuronas hipotalámicas34; provocando de este modo hiperinsulinemia e hiperglucemia. Por otro lado, éste tejido adiposo es capaz de transformar la testosterona y/o la androstenodiona en estrona y estadiol32,35. Es decir, el TAB transforma los andrógenos en estrógenos. De este modo, el sobrepeso y obesidad están relacionados directamente con la diabetes mellitus tipo 2 y con la hipotestosteronemia, el cual a su vez, es factor de riesgo para el desarrollo de aterosclerosis35 y enfermedad de Alzheimer36.
Por tanto el TAB, constituido por adipocitos ,matriz celular y células estromavasculares, sintetizan y liberan una diversidad de moléculas multifuncionales denominadas adipocitoquinas24,25,35,37. Por ejemplo, algunos estudios han demostrado que los adipocitos liberan leptina, adiponectina,PAI-1, TNF-alfa ,factores de crecimiento y varias citoquinas. Las células plasmáticas liberan angiotensinogeno, factor de crecimiento epidermal, factor de crecimiento nervioso, histamina, serotonina, heparina y citoquinas. Mientras que los fibroblastos, liberan varios factores de crecimiento y son los encargados de transformar los andrógenos en estrógenos (fuente extragonadal). Además, en el omento, el órgano linforeticular libera TNF-alfa y factores de crecimiento angiogénico tales como: 1) el FGF y 2) el VEGF24, 38-40.
La leptina, hormona secretada por los adipocitos, inhibe la acción estimulante del área hipotalámica lateral y de este modo, reduce o suprime el apetito y promueve la pérdida de peso37. Entonces, porqué las personas obesas tienen el apetito incrementado?.La respuesta es, porque en estas personas la leptina no tiene acción, debido a isquemia en esta área hipotalámica por aterosclerosis38. Por contraste a esto, su revascularización por medio del epiplón, provoca pérdida de peso39 ;sugiriendo así, acción de la leptina sobre ésta área revascularizada. No obstante, este mecanismo es incompleto, porque debemos considerar además al tracto digestivo para explicar la acción hormonal emanado del sistema nervioso central, del tracto gastrointestinal alto y desde el TAB ( eje cerebro-intestino-tejido adiposo )41.
METODOS DE IMPLANTACIóN DEL EPIPLóN
Para implantar omento al sistema nervioso, se requiere de dos equipos quirúrgicos .Un equipo de cirujanos generales, responsables de realizar laparotomía y extraer o elongar el epiplón,y un equipo de neurocirujanos encargados de implantar el epiplón en el sistema nervioso a través de dos métodos2,11,27:
Transposición
Consiste en elongar la superfice del omento dentro o fuera de la cavidad abdominal y mantenerlo unido por un pedículo vascular gastroepiploico. Luego se realiza incisiones en la piel del abdomen, tórax, cuello,cráneo o en la parte lateral del abdomen, según la región a transponer. El extremo distal avanza a través de un tunel subcutáneo hasta llegar al cráneo o a la columna. Es decir,es un injerto pediculado como se ve en la Figura 1.
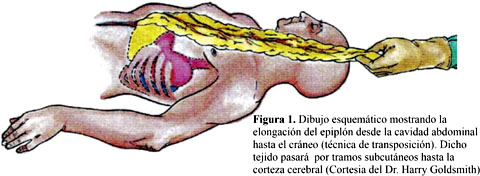
Después de una craneotomía o laminectomía, se abre la duramadre y el tejido se coloca sobre el sistema nervioso lesionado. Esta técnica quirúrgica no puede ser realizado en el 16 % de las personas, porque el epiplón es pequeño12. Goldsmith y cols en 1978 y 1984, utilizaron ésta técnica quirúrgica por primera vez al cerebro3 y medula espinal4, respectivamente. Asi mismo, el mismo método ha sido utilizado también, en el transplante de pulmón42,43, para revascularizar la cabeza femoral44 y para cerrar fístulas esofágicas45 entre otros usos.
Transplante
Hay dos formas de transplante o trasplante de omento al sistema nervioso:
A. Transplante sin anastomosis vascular
La técnica consiste en colocar el extremo proximal (conteniendo vasos gastroepiploicos) del epiplón, adherido a un vaso arterial de moderado a gran calibre y el otro extremo distal, sobre el tejido a revascularizar. En 1967, Vineberg y Syed46 reportaron el uso de ésta técnica en 450 operaciones para revascularizar al miocardio. El extremo proximal del omento fue colocado sobre la arteria subclavia y el distal, sobre el corazón isquémico.
Esta técnica ha sido usado por nosotros47,48 en 12 casos de 270 pacientes que recibieron transplante de epiplón a la medula espinal con lesión crónica, ante la ausencia de un vaso arterial de buen calibre para realizar la anastomosis
B. Transplante con anastomosis vascular
Esta técnica consiste en implantar un segmento de epiplón conteniendo un porción de arteria y vena gastroepiploica (o de vasos epiploicos) a cualquier área del encéfalo o medula espinal. Por tanto, es un injerto libre vascularizado. Para implantar omento al encéfalo, los vasos gastroepiploicos (o epiploicos) se anastomosan a los vasos temporales superficales o vasos occipitales, mediante microanastomosis49.Desde 1987,nosotros hemos utilizado este procedimiento quirúrgico para pacientes con infarto isquémico al cerebro, lesiones medulares crónicas, enfermedad de Parkinson, enfermedad de Huntington, enfermedad de Alzheimer, epilepsia, hipertensión arterial esencial, diabetes mellitus tipo 2 y contra el envejecimiento2,13-16,39,50. Hallazgos quirúrgicos han mostrado que casi todas las enfermedades llamadas neurodegenerativas , no son más que de origen isquémico ,en determinados núcleos del hipotálamo y zonas circundantes ,secundario a aterosclerosis cerebral, en especial en las carótidas supraclinoideas. De este modo, la isquemia y/o penumbra isquémica, provocan la formación de radicales libres y éstas, ocasionan estrés oxidativo, para finalmente expresarse como atrofia cerebral local o difusa.
CONCLUSIONES
El omento, una forma de TAB, es un tanto diferente a los demás tejidos adiposos, por su inmensa capacidad para desarrollar conexiones vasculares con tejidos subyacentes y adyacentes. Por un lado, los neovasos omentales penetran directa y profundamente dentro del parénquima subyacente ( encéfalo , medula espinal, miocardio, etc), manteniendo la misma estructura histológica que los vasos epiploicos, y por el otro lado, estableciendo anastomosis con las arterias pequeñas y medianas del espacio subaracnoideo e incrementando el flujo sanguíneo al sistema nervioso adyacente. De modo tal, que a través de estas conexiones vasculares ,el parénquima cerebral isquémico recibe nutrientes, oxígeno ,neurotransmisores, factores neurotróficos y células madre. Por estas razones y en base a experiencias quirúrgicas previas, concluyo que el omento es el mejor tejido para revascularizar áreas isquémicas y sin provocar daño subyacente por tejido cicatricial
REFERENCIAS BIBLIOGRÁFICAS
1. Schlaug G , Benfield A, Baird AE,et al. The ischemic penumbra:Operationally defined by diffusion and perfusion MRI. Neurology 1999;53 :1528-1537.
2. Rafael H. El epiplón: Trasplante al sistema nervioso. México,DF, Editorial Prado 1996:1-171.
3. Goldsmith HS, Saunders RL, Reeves AG,et al. Omental transposition to brain of stroke patients. Stroke 1979 ;10(4): 471-472.
4. Goldsmith HS, Neil-Dwyer G, Barsoum L. Omental transposition to the chronically injured human spinal cord. Paraplegia 1986;24:173-174.
5. Ni M-S, Zou X-W, Xi K-M, Zhao Y-P. Free omental autotransplant to brain surface in ischemic cerebrovascular disease. Chin Med J 1983;96(10): 787-789.
6. Abraham J,Chandy MJ,Gammon K,et al. Omental transposition to brain in patients with focal ischemia. India J Surg 1986 ;48(4): 138-142.
7. Nagashima Ch,Masumori Y, HoriE,et al. Omentum transplantation to the cervical cord with microangioanastomosis. No Shinkei Geka (Japan ) 1991;19(4): 309-318.
8. MacMillan M,Stauffer Sh. The effect of omental pedicle graft transfer on spinal microcirculation and laminectomy membrane formation. Spine 1991 ;16(2): 176-180.
9. Karasawa J, Kikuchi H, Kawamura J, Sakai T. Intracranial transplantation of the omentum for cerebrovascular moyamoya disease :A two year follow-up study. Surg Neurol 1980 ;14:444- 449.
10. Mohamed R,Youssef E. Omental transposition to the brain as a treatment of motor sequelae due to brain infarct. Book of abstract. The International Congress of Omentum in CNS. Xuzhou,China. May 1995,pp 35-36.
11. Rafael H,López E,Cavazos J,Mendez J. Transplante de epiplón a la corteza cerebral. Rev Gastroenterol Méx 1988 ;53 :33-35.
12. Rafael H,Malpica A, Ruiz C, y coLS. Paraplejia traumática crónica:Diagnóstico y tratamiento. Mundo Médico (Méx ) 1991 ;18 (204):11-19
13. Rafael H, Malpica A, Espinoza M, Moromizato P. Omental transplantation in the management of chronic traumatic paraplegia:Case report. Acta Neurochir (Wien ) 1992; 114: 145-146.
14. Rafael H. Cerebral atherosclerosis and oxidative stress in some challengin diseases. J Neurol Sci (Turk ) 2004;21 (4):343- 349.
15. Rafael H. Neural transplantation. J Neurosurg 2006 ;104:336- 338 (letter ).
16. Rafael H. Hypothalamic ischemia and premature aging .Med Sci MONIT 2007 ;13(7): LE 9-10 (letter ). www.medscimonit. com
17. Testud L,Latarjet A. Anatomía humana. Tomo IV. Barcelona,Salvat editores SA 1978:787-802.
18. Das SK. The size of the greater omentum and methods of lengthening it for transplantation . Br J Plast Surg 1976;29:170- 174.
19. Liebermann-Meffert D., The greater omentum: Anatomy,embryology and surgical applications. Surg Clin North Am 2000 ;80:275-293.
20. Alday ES, Goldsmith HS. Surgical technique for omental lengthening based on arterial anatomy. Surg Gynecol Obst 1972 ;135: 103-107.
21. Goldsmith HS. Omental transposition to the brain and spinal cord. Surg Rounds 1986; 9:22-33.
22. Fawcett DW. Bloom and Fawcett : A texbook of histology. Twelfth edition. Chapter 6. New York, Chapman and Hall 1994,pp 170-181.
23. Chaldakov GN, Tonchev AB,Tuncel N, et al. Adipose tissue and mast cells. I n ,Fantuzzi G and Mazzone T (eds ). Nutrition and health :Adipose tissue and adipokines in health and disease. New Jersey, Human Press Inc 2006,pp 147-154.
24. Chaldakov Gn,Stankulov IS, Hristova M, Ghenev PI. Adipobiology of disease: Adipokines and a dipokines-targeted pharmacology. Curr Pharm Design 2003;9:1023-1031.
25. Bettowski J. Adiponectin and resistin.New hormones of white sipose tissue. Med Sci Monit 2003; 9(2): RA 55-61.
26. Dux K, Anatomy of the greater and lesser omentum in the mouse with some physiological implications. In, Goldsmith HS(ed ).The omentum:Research and clinical aplications. New York, Springer-Verlag 1990,pp 19-43.
27. Williams R,White H. The greater omentum.Its applicability to cancer surgery and cancer therapy . Chicago,Year Book Medical Publ Inc 1986,pp 795-865.
28. Shimotsuma M,Kawata M,Hagiwara A,et al. Milky spots in the human greater omentum. Acta Anat 1989 ;136 :211-216.
29. Van Harmelen V,Rohrig K,Hauner H. Comparison of proliferation and differentation capacity of human adipocyte precursor cells from the omental and subcutaneous adipose tissue of obese subjects .Metabolism 2004;53:632-637.
30. Bakker AH,Van Dielen FM,Greve JW, et al. Preadipocyte number in omental and subcutaneous adipose tissue of obese individuals. Obesity Res 2004;12 :488-498.
31. Rafael H. False localizing signs in upper cervical spinal cord compression .Neurosurgery 1997 ;48:217-218.
32. Rafael H. Pathogenesis of overweight and obesity. Rev Climaterio 2005;8(48):233-237. www.revistasmedicasmexicanas.com.mx
33. Rafael H. Hypothalamic ischemia and metabolic syndrome. Med Sci Monit 2006;12(9):LE17-18.
34. Dufy-Barbe L. Las hormonas hipotalámicas. Mundo Científico 1984;5 (43):4-12.
35. Sieminska L, Wojciechowska C,Swietochowska E, et al. Serum free testosterona in men with coronary artery atherosclerosis. Med Sci Monit 2003;9 (5):CR 162-166.
36. Moffat SD, Zonderman AB,Metter EJ,et al. Free testosterone and risk for Alzheimer´s disease in older men. Neurology 2004;62:188-193.
37. Fulton S,Woodside B,Shizgal P, Modulation of brain reward circuitry by leptin. Science 2000; 187:125-128.
38. Rafael H. Isquemia hipotalámica por aterosclerosis y diabetes mellitus tipo 2. Rev Climaterio 2004; 7(41):192-197.
39. Rafael H. Rafael H,Fernandez E, Ayulo V, Dávila L. Weight loss following omental transplantation on the anterior perforated space. Case Rep Clin Pract Rev 2003;4(3):160-162. www.crcpronline. com
40. García-Gómez I,Goldsmith HS,Angulo J, et al. Angiogenic capacity of human omental stem cells. Neurol Res 2005;27(8):807- 811.
41. Fride E. The endocannabinoid-CB receptor system :A new player in the brain-gut-adipose field. Biomed Rev 2006;17:23- 42
42. Santillán-Doherty P. Trasplante unilateral de pulmón en un caso de fibrosis terminal. Rev Invest Clin (Méx ) 1990;42 :127-134.
43. Klepetko W, Mihai G, Wisser W,et al. Heterotiopic tracheal transplantation with omentum wrapping in the abdominal position preserves functional and structural integrity of a human tracheal allograft. J Thor Cardiov Surg 2004 ;127: 862-867.
44. Ceballos A,Balmaseda R, Puentes R,y cols. Revascularización de la cabeza femoral. Invest Médicoquir (Cuba ) 1997 ;1 :56- 61.
45. Reid RR, Dutra J, Conley DB, et al. Improved repair of cervical esophageal fistula complicating anterior spinal fusion :Free omental flap compared with pectoralis major flap . J Neurosurg:Spine 2004;100:66-70.
46. Vineberg AM, Syed AK. Arterial vascular pathways from subclavian arteries to coronary arterioles created by free omental myocardial implanta: A preliminary study. Canad Med Ass J. 1967 ;97:399-401.
47. Rafael H. Cervical spondylotic myelopathy:Results and factors affecting outcome with special reference to age differences. Neurosurgery 2003 ;53(3):787-788.
48. Rafael H. Low-back pain. J Neurosurg: Spine 2007; 7(7 ):114-115 (letter )
49. Rafael H. Intracranial anastomosis . J Neurosurg 2003;98 (2):439-440
50. Rafael H, Mego R, Moromizato P, García W. Omental transplantation for temporal lobe epilepsy. Report of two cases. Neurol India 2002 ;50:71-74.
CORRESPONDENCIA
Hernando Rafael
hrtumi@yahoo.com













