Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.25 no.4 Lima Oct./dic. 2008
ARTÍCULO DE REVISIÓN
Tuberculosis extremadamente resistente (TB-XDR), historia y situación actual
Extremely resistant tuberculosis (XDR-TB), history and current situation
Alberto Mendoza Ticona1 ; Eduardo Gotuzzo Herencia2
1 Médico Infectólogo-Tropicalista.Centro Nacional de Salud Pública del Instituto Nacional de Salud, Lima, Perú
.2 Médico Infectólogo-Tropicalista. Director del Instituto de Medicina Tropical Alexander von Hulmboldt de la Universidad Peruana Cayetano Heredia. Profesor Principal de la Universidad Peruana Cayetano Heredia. Lima, Perú.
RESUMEN
Las enfermedades ocasionadas por micobacterias constituyen sin duda un capítulo importante de la patología infecciosa en la historia de la humanidad encontrándose desde sus albores enfermedades tan antiguas como la tuberculosis y la lepra, así como otras las producidas por otras micobacterias.
La tuberculosis es una micobacteriosis causada por el Complejo Mycobacteria Tuberculosis, en la que se encuentra comprendida el Mycobacterium tuberculosis. Este evolutivamente al igual que la humanidad ha afinando sus mecanismos de sobrevivencia y resistencia a sustancias antibioticas.
Como otros microorganismos, la base de la resistencia del Mycobacterium tuberculosis es la selección de bacterias mutantes con resistencia innata a las drogas antituberculosas existentes, asi en virtud a este fenómeno adaptativo-evolutivo surge una subpoblacin de Mycobacteria Tuberculosis extremadamente resistentes al tratamiento antibioterápico múltiple, con un pronostico de sobrevida sobre los pacientes pobre y diferente al de las subpoblaciones catalagadas como tbc multidrogo resistente o TB-MDR. Hasta junio de 2008 la TB XDR se ha reportado en 49 países, entre ellos el Perú. Un solo caso de TB XDR y el estudio de sus contactos deben ser enfocados como una emergencia sanitaria. El desarrollo de la TB XDR revela debilitamiento de los servicios asistenciales en el primer nivel de atención. Los dos factores de riesgo más fuertemente asociados con la TB XDR son: 1) Fracaso a un régimen antituberculoso que contiene drogas de segunda línea que incluye un inyectable y una fluoroquinolona y 2) Contacto estrecho con un individuo con TB XDR documentada o que viene fracasando a un esquema con drogas de segunda línea. El enfoque que debe darse a la TB-XDR, desde un punto de vista de salud pública, es el de una emergencia sanitaria, por lo que se debe lograr los recursos financieros necesarios para controlar su diseminación, lo que pasa por diagnósticos precoces, tratamientos oportunos, manejo integral y subvención de los paciente y colaterales; así como aislamiento de los casos índices hasta que dejen de ser contagiantes.
Palabras clave: tuberculosis, Mycobacteria Tuberculosis, TB-XDR.
ABSTRACT
Diseases caused by Mycobacteria are an important area within infectious diseases in mankinds history, and since early times conditions such as tuberculosis (TB) and leprosy (Hansens disease) had already been described. This also holds true for diseases caused by other Mycobacteria.
Tuberculosis is a mycobacterial disease caused by Mycobacteria tuberculosis complex, being Mycobacterium tuberculosis one of its most conspicuous components. This microorganism has perfected its mechanisms for survival, allowing it to develop resistance against antituberculous therapy.
As it is the case for other microorganisms, the basis for M. tuberculosis resistance is the selection of mutant bacteria with innate resistance to currently available antituberculous drugs; so, by virtue of this adaptive and evolutive phenomenon, there is the emergence of a subpopulation of M. tuberculosis that is extremely resistant to multiple antituberculous drugs, and the survival prognosis for patients with TB disease caused by these particular microorganism is quite poor, so different to that in subpopulations with TB disease caused by multidrug-resistant (MDR-TB) M. tuberculosis.
Until June 2008, XDR-TB had been reported in 49 countries, Peru amongst them. The occurrence of a single case of XDR-TB and its contacts must be approached as a sanitary emergency. The development of XDR-TB reflects a weakening of healthcare services, particularly those at the first level or primary care. The two most important risk factors associated with the occurrence of XDR-TB are: 1) failure with a second-line antituberculous drug regimen including one injectable drug and a fluoroquinolone, and 2) close contact with any individual with documented XDR-TB who is failing with a second-line antituberculous drug regimen. XDR-TB must be approached as a sanitary emergency, so adequate financial resources must be allocated for controlling its spread, which means having early diagnosis, timely therapy, integral management and adequate support for the patients and his/her relatives; also, index cases must be isolated until they become non-infectant.
Keywords: Tuberculosis, Mycobacterium tuberculosis, XDR-TB.
INTRODUCCIÓN
La tuberculosis (TB) convive con la humanidad desde sus albores, y así como las civilizaciones han evolucionado, el bacilo de Koch también lo ha hecho, resistiéndose a quedar relegado en la historia. La TB ha causado enfermedad en casi todas las antiguas civilizaciones del mundo, pasando por los egipcios, hindúes, chinos, incas, mayas, entre otros1 y el intento de querer desprendernos de esta enfermedad, a la luz de la reciente aparición de la TB extremadamente-resistente (TB XDR), ha sido un efímero sueño del cual la genética y biología molecular del bacilo nos han hecho despertar.
Selman Waksman, premio Nobel en 1952 por el descubrimiento de la estreptomicina (SM), se equivocó al proclamar que las drogas brindarían el camino para la eliminación de la "Gran Plaga Blanca"2. En los primeros meses del uso masivo de la SM se encontraron cepas de M. tuberculosis resistentes a la SM3. Esto fue corroborado por el ensayo clínico de tratamiento con monoterapia con SM por el British Medical Research Council y el seguimiento a cinco años demostró sólo un pequeño beneficio eventual de la SM comparado con el grupo control4,5. Posteriormente se demostró que la administración simultánea de SM y el derivado para amino de la aspirina (ácido p-aminosalicílico o PAS), reducía la producción de cepas resistentes a SM6.
La isoniacida (INH) sintetizada en 1952 a partir de de la nicotinamida y de la tiosemicarbazona (Conteben), mostró ser más potente que SM y PAS. Hasta la mitad de los años sesenta se realizaron ensayos de combinaciones de SM, PAS e INH (método de Edimburgo)7 resultando un esquema efectivo de 12 meses, con terapia triple los 3 primeros meses y doble el resto del tratamiento, desafortunadamente su elevado costo y alta tasa de abandonos no permitió su uso en forma masiva5.
Otros hitos efectivos en la lucha contra la TB fueron: la demostración del mismo efecto terapéutico con PAS e INH dado en hospital o en domicilio, ensayo de Madras, India en 19567; los regimenes intermitentes, los esquemas acortados, la demostración de la actividad sinérgica esterilizante de pirazinamida (PZA), la introducción de la rifampicina (RMP) por laboratorios CIBA a partir de la rifamicina B aislada del Streptomyces mediterranei, la división del régimen terapéutico en fase inicial intensiva y fase de continuación, hasta los modernos regimenes de quimioterapia acortados basados en rifampicina por 6 meses, los dos primeros meses acompañados de SM, INH y PZA; y los cuatro últimos meses acompañado de INH (2SHRZ/4HR); esta segunda fase dada 2 ó 3 veces por semana demostrando ser el régimen más eficaz y mejor tolerado. Posteriormente con el riesgo de transmisión del VIH, se decide cambiar la SM por el etambutol por su administración oral. El último aporte en el campo terapéutico lo constituye la demostración de la eficacia de las fluoroquinolonas y la posibilidad de esquema primarios de menor duración8.
A medida que se buscaban los mejores regimenes para el tratamiento de la TB se reportaban un creciente número de casos resistentes a drogas, principalmente como resultado de esquemas de tratamiento inadecuados y la no adherencia a los esquemas de tratamiento. La creencia equivocada que las mutaciones que conferían resistencia disminuían la patogenicidad de estas bacterias fue rebatida por la ocurrencia de transmisión primaria de TB resistente a RFP e INH, llamado TB multidrogoresistente (TB MDR) durante los años noventas, como la epidemia intrahospitalaria de TB MDR en New York9 y más aún con el reporte de Gandhi y col. sobre la alta transmisibilidad y letalidad de cepas de TB XDR en población inmunocomprometida por el VIH en Kwa Zulu-Natal en Sudáfrica10.
DEFINICIONES
El término tuberculosis extremadamente resistente o TB XDR es una traducción impropia del inglés: "extensively drug-resistant tuberculosis (XDR-TB)", sin embargo, es la forma más esgrimida en el idioma español para referirse a esta enfermedad. En el primera reunión del Comité Especial de la OMS sobre TB XDR, en octubre de 2006, se optó por definir a la TB XDR como aquel caso producido por una cepa de M. tuberculosis con resistencia demostrada a por lo menos: isoniacida, rifampicina, una fluoroquinolona (cirofloxacino, levofloxacino, ofloxacino o moxifloxacino) y una droga parenteral de segunda línea (los aminoglucósidos: kanamicina y amikacina, o el polipéptido capreomicina)11. Este término fue usado por primera vez por en un reporte del CDC sobre la resistencia del M. tuberculosis en una evaluación de laboratorios supranacionales12, si bien la definición inicial se refirió a cepas de TB MDR que además presente resistencia a por lo menos tres drogas de segunda línea de diferente mecanismo de acción, posteriormente se decide cambiar esta definición debido a que se optó por un mejor marcador de pronóstico, la accesibilidad a drogas de segunda línea en países de escasos recursos y una mejor confiabilidad de las pruebas de susceptibilidad a fluoroquinolonas y drogas parenterales de segunda línea.
EPIDEMIOLOGÍA
En el cuarto reporte de la resistencia global a drogas antituberculosas de la OMS, publicado en el 200813, se comprueba el incremento global de casos de TB MDR en el mundo. Se estima que se produjeron 489 139 casos de TB MDR, lo que represente un 5,3% de los casos de TB producidos en el mismo año. Entre los 81 países y dos regiones administrativas especiales de China, el incremento de TB MDR en casos nuevos se produjo sólo en Corea y Perú. En el caso de Corea este incremento es explicado por la inclusión del sector privado en sus reportes nacionales y en Perú por un debilitamiento en el control básico de la TB incluyendo el manejo de la TB MDR13. En cambio en Estados Unidos y Hong Kong, se evidenció una significativa reducción de la TB MDR y los países de Europa del este presentaron una tendencia plana.
En el mismo reporte se determinó que el 7% de 4 012 casos de TB MDR cumplieron el criterio de TB XDR, de acuerdo a lo reportado por 35 países y dos regiones administrativas13. Siendo los países de la ex república socialista soviética donde se reportaron el mayor número de casos de TB XDR. La TB-XDR se ha notificado en todas las regiones de OMS.
En el año 2000, se creó el Comité Luz Verde para facilitar el abastecimiento de drogas de segunda línea para países con escasos recursos. Durante sus asistencias a programas nacionales, este comité dio cuenta de varios casos de resistencia consistentes con la actual definición de TB XDR. La primera publicación donde se utiliza el término TB XDR fue el reporte en el boletín mensual MMWR del CDC, correspondiente al estudio realizado en 25 laboratorios supranacionales de tuberculosis de la OMS en el que evaluaron un total de 17 690 cepas de M. tuberculosis de los cuales el 20% fueron TB MDR y el 2% fueron TB XDR, de acuerdo al criterio anterior de resistencia de por lo menos a tres tipos de diferentes drogas de segunda línea; de los 3 520 aislamientos de TB MDR, 347 (10%) fueron TB XDR12.
Hasta junio de 2008 la TB XDR se ha reportado en 49 países según reportes de la OMs. Ver Figura 1. Sin embargo, no se ha definido a que magnitud constituiría como un problema de salud pública. Para muchos expertos, un solo caso de TB XDR y el estudio de sus contactos deben ser enfocados como una emergencia sanitaria14.
Definitivamente la TB XDR es un problema sanitario muy grave en Sudáfrica, por la coinfección con el VIH, en las ex repúblicas socialistas soviéticas, por la carga de enfermedad, al igual que India, China, Corea del Sur, el sudeste asiático y Perú, basado en el número de casos reportados. Sin embargo, en África existe un subregistro por sus limitados recursos de laboratorio. Datos recientes de Sudáfrica muestran que 996 (5,6%) de 17 615 aislamientos de TB MDR colectados desde el 2004 a octubre de 2007 fueron TB XDR13.
En Estados Unidos desde 1993 a 2007, de un total del 212 896 casos de TB con cultivo positivo, se reportaron un total de 3379 casos de TB MDR, de los cuales 2 087 (62%) tuvieron susceptibilidad drogas de segunda línea, detectándose 83 (3,9%) casos de TB XDR, basados en la última definición de OMS. El número de casos de TB XDR declinó de 18 (0,07% de 25 107 casos de TB) en 1993 a 2 (0,02% de 13 293 casos de TB) en 200715.
La real magnitud del impacto de la TB XDR en África fue evidente con el reporte de Ghandi y col. en un hospital rural en Tugela Ferry, Kwa Zulu-Natal, Sudáfrica10. De 1 539 personas evaluadas por tuberculosis desde enero de 2005 a marzo de 2006, 542 tuvieron cultivos positivos para TB y de ellos, 221 fueron TB MDR y 53 (24%) tuvieron TB XDR. De los 44 pacientes evaluados para VIH el 100% tuvo resultado positivo. El tiempo promedio de sobrevida desde la fecha de colección de la muestra de esputo fue de 16 días, llegando a morir 52 de los 53 pacientes evaluados. Además de la alta letalidad, el reporte de Sudáfrica precisa que en solo el 15% de casos hubo la probabilidad de desarrollar la resistencia durante el tratamiento como consecuencia de abandonos o fracasos, por el contrario en el 55% no hubo antecedente previo de tuberculosis y en el 30% se tenía el antecedente de TB previa curada. El 67% de los pacientes con TB XDR fueron admitidos en el hospital en los últimos dos años, dos de ellos fueron trabajadores de salud. No hubo contacto cercano entre las regiones geográficas de las viviendas de los pacientes, teniendo como único factor en común el centro de salud donde son tratados y finalmente, se confirmó que el 85% de cepas de M. tuberculosis evaluadas correspondían al mismo patrón de la familia KZN, que inicialmente fue sensible a todas las drogas y sólo en los últimos tres años mostró resistencia a drogas de segunda línea. Esto último evidencia la transmisión interpersonal de TB XDR, principalmente en ambientes nosocomiales en países en desarrollo con limitadas medidas de control de infecciones y alta prevalencia de infección TB/VIH16.
MECANISMOS DE RESISTENCIA Y CAPACIDAD DE TRANSMISIÓN DE LA TB XDR
Como otros microorganismos, la base de la resistencia del bacilo de Koch es la selección de bacterias mutantes con resistencia innata a las drogas antituberculosas existentes. Las epidemias de cepas resistentes pueden deberse a tres mecanismos: a) conversión de cepas salvajes pan-susceptibles durante el tratamiento (resistencia adquirida) b) incremento del desarrollo de la resistencia en cepas resisten a drogas debido a una quimioterapia inapropiada (resistencia amplificada) y c) transmisión de cepas mutantes a personas susceptibles produciendo casos nuevos o recaídas de tuberculosis resistente (resistencia transmitida)2.
La transmisión de cepas resistentes depende de la virulencia del organismo, si bien las mutaciones de resistencia pueden disminuir la capacidad de transmisión y su potencial reproductivo, pueden producirse también mutaciones que restablezcan su capacidad virulenta como las cepas salvajes17.
Algunos de los genes de resistencia que se han descrito para drogas de primera y segunda línea se presentan en la Tabla 1. Aproximadamente el 95% de todos los aislamientos clínicos resistentes a rifampicina se deben a una mutación del gen rpoâ que codifica la cadena â de del DNA dependiente de la RNA polimerasa del M. tuberculosis. En cambio la resistencia a isoniacida es más compleja, existiendo por lo menos cinco genes implicados.
RELEVANCIA CLÍNICA Y SALUD PÚBLICA
La prevalencia de la TB MDR y de la TB XDR está inversamente correlacionada con la calidad de los programas nacionales de control, siendo el factor más importante del desarrollo de TB MDR y TB XDR el uso inapropiado de drogas de primera y segunda línea, respectivamente23. El desarrollo de la TB XDR revela debilitamiento de los servicios asistenciales en el primer nivel de atención16, por lo que siendo la TB una enfermedad prevenible y curable, llegar a un estado de padecer una forma virtualmente incurable y a mediano o largo plazo letal, es para muchos expertos, un indicador de negligencia en salud pública24.
Se ha documentado un peor pronóstico de TB MDR comparado con la TB sensible y peor pronóstico de TB XDR con respecto a TB MDR12,15. Esto se dio a conocer inicialmente en el grupo de pacientes con-infectados con el VIH16; sin embargo, estudios posteriores en personas no co-infectadas, han confirmado que la TB XDR también es, para ellos, un marcador de mal pronóstico18,19,20.
Sin embargo, Mitnick y col. en una serie de 656 pacientes, 48 (7%) con TB XDR y 608 con TB MDR, tratados entre 1999 y 2002 en el Norte de Lima, reportaron no haber diferencia en cuanto a la cura o resultados favorables entre TB MDR y TB XDR, reportando un éxito de tratamiento de 66,3% y 60,4% (P=0,36) respectivamente21.
Es importante destacar que en esta serie de pacientes con TB XDR, el promedio de esquemas recibidos fue 4,2 y el tiempo de tratamiento previo con drogas antituberculosas fue 34 meses en promedio. Esto abre una esperanza de un mejor pronóstico de la TBMDR y TB XDR, si se diagnostican precozmente y se tiene la capacidad para tratarlas eficientemente. En el caso de pacientes con TB MDR el éxito de tratamiento en pacientes con diagnóstico precoz y tratamiento individualizado oportuno puede llegar hasta 81%.
Los dos factores de riesgo más fuertemente asociados con la TB XDR son: 1) Fracaso a un régimen antituberculoso que contiene drogas de segunda línea que incluye un inyectable y una fluoroquinolona y 2) Contacto estrecho con un individuo con TB XDR documentada o que viene fracasando a un esquema con drogas de segunda línea. En la Tabla 2 se menciona algunos factores de riesgo de TB MDR y factores pronóstico en pacientes con TB MDR y TB XDR22.
El enfoque que debe darse a la TB-XDR, desde un punto de vista de salud pública, es el de una emergencia sanitaria, por lo que se debe lograr los recursos financieros necesarios para controlar su diseminación, lo que pasa por diagnósticos precoces, tratamientos oportunos, manejo integral y subvención de los paciente y colaterales; así como aislamiento de los casos índices hasta que dejen de ser contagiantes. El manejo de pacientes con TB resistente, el cual puede ser considerado como amenaza a la salud pública, debe ser balanceado con una consideración de los derechos humanos y la dignidad del paciente. Guiado por los principios de Siracusa25 la OMS establece que el asilamiento forzado de personas con TB resistente debe ser usado solamente como el último recurso posible cuando todas las otras medias han fracasado, y solo como una medida temporal14.
DIAGNÓSTICO
El diagnóstico de la tuberculosis resistente es eminentemente de laboratorio. Un diagnóstico definitivo de TB MDR o TB XDR requiere que el M. tuberculosis sea aislada en un cultivo (sólido o líquido), identificada y sometida a una prueba de susceptibilidad indirecta.
El cultivo de micobacterias en medios sólidos, seguido por una prueba de susceptibilidad por el método de proporciones en medio Löwenstein – Jesen, toma alrededor de 90 días. Este tiempo es ampliado por trámites administrativos por lo que este proceso no permite un tratamiento oportuno y se retarda la interrupción de la cadena de transmisión. Por esta razón la OMS recomienda el uso de pruebas de diagnóstico rápido de rifampicina e isoniacida en regiones con alto riesgo de TB MDR, sobre todo en las regiones con alta carga de VIH.
Existen varias técnicas que han demostrado utilidad para el diagnóstico rápido de resistencia a isoniacida y rifampicina. La prueba molecular Geno Type MTBDR plus (Hain Lifescience,Nehren, Germany), detecta mutaciones en el gen rpoB para resistencia a RMP, el gen katG para altos niveles de resistencia INH, y el gen inhA para bajos niveles de resistencia a INH, directamente desde muestras de esputo positivas o de aislamientos en cultivos26. Un estudio con 536 muestras de esputo con baciloscopía positiva en Sudafrica determinó una sensibilidad, especificidad y exactitud de diagnóstico de TB MDR de: 98,8%, 100% y 99,8%, respectivamente. El tiempo en emitir resultados en este laboratorio fue entre 1 a 2 días. Además el Geno Type MTBDR plus tuvo una significativa mayor proporción de resultados interpretables (96,8%) comparado con el método convencional de proporciones en agar 7H11 (86,6%) (P<0,001), lo que se debió un número importante de contaminaciones y no desarrollo de micobacterias en los medios de cultivo y sensibilidad27.
En Perú se ha desarrollado la prueba rápida MODS (Mycroscopic Observation Drug Susceptibility), una prueba fenotípica que detecta en el crecimiento de microcolonias con patrón de cordones (agregación de bacilos tuberculosos formando estructuras serpenteantes que es único de M. tuberculosis) en pozos con medio líquido enriquecido y antibióticos; a través de la visualización periódica con un microscopio de luz invertida. Esto permite diagnosticar, en un tiempo promedio de siete días, tuberculosis en muestras de esputo y simultáneamente determinar la susceptibilidad a rifampicina e isoniacida28.
Moore y Et al. col. evaluaron el rendimiento de MODS para detectar directamente de esputo la susceptibilidad a INH, RMP en establecimientos de salud de Lima. En 334 muestras de esputo con cultivo positivo determinaron una sensibilidad, especificidad y concordancia para INH de 84,6%; 99,6% y 97%, para RMP: 100%, 100% y 100%; y para MDR: 88,6%, 100% y 99%. Además MODS reportó mayor capacidad de diagnóstico de tuberculosis con respecto al medio Löwenstein – Jensen y MB BacT system (bioMérieux)29. Reportes en otros países han confirmado las bondades de este método peruano30,31. Sin embargo, consideramos que debe mejorar la sensibilidad a INH por lo que se debe estandarizar mejor la técnica y garantizar las mejores condiciones de bioseguridad posibles del laboratorio, por tratarse de cultivos en medio líquido que tiende a formar aerosoles más fácilmente.
Otra prueba valida en Perú, es el método de nitrato reductasa o Griess (Griess fue un químico alemán que descubrió la reacción de disociación lo que formó las bases para la prueba de detección de nitrato o prueba de Griess) realizado directamente de muestras de esputo. Asencios–Solis y col. estudiaron 192 especimenes de esputo recolectados consecutivamente, detectando por el método Griess 113 de las 114 cepas resistentes a INH y 101 de 108prueba de proporciones de Canetti. Con estos datos se obtuvo una sensibilidad, especificidad y concordancia para INH de 99,1%, 100% y 99,5%, respectivamente y para RMP estos valores fueron: 93,5%, 100% y 96,4%, no se mencionan datos para la detección de TB MDR32. Las limitaciones de este método consistieron en que demandó 28 días para emitir resultados, sólo fue aplicable a los pacientes con baciloscopía de esputo positiva, que representan un 75% del total de pacientes reportados con TB pulmonar, y no discrimina si el crecimiento en el medio es M. tuberculosis, pudiendo dar resultados falsos positivos. En el meta análisis de la prueba de nitrato reductasa de Martin y col., sólo se tuvo información de tres estudios que evaluaron Griess aplicado directamente a muestras de esputo, concluyendo que falta aún mayor evidencia del método usado directamente, no ha si del usado en cultivos (indirecto) que tuvo una alta sensibilidad y especificidad, pero que técnicamente no sería una prueba rápida porque requiere los 30 a 40 días necesarios para el aislamiento primario33
Sin embargo, la confirmación de TB MDR por pruebas de susceptibilidad convencionales es aún requerida como prueba estándar, por ello, es fundamental lograr una capacidad adecuada del laboratorio para asegurar calidad en el diagnóstico de TB MDR.
Las pruebas in vitro para drogas de segunda línea son mucho más problemáticas: los aminoglucósidos, polipéptidos y fluoroquinolonas han sido evaluados en diferentes laboratorios y han mostrado tener relativamente buena reproducibilidad y confiabilidad. Sin embargo, son muy limitados los datos sobre reproducibilidad y confiabilidad para las otras drogas de segunda línea, y la metodología para evaluarlos no ha sido establecida34-40. No hay publicaciones disponibles sobre pruebas rápidas de susceptibilidad a drogas de segunda línea.
TRATAMIENTO DE LA TB XDR
Cualquier paciente en el que se sospecha o diagnóstica TB resistente debe ser tratado con atención de alta calidad y centrada en el paciente, como se indica en las Normas Internacionales de Atención de la Tuberculosis y en la Carta de los Pacientes para el Cuidado de la Tuberculosis14.
Dadas las limitaciones en la realización de ensayos clínicos, la evidencia actual de los tratamientos recomendados se basa en opiniones de expertos, cohortes o series de casos.
Todo paciente con TB MDR o XDR debe recibir drogas de segunda línea directamente supervisada, indepen-dientemente de su vía de administración, las drogas de segunda línea son más caras, menos efectivas y con más reacciones no deseadas, que las drogas de primera línea. En la Tabla 3 se presenta la actual clasificación de las drogas antituberculosas propuesta en la última guía de manejo programático de la TB resistente de la OMS14.
La columna vertebral de los regímenes para el tratamiento de la TB MDR consiste de un medicamento inyectable (aminoglucósido o polipéptido) y una fluoroquinolona, apoyados de al menos otros dos drogas de primera línea, o en su defecto de segunda línea, con el fin de garantizar que el régimen incluya al menos cuatro fármacos con eficacia confirmada o que se espera sean efectivas.
Las últimas recomendaciones propuestas por la OMS para el manejo de la TB resistente se mencionan a continuación14:
-
Diseñar regímenes de tratamiento con un enfoque coherente basado en la jerarquía de los cinco grupos de drogas antituberculosas.
-
Diagnosticar rápidamente la TB resistente e iniciar el tratamiento adecuado.
-
Utilizar por lo menos cuatro fármacos, ya sea con cierta o casi cierta eficacia.
-
Las pruebas de susceptibilidad deberían ser utilizadas para orientar la terapia. Sin embargo, las drogas etambutol, pirazinamida y las drogas de los grupos 4 y 5 no dependen de la prueba de susceptibilidad para ser incluidas en los regimenes individuales.
-
No usar ciprofloxacino como agente antituberculoso.
-
Diseñar o un programa que tome en cuenta el acceso a pruebas de susceptibilidad de alta calidad, las tasas de resistencia a drogas, la prevalencia de VIH y la capacidad técnica y recursos financieros.
-
Tratar durante 18 meses una vez que se haya logrado la negativización del cultivo.
-
Utilizar medidas adyuvantes adecuadamente, incluyendo cirugía, buena nutrición y apoyo social.
-
Tratar agresivamente la TB-XDR, siempre que sea posible.
-
Tratar adecuadamente los efectos adversos y de manera inmediata.
La TB XDR requiere tratamiento individualizado (elaborados tomando en cuenta las drogas previamente recibidas y una prueba de susceptibilidad reciente, menos de 6 meses) dado la limitada exactitud de los regimenes estandarizados (determinados por la vigilancia de la resistencia a drogas en regiones geográficas específicas) para definir la resistencia a drogas de segunda línea. Por ello es importante contar con pruebas de susceptibilidad de alta calidad, lo que hace más difícil el tratamiento de la TB XDR en países con escasos recursos.
La eficacia del tratamiento y otras características de las series de casos de pacientes con TB XDR publicadas en la literatura internacional se presentan en la Tabla 4. En promedio el éxito de los tratamientos de las once series reportadas en esta revisión fue de 47%, lo que es compara a las tasas de cura que se lograban con la era pre-antibiótica. Es notable destacar que la mayoría de esquemas fueron individualizados y contaron con drogas de segunda línea. Los países con tasas de cura mayores al 50% fueron Corea, Perú y Alemania.
Por otro lado la disponibilidad de nuevas drogas antituberculosas no será posible por varios años, por lo que la administración de las actuales drogas de segunda línea debe ser hecha con los mejores estándares de control, dado que constituyen el último recurso terapéutico disponible. Científicos y líderes de salud pública del mundo se reunieron el 12 de junio de 2008 en Estados Unidos y firmaron la Declaración de Cambridge por la cual se acepta que la TB resistente es una emergencia de salud pública y se impulsa la realización de ensayos clínicos para procurar tratamientos eficaces para combatir la tuberculosis y sus formas resistentes en adultos y niños42. Perú, representado por el coordinador nacional de la Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis, ha firmado esta declaración.
PREVENCIÓN Y CONTROL
Se requiere una participación multisectorial para enfrentar la epidemia de TB XDR. El Comité especial de TB XDR de OMS11 estableció recomendaciones en el 2006 para promover las medidas de control y prevención de la TB XDR. Estas medidas comprenden:
-
Fortalecer las actividades básicas para el control de la TB y el VIH/SIDA.
-
Expandir el manejo programático de la TB MDR y la TB XDR.
-
Fortalecer los servicios de laboratorio para un diagnóstico adecuado y oportuno de la TB resistente.
-
Expandir la vigilancia de TB MDR y TB XDR para comprender la magnitud mundial del problema y su relación con el VIH.
-
Promocionar el control de infecciones para proteger a los pacientes y trabajadores de salud.
-
Fortalecer la abogacía, comunicación y movilización social para lograr la participación política en el problema.
-
Conseguir la disponibilidad de fondos a todos los niveles para garantizar los recursos necesarios.
-
Promover investigaciones para desarrollar nuevas prueba de diagnóstico, drogas y vacunas: así como investigación operacional.
En la última reunión del Comité Especial de TB XDR de la OMS, en abril de 2008 [43] se presentaron los siguientes progresos más destacados:
-
Perú se ha convertido en el primer país con bajos recursos que ha logrado el acceso universal para el diagnóstico de la TB MDR y tratamiento de los pacientes con TB MDR. No se aclara las razones ni las fuentes para esta declaración.
-
Se han adaptado las guías de manejo de TB resistente de la OMS.
-
La iniciativa global de laboratorio ha logrado fortalecer la capacidad del laboratorio.
-
Los ensayos de diagnóstico con PCR han sido exitosamente evaluados en Sudáfrica.
-
Se ha logrado evidencia de que la TB MDR puede ser manejada en circunstancias muy difíciles, como países con alta prevalencia en VIH, como Lesotho.
TB XDR EN PERÚ
Perú ocupa el primer lugar en reportar más casos de TB MDR y TB XDR en todo el continente americano. En nuestro país se produce el 33% de todos los casos de TB MDR que anualmente se estiman en América. En el año 2006 se produjeron se estima que se produjeron 3 972 nuevos casos de TB MDR (Intervalo de confianza 95%: 2,842 - 5,192)13.
Según el tercer estudio de vigilancia nacional de la resistencia a drogas antituberculosas en el Perú, el 5,8% de los casos con TB MDR cumplen el criterio de TB XDR44.
En julio de 2007 reportamos la presencia de TB XDR en aislamientos de Perú en el INS45 y desde 1997 a julio de 2008, se reportaron oficialmente por e MINSA 192 casos confirmados de TB XDR, el 91% de ellos procedían de Lima y Callao y el resto de Ica, Ancash, La Libertad, Lambayeque, Piura y Arequipa46.
En la serie de 119 pacientes con TB XDR reportados por Bonilla y col. en el Perú, el 58,8% de los casos fueron varones y el promedio de edad fue de 27 años, con un rango de 10 a 78 años37. Sin embargo, conocemos el caso de un lactante de 10 meses diagnosticado de TB XDR (cepa aislada de contenido gástrico) con el mismo patrón de susceptibilidad que su madre, en la zona de Huaycán (comunicación personal Dr. Hernán Del Castillo, Instituto Nacional de Salud del Niño) que sería a nuestro entender el caso más joven reportado de TB XDR en el mundo.
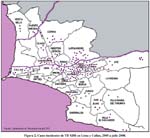
En la Figura 2. Se presenta la incidencia acumulada de los casos de TB XDR detectados desde el 2005 a 2008 en los distritos de Lima y Callao. Las zonas más afectadas de TB MDR y TB XDR se da en 18, distritos que tienen como denominador común un alto índice de hacinamiento: Ate, San Juan De Lurigancho, El Agustino, La Victoria y El Cercado de Lima, Santa Anita, San Martín de Porras, San Juan de Miraflores, Villa María del Triunfo, Villa EL Salvador, Comas, Independencia, Los Olivos, El Rímac, y los distritos de Callao46.
De acuerdo al estudio de Bonilla y col.37 en el Perú se curan o terminan su tratamiento 49% de los pacientes con TB XDR, lo que es menor al 60,4% reportado por Mitnick y col21 en pacientes de Lima Norte, donde la ONG Socios en Salud realizó una intervención de diagnóstico y tratamiento en comunidad, dotando de pruebas de sensibilidad a drogas de segunda línea y medicamentos suficientes para diseñar esquemas individuales, en cambio los datos de Bonilla y col. son de todo el país y representan la efectividad de la estrategia de control del Ministerio de Salud.
A pesar de la recomendación de OMS de aislamiento de estos pacientes hasta que termine su estado de contagiante en instituciones especializadas para tal fin14, esto no se esta dando en el Perú y se continúa con la transmisión de estas cepas en las viviendas, lugares de estudio, trabajo o probablemente en los vehículos de transporte público. No se conoce bien los genotipos implicados en la resistencia en Perú, sin embargo, aparentemente no estaría asociado al genotipo Beijing. Algunos estudios aislados encontraron que menos del 10% de asilamientos de M. tuberculosis en Perú tuvieron este fenotipo.
CONCLUSIONES
La tuberculosis se ha convertido en la enfermedad más amenazadora a la salud pública en todo el mundo, debido a su difícil de control por su mecanismos de transmisión (vía aérea), su comportamiento crónico, que hace a las personas contagiantes por un tiempo prolongado, la pobreza y discriminación que afecta a los pacientes y la alta capacidad bacilo de Koch mutar haciéndose resistente y virulento.
Las formas altamente resistentes de tuberculosis desde la TB mono resistente a la nueva TB XDR amenazan cambiar el actual estado de la tuberculosis desde un gran reto de la salud pública a una enfermedad incurable y altamente letal, sobre todo si se asocia al VIH/SIDA.
Esta preocupación internacional se ve reflejada en las permanentes sesiones del Comité Espacial de la OMS y declaraciones internacionales para impulsar la realización de ensayos clínicos para probar nuevas drogas. Sin embargo, en el país amerita una mayor intervención por parte del Estado ya que no se están cumpliendo siquiera los estándares que propone OMS para controlar esta epidemia, como son: fortalecimiento del primer nivel de atención, el acceso universal al diagnóstico precoz de TB MDR, el tratamiento oportuno con esquemas individualizados, el soporte social y aislamiento consentido de los caso de TB XDR hasta que dejen de ser contagiantes; así como el desarrollo de un marco legal para lograr actividades de control más efectivas. Menos aún se desarrollan actividades de educación a la población general.
El Comité de TB XDR conformado por especialistas del Comité de Evaluación de Re-tratamientos Nacional (CERN) de la Unidad Técnica de TB MDR del MINSA, ha presentado al MINSA y a la sociedad civil, representada por el Colegio Médico del Perú, un informe técnico evaluando la situación actual proponiendo intervenciones sanitarias urgentes para controlar esta epidemia47. Este informe debería ser atendido por las autoridades competentes.
REFERENCIAS BIBLIOGRÁFICAS
1. Daniel TM. The history of tuberculosis. Respir Med 2006; 100: 1862-1870.
2. Jassal M y Bishai W. Extensively drug-resistant tuberculosis. Lancet Infect Dis 2009;9:19-30
3. Cannetti G. The J Burns Amberson lecture: present aspects of bacterial resistance in tuberculosis. Am Rev Respir Dis 1965; 92: 687–703.
4. British Medical Research Council. Streptomycin treatment of pulmonary tuberculosis. BMJ 1948; 2: 769–782.
5. Mitchison D. The Diagnosis and Therapy of Tuberculosis During the Past 100 Years. Am J Respir Crit Care Med 2005;171:699–706.
6. Ryan F. The forgotten plague: how the battle against tuberculosis was won – and lost. 1st Ed. Little, Brown and Company, New York, 1992.
7. Cardoso Leão S y Portaels F. History of Tuberculosis. En Palomino JC, Cardoso Leão S y Ritacco V. Tuberculosis 2007, from basic science to patient care. Disponible en: www.TuberculosisTextbook.com
8. Hart PD. Chemotherapy of tuberculosis - research during the past 100 years. BMJ 1946; 2: 805–810.
9. Frieden TR, Sterling T, Pablos-Mendez A, Kilburn JO, Cauthen GM, Dooley SW. The emergence of drug-resistant tuberculosis in New York City. N Engl J Med 1993; 328: 521–526.
10. Gandhi NR, Moll A, Sturm AW, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. Lancet 2006; 368: 1575–1580.
11. WHO. WHO Global Task Force outlines measures to combat XDR-TB worldwide. Oct 17, 2006. Disponible en: http://www.who.int/mediacentre/news/notes/2006/np29/en/index.html
12. CDC. Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs-worldwide, 2000–2004. MMWR Morb Mortal Wkly Rep 2006; 55: 301–305.
13. WHO. Anti-Tuberculosis Drug Resistance in the World. Fourth Global Report. WHO/HTM/TB/2008.394.
Disponible en: www.who.int/tb/publications/2008/drs_report4_26feb08.pdf14. WHO.Guidelines for the programmatic management of drug-resistant tuberculosis. Update 2008. WHO/HTM/TB/2008.402. Disponible en: http://www.who.int/tb/publications/2008/programmatic_guidelines_for_mdrtb/en/index.html
15. Shah NS; Pratt R; Armstrong L; et al. Extensively Drug-Resistant Tuberculosis in the United States, 1993-2007. JAMA. 2008;300:2153-2160.
16. Raviglione M y Smith I. M XDR Tuberculosis Implications for Global Public Health. N Engl J Med 2008; 356: 656–659
17. Gillespie SH. Evolution of drug resistance in Mycobacterium tuberculosis: clinical and molecular perspective. Antimicrob Agents Chemother 2002; 46: 267–274.
18. Kim H-R, Hwang SS, Kim HJ, et al. Impact of extensive drug resistance on treatment outcomes in non–HIV-infected patients with multidrug-resistant tuberculosis. Clin Infect Dis 2007; 45:1290–1295.
19. Kim DH, Kim HJ, Park S-K y col. Treatment Outcomes and Long-term Survival in Patients with Extensively Drug-resistant Tuberculosis.Am J Respir Crit Care Med Vol 178. pp 1075–1082, 2008
20. Migliori G, lange C, Girardi G, et al. Extensively Drug –Resistant Tuberculosis is worse than multidrug – resistant tuberculosis: different methodology and settings, same results. Clin Infect Dis 2008;46:958-959.
21. Mitnick CD, Shin SS, Seung KJ, et al. Comprehensive treatment of extensively drug-resistant tuberculosis. N Engl J Med 2008; 359: 563–574.
22. Chan ED e Iseman MD. Miltidrug – resistant and extensively drug –resistant tuberculosis: A review. Curr Op Infect Dis 2008;21:587-595
23. Matteelli A, Migliori GB, Cirillo D, et al. Multidrug-resistant and extensively drug-resistant Mycobacterium tuberculosis: epidemiology and control. Expert Rev Anti Infect Ther 2007; 5:857–871.
24. Van Rie A, Enarson D. XDR tuberculosis: an indicator of public-health negligence. Lancet. 2006;368:1554-1556.
25. Siracusa principles on the limitation and derogation provisions in the International Covenant on civil and political rights. New York, United Nations Economic and Social Council, 1985; disponible en: http://www1.umn.edu/humanrts/instree/siracusaprinciples.html
26. Hilleman D, Rusch-Gerdes S, Richter E. Evaluation of the Genotype MTBDRplus Assay for rifampicin and isoniazid susceptibility testing of Mycobacterium tuberculosis strains and in clinical specimens. J Clin Microbiol 2007;45:2635–2640.
27. Barnard M, Albert H, Coetzee G y col. Rapid Molecular Screening for Multidrug-Resistant Tuberculosis in a High- Rapid Molecular Screening for Multidrug-Resistant Tuberculosis in a High-Volume Public Health Laboratory in South Africa. Am J Respir Crit Care Med 2008, 177:787–792.
28. Caviedes L, Lee TS, Gilman RH, et al. Rapid, efficient detection and drug susceptibility testing of Mycobacterium tuberculosis in sputum by microscopic observation of broth cultures. The Tuberculosis Working Group in Peru. J Clin Microbiol 2000; 38: 1203–1208.
29. Moore DA, Evans CA, Gilman RH, et al. Microscopic-observation drug-susceptibility assay for the diagnosis of TB. N Eng J Med 2006; 355: 1539–1550.
30. Ejigu GS, Woldeamanuel Y, Shah NS. Microscopic-observation drug susceptibility assay provides rapid and reliable identification of MDR-TB. Int J Tuberc Lung Dis. 2008;12:332-337
31. Mello FC, Arias MS, Rosales S, et al. Clinical evaluation of the microscopic observation drug susceptibility assay for detection of Mycobacterium tuberculosis resistance to isoniazida or rifampin. J CLin Microbiol 2007:45:3387-3389.
32. Solis LA, Shin SS, Han LL, et al. Validation of a rapid method for detection of M. tuberculosis resistance to isoniazid and rifampin in Lima, Peru. Int J Tuberc Lung Dis 2005;9:760–764.
33. Martin A, Panaiotov S, Portaels F, et al. The nitrate reductase assay for the rapid detection of isoniazid and rifampicin resistance in Mycobacterium tuberculosis: a systematic review and meta-analysis.
34. WHO. Policy guidance on drug-susceptibility testing (DST) of second-line antituberculosis drugs. WHO/HTM/TB/2008.392; disponible en: http://www.who.int/entity/tb/publications/2008/who_htm_tb_2008_392.pdf
35. Migliori GB, Lange C, Centis R; et al. Resistance to second-line injectables and treatment outcomes in multidrug-resistant and extensively drug-resistant tuberculosis cases.
Eur Respir J 2008; 31: 1155–115936. Migliori GB, Besozzi G, Girardi E; et al. Clinical and operational value of the extensively drug-resistant tuberculosis definition. Eur Respir J 2007; 30: 623–626
37. Bonilla CA, Crossa A, Jave HO, Mitnick CD, Jamanca RB, et al. (2008) Management of Extensively Drug-Resistant Tuberculosis in Peru: Cure Is Possible. PLoS ONE 3(8): e2957. doi:10.1371/journal.pone.0002957
38. Keshavjee S, Gelmanova IY, Farmer P et al. Treatment of extensively drug-resistant tuberculosis in Tomsk, Russia: a retrospective cohort study. Lancet 2008; 372: 1403–1409
39. Kwon YS, Kim YH, Suh GY; et al. Treatment Outcomes for HIV-Uninfected Patients with Multidrug-Resistant and Extensively Drug- Resistant Tuberculosis. Clin Infec Dis 2008; 47:496–502
40. Banerjee R, Allen J, Westenhouse J; et al. Extensively Drug-Resistant Tuberculosis in California, 1993–2006 Clin Infec Dis 2008; 47:450–457
41. Eker B, Ortmann J, Migliori G; et al. Multidrug- and Extensively Drug-Resistant Tuberculosis, Germany. Emerg Infec Dis 2008; 14:1700 –17 06
42. Espinal M y Farmer P. The Cambridge Declaration: towards clinical trials for drug-resistant tuberculosis. Int J Tuberc Lung Dis 2009;13:1-2
43. WHO. Report of the second meeting of the WHO Task Force on XDR-TB WHO headquarters, Geneva, Switzerland 9–10 April 2008.
WHO/HTM/TB/2008.403.44. INS. Informe final: Vigilancia de la resistencia a drogas antituberculosas en el Perú. Tercera encuesta nacional 2005 - 2006. Disponible en: www.ins.gob.pe
45. Mendoza A, Asencios L, Quispe N y Leo E. Evidencia de tuberculosis con resistencia extendida a drogas de segunda línea (TB XDR) en el Perú. Rev Peru Med Exp Salud Publica 2007;24:313-314
46. MINSA – ESN PCT. Situación de la Tuberculosis en el Perú. Informe de Gestión – 2008.
47. Comité TB XDR del CERN. Unidad Técnica TB MDR. ESN PCT- MINSA. Análisis de la situación actual y propuesta de lineamientos técnicos para el control y prevención de la tuberculosis resistente en el Perú, 2008. Disponible en www.speit.org
CORRESPONDENCIA
Alberto Mendoza Ticona
mendozalberto@hotmail.com