Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.27 no.1 Lima Jan./mar. 2010
Artículo Original
Meningiomas recurrentes: Factores asociados
Recurrent meningiomas: Associated factors
Edwin Suárez Alvarado1, Hugo Heinike Yáñez2
1 Médico Neurocirujano. Magister en Medicina. Jefe del Servicio de Neurocirugía del Hospital Nacional Sergio E. Bernales, Lima - Perú.
2 Médico Neurocirujano Oncólogo. Jefe del Servicio de Neurocirugía Oncológica. Instituto Especializado de Enfermedades Neoplásicas Dr. Eduardo Cáceres Graziani Lima - Perú.
RESUMEN
Objetivo: Identificar los factores relacionados con la recurrencia de los meningiomas intracraneales operados en el INEN.
Material y método: Estudio retrospectivo, comparativo, analítico, de caso control. Pacientes con diagnóstico anatomopatológico de meningioma operados con control postoperatorio a cinco años.
Resultados: Se realizó la remoción quirúrgica total en 36 pacientes y subtotal en 19 pacientes. Tuvieron recurrencia el 57,8% de los pacientes con resección quirúrgica subtotal y el 33,3% de pacientes con remoción total; esto nos da un OR de 2,7 con una p< 0,05. Se observó mayor recurrencia en pacientes de sexo masculino, con un OR de 1,7. La edad de recurrencia fue de 43,9 ± 16,3 años versus 40,85 ± 17,7 del grupo control. El tiempo de recurrencia fue en promedio de 30,7 ± 16,3 meses. La localización del meningioma que más recurre fue la zona temporal. No existe preponderancia de ningún tipo de meningioma con respecto a la recurrencia.
Conclusiones: El factor de la recurrencia fue el grado de resección quirúrgica, encontrándose que un paciente sometido a una remoción quirúrgica subtotal tiene 2,7 veces más posibilidades de presentar recurrencia del meningioma en comparación con la resección quirúrgica total. El sexo masculino presentó mayor recurrencia. La edad promedio fue de 43,9 años. El tiempo de recurrencia en promedio fue de 30,7 meses. La localización más frecuente fue la zona temporal. El abordaje que presentó mayor recurrencia fue el frontoparietal. No existió preponderancia de ningún tipo histológico en el meningioma recurrente.
Palabras clave: Meningioma, neoplasias meníngeas, neoplasias del sistema nervioso.
ABSTRACT
Objective: To identify factors related with recurrence of intracranial meningiomas operated at the Instituto Nacional de Enfermedades Neoplásicas (Peruvian National Cancer Institute).
Material and method: Retrospective, comparative, analytical, case control study. Patients operated who had an anatomopathological diagnosis of meningioma and who underwent a post-operative control after five years were included.
Results: Total surgical resections were performed in 36 patients, and subtotal resections were performed in 19 patients. Nearly sixty per cent (57.8%) of patients undergoing subtotal resections developed recurrences, as well as 33.3% of those who underwent total resections, giving a 2.7 odds ratio (OR) and p<0.05. Recurrences were most frequently observed in male patients, with a 1.7 OR. Age of recurrence was 43.9 ± 16.3 years compared to 40.85 ± 17.7 in the control group. Time for recurrence was on average 30.7 ± 16.3 months. The location of most frequently recurring meningiomas was the temporal area. There is no predominance of any type of meningioma with respect to recurrence.
Conclusions: The factor for recurrence was surgical resection, and it was found that a patient undergoing a subtotal surgical resection had 2.7 times more likelihood for developing meningioma recurrence compared to total surgical resection. Male patients recurred more frequently. Average age of patients was 43.9 years. Average time for recurrence was 30.7 months.
Key words: Meningioma, meningeal neoplasms, nervous system neoplasms.
INTRODUCCIÓN
La recurrencia es el factor pronóstico más importante del meningioma operado, que si es resecado totalmente, se esperaría una cura cercana al 100%, sin embargo, a pesar de realizarse resecciones totales existe un grupo de pacientes que experimenta recurrencia, existen, por lo tanto otros factores asociados, ya que es bien sabido que resecciones totales a la macroscopía y con estudios histopatológicos de total benignidad, llegan a recurrir, y a la inversa, meningiomas operados con resecciones subtotales y con elementos celulares de agresividad y/o malignidad pueden no recurrir 2, 10, 23, 38.
Los meningiomas son los tumores que representan el 15% de los tumores intracraneales según Stafford84, 13-26% según Whitte95, 15-20% según Klenert36, 13,4% según Youmans99 y 11,6% según Heinicke24 y los segundos en orden de frecuencia de todos los tumores primarios del SNC cuya extirpación quirúrgica completa es a la vez posible.
Los meningiomas son tumores del adulto, como pone de manifiesto el hecho que su máxima incidencia tenga lugar a los 42,9 años en el sexo femenino y a los 52 años en el sexo masculino99, son más frecuentes en las mujeres con una relación de 3/2 71. Los pacientes con historia previa de radiación craneal corren un riesgo cuatro veces mayor de desarrollar meningiomas, aunque el periodo de latencia es muy largo 15- 20 años.
Los meningiomassondeorigen leptomeníngeo y seoriginan a expensas de nidos de las células de la capa aracnoidal de la duramadre, pueden localizarse en cualquier sitio del sistema nervioso central y aún ser intraventriculares. Sin embargo, el 90% son intracraneales y a su vez, el 90% de estos últimos afectan el compartimiento supratentorial, predominando en la convexidad 98.
Las tres localizaciones más comunes son las adyacentes al seno sagital superior (meningiomas parasagitales de la hoz), la convexidad cerebral (meningiomas de la convexidad) y a lo largo del reborde esfenoidal (meningiomas esfenoidales)2, 10, 14. Estas localizaciones comprenden alrededor del 60% de todos los meningiomas intracraneales. La mayor parte de los restantes se desarrollan a lo largo de la base del cráneo (meningioma del surco olfatorio, de la silla turca, tentoriales y petroclivales). Otras localizaciones menos frecuentes son la vaina del nervio óptico, el ventrículo lateral y la región de la glándula pineal. Los meningiomas infratentoriales que constituyen el 10% de todos estos tumores, se encuentran sobre la convexidad del cerebelo, en el ángulo pontocerebeloso, a lo largo del clivus o en la región del agujero occipital2, 3.
A pesar de que el 90% de los meningiomas son benignos, un cierto número de casos recurren, incluso después de muchos años. El estudio realizado por Scott84 en una cohorte de 581 pacientes operados en la Clínica Mayo Rochester entre los años 1978 a 1988 (10 años) encuentra que recurren 106 pacientes. Los que tienen resección total del tumor tiene una progresión libre del tumor a los 5 años del 88% y a los 10 años 75% y en el caso de los que tienen resección subtotal tienen progresión libre del tumor 61% a los 5 años y 39% a los 10 años. Jaaskelainen29 considera que los factores de riesgo de recurrencia más importantes son: la invasión al hueso subyacente, coagulación de la dura y la consistencia blanda del meningioma y no exclusivamente los factores anatomopatológicos. Por otro lado, se considera a la resección subtotal como el factor más importante en la recurrencia debido a las localizaciones quirúrgicamente difíciles de abordar10, 11, 19.
La posibilidad de que un meningioma recurra está en función a la resección amplia tumoral, sin embargo, las resecciones totales a la macroscopía tienen una tasa de recurrencia alrededor de 9 al 32% que está relacionada con células tumorales viables con cambios displásicos a la microscopía10.
Los meningiomas son tumores mesodérmicos que generalmente se originan a partir de células meningoteliales especializadas, fibroblastos durales y/o de restos aracnoideos. Estos tumores pueden experimentar recurrencia luego de su extirpación total a la macroscopía.
En el año 1957 Simpson realizó una clasificación del tipo de cirugía en base al grado de resección del meningioma82.
Simpson aplicando esta clasificación en forma retrospectiva en Inglaterra a 265 pacientes, halla que 55 pacientes presentan recurrencia (20,8%). En el grado I, 9%; en el grado II, 19%; en el grado III, 29% y en el grado IV, 44%.
Posteriormente Borovich10 en el año 1986 propone agregar a esta clasificación el grado 0 (cero) el cual consiste en la resección de la duramadre marginal al meningioma hasta 4 centímetros por fuera de la zona de inserción, ya que se demostró que en la microscopía existían células de tipo meningoteliomatosas.
Chan y Thompson14 reportan 22% de recurrencia en todos los casos (57/257). Simpson I: 11% (10/89) y Simpson II: 22% (26/118) de recurrencia en los grados de Simpson III: 50% (3/6), en el Simpson IV: 37% (16/43) y en el Simpson V: 100% (1/1) .
Mirimanoff55 tras la resección total encuentra una sobrevida de 83%, 77%, y 69 % a 5, 10 y 15 años respectivamente; cuando la resección es subtotal encuentra una sobrevida de 63%, 45%, y 9 % a los 5, 10 y 15 años respectivamente.
Tratar de predecir la recurrencia del meningioma, en función del tipo histológico, es un enfoque inadecuado, ya que no existe correlación entre el tipo histológico del tumor y la posibilidad de recurrencia1, 4, 21, 38, 51, 67, 85. Por esta razón se idean diferentes técnicas que puedan predecir el comportamiento a futuro del meningioma operado tales como la cistometría de flujo en parafina reportada por May51 que mide el porcentaje de células que se encuentran en la fase S y la relación G2/M y, cuando se encuentra por encima de 20%, a pesar que se realice una resección total, la posibilidad que el meningioma recurra es alta.
Los resultados del estudio de Konstantinidou38 demuestran la presencia de apoptosis en el meningioma recurrente y la cuantifican a través del potencial apoptótico por medio del monoclonal del anti-ssDNA; que es un anticuerpo que proporciona información de pronóstico.
Klener36 relaciona la actividad de la enzima ORNITINA DE DECARBOXILASA y encuentra que el nivel de ODC mRNA era significativamente más alto en los meningiomas recurrentes comparado al de meningiomas sin recurrencia. En contraste, la actividad de ODC no ha mostrado ninguna diferencia entre los grupos de tumores primarios. Igualmente, un aumento del Ki-67 es un índice que está aumentado en el grupo recurrente. Estos resultados sugieren que los mRNA de ODC pueden representar un factor del pronóstico para predecir su recurrencia.
Okada65 demostró que el uso de matriz metaloproteinasa-2 (MMP-2) y de matriz metaloproteinasa-9 (MMP-9) son factores pronóstico de recurrencia.
El uso de Mcm-2 (protein are member of the maintenane-2), por parte de Coleman16, identifica a los meningiomas que harán recurrencia.
El crecimiento del meningioma está relacionado con receptores diversos. En un estudio realizado por Ojeda62 en el INEN encuentra que de 24 pacientes, 9 (37%) presentaban receptores de progesterona y de éstos 8 eran de sexo femenino. Nagashima57 hace el correlato de receptores de progesterona respecto al antígeno KI -67, comprobando que existe relación con el crecimiento del mismo. Carroll13 encuentra receptores para dopamina (D1) y receptores para prolactina en el 50-60% de los meningiomas.
Existen otros factores relacionados con el crecimiento tumoral del meningioma como: 1) factor de transformación del desarrollo, 2) factor de crecimiento derivado de plaquetas (PDGF) 3) factor del desarrollo fibroblástico y 4) factor de crecimiento ligado a la insulina.
Hakin-Smit23 cuando estudia la regulación de la expresión del ciclo celular por parte de p-53, p-21, mdm2, la proliferating cell nuclear antigen (PCNA) encuentra una inducción por parte de la p53.
La presencia de deleción del brazo largo del cromosoma 22 ocurre en el 72% de los casos del meningioma18.
Jesen30 demuestra que los bloqueadores de calcio tipo L voltaje dependientes como el verapamilo, nifedipino y diltiazem disminuyen la velocidad de crecimiento de los meningiomas in vitro.
Strojnik86 encuentra niveles elevados de catepsina B y L en los meningiomas de tipo invasivo.
Con respecto a la localización del meningioma han existido a través del tiempo diferentes enfoques tales como el de Apuzo5 que considera: meningiomas de la convexidad, parasagital, parafalsiano, surco olfatorio, paraselar y esfenoidal. Con respecto a la región tentorial considera: el parcelar, cavernoso, petroclivotentorial, tentorial, falcotentorial, torcular y del ángulo pontocerebeloso.
Sin embargo, consideró que la clasificación más completa es la de Al-Mefty3.
La clasificación histológica también tiene diferentes etapas, ya que Cushing los divide en: mesenquimatoso, angioblástico, menintoteliomatoso, psamomatoso, osteoblástico, condroblástico, fibroblástico, melanoblástico y lipomatoso.
La clasificación de Russell y Rubinstein divide en: meningoteliomatoso (sincicial), fibroso, transicional, angioblástico. Por último, la OMS realiza una clasificación utilizando puntajes de 0 a 3 con respecto a los parámetros: arquitectura, incremento de celularidad, pleomorfismo nuclear, figuras mitóticas, necrosis focal, y presencia o ausencia de infiltración del cerebro y según esto tenemos: Grado I (benigno): de 0 -2 puntos, Grado II (atípico): de 3-6 puntos, Grado III (anaplásico): de 7-11 puntos y grado IV (sarcomatoso): 12-18 puntos.
MATERIAL Y MÉTODO
Diseño de Investigación
Estudio de tipo retrospectivo, comparativo, analítico, de caso control.
Población
Pacientes operados en el Instituto Especializado de Enfermedades Neoplásicas Dr. Eduardo Cáceres Graziani entre los años 1984-1997, con un seguimiento hasta 05 años post operados y que tienen diagnóstico anatomopatológico de meningioma, los cuales se dividen en dos grupos los que recurren; y otro grupo con las mismas características que no presenta recurrencia tumoral.
Análisis Estadístico
El tratamiento estadístico se realiza utilizando cuadros inferenciales comparativos conla estadística de Chi Cuadrado con la corrección de Yates, para las variables cualitativas de comportamiento normal, sin embargo para las variables cuantitativas discretas, que se pueden expresar a través de una media y desviación estándar, la t de Student.
Cuando la variable es cualitativa se utiliza la estadística de diferencia de proporciones, para variables cuantitativas de comportamiento no normalizado se utiliza la estadística de Wicolson. Se ayuda con el programa estadístico SPSS 7,5.
Además se realiza el análisis del Odds Ratio (OR), en los casos necesarios.
Se considera estadísticamente significativo cuando p < 0,05.
RESULTADOS
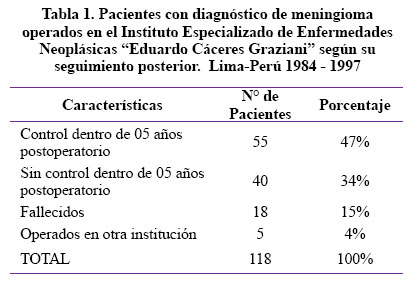
En la Tabla 1 se aprecia que 55 pacientes cumplen los criterios de inclusión para el estudio ya que 40 pacientes fueron excluidos por no tener control a los cinco años postoperatorios, además se excluyeron los 18 pacientes fallecidos en el postoperatorio tanto inmediato como mediato y cinco pacientes operados en otra institución diferente al Instituto Especializado de Enfermedades Neoplásicas Dr. Eduardo Cáceres Graziani, debido a que se desconoce las características de éstos.
De los 55 pacientes que cumplieron con los criterios de inclusión: 23 (41,8%) presentaron recurrencia del meningioma y 32 (58,2%) no presentaron recurrencia a cinco años de seguimiento.
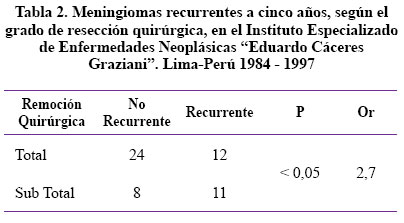
Se realizó una resección quirúrgica total (RQT) en 36 pacientes y resección quirúrgica subtotal (RQS) en 19. En las RQT, 12 (33,3%) presentaron recurrencia, mientras que 24 (66,7%) no. En las RQS, 11 (57,8%) presentaron recurrencia y 8 (42,4%) no.
En la Tabla 2 se observó que existe una diferencia en los pacientes que han tenido una resección quirúrgica subtotal, en los cuales la posibilidad de reintervención quirúrgica es alta, el 0R nos muestra que estos pacientes tienen 2,7 veces más posibilidad de reingresar a una nueva cirugía a causa de recurrencia del meningioma con un índice de certeza de 95% de estar en lo cierto.
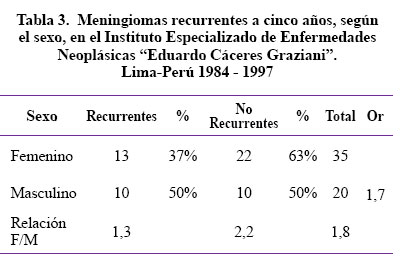
Con respecto al sexo, en la Tabla 3 se observa que 35 pacientes son del sexo femenino y 20 son del sexo masculino, la relación F/M de la presente serie es de 1,8, lo que indica que las mujeres presentan mayor frecuencia de meningiomas en general. Sin embargo, cuando se realiza el análisis de los pacientes que presentaron recurrencia notamos que: 13 (37%) pacientes son del sexo femenino y 10 (50%) son del sexo masculino Al realizar el análisis con el OR resulta 1,7, lo cual nos indica que un paciente de sexo masculino tiene 1,7 veces más probabilidades de hacer recurrencia del meningioma dentro de los cinco años después de la cirugía.
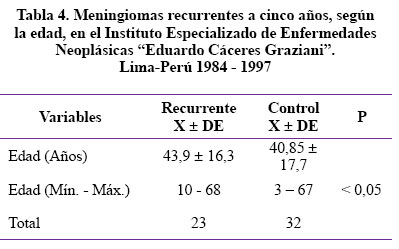
Con respecto a la edad se puede apreciar en la Tabla 4 que la edad de los pacientes con meningiomas recurrentes es, en promedio, 43,9 años con una desviación estándar de 16,3 años y con un rango de 10 - 68 años y que la edad promedio del meningioma no recurrente es de 40,85 años con una desviación estándar de 17,7 años con un rango de 03 a 67 años. Por lo tanto, el meningioma que recurre presenta mayor edad y esta diferencia es estadísticamente significativa, con 95% de certeza.
El intervalo de tiempo entre la cirugía inicial y la recurrencia del mismo en el presente estudio es de 30,7 meses con una desviación estándar de 16,3 meses y un rango de 03 - a 72 meses.
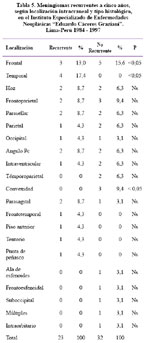
Respecto a la localización, se aprecia en la Tabla 5 que el lugar donde menos recurre es la zona frontal con los siguientes valores: meningioma no recurrente 5 (15,6%) y meningioma recurrente 3 (13%) y en la localización de la convexidad: no recurrente 3 (9,4%) y recurrente 0 (cero) esto hace que exista una diferencia estadísticamente significativa con una p< 0,05, es decir, en la zona frontal y la convexidad existe una menor recurrencia con una diferencia estadísticamente significativa. No se encontró diferencia significativa cuando el meningioma es de la hoz, frontoparietal, parasellar, parietal, occipital, ángulo pontocerebeloso, intraventricular, temporoparietal, parasagital, frontotemporal, de piso anterior, tentorio, punta del peñasco, ala mayor del esfenoides, frontoesfenoidal, suboccipital y múltiple.
En la histología se observa que no existe preponderancia de ningún tipo histológico con respecto a la recurrencia, sin embargo el tipo histológico que menos recurre es el meningoteliomatoso y el fibroblástico, con una P< 0,05.
Podemos apreciar que 118 pacientes fueron operados por meningioma entre los años de 1984 a 1997, de los cuales 40 pacientes se excluyen del estudio por no tener control postoperatorio hasta cinco años después de la cirugía, también se excluyen 18 pacientes que fallecieron dentro de los cinco años posterior al tratamiento quirúrgico y además se excluyen los que han sido operados en otra institución diferente al Instituto Especializado de Enfermedades Neoplásicas por no tener claro cuáles fueron las características de las variables en estudio, por lo tanto ingresan al estudio un total de 55 pacientes.
En el grupo de 55 pacientes cuando se les estudia desde el punto de vista de la remoción quirúrgica, se encuentra que se realizó una resección quirúrgica total en 36 pacientes, de los cuales 12 (33,3%) presentaron recurrencia, mientras que 24 (66,7%) pacientes no presentaron recurrencia, y además, se realizó una resección subtotal en 19 pacientes, de los cuales 11 (57,8%) presentaron recurrencia y 8 (42,4%) no presentaron recurrencia.
Es decir que cuando se realiza resección quirúrgica subtotal la recurrencia alcanza al 57,8 % de pacientes, mientras que cuando la resección es total sólo recurren un 33,3% de pacientes, a cinco años de seguimiento post operatorio. Esta diferencia es estadísticamente significativa y además la probabilidad de que estos pacientes reingresen a una nueva cirugía cuando se realiza resecciones subtotales es de 2,7 veces más que cuando se realiza una resección total del mismo.
Comparando los anteriores resultados con un estudio de cohortes realizado por Stafford84 en la Mayo Clinic Rochester, Minnesota, en 581 pacientes, entre los años 1978-1988, quien clasifica las resecciones en totales y subtotales, encuentra una recurrencia de 12% para las resecciones totales y 39% para las resecciones subtotales a 5 años de seguimiento. Se puede apreciar que en ambos trabajos existe recurrencia a pesar de las resecciones tumorales totales, probablemente debido a la existencia de células displásicas, alrededor de la zona de implantación del meningioma, que posteriormente se convierten en neoplásicas10.
Borovich10 en el año 1986, estudiando las meninges que rodean el meningioma, encuentra células meningoteliomatosas con cambios displásicos, es por esta razón que recomienda su resección con un margen de cuatro centímetros del lugar de implantación del meningioma y se agrega una nueva graduación a la escala de Simpson con el número 0 (cero) que corresponde a la resección total del meningioma más la exéresis de 4 cm por fuera de la inserción del meningioma que a la macroscopía aparenta estar sana.
Esta resección total ampliada a 4 cm por fuera de la inserción tumoral garantiza una recurrencia de 0% tal como lo demuestra Kinjo35; sin embargo, la posibilidad de realizar una resección total es, muchas veces, imposible en los meningiomas de base de cráneo o los que están infiltrados al seno y que lo invaden en forma parcial, ya que no se puede realizar una obliteración del seno sin que se produzca una redistribución del drenaje venoso con edema postoperatorio intratable, por lo que se realiza una resección subtotal. Los pacientes con resección subtotal, a pesar de tener un tipo histológico benigno, tendrán necesariamente una recurrencia en aproximadamente 30,7 meses, según el presente estudio.
TIIT encuentra una recurrencia de 4% en resecciones I y II de la escala de Simpson y de 25-45 % en la escala de III - IV . Kinjo35, demuestran que cuando existe una resección a nivel de la convexidad, y se agrega la remoción a 4 cm de la implantación del meningioma, la recurrencia es 0%, se excluyen, en el trabajo, a los meningiomas malignos, al hemangiopericitoma, a los meningiomas múltiples y a meningiomas relacionados con la enfermedad de Von Recklinghausens.
Jaaskeleinen29 encuentra una recurrencia a 20 años en el 19 % y encuentra como factores de riesgo: la coagulación de la dura, la invasión del hueso y la consistencia blanda del meningioma.
En la tabla 5 se relaciona el grado de resección quirúrgica con la recurrencia del meningioma; tenemos que el OR es de 2,7, que implica que un paciente sometido a remoción quirúrgica subtotal tiene 2,7 veces más posibilidades de reingresar a cirugía a causa de recurrencia del meningioma, con un de 95% de certeza. Esta variable es la más importante en el pronóstico de recurrencia del meningioma.
Por lo tanto, al ser el grado de resección, la variable más importante para la recurrencia del meningioma, es necesario realizar una acuciosa evaluación prequirúrgica consistente en una resonancia con contraste, panangiografía con sustracción digital, para evaluar el drenaje venoso y la presencia u obliteración de los senos comprometidos, y de ser posible, embolización de los vasos que alimentan al meningioma que nos permitirá un mejor plano de clivaje y menor sangrado, y además siempre tratar de realizar una exéresis de la duramadre adyacente a la zona de implantación del meningioma, que a la macroscopía aparentemente parece sana, pero que sin embargo ya presenta cambios displásicos .
Con respecto a la vida libre de recurrencia a 5 años, se aprecia que, cuando la resección es total, existe una vida libre de recurrencia a 5 años en el 66,7% de pacientes, y cuando la resección es subtotal, la vida libre de recurrencia a 5 años se reduce al 42,2% de pacientes. Estos resultados arrojan porcentajes semejantes con los obtenidos en otros estudios84 en los cuales encuentran una vida libre de recurrencia a cinco años en el 88% de pacientes con remociones totales y en 61% de pacientes con resecciones subtotales. Comparando con el estudio de Simpson82, este autor encuentra que en el grado de resección I existe recurrencia del 8%; en el grado II, 16 %; en el grado III, 29 % y; grado IV, 42%. Como podemos observar a pesar de realizarse una resección total en las diferentes series se reporta recurrencia tumoral, que muchas veces se le atribuía a una técnica quirúrgica mal desarrollada.
Con respecto al sexo, se encuentra que 35 (63%) pacientes son de sexo femenino y 20 (47%) pacientes, de sexo masculino, esto coincide con el trabajo de Heinicke24 quien encuentra una frecuencia de 69% en el sexo femenino. En el grupo de meningiomas recurrentes se observa que son más frecuentes los pacientes de sexo masculino con el 50%, mientras que las mujeres alcanzan una recurrencia de 37%. Con respecto a la relación F/M de la presente serie es de 1,8 de todo el grupo estudiado que nos indica que las mujeres presentan mayor frecuencia de meningiomas en forma general; sin embargo, es el sexo masculino el que presenta mayor recurrencia, con 1,7 veces más probabilidades de hacer recurrencia del meningioma, en relación al sexo femenino.
Comparando estos resultados con el trabajo de Susan87 que demuestra una mayor incidencia en la población femenina de los meningiomas en general, por la presencia de receptores para progesterona, teniendo el meningioma meningotelial 96% de positividad; el meningioma transicional, 71% y; el meningioma fibroblástico, 48%. Por esta razón Grunberg22 usa el RU 486 (Mefiprestone), antagonista de los receptores de la progesterona a nivel del meningioma, con el objetivo de disminuir la velocidad de crecimiento, siendo su mecanismo de acción mediante la iteración de la P-53 94.
Wahab y Azzawi94 reportan la presencia de receptores para progesterona (PR) en un 81% de pacientes de sexo femenino y en un 91% en pacientes del sexo masculino y existiendo dos tipos: el PR-A y el PR-B siendo la positividad de 60% de PR-A para los meningiomas, estos receptores a su vez presentan cofactores asociados como el Receptor Cofactor de Esteroides – 1 (SRC-1) y el Factor Intermediario Transcripcional- 2 (TIF-2).
También se demuestra en el sexo femenino la presencia de receptores para estrógenos (ERs), Carrol12 reportan dos isoformas los ERs- alfa y los ERs .- beta estudio en la cual postula que este receptor ERs- beta es independiente a la acción de los estrógenos
La mayor recurrencia del meningioma en el sexo masculino probablemente se deba a la existencia de receptores independientes de progesterona y de estrógenos que presenten una mayor estimulación del crecimiento de los meningiomas; tales como los receptores para andrógenos, de glucocorticoides, neurotensina, factor de crecimiento derivado de plaquetas (PDGF-B), factor de crecimiento ligado a la insulina 1 y 2 (IGF 1 y 2), factor de crecimiento transformador beta-1 (TGF-1), interferón alfa (FFN-α), interleucina 6 (IL 6), factor de crecimiento de receptores de fibroblasto-1 y endotelina A98.
Los estudios de Markwalder46 identifican receptores: para andrógenos en un 47%, receptor de somatostatina, factor de crecimiento para la insulina, factor de crecimiento epidermal y receptores de D1 de la dopamina. Carrol12 encuentra receptores de dopamina D1 y receptores de prolactina en el 50-60% de los casos. Además, Jensen30, en estudios realizados in vitro, nota una disminución de la velocidad de crecimiento del meningioma con bloqueadores de canales de calcio tipo L voltaje- dependientes, tales como verapamilo, nifedipino y diltiazem, demostrando con esto el papel de los receptores de calcio en el crecimiento del meningioma.
Con respecto a la edad promedio encontrada en el presente trabajo es de 43,9 ± 16,3 años y del grupo control 40,85 ± 17,7. Se sabe que la incidencia de meningiomas se incrementa con la edad, en el presente estudio se considera la edad de la primera cirugía, y es interesante resaltar que los meningiomas tienen comportamiento más agresivo cuando los pacientes son de mayor edad. Diferentes estudios2, 10, 48, 49 demuestran que existe mayor incidencia de meningiomas al incrementarse la edad. El presente estudio encuentra que los pacientes con meningiomas recurrentes tienen mayor edad que los que no presentan recurrencia con una p<0,05 haciendo una diferencia significativa, la explicación de la agresividad del meningioma en el paciente de mayor edad podría ser su descubrimiento tardío y por lo tanto ha tenido un crecimiento mayor, y con compromiso de estructuras nobles intracraneales que hacen que no sea posible su resección total en la mayoría de las veces.
El tiempo de la recurrencia del meningioma en el presente estudio es en promedio de 30,7 ± 16,3 meses con un mínimo de 3 meses y máximo de 72 meses. Comparamos estos resultados con los de Abramovich1 quien encuentra un tiempo de recurrencia promedio de 55 meses con un mínimo de 5 meses y máximo de 183 meses.
Respecto a la localización, se aprecia que el lugar donde menos recurre es la zona frontal y la convexidad con una p< 0,05.
Ojemann64, en un trabajo realizado en 66 pacientes, en 65 de los cuales la resección fue total y en un caso fue subtotal, encuentra recurrencia en un solo paciente. Kinjo35 realiza resecciones radicales a 4 cm por fuera del meningioma de la convexidad y encuentra 0% de recurrencia.
El lugar donde más recurre, con una p< 0,05, es en la zona temporal relacionada con la base de cráneo y con el ala mayor del esfenoides razón por la cual su resección, la mayoría de veces, es subtotal. Estos resultados coinciden con los resultados encontrados por Kinyo35, Miller54, Mirimanoff 55. Sin embargo, el presente estudio, no encuentra diferencia significativa cuando el meningioma es de la hoz, frontoparietal, parasellar, parietal, occipital, ángulo pontocerebeloso, intraventricular, témporoparietal, parasagital, frontotemporal, de piso anterior, tentorio, punta del peñasco, ala mayor del esfenoides, frontoesfenoidal, suboccipital y múltiple. Considero que este tipo de nomenclatura para las localizaciones no es la más adecuada ya que menciona un lugar en el espacio dentro de la cavidad craneana y la nomenclatura de localización del meningioma debe estar más relacionada con el lugar de nacimiento o de inserción del mismo; por lo tanto, la clasificación propuesta por Al- Mefty3 cumple con este requisito fundamental, por lo cual se propone que en los reportes operatorios se especifique a cuál de los siguientes lugares pertenece el meningioma operado: 1) Meningiomas de la base craneal anterior: meningiomas del tubérculo selar, meningiomas del surco olfatorio; 2) Meningiomas de la base craneal media: meningiomas del ala mayor del esfenoides, meningiomas de clinoides anteriores, meningiomas de la placa del ala del esfenoides, meningiomas del seno cavernoso, meningiomas del canal óptico y órbita, meningiomas del cavun de Meckel, meningiomas cráneo orbitarios, meningiomas de Clinoides posteriores y clivus superior; 3) Meningiomas de la base craneal posterior: meningiomas del clivus, meningiomas petroclivales, meningiomas esfenopetroclivales, meningiomas petrosos, meningiomas de la punta del peñasco, meningiomas ángulo pontocerebelosos, meningiomas del agujero de la yugular, meningiomas tentorial, meningiomas hueso temporal; 4) Meningiomas de la bóveda craneal, meningiomas del convexidad, meningiomas parasagitales, meningiomas de la hoz. Esta clasificación permite la planificación del abordaje quirúrgico3.
Respecto a la histología se observa que no existe preponderancia de ningún tipo histológico con respecto a la recurrencia. Sin embargo el tipo histológico que menos recurre es el meningoteliomatoso y el fibroblástico, no existiendo diferencia significativa con los de tipo transicional, transicional-fibroblástico, sincicial, microquístico, psamomatoso, hemangiopericitoma, angioblástico, meningoteliomatoso-fibroblástico, transicional-fibroblástico-psamomatoso y el meningoteliomatoso maligno.
Diferentes autores tratan de encontrar una prueba para evaluar el pronóstico de recurrencia tales como Fukui21 que lo evalúa a través del uso de bromodeoxiuridine; Hoshino26 realiza el estudio cinético de la célula a través de la bromodeoxiuridine; Prayson72 lo evalúa a través de la p53; Salmon77 utiliza el índice de proliferación delADN para la predicción del meningioma; Shibuya80 utiliza un análisis con el Ki-67 y el antiDNApolimerasa, anticuerpos alfa monoclonales y bromodeoxiuridine; Striepecke85 hace una correlación histológica citogenética y de la fracción de proliferación con Ki-67 y PCNA encontrando que no existe relación en la predicción para la recurrencia con respecto al tipo histológico coincidiendo con los resultados del presente trabajo, lo cual también fue demostrado por Vagner93.
Uno de los determinantes del comportamiento del meningioma que recurre es su tipo histológico siempre y cuando sea del tipo maligno y anaplásico que incluso pueden dar metástasis. Rivas73 reporta el caso de una mujer de 41 que desarrolló meningiomas angioblásticos con metástasis a la región retroauricular y al hígado, la paciente fue sometida a hepatectomía izquierda por una metástasis de 9 cm de diámetro. Williamson96 describe el caso de una mujer de 64 años en quien se realiza una resección del meningioma del hemisferio cerebral derecho con recurrencia a los diez años y además presenta una metástasis a nivel pulmonar en región subpleural, se realizó una toracotomía y resección del tumor que fue evaluado con microscopía e inmunohistología en los cuales se demuestra que fue meningioma de tipo metastático.
Vagner93 realiza una correlación entre la histopatología y la citogenética y encuentra en el tipo histológico benigno una monosomía del cromosoma 22; sin embargo, el meningioma atípico muestra la existencia de telómeros y asociaciones en 8; por último en el grado III (anaplásico) encuentra anormalidades completas y asociaciones teloméricas, demostrándose una asociación entre el grado y las anormalidades cromosómicas. El trabajo de Vagner93 también encuentra una asociación entre el lugar del meningioma y su comportamiento histopatológico, siendo en la convexidad de tipo atípico en el 78% y del tipo anaplásico en el 86% versus en la base de cráneo con predominio del tipo benigno en el 80%.
Dan X Cai18 reporta anormalidades genéticas como la pérdida del brazo largo 22q por deleciones en las regiones 1p y 14q y encuentra que el 23-31% son meningiomas de tipo benigno, el 56-57% son atípicos y el 67-75% son meningiomas anaplásicos, siendo esta diferencia altamente significativa (p<0,05).
En conclusión, los estudios mundiales y el presente estudio demuestran que no existe relación entre el tipo histológico y la posibilidad de recurrencia, por lo tanto, el tipo histológico no tiene valor predictivo.
REFERENCIAS BIBLIOGRÁFICAS
1. Abramovich Caroline, Prayson Richard. Histopathologic Features and MIB-1 Labeling Indices in Recurrent and Nonrecurrent Meningiomas.Archives of Pathology & Laboratory Medicine. 1999; 123: 793-800.
2. AdegbiteAb,KhanMi,PaineKwe,TanLk:Therecurrenceof intracranial meningiomas after surgical treatment. J Neurosurg. 1983; 58:51-56.
3. Al- Mefty. Cirugía De Los Meningiomas. Editorial Marbab New York 1999.
4. Álmos Klener, Bagriele Rohn, Gerhard Schillinger, Roland Schoder, Norfrid Klug, Ralf-Ingo Ernestus. ODC mRNA as a prognostic factor for predicting recurrence in meningiomas. Journal of Neuro-Oncology 2001; 53: 67-75.
5. Apuzzo, Michael. Brain Surgery. Edit. Churchil Libinston. N.Y. 1992.
6. Apuzzo, Michael. Surgery of the third ventricle. USA. Ed. William & Wilkins. 1996.
7. Barbaro Nm, Gutin Ph, Wilson Cb, Sheling Ge, Boldrey Eb, Wara Wm: Radiation therapy in the treatment of partially resected meningiomas.Neurosurgery. 1987; 20: 525-528.
8. Bickerstaff, E. R., Small, J. M., Guest, I. A. The relapsing course of certain meningiomas in relation to pregnancy and menstruation. J. Neurol. Neurosurg. Psychiatry, 1958; 21: 89–91.
9. Boker Dk., Meurer H Gullotta. Recurring intracraneal meningiomas. J.Neurorug Sci. 1985; 29: 11-17.
10. Borovich.B,YDorenY.Recurrenceintracranealmeningiomas: The role played by regional multicentricity. J. Neurosurger. 1986; 64-68.
11. Cabrera, Hector De Navarro; Luzio, Jos; Pahl, FLix H; Hellutini, Eduardo A. S; Teixeira, Manoel Jacobsen; Silva, Clemar C. Da; Almeida, Gilberto Machado De. Treatment of sphenoidal ridge meningiomas by means of fronto-temporoorbital craniotomy. Arq. bras. Neurocir. 1985; 4(4): 215-222.
12. Carroll R., Schrell U., Zhang J., Dashner K., Nomikos P., Fahlbusch R., Black P. Dopamine D1, Dopamine D2, and Prolactin Receptor Messenger Ribonucleic Acid Expression by the Polymerase Chain Reaction in Human Meningiomas. Neurosurgery. 1996; 38: 367-375.
13. Carrol Rs, Zhang J, Black Pm. expression of estrogen receptors alfa and beta in human Meningioma. J Neurooncol. 1999; 42: 109-116.
14. Chan Rc, Thompson Gb. Morbidity, Mortality, and cuality of life following surgery for intracranial meningiomas. J Neurosurg 1984; 60: 52-60.
15. Cheek,William.PediatricNeurosurgery.USAW.B.Sauders company 1998.
16. Coleman N. Early recurrence of benign meningioma correlates with expression of mini-chromosome maintenance-2 protein. British Journal of Neurosurgery. Feb 2002; Tomo 16, Nº 1:10.
17. Cushing, H., Eisenhardt, L.: Meningiomas. Their Classification, Regional Behavior, Life History, and Surgical End Results. Springfield, Ill., Charles C Thomas, 1938.
18. Dan X Cai, et al Chromosome 1p and 14q FISH Analysis in Clinicopathologic subsets of Meningioma: Diagnostic and Prognostic implications. Journal off Neuropathology and experimental Neurology. Lawrence: Junio 2001; Vol. 60: 628 629.
19. De La Monte Sm, Flickinger J, Linggood Rm. Histopathologic features predicting recurrence of meningiomas following subtotal resection. Am J Surg Pathol. 1986; 10: 836-843.
20. Ellinger K, Slowik F. Histological subtypes and prognostic problems in meningiomas. J Neurol. 1975; 208: 279-298.
21. Fukui M, Iwaki T, Sawa H, Inoue T, Takeshita I, Kitamura K: Proliferative activity of meningiomas as evaluated by Bromodeoxyuridine uptake examination.Acta Neurochir (Wien). 1986; 81: 135-141.
22. Grunberg Sm, Weiss Mh, Spitz Im, Ahmadi J, Sadur A, Russell Ca, Lucci L, Stevenson LL: Treatment of unresectable meningiomas with the antiprogestrone agent mifepristone. J Neurosurg 1991; 74: 861-866.
23. Hakin-Smith, V.; Battersby, R. D.; Maltby, E. L.; Timperley, W. R.; Royds, J. A. Elevated p53 expression in benign meningiomas protects against recurrence and may be indicative of senescence. Neuropathology and Applied Neurobiology. 2001; 27(1): 40-49.
23. Heinicke Yañez, Hugo Ricardo. Meningiomas: Aspectos Clínicos y terapéuticos. Tesis Doctoral UPG. UPCH 1997.
24. Hodgson T.J., Kingsley D.P.E., Moseley I.F. The Role of Imagining in the follow up of Meningioma. Journal of Neurology, Neurosurgery, Psichiatry. November 1995; Vol 59: 545-547.
25. Hoshino T, Nagashima T, Murovic Ia, Wilson Cb, Davis RL. Proliferative potential of human meningiomas of the brain: a cell kinetics study with bromodeoxyuridine. Cancer 1986; 58: 1466-1472.
26. Hsu Dw, Pardo Fs, Efird It, Linggood Rm, Hedley-Whyte Et. Prognostic significance of proliferative indices in meningiomas. I Neuropathol Exp Neurol. 1994; 53: 247-255.
27. Ide M, Limbo M, Yamamoto M, Umebara Y, Hagiwara S, Kubo O. MIB-1 staining index and peritumoral brain edema of meningiomas. Cancer. 1996; 78: 133-143.
28. Jaaskelainen J. Seemingly Complete removal of histologically benign intracraneal meningiomas: late recurrence rate and factors predicting recurrence in 657. Surg Neurol 1986; 25: 461-469.
29. Jensen R., Soo Lee Y., Guijrati M., Origitano T., Wurster R., Howard Reichmann O. Inhibition of in Vitro Meningioma Proliferation after Growth Factor Stimulation by Calcium Channel Antagonists: Part II Aditional Growth Factors, Growth Factors Receptor Inmunohistochemistry, and Intracellular Calcium Measurements. Neurosurgery 1995; 37: 937-947.
30. Kamei, Yusuke; Watanabe, Masatoshi; Nakayama, Tsuyoshi; Kanamaru, Kenji; Waga, Shirou; Shiraishi, Taizo. Prognostic significance of p53 and p21WAF1/CIP1 immunoreactivity and tumor micronecrosis for recurrence of meningiomas. Journal of Neuro-Oncology. 2000; 46(3): 205-213.
31. Karamitopoulou E, Perentes E, Diamantis I, Maraziotis T. Ki67 immunoreactivity in human central nervous system tumors: a study with MIB-1 monoclonal antibody on archival material. Acta Neuropathol. 1994; 87: 47-54.
32. KaramitopoulouE,PerentesE,TolnayM,ProbstA.Prognostic significance of MIB-1, p53, and bcl-2 immunoreactivity in meningiomas. Hum Pathol.1998; 29: 140-145.
34. Kempe Luwing. Técnicas Neuroquirúrgicas. España. 1972. Editorial Científico-Médica.
35. Kinjo, Toshihiko M.D.; Ossama Al-Mefty, M.D.; Imad Kanaan, M.D. Grade Zero Removal of Supratentorial Convexity Meningiomas neurosurgery. September 1993; 33(3): 394.
36. Klekner, Almos; Rohn, Gabriele; Schillinger, Gerhard; Schroder, Roland; Klug, Norfrid; Ernestus, Ralf-Ingo. El RNA m y ODC ODC mRNA as a prognostic factor for predicting recurrence in Journal of Neuro-Oncology. 2001; 53(1): 67-75.
37. Knosp E., Perneczky A., Koos W., Fries G., Matula C. Meningiomas of the Space of the Cavernous Sinus. Neurosurgery. 1996; Vol 38: 434-444.
38. Konstantinidou, Anastasia; Korkolopoulou, Penelope; Patsouris, Efstratios; Mahera, Helen; Hranioti, Stavroula; Kotsiakis, Xenophon et al Apoptosis detected with monoclonal antibody to single- stranded DNA is a predictor of recurrence in intracranial meningiomas. Journal of Neuro-Oncology. 2001; 55(1):1-9.
39. Lamszus K. Meningioma Pathology, Genetics, and Biology. Journal of Neuropathology and experimental Neurology; apr 2004; 63(4): 275-276.
40. Langford La, Cooksley Cs, Demonte F. Comparison of MIB-1 (Ki-67) antigen and bromodeoxyuridine proliferation indices in meningiomas. Hum Pathol. 1996; 27:3 50-354.
41. Lee Ks, Hoshino T, Rodriguez La, Bederson J, Davis Rl, Wilson Cb. Bromodeoxyuridine labeling study of intracranial meningiomas: proliferative potential and recurrence. Acta Neuropathol. 1990; 80: 311-317. 26.
42. Madsen C, Schroder Hd. Ki-67 immunoreactivity in meningiomas: determination of the proliferative potential of meningiomas using the monoclonal antibody Ki-67. Clin NeuropathoL 1997; 16(3): 137-142.
43. Mahmood A, Caccamo DV, Tomecek FJ, Malik GM. Atypical and malignant meningiomas: a clinicopathological review. Neurosurgery. 1993; Vol. 33: 955-963.
44. Maier H, Ofner D, Hittmair A, Kitz K, Budka H. Classic, atypical, and anaplastic meningioma: three histopathological subtypes of clinical relevance. J Neurosurg. 1992;77:616-623.
45. Marks Sm, Whitwell Hl, Lye RH: Recurrence of meningiomas after operation.Surg Neurol. 1986; 25: 436-440.
46. MarkwalderTm,GerberHa,WaeltiE,SchaffnerT,Markwalder RU: Hormonotherapy of meningiomas with medoxyprogestrone acetate: Immunohistochemical demonstration of the effect of medoxyprogestrone acetate on growth fractions of meningioma cells using the monoclonal antibody Ki67.Surg Neurol 1988; 30: 97-101.
47. Mastronardi L., Ferrante L., Qasho R., Ferrari V., Tatarelli R., Fortuna A. et al. Intracranial Meningiomas in the 9th Decade of life: A Retrospective Study of 17 Surgical Cases. Neurosurgery 1995; Vol 36 : 270-274.
48. Mathiesen, Tiit M.D., Ph.D.; Lindquist, Christer M.D., Ph.D.; Kihlstrom, Lars M.D.; Karlsson, Bengt M.D. Recurrence of Cranial Base Meningiomas. Neurosurgery. July 1996; 39(1): 2-9.
49. Matsuno A, Fujimaki T, Sasaki T, et al. Clinical and histopathological analysis of proliferative potentials of recurrent and non-recurrent meningiomas. Acta Neuropathol 1996; 91: 504-510.
50. Matsuno A, Nagashima T, Matsuura R, et al. Correlation between MIB-1.staining index and the immunoreactivity of p53 protein in recurrent and non recurrent meningiomas. Am I Clin Pathol. 1996; 106: 776-781.
51. May Paul et al The Prediction Of Recurrence In Meningiomas.A Flow Cytometric Study of Paraffin-embedded Archival Material. J. Neurosurg. 1989; 71: 347-351.
52. Mayberg. Marc R. Md And Lindsay Simon T.D. F.R.C.S. Meningiomas of the clivus and apical petrous bone j. Neurosurg. 1986; Vol 65: 160-167.
53. Mclean CA, Jolley D, Cukier E, Giles G, Gonzales MF. Atypical and malignant meningiomas: importance of micronecrosis as a prognostic indicator. Histopathology. 1993; 23: 349-353.
54. Miller DC. Predicting recurrence of intracranial meningiomas: a multivariate clinical pathologic model: interim report of the New York University Médical Center meningioma project. Neurosurg Clin North Am. 1994; 5: 193-200.
55. Mirimanoff RO. Dosoretz DE. Lingood RM. Meningioma: analysis of recurrence and progression following neurosurgical resection. J Neurosurg. 1985; 62; 18-24.
56. Moller M, Braendstrup O. No prediction of recurrence of meningiomas bv PCNA and Ki-67 immunohistochemistry. J Neurooncol. 1997; 34: 241-246.
57. Nagashima G, Aoyagi M, Wakimoto H, Tamaki M, Ohno K, Hirakawa K. Immunohistochemical detection of progesterone receptors and the correlation with Ki-67 labeling indices in paraffin-embedded sections of meningiomas. Neurosurgery. 1995; 37: 478-483.
58. Nakamura Makoto, MD et al The Natural History Of Incidental Meningiomas. Neurosurgery. 2003; 53: 62-71.
59. Nakasu S, Masayuki N, Matsumura K, Nakasu Y, Handa J. Meningioma: proliferating potential and clinic radiological features. Neurosurgery: 1995; 37: 1049-1054.
60. NiedermayerI,KollesH,ZangKd,FeidenW.Characterization of intermediate type (WHO atypical) meningiomas. Clin Neuropathol. 1996; 15: 330-336.
61. Ohta M, Iwaki T, Kitamotot, Takeshita I, Tateishi J, Fukui M MIB1 staining index and scoring of histologic features in meningiomas: indicators for the prediction of biologic potential and postoperative management. Cancer 1994; 74: 3176-3189.
62. Ojeda Di Ninno H., Castro De La Matta, O. Receptores de Progesterona en meningioma. Rev Med Hered 1995; 6: 121-130.
63. Ojemann Robert G. Convexity Meningiomas Clinical Neurosurgery. 1992; Vol 40 chapter 17: 321-383.
64. Ojemann Robert G. Parasagittal Meningiomas Clinical Neurosurgery. 1992; Vol 40 chapter 17: 384-390.
65. Okada M, miyake K, matsumoto Y, kawai N, et al. Matrix metalloproteinase-2 and matrix metalloproteinase-9 expressions correlate with the recurrence of intracranial meningiomas. Journal of Neuro-Oncology. Jan 2003; Tomo 66, Nº 1-2: 29.
66. Osborn Anne. Neurorradiología Diagnóstica. Madrid. Editorial Mosby. 1996.
67. Palma L, Celli P Franco C, Cervoni L, Cantore G. Long-term prognosis for atypical and malignant meningiomas: a study of 71 surgical cases. I Neurosurg. 1997; 86: 793-800.
68. Perry A, Stafford SL, Scheithauer BW, Suman VL, Lohse CM. The prognostic significance of MIB-1, p53, and DNA flow cytometry in completely resected primary meningiomas. Cancer 1998; 82: 2262-2269.
69. Perry, Arie M.D.; Stafford, Scott L. M.D.; Scheithauer, Bernd W. M.D.; Suman, Vera J. Ph.D.; Lohse, Christine M. B.S. Meningioma Grading: An Analysis of Histologic Parameters. American Journal of Surgical Pathology. December 1997; 21(12): 1455-1465.
70. Pete S. Batra, et al. Auditory and Facial Nerve Function Following Surgery for Cerebellopontine Angle Meningiomas. Archives of Otolaryngology- Head & Neck Surgery; Apr 2002; 128(4): 369- 374.
71. PeterMcl.Black,M.D.,Ph.D.Meningiomas.Neurosurgery. April 1993; 32(4): 643.
72. PraysonRA.Malignantmeningioma:aclinicopathologicstudy of 23 patients including MIB1 and p53 immunohistochemistry. Am I Clin Pathol. 1996; 105: 719-726.
73. Rivas H., Angelica; Sigler, Luis; Zenteno, Genaro; Peña, Carlos De La; Nochlin, David. Hepatectomy for recurrent metastatic hemangioma. Rev. gastroenterol. 1986; 51(1): 43-46.
74. Roggendorf W, Schuster T, Peiffer J. Proliferative potential of meningiomas determined with the monoclonal antibody Ki-67. Acta Neuropathol. 1987; 73: 361-364. 75. Roquette, Antonio Geraldo Diniz; Santos, Marcelo Batista Dos; Car¡Sio, Carlos Robson De AlarcO; Assis, Marcelo Cardoso De; Castro, Samuel Caputo De; Bertucci, Agnaldo; Silva, Zenon; PaixO, Greg¢Rio Marquez DA. Abordagem preauricular zigom tica subtemporal infratemporal para da base de cranio / Subtemporal pre-auricular zygomatic infratemporal approach to lesions at cranial base. Arq. bras. Neurocir.1992; 11(3): 147-151.
76. Sampaio, Pedro; Telles,Carlos Parise, Maud. Meningioma da goteira olfativa e cancer de mama: relato de 2 casos / Meningioma of olfactory groove and breast neoplasms: report of 2 cases Arq. Neuropsiquiatr. 1992; 50(2): 212-215.
77. Salmon I, Kiss R, Levivier M, et al. Characterization of nuclear DNA content, proliferation index, and nuclear size in a series of 181 meningiomas, including benign primary, recurrent, and malignant tumors. Am) Surg Pathol. 1993; 17: 239-247.
78. Sekar. Lalingam. Craneal Microsurgery Approaches and Techniques. New York. Editorial Thieme. 1999.
79. Shibuya M, Hoshino T, Ito S, et al. Meningiomas: clinical implications of a high proliferative potential determined by bromodeoxyuridine labeling. Neurosurgery. 1992; 30: 494-498.
80. Shibuya M, Satoyuki T, Miwa T, Davis Rl, Wilson Cb, Hoshino T. Proliferative potential of brain tumors: analyses with Ki-67 and anti-DNA polymerase alpha monoclonal antibodies, bromodeoxyuridine labeling, and nucleolar organizer region counts. Cancer 1993; 71: 199-206.
81. Sheehan Jason, M.D., Ph.D.; Douglas Kondziolka, M.D.; John Flickinger, M.D.; L. Dade Lunsford, M.D. Radiosurgery for Treatment of Recurrent Intracranial Hemangiopericytomas. Neurosurgery.October 2002; 51(4): 905.
82. Simpson, D. The recurrence of intracranial meningiomas after surgical treament. J.Neurol. Neurosurg. Psychiatr.1957; 20-22.
83. Snyder,WilliamE.Jr.M.D.;Shah,MiteshV.M.D.;Weisberger, Edward C. M.D.; Campbell, Robert L. M.D. Presentation and Patterns of Late Recurrence of Olfactory Groove Meningiomas. Skull Base Surgery. September 2000; 10(3): 131-139.
84. Stafford Scott L., M.D., Arie Perry, M.D., Vera J. Suman, Ph.D., Freddric B. Meyer, M.D., Bernd W. Sheithauer, M.D., Christine M. Lohse, B.S. et al. Primarily Resected Meningiomas: Outcome and Pronostic Factors in 581 Mayo Clinic Patients, 1978 Through 1988. Mayo Clinic Proceedings. Oct 1998; 73: 936-942
85. Striepecke E, Handt S, Weis J, et al. Correlation of histology, cytogenetics, and proliferation fraction *Ki-67 and PCNA) quantitated by image analysis in meningiomas. Pathol Res Pract. 1996; 192: 816-824.
86. Strojnik, Tadej M.D., Ph.D.; Idanik, Boris M.D.; Kos, Janko Ph.D.; Lah, Tamara T. Ph.D. Cathepsins B and L Are Markers for Clinically Invasive Types of Meningiomas. Neurosurgery. 2001; 48(3): 598-605.
87. Susan Preston-Martin, An International Case-control Study of Adult Glioma and Meningioma: The Rol of Head Trauma. International Journal of Epidemiology. Agosto 1998; 27(4): 579-586.
88. Tews, Dominique S. M.D.; Fleissner, Claudia; Tiziani, Barbara; Gaumann, Andreas K.A. M.D. Intrinsic Expression of Drug Resistance-Associated Factors in Meningiomas. Applied Immunohistochemistry. September 2001; 9(3): 242-249.
89. Tindall, George. The Practice Of Neurosurgery. 1980. Editorial William & Wilkins. Baltimore.
90. Tiit Mathiesen, M.D.,Ph.D.; Christer Lindquist, M.D.,Ph.D.; Lars Kihlström, M.D.; Bengt Karlsson, M.D. Recurrence of Cranial Base Meningiomas Neurorurgery July 1996; 39(1): 2.
91. Tiet Valtonen S. The growth rate of intracranial meningiomas and its relation to histology. Surg Neurol. 1985; 24: 165-172.
92. Turgut, M.; Ozcan, O. E.; Benli, K.; Ozgen, T.; Gurcay, O.; Bertan, V.; Erbengi, A.; Saglam, S. Factors affecting morbidity and mortality following surgical intervention in patients with intracranial meningioma. Australian & New Zealand Journal of Surgery. March 1996; 66(3): 144-150.
93. Vagner-Capodano A. M., Ph.D.; F. Grisoli, Ph.D; D. Gambarelli, M.D.; R. Sedan, Ph.D.; W. Pellet, Ph.D.; B. DeVictor, M.D. Correlation between Cytogenetic and Histopathological Findings in 75 Human Meningiomas Neurosurgery. June 1993; 32(6): 892.
94. Wabab M, Al-Azzawi. Meningioima and Hormonal Influences. Climateric 2003; 6: 285-292.
95. Whittle Ian, Smith Colin, Navoo Parthiban, Collie Donald. Meningiomas. The Lancet. 2004; Vol 363: 1535-1543.
96. Williamson Barry E, et al, Chest Wall Metastasis from recurrent Meningioma. The American Surgeon; Oct. 2001; 67(10): 966- 973.
97. Yamashita J, Handa H, Iwaki K, Abe M: Recurrence of intracranial meningiomas, with special reference to radiotherapy. Surg Neurol. 1980; 14: 33-40.
98. Yasargil MG. Microneurosurgery. 1995. Editorial Geor. Thiere Verlag Stuttgart. N.Y.
99. Yuomans, Julian. Neurolgical Surgery. 4° edicion. 1996. Editorial W.B. Sauders. Company.
100. Yusuke Kamei, Masatoshi Watanabe, Tsuyoshi Nakayama, Kenji Kanamani, Shirou Waga, Taizo Shiraishi. Pronostic significance of p53 and p21WAF1/CIP1 inmunoreactivity and tumor micronecrosis for recurrence of meningiomas. Journnal of Neuro-Oncology. 2000; 46: 205-213.
CORRESPONDENCIA
Edwin Suárez Alvarado
Recibido: 02/10/09
Arbitrado: Sistema por pares
Aprobado: 01/11/09