Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.27 n.1 Lima ene./mar. 2010
Artículo de opinión
Uso de recursos sanitarios para tratar la leucemia mieloide crónica en Perú
Use of healthcare resources for treating chronic myeloid leukemia in Peru
Juan Navarro Cabrera1, Carlos Carracedo Gonzáles2, César Samanez Figari3, Olga Vargas Castro4, Cecilia Arteta Altamirano5, Sebastián Garrido Lecca de la Piedra6, Laura Jotimliansky7
1. Jefe del Departamento de Hematología del Hospital Nacional Edgardo Rebagliati Martins; EsSalud, Lima, Perú.
2. Médico Oncólogo. Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú.
3. MédicoOncólogo.InstitutoNacionaldeEnfermedadesNeoplásicas,MINSA,Lima, Perú.
4. Médica Hematóloga. Hospital Nacional Guillermo Almenara Irigoyen, EsSalud, Lima, Perú.
5. Asistente Servicio de Hematología Hospital Nacional Alberto Sabogal Sologuren, EsSalud, Lima, Perú.
6. Departamento Médico, Bristol-Myers Squibb, Ciudad de Lima, Perú.
7. Director Médico, Bristol-Myers Squibb, Argentina – Chile – Perú.
Ninguno de los autores reportan conflictos de ínteres, dos de ellos son parte de Bristol-Myers.
RESUMEN
En el presente artículo original se describen y comentan los datos aportados por un grupo de oncohematólogos, acerca del uso actual de los recursos sanitarios para el tratamiento de la leucemia mieloide crónica y de los eventos adversos relacionados con ésta, en Perú. Mediante la técnica de consenso Mini Delphi, los panelistas lograron elevado grado de acuerdo sobre los temas de interés.Amodo de síntesis, se observó distribución de los recursos generales disponibles acorde con las necesidades de cada fase de la leucemia y en adhesión a las pautas terapéuticas internacionales, aunque se detectaron algunas instancias que podrían optimizarse. Resultó evidente la notable disminución de la realización de trasplantes de médula ósea, en Perú. Esta información puede constituir un punto de partida para futuros estudios adicionales en el contexto de la práctica clínica en Latinoamérica. Además, aplicada a modelos farmacoeconómicos apropiados, los datos podrían agilizar la toma de decisiones acorde a la realidad local, por parte de los distintos responsables de los sistemas de salud, para permitir a los enfermos con LMC acceder a las opciones terapéuticas más ventajosas y, aún más trascendente, mejorar su calidad de vida y supervivencia.
Palabras clave: Fase crónica, leucemia, mieloide, recursos de salud, técnica Delfos.
ABSTRACT
This original article details and discusses the information provided by a group of hematologists, about the current use of health resources in the management of chronic myeloid leukemia and its treatmentrelated adverse events in Peru. By applying the Mini Delphi consensus technique, a high degree of agreement about the issues of interest was reached among the faculty. To summarize, although it was noticed that the allocation of health resources matches the requirement for each phase in the management of leukemia and it adheres to international guidelines, some topics that could be optimized were identified. A remarkable reduction of bone marrow transplant procedures was evident. These data may represent a starting point for further studies in the clinical practice setting in Latin America. Moreover, using appropriate pharmacoeconomic models, the information obtained may speed up the decision making process according to the local circumstances by those responsible for sanitary assistance, allowing patients with CML to reach the most convenient therapeutic options and, more importantly, improving their quality of life and survival.
Key words: Chronic-Phase, myeloid, leukemia, health resources, Delphi technique.
INTRODUCCIÓN
La leucemia mieloide crónica (LMC) se debe a una disfunción de la mielopoyesis definida desde el punto de vista citogenético por la presencia del cromosoma Philadelphia (Ph), que se origina en una translocación entre los cromosomas 9 y 22 en la región de los genes BCR-ABL. La resultante oncoproteína Bcr-Abl, una tirosina cinasa constitutivamente activa, desencadena una serie de señales de transducción que inducen la proliferación celular no controlada e inhiben la apoptosis de las células madre de la línea mieloide1. La evolución natural de la enfermedad incluye tres fases (crónica, acelerada y blástica), durante la última de las cuales los enfermos suelen fallecer.
La trascendencia de las neoplasias hematológicas, incluidos los linfomas y las leucemias, es clara, ya que se ubican entre las 10 causas más frecuentes de mortalidad en el mundo2. La incidencia de LMC en EE.UU. es entre 1,5-1,8 casos/100 000 habitantes/año3 y, acorde con el Swedish Cancer Registry de Suecia, de 0,9 casos/100 000 habitantes/año. Los datos correspondientes a los países en desarrollo son más escasos y frecuentemente no disponibles. En Perú, país donde se llevó a cabo la reunión de consenso descrita en el presente trabajo, la información publicada por el Instituto Nacional de Enfermedades Neoplásicas (INEN), basada en el registro de cáncer de Lima Metropolitana, indica que la LMC se encuentra entre las cinco neoplasias malignas más frecuentes, especialmente en los varones.Además, en 2004, representó la sexta causa de muerte debido a cáncer, en ambos géneros (4,5% del total de defunciones), también más habitualmente entre los varones4. En Perú, la atención de los enfermos leucémicos está a cargo fundamentalmente por el Ministerio de Salud, la Seguridad Social y Hospitales de las Fuerzas Armadas y Policía Nacional del Perú.
Afortunadamente, el conocimiento cada vez más detallado de la biología molecular de las células neoplásicas5 permitió la creación de nuevos fármacos dirigidos a moléculas precisas, tales como los inhibidores de tirosina cinasas (ITC) específicos contra proteínas Bcr-Abl mutadas. Los ITC han cambiado radicalmente la historia natural de la LMC hasta tal punto, que algunos autores afirman que se ha convertido en una verdadera enfermedad crónica6. El primero de dichos agentes, el imatinib, modificó el paradigma de tratamiento de la neoplasia. Luego del trascendente ensayo clínico IRIS7, comparativo con el estándar de tratamiento previo (el interferón alfa), el imatinib se ha establecido actualmente como la alternativa de primera elección para la LMC en fase crónica8, 9, 10. No obstante, no todos los pacientes obtienen beneficios. La intolerancia o la toxicidad asociadas con imatinib puede presentarse y, sumadas a la prevalencia creciente de resistencia o fracaso del tratamiento (respuesta subóptima), han generado la clara necesidad de nuevos compuestos y enfoques terapéuticos11 que permitan el control de la enfermedad, sin descartar que el trasplante de médula ósea (TMO) es una alternativa viable para aquellos pacientes con donante histocompatible.
La identificación temprana de los pacientes con respuesta inadecuada o intolerancia al imatinib, es crucial para intervenir oportunamente y brindarles la posibilidad de obtener beneficios clínicos con otros tratamientos. En caso de resistencia al imatinib en dosis de 400 mg, las opciones farmacológicas actualmente disponibles son: aumentar la dosis de imatinib o sustituirlo por un ITC de segunda generación. Aunque el aumento de dosis de imatinib puede tener efecto beneficioso para algunos pacientes, la multiplicidad de mecanismos de resistencia al fármaco destaca la necesidad de emplear agentes alternativos.
Entre los ITC de segunda generación, el dasatinib es un potente inhibidor dual de cinasas Bcr-Abl/Src, con buena biodisponibilidad por vía oral, y el primero aprobado en EE.UU. y Europa para el tratamiento de los pacientes con resistencia o intolerancia a imatinib, en cualquiera de las fases de la LMC. Dasatinib ha resultado eficaz frente a todas las mutaciones de Bcr-Abl de resistencia al imatinib, excepto T315I. Además, muestra actividad sobre cinasas de la familia SFK, y los receptores c-Kit mutados, para el factor de crecimiento derivado de plaquetas (PDGFR) y para efrina A11. Un extenso programa de ensayos clínicos (START) demostró que dasatinib, en dosis de 70 mg dos veces por día, es efectivo para tratar los pacientes previamente expuestos a imatinib, y posee un perfil de seguridad controlable. En comparación con los participantes que recibieron dosis altas de imatinib (600-800 mg/día), aquellos que fueron tratados con dasatinib lograron tasas de respuesta citogenética mayor notablemente más altas (de hasta 52%) y supervivencia libre de progresión de la enfermedad significativamente más prolongada (p < 0,0001)12-15.
También el nilotinib ha proporcionado beneficios a los enfermos con resistencia o intolerancia previa a imatinib, y ha sido aprobado con esa indicación (LMC en fases crónica o acelerada)11. Sin embargo, muestra actividad notablemente menor frente a las mutaciones más frecuentes en la cinasa Abl11. Se ha propuesto también la combinación de ITC con distinto grado de actividad y modo de acción frente a las proteínas mutadas, para optimizar los resultados clínicos en presencia de alto grado de resistencia al imatinib, y se encuentran en curso estudios adicionales con nuevos ITC en desarrollo (por ejemplo, bosutinib).
Por otra parte, la dosis de imatinib no debe incrementarse en caso de intolerancia a la dosis estándar, pudiendo indicarse alternativamente interferón, con o sin hidroxiurea, araC, o bien, nuevos ITC como dasatinib o nilotinib10,11.
Aunque la adquisición y divulgación de información científica tienen lugar aceleradamente, a menudo los profesionales deben tomar decisiones en situaciones en las que se carece de fundamento suficiente. En relación con lo expuesto más arriba, es evidente la necesidad de resolver varios aspectos relacionados con el manejo de la LMC, aún no suficientemente aclarados. En primer lugar, debe definirse el momento más oportuno para indicar el cambio de tratamiento, así como la mejor opción para cada enfermo. En segundo término, los médicos deben disponer y poder aplicar pautas precisas y uniformes sobre el seguimiento y los controles que deben indicarse sistemáticamente a los enfermos, con el fin de detectar oportunamente los signos de resistencia a la farmacoterapia. Finalmente, resulta fundamental recabar datos comparativos acerca de las ventajas y desventajas de los diferentes fármacos, y de su efectividad en función de los costos. Esto último es sumamente necesario en los países con recursos económicos más limitados, en los cuales la posibilidad de acceder a determinados tratamientos determina las opciones reales para algunos pacientes. Desde la década de los 90existen iniciativas importantes16paradesarrollar modelos farmacoeconómicos que permitan sustentar políticas sanitarias acorde a las necesidades y a la realidad local. Para lograrlo, es fundamental la colaboración intensiva entre los profesionales y las distintas partes que intervienen en la atención de la salud. La valiosa información que puede aportar la comunidad médica sirve de fundamento a quienes deben elaborar lineamientos de tratamiento, planes sanitarios, etc.
A tales fines, los métodos de consenso son un recurso sumamente útil, válido y productivo17-19, particularmente cuando no se dispone de evidencia más sistemática sólida, o ésta es contradictoria o excesiva. La técnica Delphi de consenso es crecientemente empleada para identificar incertidumbres y necesidades habituales en la práctica clínica, priorizar aspectos que requieren investigación adicional y valorar la utilización de recursos sanitarios, entre otros fines. Una variante de esta modalidad, denominada Mini Delphi, fue la empleada precisamente para conocer el uso de recursos sanitarios destinados al tratamiento de la LMC en sus tres fases de evolución, y de los eventos adversos del mismo, en el ámbito de la práctica clínica, en Perú. La reunión de consenso se llevó a cabo en septiembre de 2007, con la participación de 3 médicos hematólogos y 2 oncohematólogos con experiencia en el manejo de la enfermedad. Las conclusiones de dicha reunión se detallan en esta publicación, destinada a comunicar datos sobre la realidad del tratamiento de la LMC en Perú. Un ejercicio de consenso con similares metodologías y objetivos, se llevó a cabo en Argentina en el mes de julio de 200720, y sus resultados se comentan en relación con los del presente trabajo, en la sección de Discusión. Las conclusiones y los hallazgos de ambas investigaciones podrían ser útiles en el futuro cercano para adecuar las pautas terapéuticas a las necesidades no resueltas comentadas, y según las particularidades de la atención de la salud a nivel local.
METODOLOGÍA
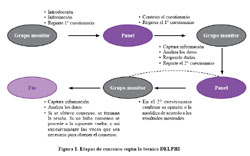
Básicamente, el método Delphi es uno de los más utilizados para obtener consenso entre un grupo de panelistas (especialistas en un área determinada), quienes en rondas sucesivas deben alcanzar un grado de acuerdo aceptable sobre las cuestiones planteadas. La técnica Delphi incluye un grupo monitor, generalmente integrado por un estadístico, un moderador y un asistente, y un grupo de panelistas invitados. Durante la primera ronda se invita a los expertos a expresar sus opiniones sobre un asunto particular o se realiza una búsqueda sistemática de información y, sobre la base de esos datos, el grupo monitor elabora cuestionarios o enunciados. En rondas sucesivas, los panelistas califican su grado de acuerdo con cada uno de los enunciados, generalmente mediante una escala numérica. El análisis de las respuestas (con medidas estadísticas de promedio y dispersión) permite examinar la concordancia entre los especialistas, y tales resultados son presentados nuevamente a ellos, para modificar o ratificar su opinión, libremente. Este proceso puede continuar hasta que se logra un grado suficiente de acuerdo que ofrezca claridad y síntesis sobre el tema tratado (Figura 1).
En el presente estudio se empleó la técnica denominada Mini Delphi, un método Delphi modificado que permite mayor flexibilidad y ahorro de tiempo21. El grupo monitor elabora con anticipación un cuestionario estructurado que es respondido por los panelistas durante la primera ronda. Posteriormente, analizan y promedian las respuestas y las presentan nuevamente a los invitados durante la segunda ronda para que los especialistas califiquen su grado de acuerdo o desacuerdo con tal visión grupal y, finalmente, extraen las conclusiones pertinentes sobre los temas de interés. Los cuestionarios y las respuestas se realizan por escrito.
Objetivo de la presente reunión de consenso
Conocer y consensuar la experiencia, las expectativas y las previsiones de un grupo seleccionado de hematólogos y oncohematólogos peruanos, acerca del uso de recursos sanitarios para el tratamiento de la LMC, así como en relación con 11 eventos adversos (EA) del mismo, seleccionados por su frecuente presentación.
Composición del panel de especialistas
El grupo de panelistas fue integrado por 3 hematólogos y 2 oncohematólogos con experiencia clínica y científica en el manejo de la enfermedad de interés. Se seleccionaron profesionales de ambos géneros, quienes se desempeñan en ámbitos de la atención sanitaria tanto pública como privada.
Proceso
La reunión de consenso tuvo lugar el 12 de septiembre de 2007, mediante la técnica Mini Delphi, con dos rondas de consulta.
Sobre la base de una revisión bibliográfica previa acerca de la LMC y su tratamiento, se elaboró un cuestionario inicial de 275 elementos, ordenados en tablas, referentes a las diferentes fases de la LMC: crónica (FC), acelerada (FA) y blástica (FB), subdivididas a su vez según la presencia o ausencia de respuesta al tratamiento. Durante la primera ronda del ejercicio, se solicitó a los participantes que vertieran su parecer respecto del uso de una lista de recursos presentados.
Una vez analizadas las respuestas, se elaboró un segundo cuestionario, formulado como afirmaciones basadas en las opiniones de los profesionales. Durante la segunda ronda de consulta, cada especialista calificó su grado de acuerdo con dichos enunciados, según una escala ordinal de 9 puntos, en la cual los valores de 1 a 3 indicaron desacuerdo o desconfianza respecto de la probabilidad de una aseveración, la puntuación entre 4 y 6 correspondió a indiferencia o inseguridad sobre lo afirmado, y aquellas entre 7 y 9 indicaron acuerdo o adhesión con el enunciado. Cada cuestionario incluyó, además, algunas preguntas para ratificar si los enunciados presentados correspondían a la práctica clínica en Perú, o debían incluirse otros parámetros.
Las respuestas se agruparon y analizaron de manera descriptiva con una medida de promedio, la mediana, considerada como el mejor indicador para definir el consenso del grupo.
RESULTADOS
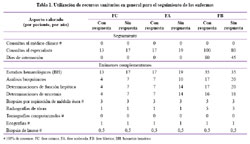
El método Mini Delphi fue bien comprendido por los participantes y la información recolectada resultó sólida. Los expertos mostraron elevado nivel de acuerdo respecto del tipo y la cantidad de los recursos sanitarios empleados habitualmente en Perú para tratar la LMC. En las Tablas 1, tabla 2 y tabla 3 se resumen los resultados analizados, destacándose en negrita los ítems para los cuales hubo nivel de consenso mayor de 8 puntos.
En relación con el empleo de los recursos sanitarios generales (Tabla 1), las respuestas indicaron que, en Perú, los médicos clínicos o de medicina familiar no realizan seguimiento a los pacientes con LMC, quienes están a cargo de especialistas. A diferencia de lo que ocurre durante las fases crónica o acelerada, en las que no es habitual la hospitalización, el uso de recursos (incluidos los análisis bioquímicos y hematológicos, la biopsia por aspiración de médula ósea, las consultas y los días de hospitalización) se incrementa durante la FB, etapa en la cual los enfermos suelen presentar característicamente anemia, trombocitopenia y leucocictosis, y tienen indicación de transfusiones con más frecuencia. En este sentido, sería interesante disponer de alternativas terapéuticas que permitieran optimizar la utilización de los recursos al disminuir la cantidad de consultas y de días de hospitalización y, al mismo tiempo, mejorar la calidad de vida de los enfermos.
El número de aspirados de MO en la FB es algo mayor de lo habitual, dado que probablemente 2 ó 3 serían suficientes para confirmar la progresión22. De manera esperada, muy excepcionalmente se requieren tomografías computarizadas para evaluar los pacientes con LMC. Por lo general, tampoco se utiliza la biopsia de hueso con fines de diagnóstico ni pronóstico, y una ecografía de abdomen en cada etapa de la LMC es suficiente para evaluar a los pacientes.
Al analizar la utilización de recursos más específicos (Tabla 2), la cantidad de pruebas citogenéticas corresponde al mínimo aceptable durante la FC con respuesta; en la FC sin respuesta y durante la FA y la crisis blástica no serían necesarios más estudios que los especificados. La cantidad de exámenes complementarios indicada es congruente con la realidad de la enfermedad ya que, como se mencionó previamente, la atención de los pacientes en FB involucra más recursos en general.
El uso de FEC-GM está limitado en Perú debido a su falta de disponibilidad. Por su parte, los pacientes en FA y FC, intensivamente tratados, pueden requerir con más frecuencia la indicación de FEC-G. Este dato tiene relevancia clínica y farmacoeconómica.
Se interpreta que la pregunta relacionada con los exámenes de compatibilidad HLA habría sido respondida en relación con los potenciales donantes para el TMO, lo cual resultaría razonable. A diferencia de lo que ocurre en otros países, la solicitud de tales pruebas sugiere que los médicos peruanos consideran la indicación del trasplante en todas las fases de la LMC, a pesar que se realiza en sólo una institución. Esta conclusión surge al observar el nivel de acuerdo entre los panelistas respecto de la cantidad de días de internación para TMO, que fue sumamente variable (entre 1 y 9 puntos de consenso). Probablemente, las dificultades y los gastos asociados con el trasplante inclinen a los especialistas a utilizar los ITC.
La aféresis de progenitores hematopoyéticos no fue señalada por los especialistas como una práctica habitual, y tampoco habría actividad para criopreservar células madre, con fines de trasplante autólogo.
En general, los pacientes en FB presentan similares requerimientos que quienes sufren leucemia aguda, entre ellos, transfusiones de sangre. La indicación de cuidados paliativos concuerda con lo habitual durante cada fase de la leucemia.
En la Tabla 3 se presentan los recursos destinados al control de los 11 eventos adversos (EA) más frecuentes en los pacientes con LMC. Hubo consenso superior a 8 puntos para todas las respuestas.
El uso de recursos en relación con los EA es muy bajo. En contraste con lo habitual, en ningún caso el paciente es atendido por el médico clínico, ni es motivo de internación. Tampoco se solicitan placas radiográficas de tórax para detectar la presencia de derrame pleural, por ejemplo, ni se indican transfusiones de sangre debido a anemia, si bien esto último puede deberse a la prescripción de eritropoyetina.
No se realiza TMO en ninguna circunstancia relacionada con los EA, y los cuidados paliativos suelen realizarse de manera ambulatoria.
DISCUSIÓN
En primer lugar, cabe realizar algunos comentarios sobre la metodología de consenso utilizada. Tanto la técnica Delphi original como la modificada17, seleccionada para este estudio, constituyen instrumentos útiles y válidos para identificar y caracterizar aspectos sobre los cuales existe incertidumbre, tal como ocurre frecuentemente en la práctica clínica.
Una de sus ventajas es que su principal objetivo es determinar el grado de acuerdo entre los especialistas o las personas pertinentes, acerca de temas de complejidad variable, evitando la sobrevaloración o preponderancia de la opinión de cualquier individuo, un sesgo habitual de la toma de decisiones en comités.
Las principales críticas que se han formulado a las técnicas de consenso se relacionan con su aplicación inadecuada, ya sea por falta de justificación de su realización, de los criterios de selección de los participantes o de definición clara del nivel de acuerdo aceptable; otro error habitual es el modo de presentación de los resultados, que no constituyen en sí mismos ninguna respuesta correcta a un problema sino que deben interpretarse como punto de partida para elaborar políticas sanitarias, pautas de práctica clínica, de investigación, etc.17-19. Estas cuestiones fueron tomadas en consideración durante la planificación del presente ejercicio.
En relación con la LMC, las técnicas de consenso, incluida la Mini Delphi, se han utilizado previamente con éxito para validar la utilidad de clasificaciones de pronóstico de los pacientes, así como de criterios de respuesta a la terapia; para elaborar recomendaciones y algoritmos de tratamiento (por ejemplo, las indicaciones del TMO y de ITC); para estandarizar la metodología de detección de alteraciones genéticas y moleculares en las células neoplásicas; para debatir el papel de los fármacos más novedosos, cuya eficacia y seguridad a largo plazo no se conocen suficientemente, o investigar la repercusión de la enfermedad sobre el gasto en atención de la salud8,23-36.
Al analizar los datos aportados por los especialistas peruanos durante el ejercicio de consenso, surgen algunas consideraciones interesantes. En primer término, el empleo de los recursos sanitarios en general mostró concordancia con las necesidades que plantea cada fase de la LMC. No obstante, el incremento de las consultas con el especialista y las internaciones durante la FB resultó muy llamativo, ya que superó en más del doble las cifras informadas por los hematólogos argentinos (24 y 30 consultas/año/ paciente, y 20 y 30 días de internación/año/paciente, para los pacientes con o sin respuesta, respectivamente)20. Por lo tanto, resultaría pertinente disponer de alternativas farmacológicas que, indicadas en etapas más tempranas de la enfermedad, retrasaran o evitaran su progresión y, de ese modo, disminuyeran la necesidad de tratamientos más intensivos, complicaciones y demanda de atención sanitaria.
Respecto de los exámenes y recursos más específicos para tratar la leucemia, de manera similar a lo observado en Argentina, las pruebas citogenéticas se realizarían en Perú con frecuencia algo menor que la sugerida por las guías internacionales de tratamiento10, según las cuales es aconsejable efectuar 3 exámenes a los pacientes en FC, durante el primer año de terapia. Una explicación posible se relaciona con la disponibilidad y los costos de tales exámenes, que pueden limitar su indicación. Por otra parte, los especialistas peruanos indicarían frecuentemente FEC-G, no sólo a los pacientes con crisis blástica, sino también a aquellos en FC y FAcon respuesta al tratamiento. Este hecho es importante desde el punto de vista clínico pero, además, cuando se valora la relación costo - beneficio de la terapia y del seguimiento, en relación con las nuevas alternativas farmacológicas asociadas con menor mielodepresión.
Un hallazgo inesperado fue la aparente contradicción entre la frecuente solicitud de pruebas de compatibilidad HLA y la ausencia de realización del trasplante de médula ósea. El grado de consenso entre los especialistas peruanos en ambos aspectos indicó que evalúan la posibilidad del TMO para los enfermos en cualquiera de las fases de la LMC, aunque posteriormente no se lleve a cabo. Los panelistas informaron que tampoco se realizaría aféresis de células madre procedentes de sangre periférica ni criopreservación celular. Se ha comunicado una tendencia a nivel mundial a realizar cada vez menos el trasplante de médula y, en su lugar, a prescribir ITC, un hecho probablemente relacionado con la dificultad para hallar donantes compatibles, la morbilidad y la mortalidad del TMO37,38. Este podría ser también el caso en Perú. De hecho, los lineamientos terapéuticos del NCCN9 consideran al trasplante de células madre hematopoyéticas como una opción para los pacientes que no obtienen respuesta hematológica completa a los 3 meses o citogenética completa a los 12 meses de iniciado el empleo de imatinib, o para quienes presentan crisis blástica. Otra posible explicación es que debido a los costos asociados con el trasplante, los especialistas peruanos opten por indicar imatinib como tratamiento de primera elección. Teniendo en cuenta, por una parte, la baja frecuencia de realización del trasplante de células madre en Perú y, por otro lado, las recomendaciones terapéuticas internacionales más recientes, resulta justificado el uso más temprano de los ITC como tratamiento de primera elección. Podría ser pertinente considerar el empleo de otros agentes con perfil de acción más amplio, desde el diagnóstico de la LMC o ante las primeras señales de respuesta inadecuada o intolerancia al imatinib.
Finalmente, a semejanza de lo informado por los hematólogos argentinos, se destinan escasos recursos a la detección y la resolución de los EA relacionados con el tratamiento de la LMC, en Perú. Cabe mencionar una diferencia entre los especialistas de ambos países latinoamericanos: la llamativa menor frecuencia de indicación de placas de tórax por parte de los hematólogos peruanos. Este hallazgo podría reflejar disparidades en la atención local, la ausencia de lineamientos estándar para el control de los EA o bien, el desconocimiento de ciertos eventos asociados con los nuevos fármacos, como el derrame pleural relacionado con dasatinib. Sin lugar a dudas, la menor incidencia de EA en la era del imatinib y los ITC de segunda línea ha representado un cambio dramático en el manejo de la enfermedad, ya que ha permitido mejorar la calidad de vida y la supervivencia de los enfermos notablemente y, por otra parte, ha reducido la demanda de recursos de atención sanitaria.
Si se considera que el reciente cambio paradigmático en el tratamiento de la LMC ha sido adoptado rápidamente y de modo creciente por la práctica clínica, se torna impostergable para los países con menos recursos socioeconómicos, disponer efectivamente de todas las alternativas terapéuticas más eficaces y ventajosas para los pacientes. Para ello, es indispensable que las autoridades sanitarias y los prestadores de atención sanitaria adecúen sus servicios a dicha necesidad16. La información basada en la realidad de la práctica clínica y la elaboración de modelos farmacoeconómicos son fundamentales para quienes están a cargo de la toma de decisiones al respecto16.
En relación con la LMC, si bien los ITC son costosos, los análisis de costo – eficacia en los que fueron comparados con otras opciones consideradas previamente de primera elección, han concluido que los beneficios obtenidos desde su incorporación a la farmacoterapia son evidentes. Un modelo farmacoeconómico publicado ya en 2005, basado en el caso de un paciente de 35 años con LMC en FC, comparó los costos de ciclos de tratamiento de tres meses con imatinib durante 2 años, con el TMO de donante no emparentado. La relación costo-eficacia favoreció al imatinib en 85% de los casos, de modo tal que el ITC resultó tanto menos costoso como más eficaz que el TMO, como tratamiento para la LMC durante 2 años39. Otros autores han examinado resultados a más largo plazo, incluidos los eventos adversos, y han concordado que el gasto de la terapia con imatinib o dasatinib en términos de costo por año de vida ajustado según la calidad de vida (QALY), es similar al de otros recursos aceptados, como la diálisis6,40.
Las investigaciones sobre la relación costo-efectividad de los nuevos ITC u otras alternativas terapéuticas deberían tomar también en consideración los gastos indirectos secundarios a la falta de respuesta de la leucemia. Como se mencionó en la introducción, la tasa de resistencia o de intolerancia al imatinib requiere la adecuación de los recursos disponibles, en vista que la indicación del TMO se restringe a determinadas circunstancias. La sólida evidencia acerca de la notable eficacia y el controlable perfil de tolerabilidad y seguridad del dasatinib, fundamentan la indicación de este agente en lugar del aumento de dosis del imatinib a 600 u 800 mg, para los pacientes con resistencia o intolerancia a este último11,41. Pero además, la introducción de potentes fármacos, como el dasatinib, en etapas más tempranas del tratamiento (por ejemplo, en respuesta subóptima), podría mejorar los resultados a largo plazo en una proporción mayor de pacientes42, con la consiguiente optimización del empleo y del presupuesto en recursos sanitarios y mejoría de la calidad de vida y la sobrevida de los pacientes.
Aunque en los últimos años han comenzado a realizarse mayor cantidad de estudios farmacoeconómicos referentes a la LMC, la cantidad de publicaciones continúa siendo sumamente escasa35,43 y, lamentablemente, la mayor parte proviene de países occidentales desarrollados. Son prácticamente inexistentes los estudios acerca de la infraestructura, el personal y la actividad de los servicios especializados en el manejo de la leucemia, en los países latinoamericanos. En consideración de estos aspectos, se espera que los datos aportados por la presente publicación sean útiles e impulsen investigaciones adicionales para conocer la realidad y las necesidades de los especialistas en las regiones donde los recursos socioeconómicos son más limitados, de modo que finalmente les resulte posible ofrecer a sus pacientes todas las intervenciones terapéuticas disponibles.
CONCLUSIÓN
La reunión de consenso descrita en esta publicación cumplió con el objetivo de proporcionar información sobre el uso de recursos sanitarios para el tratamiento de la LMC en Perú. Los hematólogos integrantes del panel de especialistas alcanzaron elevado grado de acuerdo.
En términos generales, la distribución de recursos en atención sanitaria se adecúa en Perú a las pautas terapéuticas internacionales y a las demandas específicas de cada fase de la LMC. No obstante, se detectaron algunos aspectos que podrían optimizarse, particularmente en relación con los pacientes que progresan a crisis blástica. Resultó evidente la disminución de la realización del TMO, posiblemente relacionada con la disponibilidad de nuevas alternativas farmacológicas, como opción más conveniente de tratamiento.
Este ejercicio de consenso, así como el realizado recientemente en Argentina, pueden constituir un punto de partida para futuros estudios que permitan conocer más detalladamente la práctica clínica de los hematólogos que se desempeñan en las diferentes regiones de Latinoamérica, sus prioridades y necesidades insatisfechas, y los aspectos del tratamiento de los trastornos hematológicos que pueden optimizarse, para que resulte posible brindar a todos los enfermos los máximos beneficios en calidad de vida y supervivencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Faderl S, Talpaz M, Estrov Z et al. The biology of chronic myeloid leukemia. N Engl J Med 1999;341:164-172.
2. OPS. Boletín Epidemiológico Set 1999; 20(3).
3. Ries LAG, Melbert D, Krapcho M et al. SEER cancer statistics review, 1975-2004, National Cancer Institute. Bethesda, MD.
4. Instituto Nacional de Enfermedades Neoplásicas, Perú. http://www.inen.sld.pe/
5. Hunter T. Treatment for chronic myelogenous leukemia: the long road to imatinib. J Clin Invest 2007; 117(8): 2036-2043.
6. Frame D. New strategies in controlling drug resistance. J Manag Care Pharm 2007; 13(8 suppl S-a): S13-S17.
7. OBrien SG, Guilhot F, Larson RA et al. Imatinib compared with interferon and low dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003; 348: 994-1004.
8. Baccarani M, Saglio G, Goldman T J, et al. Evolving concepts in the management of chronic myeloid leukemia: Recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2006; 108: 1809-1820.
9. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Chronic Myelogenous leucemia. V1.2008.Disponible en http://www.nccn.org/profesionals/physician_gls/PDF/cml.pdf.
10. Hochaus A, Dreyling M. On behalf of the ESMO Guidelines Working Group. Chronic myelogenous leukemia: ESMO Clinical Recommendations for the diagnosis, treatment and follow-up. Annals of Oncology 2008; 19 (suppl 2):ii63-ii64.
11. O Ramirez P, DiPersio JF. Therapy options in imatinib failures. The Oncologist 2008; 13: 424-434.
12. Guilhot F, Apperley J, Facot T et al. Dasatinib induces durable cytogenetic responses in patients with chronic-phase CML with resistance or intolerant to imatinib: Updated results of the CA180013 (START-C) trial. Haematologica 2007; 92 (suppl 1): 128.
13. Cortes J, Kim DW, Guilhot F et al. Dasatinib (SPRYCEL) in patients (pts) with chronic myelogenous leukemia in accelerated phase (AP-CML) that is imatinib-resistant (im-r) or intolerant (im-i): Updated results of the CA180-005 START-A phase II stydy. Blood 2006; 108: 2160.
14. Martinelli G, Hochhaus A, Coutre S et al. Dasatinib (SPRYCEL) efficacy and safety in patients (pts) with chronic myelogenous leucemia in lymphoid (CML-LB) or myeloid blast (CML-MB) phase who are imatinib-resistant (im-r) or intolerant (im-i): Updated results of the CA180-005 START-A phase II study. Blood 2006; 108: 745.
15. Martinelli G, Rousselot P, Robak T et al. Comparison of dasatinib to high-dose imatinib in patients who experience imatinib failure: Results from a randomized, phase-II trial (CA180017, START-R). Haematologica 2007; 92 (suppl 1): 319.
16. Cangialose CB, Blair AE, Borchardt JS et al. Purchasing oncology services. Summary recommendations. Cancer 2000; 88: 2876-2886.
17. Jones J, Hunter D. Education and debate – Qualitative research: consensus methods for Médical and health services research. BMJ 1995; 311: 376-380.
18. Evans C, Crawford B. Expert judgement in pharmacoeconomic studies. Guidance and future use. Pharmacoeconomics 2000; 17(6): 545-553.
19. Evans C. The use of consensus methods and expert panels in pharmacoeconomic studies. Practical applications and methodological shortcomings. Pharmacoeconomics 1997; Aug(2 Pt1): 121-129.
20. Alfonso G, Basso A, Bullorsky E y col. Utilización de recursos sanitarios para tratar la leucemia mieloide crónica en Argentina. Revista Argentina de Hematología 2008 (mayo – agosto); 12(2): 35-42.
21. Konow I, Pérez G. Métodos y Técnicas de Investigación Prospectiva para la toma de Decisiones: Ediciones Funturo, Chile, 1990.
22. Hughes T, Deininger M, Hochhaus A et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors:review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for espressing results. Blood 2006; 108(1): 28-37.
23. Moen MD, McKeage K, Plosker GL, Siddiqui MA. Imatinib: a review of its use in chronic myeloid leukemia. Drugs 2007; 67(2): 299-320.
24. Beran M, Wen S, Shen Y y col. Prognostic factors and risk assessment in chronic myelomonocytic leukemia: validation study of the M.D: Anderson Prognostic Scoring System. Leuk Lymphoma 2007; 48(6): 1150-1160.
25. Jabbour E, Cortes J, Giles F, Kantarjian H. Current perspectives on the treatment of patients with chronic myeloid leukemia: an individualized approach to treatment. Cancer J 2007; 13(6): 357-365.
26. Deininger MW, OBrien SG, Ford JM, Druker BJ. Practical management of patients with chronic myeloid leukemia receiving imatinib. J Clin Oncol 2003; 21(8): 1637-1647.
27. Brugiatelli M, Bandini G, Barosi G y col. Management of chronic lymphocytic leukemia: practice guidelines from the Italian Society of Hematology, the Italian Society of Experimental Hematology and the Italian Group for Bone Marrow Transplantation. Haematologica 2006; 91(12): 1662- 1673.
28. Simonsson B, Kloke O, Stahel RA; ESMO Guidelines Task Force. ESMO Minimum Clinical Recommendations for the diagnosis, treatment and follow-up of chronic myelogenous leukemia. Ann Oncol 2005;16 Suppl: i52-3.
29. Gale RP, Park RE, Dubois RW y col. Delphi-panel analysis of appropriateness of high-dose therapy and bone marrow transplants in chronic myelogenous leukemia in chronic phase. Leuk Res 1999; 23(9): 817-826.
30. Bacigalupo A. Third EBMT/AMGEN Workshop on reducedintensity conditioning allogeneic haemopoietic stem cell transplants (RIC-HSCT), and panel consensus. Bone Marrow Transplant 2004; 33(7): 691-696.
31. Van Bockstaele DR, Deneys V, Philippé J y col. Belgian consensus recommendations for flow cytometric immunophenotyping. The Belgian Association for Cytometry/ Belgische Vereniging voor Cytometrie/Association Belge de Cytométrie. Acta Clin Belg 1999; 54(2): 88-98.
32. Staal FJ, Cario G, Cazzaniga G y col. Consensus guidelines for microarray gene expression analysis in leukemia from three European leukemia networks. Leukemia 2006; 20(8): 1385- 1392.
33. Letestu R, Rawstron A, Ghia P y col. Evaluation of ZAP-70 expression by flow citometry in chronic lymphocytic leukemia: A multicentric international harmonization process. Cytometry B Clin Cytom 2006; 70(4): 309-314.
34. Faderl S, Coutré S, Byrd JC y col. The evolving role of alemtuzumab in management of patients with CLL. Leukemia 2005; 19(12): 2147-2152.
35. Kasteng F, Sobocki P, Svedman C, Lundkvist J. Economic evaluations of leukemia: a review of the literature. Int J Technol Assess Health Care 2007; 23(1): 43-53.
36. Goldman J. Is imatinib a cost-effective treatment for newly diagnosed chronic myeloid leukemia patients? Nat Clin Pract Oncol 2005; 2(3): 126-127.
37. Redaelli A, Bell CM, Casagrande J, Stephens JM, Botteman M, Laskin B et al. Clinical and epidemiologic burden of chronic myelogenous leukemia. Expert Review Anticancer Therapy 2004; 4: 85-96.
38. Helhman R, Berger U, Pfirmann M et al. Drug treatment is superior to allografting as first line therapy in chronic myeloid leukemia. Blood 2007; 109: 4686-4692.
39. Skepnek GH, Ballard EE. Cost-efficacy of imatinib versus allogeneic bone marrow transplantation with a matched unrelated donor in the treatment of chronic myelogenous leukemia: a decision –analytic approach. Pharmacotherapy 2005; 25(3): 325-334.
40. Frame D. New strategies in controlling drug resistance in chronic myeloid leukemia. Am J Health Syst Pharm 2007; 64(24 Suppl 15): S16-S21.
41. Kantarjian H, Pasquini R, Hamerschlak N y col. Dasatinib or high-dose imatinib for chronic-phase myeloid leukemia alter failure of first-line imatinib: a randomized phase 2 trial. Blood 2007; 109(12): 5143-5150.
42. Jabbour E, Cortes JE, Kantarjian HM. Suboptimal response to or failure of imatinib treatment for chronic myeloid leukemia: what is the optimal strategy? Mayo Clin Proc 2009; 84(2): 161-169.
43. Zhao Y, Liu L, Wang G et al. Efficacy and prognosis of chronic myeloid leukemia treated with imatinib mesylate in a Chinese population. Int J Hematol 2009; 89: 445-451.
CORRESPONDENCIA
Sebastián Garrido Lecca de la Piedra
Recibido: 01/10/09
Arbitrado: Sistema por pares
Aprobado: 02/11/09