Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.28 n.1 Lima ene./mar. 2011
Artículo original
Patrones de coloración en la inmunofluorescencia indirecta y su utilidad en el diagnóstico de leishmaniasis tegumentaria y enfermedad de Chagas
Indirect immunofluorescence staining patterns and their use for diagnosing cutaneous leishmaniasis and Chagas disease
Luis Vásquez Huerta1, Nancy Ruelas Llerena2, Eleazar Córdova Benzaquen3
1 Médico parasitólogo. Docente de la Facultad de Medicina UNSA y UCSM.
2 Biólogo. Docente de la Facultad de Medicina UNSA y UCSM
3 Biólogo. Docente de la Facultad de Medicina UNSA
RESUMEN
Objetivo: Determinar el valor diagnóstico de la Inmunofluorescencia indirecta (IFI) en el diagnóstico de leishmaniasis y enfermedad de Chagas.
Material y método: La inmunofluorescencia indirecta (IFI) fue aplicada para el diagnóstico de leishmaniasis y la enfermedad de Chagas utilizando como sustrato antigénico epimastigotos de Trypanosoma cruzi. Se descubrió un patrón de fluorescencia nuclear con los sueros de pacientes con leishmaniasis y un patrón periférico para con los de la enfermedad de Chagas. Luego, en un estudio ciego, se estimó el valor diagnóstico de la IFI en ambas enfermedades.
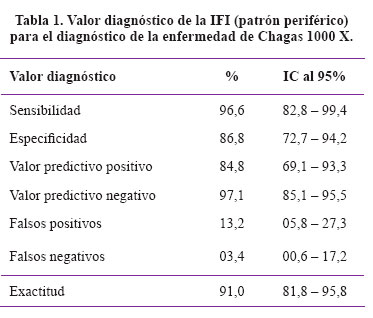
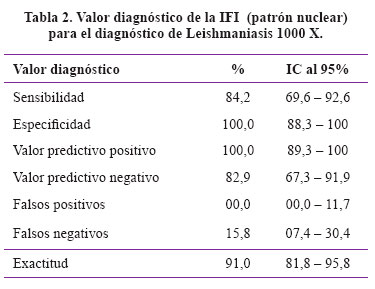
Resultados: En el diagnóstico de Leishmaniasis se encontró: Sensibilidad: 84,2%, especificidad: 100%, valor predictivo positivo: 100%, valor predictivo negativo: 82,9% y exactitud: 91,0%.
Conclusiones: La técnica de Inmunofluorescencia utilizando epimastigotos de Trypanosoma cruzi y considerando los patrones de coloración propuestos, tiene utilidad en el diagnóstico de leishmaniasis tegumentaria y también en el diagnóstico de la infección chagásica evitando la confusión dada por la reacción inmune cruzada de estas enfermedades.
Palabras clave: Leishmaniasis, enfermedad de Chagas, inmunodiagnóstico. Leishmania braziliensis. Trypanosoma cruzi.
ABSTRACT
Objective: To determine the value of indirect immunofluorescence (IFI) in the diagnosis of leishmaniasis and Chagas disease.
Material and method: Indirect immunofluorescence (IFI) was employed for diagnosing leishmaniasis and Chagas disease using Trypanosoma cruzi epimastigota as substrate antigens. A nuclear fluorescence pattern was found in sera from patients with leishmaniasis, and a peripheral pattern was found in those with Chagas disease. Afterwards, we estimated the diagnostic value of IFI for both diseases in a blinded fashion.
Results: For diagnosing leishmaniasis, IFI sensitivity was 84.2%, specificity, 100%, positive predictive value, 100%, negative predictive value 82.9%, and accuracy was 91.0%.
Conclusions: The immunofluorescence technique using Trypanosoma cruzi epimastigota, considering the proposed color patterns, is useful for diagnosing cutaneous leishmaniasis and T. cruzi infection by avoiding confusion because of immune cross-reactivity between these conditions.
Key words: Leishmaniasis, Chagas disease, immunologic tests, Leishmania braziliensis. Trypanosoma cruzi.
INTRODUCCIÓN
La inmunofluorescencia indirecta (IFI) es una técnica de muy buena sensibilidad y especificidad diagnóstica5,6 y relativamente de bajo costo debido principalmente a que el sustrato antigénico puede ser preparado en cualquier laboratorio de mediana complejidad. Esta técnica es utilizada para el diagnóstico de varias enfermedades; nosotros empleamos esta técnica para el diagnóstico de la enfermedad de Chagas y Leishmaniasis, enfermedades frecuentes en la consulta, la primera propia de la zona y la segunda propia de zonas tropicales pero que los afectados acuden a nuestra ciudad para diagnóstico y tratamiento.
En la literatura especializada se encontró que no se recomienda el uso de la IFI cuando coexisten la enfermedad de Chagas y la Leishmaniasis4,18, 22 en razón a que la IFI presenta reacción cruzada para estas dos enfermedades, condición que reduce notablemente su especificidad y por lo tanto su valor predictivo positivo. La lectura de IFI en sueros de pacientes chagásicos, hechas con frecuencia en el laboratorio de Parasitología, Universidad Nacional de San Agustín de Arequipa y la necesidad de hacer el diagnóstico de leishmaniasis usando como antígeno epimastigotes de Trypanosoma cruzi por no contar con cepas de Leishmania, nos ha permitido visualizar diferencias en cuanto a la localización de la fluorescencia en el parásito, según se trate de sueros de pacientes con infección chagásica o leishmaniásica utilizando como antígeno los epimastigotes de T. cruzi en ambos casos; por lo que fue necesario establecer patrones de coloración para cada enfermedad, ya que este conocimiento no está reportado en la bibliografía y puede ser de mucha ayuda en laboratorios que no cuentan con todos los recursos como el nuestro. Además, el cultivo de T. cruzi es relativamente fácil en comparación con el cultivo de Leishmania peruviana o L. braziliensis.
MATERIAL Y MÉTODOS
Se trabajó 29 sueros de infectados con T. cruzi diagnosticados mediante dos o más pruebas serológicas positivas (IFI, ELISA, HAI); algunos sueros de pacientes con xenodiagnóstico positivo. Así mismo, se utilizó 39 sueros de pacientes con Leihmaniasis tanto selvática como andina diagnosticados clínicamente y mediante biopsia de lesión cutánea y/o mucosa utilizando improntas de dicha biopsia y coloreándolas con Giemsa.
Como antígeno se utilizó epimastigotos de T. cruzi fijados en láminas portaobjetos21 (improntas), provenientes de medio de cultivo bifásico: el medio NNN (Nicolle, Novy, Mc Neal) como fase sólida y el medio MEM (Minimal Essential Medium), suplementado con suero de conejo inactivado a 56°C por 30 minutos, además antibióticos y antimicóticos. De un cultivo de 7 días de incubación se retiran los parásitos con solución salina formolada1. Se filtran, se centrifuga. Se decanta y el pellet se lava dos veces con solución salina estabilizadora (SSE). Se suspende en SSE colocándose de 10 a 15 parásitos (25 μl) por campo de 400X en cada pocillo de láminas portaobjetos. Se secan las improntas por medio de aire caliente y luego se fija flameándola. Se lavan los portaobjetos con agua destilada, se secan con aire frío y se fija nuevamente a la llama. Como conjugado se utilizó antigamaglobulina humana de conejo unida a tiocianato de fluoresceína (Sigma20) a una dilución de 1:20.
Se calculó la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y exactitud con sus respectivos intervalos de confianza(IC) al 95 %. El cálculo del IC se realiza mediante las siguientes fórmulas11,19, 13: IC 95% = (A – B) / C a (A + B) / C donde A = 2r + 1,962, B = 1.96 x √ (1.962 + 4rq) y C = 2 (n + 1,962)
RESULTADOS
La observación cuidadosa de las láminas preparadas con epimastigotes de T. cruzi y utilizando sueros de pacientes con infección chagásica mostró un patrón de coloración periférico, es decir, coloración fluorescente amarillo verdosa intensa en la membrana celular y en el flagelo y menos intensa en el citoplasma; el núcleo apenas coloreó su membrana (Fig. 1). Pero si observamos la misma preparación antigénica utilizando, esta vez, sueros de pacientes leishmaniásicos, la coloración fluorescente fue intensa sólo en el núcleo e inexistente en el resto del parásito. A este tipo de coloración la denominamos patrón de coloración nuclear (Fig. 2).
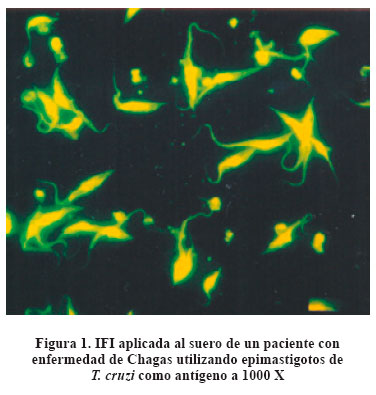
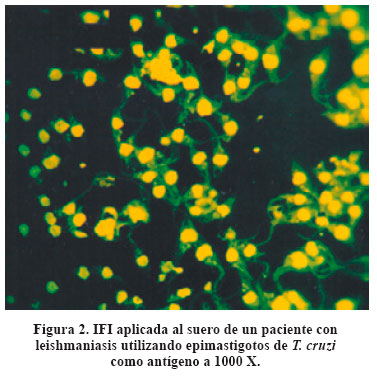
Si se considera prueba positiva a la coloración fluorescente de la membrana y flagelo principalmente y con menor intensidad el citoplasma de los parásitos (Patrón de coloración periférico) utilizando epimastigotes de T.cruzi como sustrato antigénico y los sueros de pacientes leishmaniásicos como controles negativos, la IFI con mil aumentos en el diagnóstico de infección por T. cruzi da una sensibilidad de 96,55% (28/29), una especificidad de 86,84% (33/38), un VVP de 84,85% (28/33) y una exactitud de 91%. (Tabla 1). Si se considera prueba positiva a la coloración fluorescente intensa del núcleo y con menor intensidad el resto de los parásitos (Patrón de coloración nuclear) utilizando epimastigotos de T. cruzi como sustrato antigénico y los sueros de pacientes chagásicos como controles negativos, la IFI a 1000 aumentos nos ofreció, para los sueros de pacientes leishmaniásicos, una sensibilidad de 84,21% (32/38), una especificidad de 100% (29/29) y un VPP de 100% (32/32) y exactitud de 91%.
DISCUSIÓN
En un escenario de oportunidades de trabajo23, como el cultivo de la coca, la tala de árboles, el recojo de castaña, la explotación del gas natural y en el futuro inmediato la construcción de la carretera transoceánica, surge la necesidad de hacer el diagnóstico de una enfermedad que es emergente en este contexto: Leishmaniasis tegumentaria.
Como otras veces, la falta de recursos y la experiencia ganada en el diagnóstico de otra enfermedad relacionada taxonómica e inmunológicamente, la enfermedad de Chagas, hizo que salgamos de los patrones ortodoxos o convencionales y se busque alternativas de diagnóstico viables desde el punto de vista técnico y económico. Así, basados en lo reportado en la bibliografía que afirman la reacción cruzada entre la enfermedad de Chagas y la Leishmaniasis; surgió la idea de utilizar epimastigotes de T. cruzi como sustrato antigénico en la IFI para el diagnóstico de leishmaniasis tegumentaria y no como es lo correcto, promastigotes de Leishmania. Durante las primeras lecturas de la IFI aplicada a sueros de pacientes con enfermedad de Chagas y de Leishmaniasis, corroboramos lo descrito en la bibliografía4,8,22 que señala la presencia de reacciones cruzadas para estas dos enfermedades. Sin embargo, la observación continua, persistente y detallada de la fluorescencia nos hizo ver que la coloración no era igual para los sueros de chagásicos y leishmaniásicos; sino que en algunos la fluorescencia se evidenciaba en casi todo el parásito mientras que en otros sólo comprometía el núcleo.
Para los cálculos, hemos considerado únicamente como sanos o controles a aquellos que tenían leishmaniasis cuando se probaba la infección a T. cruzi; y a los que tenían infección chagásica cuando se trataba de valorar la prueba para leishmaniasis.
Mediante este estudio se corrobora lo descrito en la bibliografía5 que señala a la IFI como una prueba de alto valor diagnóstico en la infección por T. cruzi. La imposibilidad de usar la técnica descrita anteriormente en el diagnóstico de leishmaniasis, por dar reacciones cruzadas según lo descrito en la bibliografía2, 4, 18, 22 queda superada por los resultados obtenidos ya que como hemos explicado tienen diferente patrón de coloración, pero además nos brinda la posibilidad práctica de poder usar esta técnica con epimastigotos de T. cruzi, en el diagnóstico de leishmaniasis tegumentaria, en razón a la mayor facilidad técnica de cultivo y manipulación del T. cruzi y por la buena sensibilidad (84,2%) y sobre todo por la alta especificidad (100%).
Los resultados obtenidos muestran que la respuesta inmune en los pacientes con leishmaniasis se caracteriza por la producción de anticuerpos homólogos contra determinantes antigénicos nucleares del T. cruzi, y no contra aquellos ubicados en la membrana citoplasmática, propia de los sueros de chagásicos. Los anticuerpos presentes en los sueros de pacientes con la enfermedad de Chagas reaccionan contra antígenos, del epimastigoto de T. cruzi, ubicados en la membrana citoplasmática, incluyendo el flagelo y también en el núcleo, aunque de acuerdo a la fluorescencia, con menos intensidad y en forma periférica en este último.
La membrana plasmática del trypanosoma, está altamente especializada con una gruesa cubierta de glicoconjugados y glicoproteínas que cumplen un papel principal en la virulencia. La mayoría de estas macromoléculas están adheridas a la membrana plasmática vía un ancla de glycosylphosphatidylinositol (GPI) constituyendo la estructura responsable del reconocimiento por el hospedador, según Ferguson10. Algunas de estas moléculas están expresadas como antígenos comunes en las diferentes formas del parásito15, 9.
Proteínas capaces de ligar ácidos grasos FABP (fatty acid binding proteins) son específicas de los diferentes tejidos y constituyen un conjunto familiar de catorce miembros, agrupados en cuatro grandes subfamilias FABP cardíaca, hepática, intestinal y de adipositos3, 17. Recientemente Córdova O.8 identifica FABP de T. cruzi distribuida a nivel mitocondrial, nuclear y flagelar. La interacción de las FABP con el ácido oleico, supone que el ácido oleico provoca un cambio en la FABP convirtiéndola en un ligando específico para la unión nuclear14, 16 facilitando de esta manera la interacción con el núcleo, y de ahí su presencia en dicho orgánulo8. Estas proteínas también se encuentran en Leishman8 lo que explicaría reacciones cruzadas entre las dos enfermedades.
Entre los antígenos de leishmania evolutivamente conservados, las proteínas ribosomales (LiP2a, LiP2b, LiP0/LcP0 y LeIF), se ha demostrado que son reconocidas por el sistema inmune de los hospederos con alta frecuencia7. Así también Carmelo4, demuestra que la Histona H1 recombinante de Leishmania braziliensis es reconocida por un significante porcentaje de muestras de sueros de pacientes con leishmaniasis cutánea, sin embargo señala el mismo autor que el uso de esta proteína como herramienta para el diagnóstico de leishmaniasis cutánea es impedido por la reacción cruzada con sueros de pacientes con enfermedad de Chagas4.
De otro lado, Argov2 prueba sueros de 14 pacientes con Leishmaniasis cutánea contra nueve antígenos nucleares mediante ELISA encontrando en porcentajes relativamente bajos anticuerpos anti Sm, RNP y SS-A, pero lo interesante es que estos antígenos también son reconocidos por los sueros de pacientes con lupus eritematoso sistémico, lo cual indica reacciones cruzadas en el diagnóstico de leishmaniasis y estas enfermedades autoinmunes; nos confirman también la presencia de anticuerpos contra estructuras nucleares presentes en los sueros de pacientes con leishmaniasis.
Nuestra observación permite suponer que la reacción cruzada y por lo tanto la presencia de antígenos homólogos de T. cruzi y Leishmania spp, se encuentran a nivel nuclear y no a nivel del citosol o de la membrana plasmática del epimastigoto de T. cruzi. Esta afirmación puede ser una orientación para futuras investigaciones sobre la respuesta inmune en la leishmaniasis y en la enfermedad de Chagas y también puede contribuir en la comprensión y posterior aplicación de los conocimientos para la producción de la vacuna para estas enfermedades que afectan la salud de personas que viven en áreas endémicas.
CONCLUSIONES
Se establece claramente el patrón de coloración periférico para el diagnóstico de infección Chagásica y el patrón de coloración nuclear para la leishmaniasis.
La técnica de Inmunofluorescencia Indirecta utilizando epimastigotos de Trypanosoma cruzi tiene muy buen desempeño en el diagnóstico de leishmaniasis tegumentaria causada por L. braziliensis o L. peruviana.
REFERENCIAS BIBLIOGRÁFICAS
1. Alvarez M, Cerisola J, Rohwedde R.. Test de inmunofluorescencia para el diagnóstico de la enfermedad de Chagas. Bol Chileno Parasit 1968;23:4-9.
2. Argov S, Jaffe C L, Krupp M, Slor H, Schoenfeld Y. Autoantibody production by patients infected with Leishmania. Clin Exp Immunol 1989;76:190-7.
3. Bass NM. Cellular binding proteins for fatty acids and retinoids: similar or specialized functions. Mol Cell Biochem1993;123:191-202.
4. Carmelo E, et al. Antigenicity of Leishmania braziliensis Histona H1 during Cutaneous Leishmanisis: Localization of antigenic Determinants. Clinical and Diagnostic Laboratory Immunology 2002;808-811.
5. Cerisola J, Alvarez M. Lugones H, Rebosolan J. Sensibilidad de las reacciones serológicas para el diagnóstico de la enfermedad de Chagas. Bol Chileno Parasit 1969;24(1-2):2-8.
6. Cerisola J, Rohwedder R, Di Corleto C. Estimación de la especificidad de reacciones serológicas para la enfermedad de Chagas. I Parte. Sueros de zona libre de trypanosomiasis. Bol Chileno Parasit 1968; 23 (1,2): 2-3.
7. Cordeiro-Da- Silva, A. Dual Role of Leishmania major Ribosomal Protein S3a Homologue in Regulation of T - and B- Cell Activation. Infección and immunity 2001;6588-6596.
8. Córdova Ofelia. Aislamiento, purificación y caracterización de proteínas capaces de ligar ácidos grasos en Trypanosoma cruzi. Tesis Doctoral. Universidad de Granada, España. 2004.
9. Di Noia JM, Buscaglia C, De Marchi C, Almeida I, Frasch A. A Trypanosoma cruzi small surface molecule provides the first inmunological evidence that Chagas disease is due to single parasite lineage. The Journal of Experimental medicine 2002;195(4):401-413.
10. Ferguson MA, Allen AK, Snary D. The detection of phospholipids in the protozoan Trypanosoma cruzi. Biochem J.1982;207(1):171-174.
11. Gonzales de Dios J, Mollar J, Rebagliato M. Evaluación de las pruebas y programas de detección precoz (cribado o screening) de enfermedades. Rev Pediatr Aten Primaria 2005;7:593-617.
12. Griemberg Gloria, Ferraroti Nidia et al. Inmunofluorescencia con Crithidia luciliae para la detección de anticuerpos anti-DNA. Imágenes atípicas y su relación con la enfermedad de Chagas y Leishmaniasis. Medicina (Buenos Aires) 2006;66:3-8.
13. Guerreo V, Gonzalez C, Medina E. Epidemiología. Addison - Wesley Iberoamericana, SA. Washinton. Delaware. USA. 1986;174-184.
14. Honma Y, Niimi M, Uchiumi T Takahashi Y Odani S. Evidence for conformational change of fatty acid-binding protein accompanying binding of hydrophobic ligands. Biochem Tokyo 1994; 116:1025-1029.
15. Krautz GM, Micheli GC et al. Antígenos solúveis liberados tripomastigotas de Trypanosoma cruzi utilizados no teste de ELISA para detectar cura em pacientes chagásicos após tratamento. Ver Soc Bras Med Trop 1994;27:199-207.
16. Li M, Ishibashi T. Reversible conformational changes of rat liver fatty acid binding protein following lipid binding: circular dichroic and nuclear magnetic resonance analysis. Biomed Res 1992;5:335-341.
17. Ockner R, Manning J, Poppenhausen R, Ho WK. A binding protein for fatty acids in citosol of intestinal mucosa, liver, myocardium and other tissues. Science 1972;177:56-58.
18. Requena JM, Soto A. Evolutionarily Conserved Proteins as Prominent Immunogens during Leishmania Infections. Parasitology Today 2000;16(6):246-250.
19. Ruiz A, Morillo L. Epidemiología clínica. Ed Med Internacional Bogotá. 2004;11-126
20. Sigma-Aldrich. Inmunoflourescencia Labeling of Cells. http://www.sigmaaldrich.Com/Area_of_Interest/Life_Science/Antibody_Explorer/Procedures/Immunofluorescence.
21. Stagno S, Knierim F, Saavedra P. El test de Inmunofluorescencia indirecta aplicado al diagnóstico serológico de la enfermedad de Chagas. Bol Chilen Parasit 1971;26(1-2):28-32.
22. Umezawa E, Da Silveira JF. Diagnosis serológica de la enfermedad de Chagas con los antígenos purificados y definidos de Trypanosoma cruzi. Mem Inst Oswaldo Cruz 1999;94(s1):285-288.
23. WHO. Leishmaniasis. Economic and social impact/Risk factors. http://www.who.int/leishmaniasis/burden/en/
CORRESPONDENCIA
Luis Vásquez Huerta
Recibido: 05/9/10
Arbitrado: Sistema por pares
Aprobado: 01/11/10













