Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.28 n.1 Lima ene./mar. 2011
Artículo de revisión
Antibioticoterapia en las infecciones graves
Antimicrobial therapy in severe infections
Aland Bisso Andrade1
1 Médico especialista en Medicina Interna. Magíster en Gerencia de Servicios de Salud. Médico Asistente de la Unidad de Cuidados Intensivos Generales del Hospital Nacional Luís N. Sáenz (HNLNS) de la Policía Nacional del Perú (PNP). Miembro del Comité de Enfermedades Infecciosas del Consejo Nacional de Salud del Ministerio de Salud (MINSA).
RESUMEN
La sepsis se considera un problema de salud pública debido a que las infecciones graves aún constituyen una causa importante de muerte en todo el mundo. Dentro del manejo integral del paciente en estado de sepsis grave o en shock séptico, la administración temprana de un régimen antibiótico adecuado, constituye una de las estrategias fundamentales para la supervivencia y disminución de la morbimortalidad. En esta revisión se presenta el manejo antibiótico de las siguientes entidades: neumonía grave, urosepsis, infecciones intra-abdominales, infecciones graves de la piel y partes blandas, meningitis bacteriana, sepsis fungal, infección relacionada al catéter venoso y sepsis de origen no determinado. Es necesario que los médicos que tratan infecciones graves, conozcan no solo las manifestaciones clínicas de cada proceso, sino también sus características epidemiológicas, prevalencia bacteriana local, patrones de resistencia y la farmacología de los antibióticos disponibles, a fin de tomar la mejor decisión. Las guías y las revisiones sistémicas son herramientas fundamentales para el manejo de las infecciones graves.
Palabras clave: Antibiótico, bacteriemia, agentes antifúngicos, candidemia, sepsis, shock séptico.
ABSTRACT
Sepsis is considered a public health problem because severe infections still are a major cause of death worldwide. Within the comprehensive management of the patient with severe sepsis or septic shock, the early administration of an appropriate antimicrobial regimen is one of the key strategies for survival and for reducing morbidity and mortality. In this review, we describe the antimicrobial therapy for the following conditions: severe pneumonia, urosepsis, intra-abdominal infections, serious skin and soft tissue infections, bacterial meningitis, fungal sepsis, venous catheter-related infections, and sepsis of undetermined origin. It is necessary for physicians who take care of patients with serious infections, that they must know not only the clinical manifestations of each process, but also their epidemiological characteristics, local bacterial prevalence, resistance patterns and pharmacology of available antimicrobial agents in order to make the best decisions. Both guidelines and systematic reviews are fundamental tools for the management of serious infections.
Key words: Anti-Bacterial Agents, bacteremia, Antifungal Agents, candidemia, sepsis, shock septic.
INTRODUCCIÓN
Las infecciones, en general, constituyen un tipo de patología de muy alta incidencia y prevalencia en la población general, pero cuando se trata de infecciones particularmente graves, se asocian a altos costos de hospitalización, pérdida de horas-hombre y a una significativa tasa de mortalidad. Hoy en día, se reconoce a la sepsis como un problema de salud pública. Datos epidemiológicos reportan unos 300 casos de sepsis por 100 000 habitantes (alrededor de 1,8 millones de casos al año), que generan el 2% de todas las hospitalizaciones y un promedio del 30% de las admisiones en UCI1,2.
Las hospitalizaciones por sepsis se han duplicado en la última década y, actualmente, pese a los esfuerzos desplegados, es la segunda causa de muerte en UCI. Uno de cada 4 pacientes internados en la UCI con infección o sepsis, evolucionan a sepsis grave o al shock séptico con tasas de mortalidad del 20% al 95%3. En el Perú, la sepsis tiene una tasa de 18 por 100 000, pero en la población mayor de 65 años la muerte por sepsis tiene una tasa de 141 por 100 000. Lo cual expresa la relación directa entre mayor edad y el mayor riesgo de muerte por infección aguda4. Se ha demostrado que la mortalidad es mayor en los pacientes con sepsis grave o en shock séptico que no reciben terapia antibiótica temprana, en comparación con aquellos que sí la reciben5. De ahí la alta recomendación que estos pacientes reciban un régimen antibiótico adecuado lo antes posible –incluso dentro de la primera hora de realizado el diagnóstico-, debido a que dicha estrategia se relaciona con la elevación significativa de la tasa de supervivencia en pacientes con infecciones graves6,7. El creciente fenómeno de la resistencia antibiótica demanda que la selección del tratamiento antibiótico se sustente en los factores clínicos de riesgo para patógenos específicos, el conocimiento de los patrones locales de resistencia a los antibióticos y la prevalencia del microorganismo7. Por tanto, el enfoque óptimo para el paciente con una infección grave, implica la iniciación de una terapia empírica agresiva y de amplio espectro, seguido de la oportuna evaluación de los parámetros clínicos y de los resultados microbiológicos disponibles, a fin de modificar el régimen antibiótico de la manera más conveniente8. Además, más allá del inicio temprano, se debe indicar en forma correcta: las dosis apropiadas, el intervalo entre dosis y la forma de administración, a fin de aprovechar los beneficios farmacológicos de los antibióticos escogidos y de sus efectos antibacterianos, minimizar la aparición de efectos adversos y disminuir la emergencia de bacterias resistentes8. Al respecto, se ha encontrado que cuando los médicos tienen buena adherencia a las guías del uso de antibióticos, llegan a dar coberturas antimicrobianas empíricas más adecuadas, las mismas que ulteriormente tienen concordancia con los resultados que obtienen en los cultivos solicitados9.
La antibioticoterapia es fundamental en el manejo de la sepsis; sin embargo, es solo parte de toda una estrategia global que debe ofrecerse. No debemos olvidar que el éxito terapéutico es el producto de un tratamiento integral, adecuado y oportuno, no solo por la administración de buenos antibióticos sino también por otras medidas vitales, como la fluidoterapia, el uso racional de vasopresores, el manejo hidroelectrolítico y ácido-base, la nutrición, el control de la glicemia, la adecuada oxigenoterapia y el manejo de las comorbilidades, entre otras medidas no menos importantes6.
Definición de términos
Los siguientes cuatro términos se definen según la última Conferencia Internacional de Definición de Sepsis10.
Infección. Todo proceso patológico causado por la invasión de microorganismos patógenos o potencialmente patógenos, a un tejido, fluido corporal o cavidad anatómica, que normalmente debe permanecer estéril.
Sepsis. Infección con manifestaciones de respuesta inflamatoria sistémica (SIRS), como: fiebre o hipotermia, taquicardia, taquipnea, leucocitosis o leucopenia, entre otras.
Sepsis grave. Presencia de sepsis en asociación a manifestaciones de disfunción orgánica o de hipoperfusión tisular, como hipoxemia, oliguria, acidosis láctica, elevación de enzimas hepáticas, alteración mental, trastorno de la coagulación, entre otras.
Shock séptico. Sepsis con falla circulatoria por hipotensión arterial persistente (PAM < 60 mmHg) pese a una adecuada fluidoterapia.
Para fines de la presente revisión, nos referimos como infección grave a toda infección que se presente como sepsis grave o con shock séptico, además de los criterios clínicos que la infección en particular tenga para definir su condición de gravedad. Cabe explicar que, en castellano, lo correcto es decir sepsis grave o infección grave, sin la calificación de severas. Severo es un anglicismo de uso frecuente en medicina, pero que en castellano significa serio, áspero, riguroso o rígido y que sirve para calificar el carácter de una persona; en tanto que la palabra en inglés: severe, en medicina sí significa fuerte, intenso o grave11.
NEUMONÍA ADQUIRIDA EN LA COMUNIDAD GRAVE (NAC GRAVE)
Debe considerarse con NAC grave al paciente que tenga uno de los siguientes dos criterios mayores: necesidad de ventilación mecánica o shock séptico con necesidad de vasopresores; o con tres de los siguientes criterios menores: PA < 90/60 mmHg, frecuencia respiratoria >30/min, PaO2/FiO2 <250, infiltración multilobar, confusión o desorientación, uremia >20 mg/dL, hipotermia <36º C, leucopenia <4000/mm3 o trombocitopenia <100 000 plaquetas/mm3. El puntaje CURB65, dado por las variables: confusión, uremia >20 mg/dL, frecuencia respiratoria >30/min, PA < 90/60 mmHg y edad >65 años, considera que un puntaje de 3 a 5, conlleva un alto riesgo de mortalidad y que el paciente debe ser manejado como NAC grave en una UCI12, 13.
Antes de administrar antibióticos, es necesario solicitar los siguientes exámenes diagnósticos: hemocultivo, cultivo y tinción Gram de aspirado bronquial, principalmente. Las pruebas de detección de antígenos urinarios de neumococo y legionella, pueden solicitarse si están disponibles, pero en caso de no contar con ellas no se debe retardar ni alterar la decisión terapéutica. Si hay derrame pleural, también debe solicitarse de inmediato tinción Gram, citoquímico y cultivo del líquido drenado12.
Regímenes recomendados12-14
1. Administrar la asociación de un antibiótico beta-lactámico (ceftriaxona 2 g, cada 24 horas o cefotaxima 2 g, cada 8 horas, o cefuroxima 1,5 g, cada 8 horas, o amoxicilina/ácido clavulánico 2g/0,2 g, cada 8 horas), más una fluoroquinolona antineumocócica (levofloxacina 750 mg, cada 24 horas o moxifloxacino 400 mg, cada 24 horas). Este régimen está destinado a ofrecer cobertura antibiótica intravenosa sobre la población de agentes patógenos que se aíslan con mayor frecuencia en pacientes con NAC grave. El antibiótico beta-lactámico está dirigido contra S. pneumoniae, S. aureus, H. influenzae y enterobacterias (E. coli, Klebsiella spp) y las fluroquinolonas están dirigidas principalmente contra la Legionella spp, además de algún otro agente atípico que pueda estar involucrado.
2. Si se sospecha de neumonía aspirativa (pacientes con alcoholismo o uso de psicofármacos, trastorno del sensorio, neoplasia o alteraciones anatómicas bucofaríngeas o esofágicas, déficit neurológico secuelar y ancianos debilitados), administrar un agente beta-lactámico de actividad antianaerobia y antineumocócica como la amoxicilina/ácido clavulánico 2 g/0,2 g, cada 8 horas, más levofloxacino 500 -750 mg, cada 24 horas.
3. Debe plantearse la posibilidad de NAC grave por P. aeruginosa en pacientes que vienen de la comunidad con uno o más de los siguientes factores: EPOC terminal, bronquiectasias, fibrosis quística, neutropenia, corticoterapia crónica y traqueostomía. El antecedente de hospitalización previa reciente y/o uso de antibióticos de amplio espectro por más de siete días en el mes anterior, también se consideran factores de riesgo. Administrar un agente beta-lactámico antipseudomona, pero con actividad antineumocócica (ceftazidima 2 g, cada 8 horas, o cefepime 2 g, cada 8 horas, o piperacilina/tazobactam 4g/0,5g EV, cada 6 a 8 horas) asociado a una fluoroquinolona antipseudomona (ciprofloxacino 400 mg, cada 8 a 12 horas, o levofloxacino 750 mg, cada 24 horas). En lugar de la fluroquinolona puede administrarse amikacina 1 g, cada 24 horas (máximo 5 a 7 días), como agente alternativo.
4. Si después de tres días de iniciado el tratamiento no hay respuesta efectiva, debe sospecharse de la presencia de enterobacteria beta-lactamasa de espectro extendido (BLEE) o de P. aeruginosa resistente. Debe tomarse nuevas muestras para cultivos y administrar un carbapenem antipseudomona (imipenem 1 g, cada 8 horas, o meropenem 1 g, cada 8 horas), asociado a una fluoroquinolona antipseudomona o con amikacina. Si se identifica una enterobacteria BLEE y no hay riesgo, ni aislamiento, de P. aeruginosa el régimen indicado debe incluir como agente beta-lactámico al ertapenem, en dosis de 1 g, cada 24 horas15.
5. En caso de pacientes alérgicos a la penicilina, puede administrarse levofloxacino más aztreonam 2 g, cada 8 horas, pero si hay sospecha de NAC por P. aeruginosa, administrar ciprofloxacino más amikacina12.
Duración de tratamiento
La NAC grave requiere por lo general de 7 a 10 días de terapia antibiótica, pero puede extenderse a 15 días o más, en casos con lesión cavitaria, absceso o empiema, o si aparece otra infección extrapulmonar como meningitis o endocarditis. El tratamiento de NAC por Legionella spp no debe durar menos de 14 días12-14. No hay estudios con suficiente nivel de evidencia que determinen el límite de tratamiento, de ahí que la duración variará acorde a los casos individuales, gravedad del proceso y rapidez de resolución14. Es necesario que antes de tomar la decisión de detener el tratamiento, el paciente se encuentre afebril 48 a 72 horas, no presente hipotensión, taquipnea (>24/min), taquicardia (>100/min) ni saturación de oxígeno menor de 90%. Si al quinto día de tratamiento el paciente persiste febril, hipoxémico y/o con franco deterioro hemodinámico o sensorial, la terapia antibiótica –y la estrategia de manejo, en general-, debe replantearse, tomar nuevos cultivos y ofrecer otra cobertura antibiótica acorde a cada caso en particular12-14.
NEUMONÍA INTRAHOSPITALARIA GRAVE
La neumonía intrahospitalaria (NIH) -la segunda infección nosocomial más frecuente, pero la primera en UCI-, tiene una tasa bruta de mortalidad del 30 al 70% (incluye Neumonía Asociada a Ventilador, NAV); de ahí que, a fin de iniciar en forma temprana la terapia antibiótica, debe considerarse como NIH grave al paciente con neumonía con estas características: hospitalización >5 días (o>4 días en UCI, con o sin ventilación mecánica), haber recibido antibióticos en los últimos 15 días y presentar factores de colonización orofaríngea por bacterias resistentes, como: EPOC, síndrome de distrés respiratorio agudo, neurocirugía, trauma craneoencefálico grave, corticoterapia prolongada, intubación endotraqueal, o ventilación mecánica16. En cualquier paciente con sospecha, o diagnóstico, de NIH, que presente disnea, taquipnea, saturación de oxígeno arterial (SO2) < 90%, infiltrado pulmonar de rápida progresión, tendencia a la hipotensión, o deterioro del sensorio, debe considerarse gravedad inminente y generar un plan de trabajo inmediato a fin de instalar el tratamiento más adecuado lo antes posible.
Antes de iniciar la terapia antibiótica, pero sin que ello signifique un retraso de su inicio, debe solicitarse: dos hemocultivos, así como Gram y cultivo de secreción bronquial. El aspirado traqueal cuantitativo es igualmente sensible, pero menos específico que los métodos broncoscópicos. Ambos contribuyen a diferenciar entre colonización e infección. Los cultivos también deben realizarse antes de algún cambio del esquema terapéutico16-18.
La terapia antibiótica de la NIH grave, además de cubrir al S. pneumoniae, H. influenzae, S. aureus y las enterobacterias gramnegativas (E. coli, K. pneumoniae, Serratia marcescens, Enterobacter spp y Proteus spp), también debe cubrir a Legionella spp, P. aeruginosa, Acinetobacter spp y S. maltophilia. En todos los casos se debe tener en cuenta los patrones de resistencia locales y los factores de riesgo específicos para uno u otro tipo de resistencia.
Regímenes recomendados16-18
1. Administrar un agente beta-lactámico antipseudomona (ceftazidima 2 g, cada 8 horas o cefepime 2 g, cada 8 horas o piperacilina/tazobactam 4g/0,5g cada 8 horas), asociado a una fluoroquinolona antipseudomona (ciprofloxacino 400 mg, cada 12 horas o levofloxacino 750 mg, cada 24 horas). Este régimen debe ofrecerse al paciente con NIH grave que no está hospitalizado en UCI y que no ha recibido antibióticos del tipo beta-lactámicos y/o fluoroquinolonas en los últimos 15 días.
2. En caso de alta sospecha, o aislamiento, de una enterobacteria gramnegativa resistente (BLEE), como agente beta-lactámico debe administrarse un carbapenem (imipenem 500 mg, cada 6 horas, o meropenem 1 g, cada 8 horas), asociado a ciprofloxacino o levofloxacino en las dosis ya mencionadas. Los pacientes que previamente han recibido cefalosporinas y/o fluoroquinolonas, tienen alto riesgo de tener enterobacterias BLEE. Si no hay riesgo de infección por P. aeruginosa, como carbapenem se ha sugerido la administración de ertapenem 1 g, cada 24 horas19. Sin embargo, no hay suficientes estudios con alto nivel de evidencia que sustenten el uso del ertapenem en la NIH grave.
3. En el paciente con alta sospecha, o aislamiento, de P. aeruginosa resistente -tal como el paciente de UCI con NIH grave con o sin ventilación mecánica-, debe administrarse un carbapenem antipseudomona en alta dosis (imipenem 1 g, cada 8 horas, o meropenem 1 a 2 g, cada 8 horas), asociado a una fluoroquinolona (ciprofloxacino o levofloxacina), o a un aminoglucósido (amikacina 15 a 20 mg/kg, cada 24 horas). Es obvio que este régimen también será eficaz en caso de coexistir enterobacterias BLEE. Se ha encontrado que en pacientes críticos, como aquellos con NIH grave, tendría más beneficio la administración de los carbapenems por infusión intravenosa de 4 a 6 horas por dosis20.
4. Si hay fuerte sospecha, o aislamiento, de S. aureus- Meticilino Resistente (SAMR), debe adicionarse vancomicina 1g, cada 12 horas, o linezolid 600 mg, cada 12 horas, a cualquiera de los regímenes antes mencionados21.
Duración del tratamiento
Aún son limitados los datos acerca de la óptima duración de la terapia para los pacientes con NIH. La mayoría de pacientes recibe antibióticos durante 10 a 14 días, mientras que los infectados por P. aeruginosa o Acinetobacter spp se tratan durante 14 a 21 días. La evidencia indica que cuando se trata de patógenos sensibles, la erradicación microbiológica y la defervescencia de los síntomas y signos, ocurre en los primeros 6 a 7 de de iniciado el tratamiento17. Si el paciente ha recibido un tratamiento antibiótico inicial adecuado, hay buena respuesta clínica y el agente patógeno ha sido identificado, debemos tratar de acortar el tiempo de tratamiento a sólo de 7 días, siempre y cuando el patógeno causal no sea P. aeruginosa16. Se ha propuesto la estrategia de desescalación antibiótica como una forma de acortar el tiempo de administración del régimen inicial de amplio espectro; sin embargo, aún no hay pruebas contundentes de su eficacia y seguridad en pacientes con sepsis grave o en shock séptico24.
Se considera falla terapéutica cuando después de tres días de tratamiento hay mayor deterioro clínico. Debe considerarse: resistencia bacteriana, infección por hongos, superinfección por P. aeruginosa o Acinetobacter spp en pacientes en ventilación mecánica, absceso o empiema pulmonar, infección por M. tuberculosis, Pneumocystis jiroveci, virus (citomegalovirus, influenza), entre otros agentes infrecuentes; además, de infecciones extrapulmonares, falla multiorgánica y trombosis pulmonar16-18.
NIH grave por bacterias multidrorresistentes (MDR)
Debido a la estrecha relación entre mortalidad por NIH y el aislamiento de bacterias MDR como: P. aeruginosa, Acinetobacter baumannii y Enterobacteriaceas productoras de carbapenemasas, (todos resistentes a los beta-lactámicos –incluidos los carbapenems-, fluoroquinolonas y aminoglucósidos), se ha considerado a los antibióticos del grupo polimixinas (colistina y polimixina B) como agentes terapéuticos en pacientes con NIH grave (principalmente con NAV) por bacterias MDR22. Los nuevos carbapenems, como doripenem y biapenem, son equipotentes al imipenem frente a la P. aeruginosa y las enterobacterias, pero no tienen actividad contra las bacterias MDR23.
INFECCIÓN GRAVE DE LA VÍA URINARIA
La infección de la vía urinaria (IVU) es la infección nosocomial más frecuente (40%) de las salas de hospitalización y causa del 5% al 7% de todas las sepsis graves que precisan de ingreso a la UCI. La IVU tiene una baja tasa de mortalidad, pero cuando el paciente presenta urosepsis grave (principalmente por pielonefritis obstructiva aguda), la mortalidad es del 20% al 40%25. En un estudio realizado en casi medio millón de pacientes procedentes de unidades de cuidados intensivos médicos y quirúrgicos, se encontró que el 97% de casos de IVU se produjo en pacientes con catéter urinario26.
Urosepsis
Se diagnostica urosepsis cuando el paciente con evidencia clínica de infección de la vía urinaria presenta, además, manifestaciones de inflamación sistémica, como fiebre o hipotermia, taquicardia, taquipnea, leucocitosis o leucopenia; en tanto que la urosepsis grave se define por la presencia de disfunción de órganos (oliguria, alteración sensorial, entre otros)27. La IVU complicada es el precursor más común y frecuente de la urosepsis, debido a que se presentan condiciones asociadas que incrementan el riesgo de infección o de la falla terapéutica: catéter urinario, uropatía obstructiva por cálculos, tumores o deformaciones anatómicas; reflujo vesicoureteral, vejiga neurogénica, diabetes mellitus, insuficiencia renal, postoperados, inmunodeprimidos (transplantados, quimioterapia, corticoterapia crónica, VIH/Sida), procedimientos urológicos invasivos (endoscopías, dilataciones, biopsias). Se considera que los pacientes en edad avanzada, diabéticos e inmunodeprimidos en general, tienen el mayor riesgo de desarrollar urosepsis grave. La litiasis urinaria es causa de pielonefritis obstructiva aguda en más del 90% de casos28-29.
Escherichia coli es la bacteria más aislada (>50%) en pacientes con urosepsis con o sin catéter urinario, seguido en un 30% por Proteus spp. Enterobacter y Klebsiella spp; 15% por estafilococo y enterococo, y 5% por P. aeruginosa. La Cándida spp. y P. aeruginosa se asocian con frecuencia al catéter urinario29.
Regímenes recomendados
1. En los pacientes con pielonefritis aguda complicada y en estado de urosepsis, se debe considerar la presencia de P. aeruginosa, además de las enterobacterias gramnegativas comunes (E. coli, Proteus spp, Enterobacter spp y Klebsiella spp). Es necesario recordar que en los pacientes con urosepsis asociada a la litiasis o al catéter urinario, siempre se debe considerar la presencia de P. aeruginosa. Administrar por vía intravenosa un agente beta-lactámico antipseudoma: ceftazidima 2 g, cada 8 horas, o cefotaxima 1 a 2 g, cada 8 horas, o piperacilina/tazobactam 4g/0,5g, cada 8 horas. Alternativa: ciprofloxacino 400 mg, cada 12 horas (excepto en gestantes)28.
2. En pacientes con urosepsis intrahospitalaria, con el antecedente de haber recibido antibióticos recientemente y que, por lo general, llevan catéter urinario y/o presentan uropatía obstructiva (vg. litiasis, prostatismo), debe sospecharse de la presencia de enterobacterias BLEE y de P. aeruginosa. Administrar un carbapenem antipseudomona como imipenem 0,5 g, cada 6 horas. En alérgicos a los beta-lactámicos se puede administrar una asociación de ciprofloxacino 400 mg, cada 12 horas más amikacina 15 a 20 mg/kg, cada 24 horas30. En los pacientes con aislamiento de enterobacterias BLEE, pero sin riesgo de infección por P. aeruginosa, puede indicarse ertapenem 1 g, cada 24 horas31. En los pacientes con urosepsis grave por P. aeruginosa resistente, debe administrarse la asociación de un carbapenem antipseudomona (imipenem 1 g, cada 8 horas o meropenem 1 a 2 g, cada 8 horas) más ciprofloxacino 400 mg, cada 8 horas o amikacina. Utilizar las dosis más altas, pero reguladas acorde a la función renal del paciente. La mayoría de estos pacientes se tratan, o requieren internamiento, en UCI31.
Duración del tratamiento
La pielonefritis aguda complicada y la urosepsis grave, en general, se tratan durante 7 a 14 días, pero en algunos casos puede ser hasta de 21 días. Debido a que los pacientes con IVU complicada tienden a sufrir de recurrencias, los urocultivos deben repetirse 5 y 9 días después de terminada la terapia, y luego 4 y 6 semanas después28-31. Si después de tres días de tratamiento de amplio espectro el paciente muestra mejoría clínica significativa, y el agente patógeno, así como la sensibilidad antibiótica, son identificados, puede intentarse una estrategia de desescalamiento antibiótico a un agente de menor espectro y por menos días de tratamiento25.
INFECCIONES INTRAABDOMINALES
La infección intraabdominal (segunda causa de mortalidad por infección en la UCI), puede ser no complicada y complicada. La forma no complicada es la que solo está confinada al órgano de origen y no va más allá de una inflamación intramural; en tanto que la forma complicada es aquella que evoluciona hacia la peritonitis (secundaria o terciaria) o la formación de abscesos. En una infección no complicada la cirugía es resolutiva y solo requiere profilaxis antibiótica; sin embargo, si no es tratada en forma oportuna tiene una alta probabilidad de evolucionar a la infección complicada. Los factores más frecuentes que pueden pronosticar la evolución hacia una infección intraabdominal complicada son: postergación de la operación inicial por más de 24 horas, edad avanzada, comorbilidad, disfunción de otros órganos, hipoalbuminemia, malnutrición e inmunodepresión en general32, 33.
Peritonitis bacteriana
Peritonitis primaria. Es la peritonitis espontánea que deriva de una traslocación bacteriana en ausencia de la perforación de una víscera hueca. Puede presentarse en pacientes con cirrosis y ascitis (10% a 30% de casos), tuberculosis y diálisis peritoneal. Por su origen y manejo, no corresponde a una infección intraabdominal complicada de necesidad quirúrgica. Los agentes microbianos más aislados son E. coli (40%), Streptococcus spp (30%), Klebsiella spp (7%), otros gramnegativos como P. aeruginosa y Proteus spp (20%), anaerobios 5%. Más del 90% de casos son de causa monomicrobiana.
Se recomienda administrar cefotaxima 2 g, cada 8 a 12 horas, o ceftriaxona 2 g, cada 24 horas, o amoxicilina/ ácido clavulánico 1g/0,2 g, cada 6 a 8 horas. En alérgicos a los beta-lactámicos puede ofrecerse ciprofloxacino 400 mg, cada 12 horas34.
Peritonitis secundaria. Las causas más comunes son: apendicitis perforada, perforación de úlcera gástrica o duodenal; perforación del colon por diverticulitis, vólvulos o cáncer, incarceración del intestino delgado y perforación por trauma penetrante (vg. arma de fuego, arma blanca). La pancreatitis necrotizante también puede estar asociada con peritonitis en caso que ocurra la infección del tejido necrótico. Menos frecuentes son las ocasionadas por patología biliar, enfermedad pélvica y iatrogenia (poscirugía, posendoscopía). La flora causal suele ser polimicrobiana y los agentes más aislados son: bacterias gramnegativas (E. coli 71%, Klebsiella spp 14%, P. aeruginosa 14%); grampositivos (Streptococcus spp 38%, Enterococo spp 23%) y anaerobios (Bacteroides fragilis > 70%).
Regímenes recomendados33, 34
1. En los pacientes que proceden de la comunidad con signos clínicos de peritonitis, pero que no reúnen criterios de sepsis grave y aún no han recibido terapia antibiótica, debe ofrecerse la asociación de una cefalosporina de 3ª generación (ceftriaxona 2 g, cada 24 horas, o cefotaxima 1 g, cada 6 a 8 horas) con metronidazol 500 mg EV, cada 8 horas. En pacientes alérgicos a los beta-lactámicos puede asociarse una fluoroquinolona (ciprofloxacino 400 mg, cada 12 horas o levofloxacino 750 mg, cada 24 horas) más metronidazol. Como agente antianaerobio, también puede utilizarse clindamicina 600 mg, cada 8 horas en lugar del metronidazol. Como monoterapia puede administrarse piperacilina/tazobactam 4g/0,5g, cada 8 horas.
2. En pacientes que proceden de la comunidad sin sepsis grave, pero que ya recibieron antibióticos (cefaloporinas y/o quinolonas), debe sospecharse presencia de enterobacterias beta-lactamasa de espectro extendido (BLEE). Si no hay riesgo de infección por P. aeruginosa, puede administrarse como monoterapia ertapenem 1 g, cada 24 horas35.
3. Pacientes que proceden de la comunidad y presentan criterios de sepsis grave deben recibir una combinación antibiótica de amplio espectro. Si aún no recibió antibióticos puede ofrecerse una cefalosporina antipseudomona (ceftazidima 2 g, cada 8 horas o cefepima 2 g, cada 8 horas) asociado a metronidazol 500 mg, cada 8 horas. Si ya recibió antibióticos y hay sospecha, o aislamiento, de bacterias resistentes, debe administrarse un carbapenem antipseudomona, (imipenem 1 g, cada 8 horas, o meropenem 1 g, cada 8 horas). Los carbapenems cubren a los agentes anaerobios y no es necesario asociar el metronidazol. En los pacientes con alergia a los beta-lactámicos puede administrarse una fluoroquinolona (ciprofloxacino o levofloxacino) asociada al metronidazol o a la clindamicina.
Peritonitis terciaria.
Es la peritonitis que persiste después de 48 horas de un adecuado manejo de la peritonitis primaria o secundaria. Por lo general son pacientes postoperados que ya recibieron antibióticos, están inmunodeprimidos y reciben nutrición parenteral. También puede asociarse o producirse a causa de un absceso peritoneal. Más del 50% de estos pacientes ingresan a UCI con cuadro de sepsis grave y presentan alta tasa de mortalidad (>30%). Más del 90% presenta ascitis, pero debe buscarse la presencia de abscesos residuales. Debe considerarse la presencia de enterobacterias BLEE, anaerobios, enterococo, P. aeruginosa, S. aureus y Cándida spp. La presencia de abscesos es la principal causa de infección persistente y del desarrollo de la peritonitis terciaria, el mismo que debe drenarse de inmediato por catéter percutáneo o cirugía.
En los pacientes de UCI con aislamiento de bacterias multirresistentes y/o presencia de otros focos infecciosos extraabdominales, debe asociarse un carbapenem antipseudomona (1 g, cada 8 horas, de imipenen o de meropenem) más una fluoroquinolona (ciprofloxacino o levofloxacino) Si se aisla S.aureus-Meticilino Resistente (SAMR) debe asociarse vancomicina 1 g, cada 24 horas. Si no es posible administrar vancomicina o si se aísla enterococo vancomicina-resistente, puede administrarse linezolid33, 34. En los pacientes con sospecha, o aislamiento, de infección por Cándida spp debe adicionarse un antifúngico intravenoso (Ver Sepsis fungal).
INFECCIONES DE LAS VÍAS BILIARES
Colecistitis aguda
La colecistitis aguda se relaciona a la presencia de cálculos biliares en más del 90% de casos. El retardo del tratamiento adecuado puede llevar a complicaciones graves en la vesícula, como la gangrena, el empiema o la perforación; además de la colangitis, la pancreatitis aguda, el íleo biliar y las fístulas biliares.
La colecistitis no grave adquirida en la comunidad, por lo general solo requiere un solo antibiótico como cefazolina o cefuroxima; sin embargo, en la colecistitis aguda, con cuadro de sepsis grave, principalmente en pacientes de edad avanzada o en inmunodeprimidos, es necesario administrar una cefalosporina de 3ª generación o una fluoroquinolona, cualesquiera, asociada al metronidazol; o indicar monoterapia con piperacilina/tazobactam. En pacientes que ya recibieron antibióticos previamente y que presentan sepsis grave con rápido deterioro clínico, debe administrarse un carbapenem, como imipenem o meropenem.
Colangitis aguda
Es una infección del árbol biliar que, por lo general, se presenta en un paciente que ya presenta una patología de la vía biliar, como litiasis o cáncer. Clínicamente, el 50% al 70% de pacientes presentan fiebre, ictericia y dolor en hipocondrio derecho (triada de Charcot). El cuadro evoluciona rápidamente al estado de sepsis grave (disfunción orgánica, hipotensión) y tiene una alta mortalidad principalmente en la población senil.
Debe administrarse de inmediato una combinación de cefalosporina de 3ª generación más metronidazol, o monoterapia con piperacilina/tazobactam, o con ampicilina/sulbactam. Si se aísla al enterococo, debe asociarse vancomicina, o ampicilina en altas dosis, según sensibilidad documentada. Si en 48 horas no hay respuesta clínica satisfactoria, de inmediato debe realizarse un drenaje quirúrgico o endoscópico (PCRE) o radiológico, del árbol biliar, y solicitar cultivo del material drenado37.
Toda infección biliar de origen nosocomial, debe manejarse desde un inicio con cefepime más metronidazol; o piperacilina/tazobactam, o un carbapenem antipseudomona (imipenem, meropenem). Cualquier régimen debe asociarse a la vancomicina33. En pacientes alérgicos a los beta-lactámicos puede indicarse la asociación de una fluoroquinolona más metronidazol más vancomicina. El aislamiento de un enterococo vancomicino-resistente, requiere la administración de linezolid33.
INFECCIONES DE PIEL Y PARTES BLANDAS
Celulitis grave
A diferencia de la erisipela, que solo afecta la dermis superficial de la piel, la celulitis se extiende hacia el tejido celular subcutáneo. Por lo general, es secundaria a la presencia de úlceras, heridas (quirúrgicas o traumáticas), lesiones de rascado y dermatosis, y se presenta con mayor frecuencia en pacientes con obesidad, diabetes, alcoholismo, inmunodepresión en general e insuficiencia venosa periférica. La incidencia de la celulitis varía de 0,2 a 25 por 1000 habitantes. La gran mayoría son leves a moderadas y menos del 5% evoluciona a la sepsis severa y el shock.
El tratamiento antibiótico depende de la presentación clínica de la celulitis37. Las denominadas tipo I (solo inflamación local sin manifestaciones sistémicas) y tipo II (fiebre, pero sin compromiso hemodinámico), se tratan por lo general en forma ambulatoria con reposo y antibióticos por vía oral; en tanto que las del tipo III (manifestaciones de sepsis y/o comorbilidades que pueden comprometer la respuesta al tratamiento, como inmunodepresión, diabetes, IRC, cirrosis, etc.) y las de tipo IV (sepsis grave o shock séptico y/o manifestaciones de necrosis tisular), deben hospitalizarse y recibir antibióticos por vía intravenosa lo antes posible. Las celulitis tipos III y IV se denominan también celulitis complicadas. Los pacientes con celulitis facial y periorbital, también deben hospitalizarse. Si hay presencia de abscesos y/o material
purulento, deben tomarse muestras para cultivo antes de iniciar los antibióticos. En la celulitis no es necesario solicitar hemocultivos, excepto en casos de sepsis grave refractaria al tratamiento.
Regímenes recomendados
1. Si el paciente hospitalizado es inmunocompetente, y sin otras comorbilidades importantes, los agentes patógenos más comunes que deben cubrirse son Streptococcus pyogenes y S. aureus. Administrar cefazolina 1 g, cada 6 a 8 horas, o clindamicina 600 mg, cada 8 horas, en los alérgicos a la penicilina. En la celulitis facial o periorbital, administrar un régimen de ceftriaxona 2 g, cada 24 horas, más clindamicina 600 mg, cada 8 horas38.
2. En los pacientes inmunodeprimidos o con otra comorbilidad que comprometa su respuesta al tratamiento, además de los patógenos mencionados, deben considerarse: P. aeruginosa, enterobacterias, incluso hasta anaerobios38,39. De modo que en la celulitis del paciente neutropénico y en los diabéticos (principalmente con pie diabético), puede administrarse monoterapia con piperacilina/ tazobactam 4,5 g cada 8 horas, o ampicilina/ sulbactam 3 g, cada 6 horas, o la asociación de una cefalosporina de 3ª generación más metronidazol. En pacientes graves, con sospecha o aislamiento de bacterias resistentes, debe administrarse 1g cada 8 horas de imipenen o meropenem. En alérgicos a los beta-lactámicos, puede asociarse ciprofloxacino 400 mg, cada 12 horas más clindamicina 600 mg, cada 6 a 8 horas. En los casos de pie diabético y necrosis tisular, la terapia quirúrgica oportuna y prolija, debe complementar tempranamente a la terapia antibiótica de amplio espectro.
3. Los pacientes hospitalizados con celulitis que no responden al tratamiento inicial con beta-lactámicos, o en los pacientes con celulitis complicadas (carácter purulento y/o asociada a abscesos), o con celulitis secundarias a heridas quirúrgicas/traumáticas infectadas, a quemaduras o a flebitis, debe considerarse la presencia del S. aureus-Meticilino Resistente (SAMR). En estos casos, vancomicina 1 g, cada 12 horas, o linezolid 600 mg, cada 12 horas, como segunda alternativa, debe adicionarse a la cura quirúrgica y a la terapia de amplio espectro21,40.
4. En la celulitis por mordedura humana o animal que requiera de hospitalización puede administrarse uno de los siguientes: ampicilina/sulbactam 1,5 a 3 g, cada 6 horas, o piperacilina/tazobactam 4,5 g, cada 8 horas, o ertapenem 1 g, cada 24 horas. La combinación de ciprofloxacino más clindamicina, es la alternativa en pacientes alérgicos a los beta-lactámicos. Pacientes graves, con mordeduras infectadas y atención tardía, deben recibir terapia de amplio espectro y cura quirúrgica inmediata38.
Fasceitis necrotizante
Es una infección poco frecuente, pero grave, que, más allá de la piel, afecta a los planos faciales profundos. La fascia más comúnmente comprometida es la fascia superficial (no la muscular), la misma que comprende todo tejido ubicado entre la piel y el músculo subyacente. Las manifestaciones clínicas más frecuentes son: celulitis (90% de casos), edema (80%) y coloración necrótica o signos de gangrena (70%). El paciente evoluciona a estados de toxicicidad sistémica con rapidez y la terapia médico-quirúrgica debe indicarse de inmediato. Más de dos tercios de casos se presentan en los miembros inferiores y las causas subyacentes más frecuentes son: diabetes, aterosclerosis e insuficiencia venosa. En pacientes con sepsis grave por fasceitis necrotizante la mortalidad es del 50% al 70%.
Debido a que la flora patógena es polimicrobiana, incluido los anaerobios, la terapia inicial debe ser combinada. La guía del IDSA38, recomienda como primera elección la asociación triple de ampicilina/sulbactam 1,5–3,0 g, cada 6 a 8 horas, más clindamicina 600 a 900 mg, cada 8 horas, más ciprofloxacino 400 mg, cada 12 horas. En lugar de ampicilina/sulbactam también se puede indicar piperacilina/tazobactam. Otras alternativas son: imipenem o meropenem 1 g, cada 8 horas, o ertapenem 1 g, cada 24 horas, o la asociación de cefotaxima 2 g, cada 6 horas, más metronidazol 500 mg, cada 6 horas; o cefotaxima más clindamicina. Los alérgicos a los beta-lactámicos pueden recibir clindamicina más ciprofloxacino. En caso de aislar S. aureus-Meticilino Resistente (SAMR), a la terapia indicada se le puede adicionar vancomicina 15 mg/kg, cada 12 horas, o linezolid 600 mg, cada 12 horas. Con la debridación quirúrgica apropiada y el régimen antibiótico indicado, la mejora clínica debe sobrevenir 48 a 72 horas después. De lo contrario, debe hacerse otra cura quirúrgica, tomar cultivos y replantear el esquema antibiótico.
Gangrena de Fournier
Es una infección necrotizante de rápida evolución que involucra la zona perineal, el escroto y el pene o la vulva. Es más frecuente alrededor de los 50 años y la mayoría de veces se asocia a trastornos de inmunidad, en especial la diabetes. Por lo general, se inicia a partir de una lesión perianal o génito-urinaria. La flora patógena es polimicrobiana e incluye al S. aureus, P. aeruginosa y anaerobios. Los pacientes se presentan con sepsis grave o shock y requieren una inmediata debridación quirúrgica, además de cobertura antibiótica amplia, fluidoterapia intensa, curaciones continuas y adecuado soporte nutricional.
Se debe administrar regímenes combinados, como cefalosporina antipseudomona (cefepime o cefotaxima) más clindamicina; o piperacilina/tazobactam más metronidazol. Si en 48 a 72 horas no hay respuesta adecuada, debe administrarse un carbapenem antipseudomona (imipenem o meropenem) más ciprofloxacino más vancomicina o linezolid, según convenga38.
Mionecrosis clostridial
También conocido como gangrena gaseosa o clostridial, es una infección de tejidos profundos, incluido el paquete muscular, ocasionada por la inoculación de especies clostridiales, principalmente el C. perfringes. La lesión es dolorosa, la piel presenta cambios de color (bronce, violáceo, eritema), edema y signos de crepitación que concuerdan con el hallazgo de gas en la imagen radiológica. El paciente desarrolla rápidamente cuadro de sepsis grave con riesgo de alta mortalidad (30% al 100%), por lo cual la debridación quirúrgica prolija y la terapia antibiótica adecuada deben realizarse lo antes posible41.
A fin de cubrir todas las cepas clostridiales, debe administrarse una combinación de penicilina G sódica 2 a 4 millones UI, cada 4 a 6 horas, más clindamicina 600 a 900 mg, cada 8 horas. En lugar de clindamicina, también puede administrarse cloramfenicol 1 g, cada 6 horas. Si hay sospecha de sobreinfección por gramnegativos puede asociarse una cefalosporina de 3ª generación o una fluoroquinolona38.
MENINGITIS BACTERIANA
La incidencia de la meningitis bacteriana comunitaria es de 1 a 3 casos por 100 000 habitantes. El neumococo y el meningococo son responsables de más del 80% de casos. Listeria monocytogenes (4 a 8%) puede afectar a los mayores de 50 años, alcohólicos o jóvenes con inmunodeficiencia celular42. La meningitis es siempre una infección grave que debe sospecharse en todo paciente que presenta fiebre y manifestaciones neurológicas, como cefalea intensa, signos de meningismo o convulsiones. El pronóstico del paciente, incluso un alto riesgo de secuelas neurológicas, depende del intervalo entre el inicio de la enfermedad y la administración del tratamiento adecuado.
Antes de iniciar la terapia antibiótica debe solicitarse hemocultivo y realizar la punción lumbar (PL) para los estudios de Gram (especificidad >97%), citoquímico y cultivo del LCR. En los pacientes que presentan convulsiones, enfermedad previa del SNC, papiledema, o déficit neurológico focal, debe solicitarse TAC cerebral previo a la PL. Si el estudio del LCR no tiene características de etiología bacteriana, como glucosa < 35 mg/dL, y leucocitos > 2000/mm3, puede solicitarse prueba de procalcitonina debido a su alta sensibilidad y especificidad (100%), en el estudio de la meningitis bacteriana43.
La terapia empírica se administra por vía intravenosa tan rápido como sea posible (dentro de las primeras 1 a 3 horas) y en la dosis máxima a fin de que pueda alcanzarse la mayor concentración antibacteriana en el tejido cerebral y el LCR. Si después de 48 horas de terapia antibiótica intensa no hay respuesta clínica aceptable, debe repetirse la PL y replantear el régimen indicado44. La terapia adyuvante con dexametasona debe iniciarse junto, o poco antes, a la primera dosis de antibiótico, a razón de 10 mg, cada 6 horas, durante 4 días. Su uso reduce el riesgo de secuelas, pero no reduce la tasa general de mortalidad45.
Regímenes recomendados44, 46
1. En los pacientes menores de 50 años debe administrarse una cefalosporina de 3ª generación (ceftriaxona 2 g, cada 12 horas o cefotaxima 2 g, cada 6 horas) asociado a vancomicina 30 a 45 mg/kg/día, repartido cada 8 a 12 horas. Después de la primera dosis de carga de 15 mg/kg, la dosis de la vancomicina debe ajustarse a la función renal.
2. En los pacientes de 50 años o más, debe cubrirse la posibilidad de infección por L. monocytogenes; por tanto, además de administrar el régimen anterior (cefalosporina de 3ª generación más vancomicina), debe asociarse ampicilina 2 g, cada 4 horas o amoxicilina en igual dosis.
3. En pacientes con meningitis secundaria a un trauma penetrante de cabeza, o posterior a una intervención neuroquirúrgica, debe administrarse vancomicina más una cefalosporina antipseudomona, como cefepime 2 g, cada 8 horas o ceftazidima 2 g, cada 8 horas. Otra alternativa es la asociación de vancomicina más meropenem 2 g, cada 8 horas.
4. En pacientes alérgicos a los beta-lactámicos la terapia empírica consiste en la asociación de vancomicina más cloramfenicol 1 g, cada 6 horas. En pacientes con neumococo o estafilococo resistente, o que no pueden recibir vancomicina, puede asociarse linezolid 600 mg, cada 12 horas21.
Duración del tratamiento
En caso de no identificar al agente patógeno, o de aislar neumococo, la terapia debe durar de 10 a 14 días. Si se aísla meningococo o H. influenzae, el tratamiento puede durar hasta 7 días. Si se aísla P. aeruginosa u otra bacteria gramnegativa, el tratamiento dura de 21 a 28 días. En la meningitis por L. monocytogenes, el tratamiento dura hasta 21 días. Antes de detener el tratamiento el paciente debe estar afebril y sin síntomas neurológicos de 48 a 72 horas44, 46.
SEPSIS FUNGAL
Los casos de sepsis por invasión sistémica de hongos han aumentado progresivamente en las UCI y se asocian a una alta mortalidad (46% al 75%). Más del 90% se deben a las especies cándida, de las cuales predomina la C. albicans (>80%). Se ha encontrado que más del 35% de casos de candidemia ocurren dentro de los primeros cinco días de estancia en la UCI47. Según el denominado Score Cándida, a los factores de riesgo, como nutrición parenteral, hallazgo de Cándida spp en dos ó más lugares que no sean la sangre, se les otorga un punto a cada uno, en tanto que a la presencia de sepsis se le otorga dos puntos. La suma de tres puntos o más, tiene un alto valor predictivo de la existencia de candidemia, a fin de iniciar la terapia empírica48.
Regímenes recomendados47, 49
1. Pacientes no neutropénicos con candidemia y que no han recibido antifúgicos azoles antes, administrar fluconazol 800 mg, dosis de carga, luego 400 mg/día. En aquellos que ya recibieron azoles o se encuentran en sepsis grave, se recomienda el uso de una equinocandina: anidulafungin 200 mg dosis de carga, luego 100 mg/ día; o caspofungina 70 mg dosis de carga, luego 50 mg/día; o micafungina 100 mg/día. Anfotericina B 0,5 a 1 mg/kg/día, es una alternativa en pacientes que no pueden recibir azoles.
2. Pacientes neutropénicos con sepsis grave deben recibir una equinocandina o anfotericina B liposomal 3 a 5mg/kg/día. Pacientes menos graves y que antes no recibieron azoles, pueden recibir fluconazol en las dosis indicadas. Se recomienda el retiro o recambio del catéter venoso central y del catéter urinario en caso de candiduria.
En ambos regímenes puede usarse voriconazol 400 mg, cada 12 horas (primer día), luego 200 mg, cada 12 horas, como alternativa en casos de aislar C. kruzei o C. glabrata fluconazol-resistente. En pacientes con disponibilidad de la vía oral, puede usarse voriconazol por vía oral con alta eficacia debido a que su biodisponibilidad por esa ruta es mayor del 90%.
La duración de tratamiento de la candidemia debe ser hasta 14 días después del primer cultivo informado como negativo y acompañado de la resolución clínica del cuadro49.
INFECCIÓN RELACIONADA AL CATÉTER INTRAVASCULAR
Bacteriemias y fungemias relacionadas al uso de catéteres intravasculares, pueden llegar a una tasa de mortalidad del 12% al 25% en los pacientes críticos. Las infecciones están más relacionadas al uso del catéter venoso central (CVC); de ahí que debe tenerse especial cuidado en su uso racional, cuidados, técnica de colocación y detección temprana de signos inflamatorios en el lugar de la inserción. Los agentes patógenos más aislados son: cocos grampositivos (Staphylococcus epidermidis, S. aureus), bacilos aerobios gramnegativos (E. coli, Enterobacter spp, Klebsiela spp, Pseudomonas spp, S. maltophilia, Acinetobacter spp) y Cándida spp.50, 51.
Debe plantearse el diagnóstico de infección relacionada al catéter intravascular cuando un paciente con CVC presenta bacteriemia o fungemia con manifestaciones de fiebre y escalofríos. Esto sugiere la necesidad de contar con cultivos positivos en ausencia de otro foco que explique el proceso, de ahí que la presunción diagnóstica temprana debe realizarse en el paciente con cuadro febril agudo que, además, presenta signos inflamatorios o purulentos en el lugar de la inserción del catéter. La aparición adicional de hipotensión -en ausencia de hipovolemia o de un evento cardiaco-, y/o disfunción orgánica, catalogan al proceso como una infección grave. El catéter debe ser reemplazado o retirado y, una vez solicitados los cultivos correspondientes, debe iniciarse terapia antibiótica empírica lo antes posible50, 51.
Regímenes recomendados50, 51
1. Debido al incremento de aislamientos de S. aureus- Meticilino Resistentes (SAMR), la terapia puede iniciarse con vancomicina 1 g, cada 12 horas. Si el resultado del primer cultivo informa presencia de S. aureus meticilino-sensible, debe cambiarse el régimen por oxacilina 2 g, cada 4 horas, o cefazolina 2 g, cada 8 horas. Solo en caso de aislar S. aureus vancomicino-resistente puede administrarse linezolid o daptomicina, como segunda alternativa50.
2. El paciente crítico o inmunocomprometido, además de vancomicina, debe recibir cobertura antibiótica adicional para enterobacterias y P. aeruginosa, con ceftazidima 2 g, cada 8 horas, o piperacilina/ tazobactam 4g/0,5 g, cada 8 horas. Si hay sospecha o aislamiento de bacilos gramnegativos resistentes, debe asociarse un carbapenem (imipenem o meropenem).
3. Si el paciente tiene Score Cándida positivo o se confirma la candidemia, debe adicionarse fluconazol intravenoso (Ver Sepsis fungal).
Duración del tratamiento50
En los pacientes con infección no complicada y retiro del CVC, la terapia debe durar14 días en caso de aislar S. aureus, 10 a 14 días en caso de aislar un bacilo gramnegativo y hasta 14 días después del último cultivo negativo en los casos de infección por Candida spp.
En los pacientes con infección complicada (aparición de trombosis séptica, endocarditis, osteomielitis, etc.), la terapia puede durar 4 a 6 semanas, incluso hasta 8 semanas en casos de osteomielitis.
SEPSIS GRAVE DE ORIGEN NO DETERMINADO
Debido a que las manifestaciones del SIRS no son específicas para los procesos infecciosos, poco más del 40% de pacientes que ingresan por emergencia con aparente cuadro de sepsis grave o shock, no corresponden a infecciones (32% es patología no infecciosa que simula sepsis y 12% es patología de etiología no determinada)52. Sin embargo, aún cuando se haya agotado el examen clínico, laboratorial e imagenológico de rutina (incluyendo la ecografía abdominal), una vez solicitados los cultivos correspondientes, el paciente debe recibir terapia antibiótica combinada de amplio espectro lo antes posible, a fin de aumentar la supervivencia y disminuir la morbimortalidad6 - 8. Mujeres en edad reproductiva con sepsis de foco no determinado, deben tener evaluación ginecológica y descartar los diagnósticos de aborto séptico e infección pélvica. Todo catéter venoso, u otro dispositivo invasivo, deben ser evaluados como probable factor causal.
Regímenes recomendados
1. En el paciente inmunocompetente que procede de la comunidad, deben cubrirse enterobacterias gramnegativas, B. fragilis y enterococos. Se recomienda monoterapia con piperacilina/tazobactam, o ampicilina/ sulbactam, o con cefoperazona. También se ha propuesto las asociaciones de cefepime o cefoperazona más clindamicina o metronidazol; o la asociación triple de ceftazidima más levofloxacino más vancomicina. En pacientes graves que ya recibieron antibióticos y hay sospecha de enterobacterias resistentes y/o P.aeruginosa, administrar un carbapenem antipseudomona (imipenem o meropenem) más fluoroquinolona más vancomicina53,54. Los regímenes que asocian un antibiótico beta-lactámicos con una fluoroquinolona, han demostrado disminuir la mortalidad por sepsis ocasionada por bacterias gramnegativas55.
2. En el paciente inmunodeprimido, u hospitalizado, que ya ha recibido antibióticos, considerar la presencia de S.ureus-Meticilino Resistente (SAMR), enterobacterias resistentes y P. aeruginosa, y administrar un carbapenem antipseudomona (imipenen o meropenem) más una fluoroquinolona (o amikacina) más vancomicina o linezolid. En el paciente de la comunidad que ingresa con sepsis grave o shock a la sala de emergencia y en quien no es posible conocer antecedentes patológicos ni epidemiológicos, también debe administrarse dicho régimen. Los pacientes neutropénicos, además del régimen antibiótico de amplio espectro, deben recibir fluconazol intravenoso, una vez solicitados los cultivos correspondientes. En cualquier caso, debe evaluarse la respuesta terapéutica en 48 a 72 horas, antes de tomar la decisión de cambiar de régimen, sin detener la búsqueda del foco infeccioso y el aislamiento del agente patógeno53, 54.
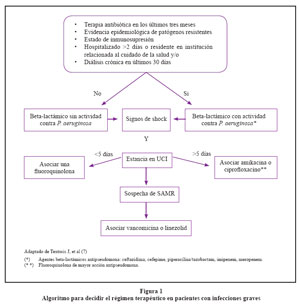
Finalmente, un enfoque práctico secuencial para la elección de antibióticos en infecciones graves, basado en factores de riesgo para patógenos específicos es mostrado en la Figura Nº 17.
Puntos Críticos
-
La sepsis es aún una causa frecuente de muerte en todo el mundo (segunda causa en la UCI).
-
La tasa de mortalidad es mayor en los pacientes con sepsis grave o shock séptico que no reciben terapia antibiótica adecuada en forma temprana.
-
La terapia antibiótica empírica y de amplio espectro bacteriano, debe ser administrada en pacientes con infección grave dentro de la primera hora del diagnóstico.
-
La selección de los antibióticos combinados debe realizarse en base a las características clínicas del paciente, patrones locales de resistencia y prevalencia microbiana.
-
La dosificación y la forma de administración de los antibióticos, deben indicarse de manera correcta.
-
Es fundamental establecer un monitoreo clínico y microbiológico continuos, a fin de poder modificar el régimen antibiótico inicial en forma oportuna.
-
Hacer todos los esfuerzos posibles para lograr el uso racional de los antibióticos y disminuir la tasa de resistencia bacteriana.
-
Debe contarse con la ayuda de guías clínicas vigentes y validadas para el manejo de la sepsis grave en general y de las infecciones específicas en particular.
REFERENCIAS BIBLIOGRÁFICAS
1. Vincent JL, Sakr Y, Sprung CL, et al. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med. 2006;34(2):344-53
2. Angus DC, Linde-Zwirble WT, Lidicker J, et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 2001;29(7):1303-10
3. Alberti C, Brun-Buisson Ch, Chevret S, Antonelli M, et al. Systemic Inflammatory Response and Progression to Severe Sepsis in Critically Ill Infected Patients . Am J Respir Crit Care Med. 2005; 171:461–468
4. Defunciones registradas en el Perú 1999–2000. MINSA-OGEI. URL: http://www.minsa.gob.pe/portada/estadistica.asp (Visitado el 22/05/2011).
5. Leone M, Bourgoin A, Cambon S, et al. Empirical antimicrobial therapy of septic shock patients: adequacy and impact on the outcome. Crit Care Med. 2003;31:462–467
6. Dellinger RP, Levy MM, Carlet JM, Bion J, et al. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008; 36(1):296-327
7. Textoris J, Wiramus S, Martin S, Leone M. Overview of antimicrobial therapy in intensive care units. Expert Rev Anti Infect Ther 2011; 9(1):97–109
8. Deresinski S. Principles of Antibiotic Therapy in Severe Infections: Optimizing the Therapeutic Approach by Use of Laboratory and Clinical Data. Clin Infect Dis. 2007; 45:S177–83
9. Shankar-Hari M, Wyncoll D. Utility of an antibiotic guideline in hospital-associated infections. Crit Care. 2010; 14: P51
10. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003; 31:1250 –1256
11. Cárdenas Rojas M. Breve guía de estilo para la redacción científica. Lima; Instituto Nacional de Salud/MINSA; 2007, pp. 109
12. Mandell LA, Wunderink RG, Anzueto A, Bartlett JG, et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community-Acquired Pneumonia in Adults. Clin Infect Dis. 2007; 44:S27–72
13. Guía de Práctica Clínica: Neumonía Adquirida en la Comunidad en Adultos. Lima; Sociedad Peruana de Enfermedades Infecciosas y Tropicales (SPEIT)/Organización Panamericana de la Salud; 2009. URL: http://www.speit.org/archivos/Guia_adultos.pdf (Visitado el 25/05/2011)
14. Lim WS, Baudouin SV, George R C, Hill AT, et al. British Thoracic Society guidelines for the management of community acquired pneumonia in adults: update 2009. Thorax. 2009;64 (Suppl III):1–55
15. Ortiz-Ruiz G, Vetter N, Isaacs R, Carides A, et al. Ertapenem versus ceftriaxone for the treatment of community-acquired pneumonia in adults: combined analysis of two multicentre randomized, double-blind studies. J Antimicrob Chemother. 2004; 53 (Suppl 2):59-66.
16. Guidelines for the Management of Adults with Hospital-acquired, Ventilator-associated, and Healthcare-associated Pneumonia (ATS, IDSA). Am J Respir Crit Care Med. 2005; 171: 388–416, 2005
17. Rotstein C, Evans G, Born A, et al. Clinical practice guidelines for hospital-acquired pneumonia and ventilator-associated pneumonia in adults. (AMMI Canada Guidelines). Can J Infect Dis Med Microbiol. 2008; 19(1): 19-53
18. Luna CM, A. Monteverde A. Rodríguez C, et al. Neumonía intrahospitalaria: guía clínica aplicable a Latinoamérica preparada en común por diferentes especialistas. Arch Bronconeumol. 2005;41(8):439-56
19. Bassetti M, Righi E, Fasce R. Efficacy of ertapenem in the treatment of early ventilator-associated pneumonia caused by extended-spectrum b-lactamase-producing organisms in an intensive care unit. J Antimicrob Chemother. 2007; 60, 433–435
20. McKenzie C. Antibiotic dosing in critical illness. J Antimicrob Chemother. 2011; 66 (Suppl 2): 25–31
21. Liu C, Bayer A, Cosgrove SE, Daum RS, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America for the Treatment of Methicillin-Resistant Staphylococcus aureus Infections in Adults and Children. Clin Infect Dis. 2011;1–38
22. Landman D, Georgescu C, D Martin DA, Quale J. Polymyxins Revisited. Clin Microbiol Rev. 2008 (July): 449–465.
23. El Solh AA, Alhajhusain A. Update on the treatment of Pseudomonas aeruginosa pneumonia. J Antimicrobial Chemother. 2009; 64, 229–238
24. Gomes Silva BN, Andriolo RB, Atallah ÁN, Salomão R. De-escalation of antimicrobial treatment for adults with sepsis, severe sepsis or septic shock. Cochrane Database of Systematic Reviews 2010, Issue 12.
25. Blanco J, Muriel-Bombín A, Sagredo V, Taboada F, et al. Incidence, organ dysfunction and mortality in severe sepsis: a Spanish multicentre study. Crit Care. 2008; 12:R158.
26. Richards MJ, Edwards JR, Culver DH, et al. Nosocomial infections in combined Medical-Surgical Intensive Care Units in the United States. Infect Control Hosp Epidemiol. 2000; 21(8): 510-515
27. Grabe M, Bishop MC, Bjerklund-Johansen TE, Botto H, et al. Guidelines on Urological Infections. European Association of Urology 2009. URL: http://www.uroweb.org/guidelines/online-guidelines/ (Visitado el 02/06/2011)
28. Prakash Kalra O, Raizada A. Approach to a Patient with Urosepsis. J Glob Infect Dis. 2009; 1(1): 57–63.
29. Nicolle LE. Complicated urinary tract infection in adults. Can J Infect Dis Med Microbiol.2005; 16(6): 349–360
30. Pallett A, Kieran H. Complicated urinary tract infections: practical solutions for the treatment of multiresistant Gram-negative bacteria. J Antimicrob Chemother. 2010; 65 (Suppl 3): 25–33
31. Wells WG, Woods GL, Jiang Q, Gesser RM. Treatment of complicated urinary tract infection in adults: combined analysis of two randomized, double-blind, multicentre trials comparing ertapenem and ceftriaxone followed by appropriate oral therapy. J Antimicrob Chemother. 2004; 53 (Suppl 2): 67-74
32. Solomkin JS, Mazuski JE, Bradley JS, Rodvold KA, et al. Diagnosis and Management of Complicated Intra-abdominal Infection in Adults and Children: Guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Clin Infect Dis. 2010; 50:133–64
33. Brian James Daley BJ, Katz J, et al. Peritonitis and Abdominal Sepsis (Medscape) URL: http://emedicine.medscape.com/article/180234-overview#a0101 (Visitado el 10/06/11)
34. Lata J, Stiburek O, Kopacova M. Spontaneous bacterial peritonitis: a severe complication of liver cirrhosis. World J Gastroenterol. 2009; 15(44):5505-10.
35. Falagas ME, Peppas G, Makris GC, et al. Meta-analysis: ertapenem for complicated intra-abdominal infections. Aliment Pharmacol Ther. 2008; 27(10):919-31
36. Mosler P. Diagnosis and management of acute cholangitis. Curr Gastroenterol Rep. 2011; 13(2):166-72.
37. Eron LJ, Lipsky BA, Low DE, et al. Managing skin and soft tissue infections: expert panel recommendations on key decision points. J Antimicrob Chemother. 2003; 52:3-17.
38. Stevens DL, Bisno AL, Chambers HF, Everett ED, et al Practice Guidelines for the Diagnosis and Management of Skin and Soft-Tissue Infections. Clin Infect Dis. 2005; 41:1373–406
39. Powlson AS, Coll AP. The treatment of diabetic foot infections. J Antimicrob Chemother. 2010; 65 (Suppl 3): 3–9
40. Liu C, Bayer A, Cosgrove SE, Daum RS, et al. Clinical practice guidelines by the IDSA for the treatment of methicillin-resistant S. aureus infections in adults and children. Clin Infect Dis. 2011; 52:1-38
41. Bryant AE, Stevens DL. Clostridial myonecrosis: new insights in pathogenesis and management. Curr Infect Dis Rep 2010; 12(5):383-91.
42. Honda H., Warren D.K. Central nervous system infections: meningitis and brain abscess. Infect Dis Clin North Am. 2009; 23:609-23
43. Viallon A, Zeni F, Lambert C, et al. High sensitivity and specificity of serum procalcitonin levels in adults with bacterial meningitis. Clin Infect Dis. 1999; 28:1313–6
44. Tunkel AR, Hartman BJ, Kaplan AL, Kaufman BA, et al. Practice Guidelines for the Management of Bacterial Meningitis. Clin Infect Dis. 2004; 39:1267–84
45. Brouwer MC, McIntyre P, de Gans J, Prasad K, van de Beek D. Corticosteroids for acute bacterial meningitis. Cochrane Database of Systematic Reviews 2010, Issue 9. Art. No.: CD004405. DOI: 10.1002/14651858.CD004405.pub3.
46. Chaudhuri A, Martinez-Martin P, Kennedy PG, Andrew Seaton R, et al. EFNS guideline on the management of community-acquired bacterial meningitis: report of an EFNS Task Force on acute bacterial meningitis in older children and adults. Eur J Neurol. 2008; 15(7):649-59.
47. Lepak A, Andes D. Fungal Sepsis: Optimizing Antifungal Therapy in the Critical Care Setting. Crit Care Clin. 2011; 27:123–147
48. Leon C, Ruiz-Santana S, Saavedra P, et al. Usefulness of the Candida score for discriminating between Candida colonization and invasive candidiasis in non-neutropenic critically ill patients: a prospective multicenter study. Crit Care Med. 2009; 37(5):1624–33.
49. Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis. 2009;48(5):503–35
50. Mermel LA, Farr BM, Sherertz RJ, Raad II, et al. Guidelines for the Management of Intravascular Catheter–Related Infections. Clin Infect Dis. 2001; 32:1249–72
51. Raad I, Hanna H, Maki D. Intravascular catheter-related infections: advances in diagnosis, prevention, and management. Lancet Infect Dis. 2007; 7:645–57
52. Heffner AC, Horton JM, Marchick MR, Jones AE. Etiology of Illness in Patients with Severe Sepsis Admitted to the Hospital from the Emergency Department. Clin Infect Dis. 2010; 50:814– 820
53. Nguyen HB, Rivers EP, Abrahamian FM, et al. Severe Sepsis and Septic Shock: Review of the Literature and Emergency Department Management Guidelines. Ann Emerg Med. 2006;48:28-54
54. Gomes DD, Aranha LF, Freitas J, Silva E. Antibiotic management of sepsis: current concepts. Expert Opin Pharmacother. 2008; 9(16):2817-2828
55. Al-Hasan MN, Wilson JW, Lahr BD, et al. Beta-Lactam and fluoroquinolone combination antibiotic therapy for bacteremia caused by gram-negative bacilli. Antimicrobial Agents Chemother. 2009:1386–1394
CORRESPONDENCIA
Aland Bisso Andrade