Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.28 n.4 Lima oct./dic. 2011
Artículo original
Costo efectividad de Abatacept en comparación con otras terapias biológicas para el tratamiento de la artritis reumatoide moderada a severamente activa en pacientes que han fallado al tratamiento con metotrexato en EsSalud para el año 2010
Cost-effectiveness of abatacept compared to other biological agents for the treatment of moderately to severely active rheumatoid arthritis in patients who failed with methotrexate in Peruvian Social Security during 2010
Felipe Becerra Rojas1, César Benites Chacaltana2, Eleonora Aiello3, Carolina Zingoni4, Gert Bergman5, Pieter Drost6, César Sanabria Montañez7.
1. Médico Reumatólogo. Profesor Asociado de la Universidad Nacional Mayor de San Marcos. Jefe del Servicio de Reumatología Hospital Edgardo Rebagliati Martins. Lima, Perú.
2. Médico Cirujano Lima, Perú.
3. Químico Farmacéutica. Master en Economía de la Salud y farmacoeconomía, Argentina.
4. Médico Reumatóloga, Argentina.
5. Doctor en Ciencias Médicas, Países Bajos.
6. Magister y Docto en Farmacia, Bélgica.
7. Economista. Magíster en Economía. Profesor Principal de la Universidad Nacional Mayor de San Marcos. Lima, Perú.
RESUMEN
Objetivo: Estimar la costo efectividad de Abatacept combinado con Metotrexato (MTX) en comparación a otras DARMEs biológicas, en combinación con MTX, en pacientes con AR moderada a severamente activa.
Materiales y métodos: Se adaptó un modelo de secuencias de tratamiento para la representación de la invalidez en términos del índice HAQ en un horizonte de 5 años de enfermedad para una cohorte de 1 000 pacientes. Abatacept en combinación con MTX se comparó contra etanercept, rituximab, infliximab, adalimumab y tocilizumab, todas asociadas a MTX.
Resultados: El costo de tratamiento con Abatacept es de S/. 169 263 y su efectividad es de 1.96 AVAC. Respecto a etanercept, adalimumab, infliximab y tocilizumab, abatacept se ha mostrado más efectivo en términos de AVACs y menos costoso. Respecto a rituximab, abatacept presenta un índice de costo efectividad incremental de S/ 75 493 por AVAC ganado.
Conclusiones: Abatacept es dominante frente a Etanercept, Adalimumab, Infliximab y Tocilizumab, desde la perspectiva del Seguro Social de Salud (EsSalud) para el tratamiento de pacientes con AR moderada a severamente activa que han fallado a MTX.
Palabras clave: Artritis reumatoide, análisis costo-eficiencia.
ABSTRACT
Objective: To estimate the cost-effectiveness of Abatacept in combination with Methotrexate (MTX) versus other biologic DMARDs in combination with MTX in patients with moderately to severely active rheumatoid arthritis.
Materials and methods: A sequential therapy model was adapted for representing disability using the HAQ Index in a 5-year horizon period for a 1000-patient cohort. Abatacept in combination with MTX was compared against etanercept, rituximab, infliximab, adalimumab, and tocilizumab, all of them combined with MTX.
Results: The cost of abatacept therapy was S/. 169 263 and its effectiveness was found to be 1.96 QALY. Compared to etanercept, adalimumab, infliximab and tocilizumab, abatacept has shown to be the most effective agent in terms of QALYs and the least expensive. Compared to rituximab, abatacept has an incremental cost effectiveness ratio of S/. 75 493 per QALY gained.
Conclusions: According to this model, abatacept was found to be superior compared to etanercept, adalimumab, infliximab, and tocilizumab, from the Peruvian Social Security (EsSalud) perspective for the treatment of moderately to severely active Rheumatoid Arthritis in patients who failed using a MTX-based therapy.
Key words: Rheumatoid arthritis, cost efficiency analysis.
INTRODUCCIÓN
La artritis reumatoide (AR) es una enfermedad autoinmune, crónica, progresiva e invalidante que compromete la calidad de vida de los que la padecen1. Existen múltiples tratamientos en el mercado peruano con el fin de inducir la remisión de la enfermedad, controlar el dolor y la inflamación disminuyendo o evitando el daño articular, la incapacidad y la pérdida de la función física. Su tratamiento farmacológico comprende múltiples intervenciones conocidas como Drogas para AR Modificadoras de la Enfermedad (DARMEs)2.
La artritis reumatoide junto con otras enfermedades músculo esqueléticas son de distribución mundial3,4. En los Estados Unidos la artritis reumatoide se encuentra dentro de las primeras causas de pensión por invalidez y pérdidas económicas directas e indirectas5.
La prevalencia a nivel nacional es acorde a la prevalencia reportada a nivel mundial fluctuando entre el 0,5% a 1% de la población general; se manifiesta predominantemente en mujeres en un intervalo que varía entre los 45 a 65 años de edad6, 7, 8.
Debido al compromiso funcional de la artritis reumatoide y su repercusión posterior en la calidad de vida y rendimiento físico de los que la padecen9, es indispensable ir en búsqueda de un diagnóstico temprano con el fin de un inicio de terapia similar, de manera que se pueda frenar la progresión de la enfermedad y por ende evitar la incapacidad10.
En la actualidad se han realizado múltiples intervenciones de salud pública debido al severo impacto de la enfermedad frente a la incapacidad o limitación física, calidad de vida, depresión y otras que condiciona la AR11.
Con el avance de la ciencia y de la tecnología se han venido haciendo disponibles múltiples terapias para el tratamiento de la AR que van desde los fármacos destinados a aliviar el dolor como anti inflamatorios no esteroides (AINEs) pasando por DARMEs hasta las terapias más modernas que son consideradas como medicamentos biológicos que han probado ser efectivas para la reducción del daño articular y la progresión de la enfermedad12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22.
La AR es considerada una enfermedad de alto costo debido a que el financiador de la salud incurre en gastos considerables para su tratamiento y recuperación23, 24, 25.
Actualmente muchas tecnologías en salud deben, no solamente probar su efectividad clínica, sino también su costo efectividad, de manera que sea factible para los financiadores de la salud, el evaluar los costos de cada intervención en términos monetarios frente a los resultados en la salud de la población a la que cubren y puedan tomar decisiones eficientes.
Asimismo es importante ver los desenlaces de la enfermedad desde el punto de vista del Estado como principal involucrado, debido a que la invalidez que conlleva la AR, condiciona una pérdida, en promedio, de 32 años de sobrevida económicamente activos generando pérdidas en la recaudación por concepto de los impuestos, esto a partir de una estudio de FISSAL sobre la población excluida que no tiene acceso a servicios de salud en el Perú26.
Abatacept (Orencia®, Bristol Myers Squibb Co.) es una proteína de fusión CTLA4Ig que modula selectivamente la co-estimulación en la célula T a nivel de los receptores CD80/86 habiéndose comprobado su eficacia clínica superior al tratamiento con metotrexato como monoterapia para el tratamiento de AR27,28,29,30,31,32. Abatacept está indicado para el tratamiento de la AR moderada a severamente activa en pacientes adultos y para el tratamiento de la artritis idiopática juvenil (AIJ)33.
Abatacept ha demostrado ser una terapia costo efectiva para el tratamiento de la AR, en múltiples realidades a nivel mundial34, 35, 36. Asimismo es recomendada por distintas guías internacionales incluyendo la proveniente de la agencia de evaluación de tecnologías del Reino Unido, denominada National Institute for Health and Clinical Excellence (NICE).
El presente trabajo compara la costo efectividad de Abatacept frente a otras terapias biológicas, usadas para el tratamiento de la AR, disponibles en EsSalud como son adalimumab, etanercept, infliximab, rituximab y tocilizumab.
OBJETIVO
Estimar la costo efectividad de Abatacept combinado con Metotrexato (MTX) en comparación a otras DARMEs biológicas, en combinación con MTX, en pacientes con AR moderada a severamente activa.
MATERIALES Y MÉTODOS
Se adaptó un modelo de secuencias de tratamiento para la representación de la invalidez en el tiempo, en pacientes cuyo rango de edad se sitúa entre los 39 y 64 años con AR moderada a severamente activa y con una respuesta inadecuada al tratamiento con MTX. Para el análisis se empleó una cohorte hipotética de 1 000 pacientes y un horizonte temporal de 5 años de observación con tratamiento37, 38, 39.
Descripción del modelo
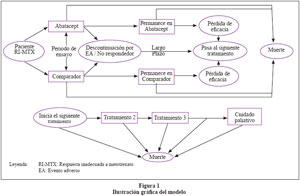
El modelo empleado se basó en el Modelo de Birmingham para AR ((BRAM), Barton 2004 y Chen 2006). El BRAM, es un modelo de muestreo individual que evalúa la costo efectividad de adicionar una terapia biológica definida frente a un comparador empleando la misma secuencia de uso de DARMEs convencionales y biológicos según sea el caso. El presente consta en la simulación de pacientes de tres brazos de terapia y secuencia de tratamiento.
La incapacidad funcional se expresó en términos del índice del Health Assessment Questionnaire-Disability Index (HAQ-DI) que define puntajes desde 0 (sin limitación en actividades de vida diaria) hasta 3 (incapacidad completa para realizar dichas actividades)40. El HAQ-DI fue estimado cada tres meses (periodicidad del modelo) y se asumió un incremento en el tiempo como resultado de la progresión de la enfermedad.
El modelo permite colocar a un paciente que responde inadecuadamente a MTX, en tratamiento con Abatacept en combinación con MTX y dos brazos alternativos de tratamiento con una secuencia fija de tratamiento tal y como se muestra en la figura 1.
El modelo contiene tres fases:
a) El tratamiento inicial con DMARDs biológicos por 6 meses, período en el cual el paciente puede responder a la terapia o descontinuarla debido a falta de respuesta o a la ocurrencia de efectos adversos serios o la muerte.
b) Si un paciente responde a la terapia el paciente se mantiene en el tratamiento inicial y el tiempo en tratamiento es modelado usando el tiempo promedio de permanencia en tratamiento.
c) El cambio a la siguiente opción de tratamiento en la secuencia de tratamientos, para lo cual la eficacia se estima en términos de HAQ.
Al ingresar a un paciente con respuesta inadecuada a MTX en el modelo, éste es clonado dos veces más y estos pacientes idénticos son analizados en tres brazos de tratamiento:
-
Brazo 1: Abatacept en combinación con MTX seguida de una secuencia fija de tratamiento.
-
Brazo 2: DMARD biológico alternativo en combinación con MTX seguido de una secuencia fija de tratamiento similar al anterior, o un DMARD convencional seguido de la misma secuencia fija de tratamiento.
-
Brazo 3: DMARD biológico alternativo en combinación con MTX seguido de una secuencia fija de tratamiento similar al anterior, o un DMARD convencional seguido de la misma secuencia fija de tratamiento.
Durante la secuencia de tratamiento completa se asignan las variables de eficacia, seguridad, calidad de vida, uso de recursos y costos.
En el modelo se asume que los pacientes reciben MTX (15 mg semanales) junto a Abatacept en los días 1, 14 y 29, y de ahí en adelante a un intervalo fijo de cada cuatro semanas. Se asume que los pacientes que reciben Abatacept inician tratamiento con infusiones intravenosas de 30 minutos y reciben entre 500 a 1 000 mg basados en el peso corporal. De acuerdo al estudio AIM, el tratamiento con Abatacept resulta en mejoras significativas en el HAQ-DI en comparación a MTX sólo, por lo que dicho estudio es tomado de base para la estimación de los resultados en el modelo de simulación. Los pacientes con mejoría de -0,5 o más en HAQ-DI permanecen en tratamiento con Abatacept, para aquellos que fallan en alcanzar este nivel de beneficio clínico se asume que pueden ser cambiados a otro DMARD biológico y viceversa.
Estimación del modelo
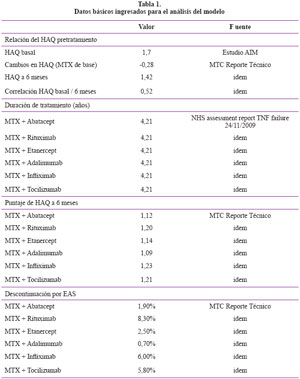
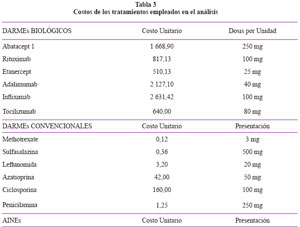
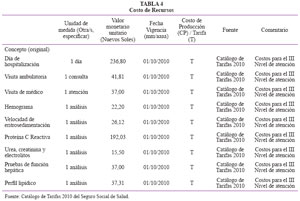
En la Tabla 1 se muestran los ingresos de datos para el modelo. La tabla 2 muestra las utilidades frente a los valores del índice HAQ. La Tabla 3 muestra los costos de medicamentos.
Población: La población seleccionada que usa el modelo, es similar a la del estudio AIM, en donde ingresan hombres y mujeres predominando las últimas en un 77,8%, con un HAQ-DI promedio de 1,70 (±0,70), la distribución por peso se dio en un 48% para el intervalo comprendido entre los 51 a 70 kg.
Pre tratamiento y HAQ-DI: Al ingreso a la cohorte del modelo, cada paciente fue asignado aleatoriamente a un valor inicial de HAQ-DI (muestreo del modelo) de acuerdo a la distribución del estudio AIM. En adelante los valores para HAQ-DI podían cambiar de acuerdo a la evolución de la enfermedad y la eficacia del DMARD biológico. HAQ aumenta a razón de 0,045/año en tratamiento con DARMEs sintéticos y en 0,06/año en cuidados paliativos.
Progresión de la enfermedad con Abatacept: De acuerdo al modelo, los pacientes en tratamiento con Abatacept son manejados de igual manera que con los otros biológicos. Los pacientes ingresados al tratamiento con Abatacept presentan un HAQ-DI similar al del estudio AIM que fue de 1,7 (±0,7) y recibiendo tratamiento mejoran significativamente en un 63,7% a comparación de los pacientes en el brazo de placebo con MTX.
Progresión de la enfermedad con otros biológicos: Para definir la progresión o éxito del tratamiento con otros biológicos se empleó el reporte del Servicio Nacional de Salud del Reino Unido. (NHS assessment report TNF failure 24/11/2009). El HAQ se mantiene constante en cualquier tratamiento con DARMEs biológicos.
Mortalidad: El modelo considera la mortalidad como parte de los eventos adversos serios de los tratamientos para AR con DARMEs convencionales y biológicos. Así también, la calcula en base del índice de daño para mortalidad ligado al HAQ; el promedio empleado fue de 1,3341
Utilidades y estado de salud: Las utilidades fueron derivadas de los puntajes del índice HAQ. El modelo utiliza un enfoque común adoptado del mapeo del HAQ en servicios públicos de salud. En este modelo, se emplea el Índice de Utilidad en Salud Mark-3 [Health Utility Index Mark-3 (HUI3)] donde las utilidades son calculadas a partir del HAQ basado en el análisis de Boggs et al., (2002) de 2 070 pacientes en cuatro ensayos clínicos aleatorios de AR. La puntuación del HAQ se convierte en HUI3, que puede ser usada para estimar la supervivencia de los años de vida ajustados por calidad.
Este modelo es el más ampliamente usado para determinar los beneficios frente a la condición de salud de una persona42.
Costos: Para el cálculo de los costos, el modelo considera la dosis y la frecuencia de administración de cualquier droga, los costos propios de la misma, los recursos y los costos de monitoreo, eventos adversos (data obtenida de los estudios pivotales de cada comparador) y costos indirectos, siendo éstos últimos pero que no se adaptaron para el presente trabajo, puesto que la perspectiva empleada es del financiador de salud. Para el ingreso de los costos se tomó los valores de SE@CE para las adquisiciones de EsSalud en el 2010 (revisado a septiembre 2010) también se empleó el Catálogo de Tarifas 2010 de EsSalud para el nivel III de atención43, 44. Se empleó el valor de 3,5% para la tasa de descuento de los costos así como para los de la salud. La Tabla 2 muestra los costos incluidos en el presente estudio.
Análisis: El modelo de simulación de Birmingham fue empleado para la estimación del impacto de Abatacept en los valores del HAQ-DI en el tiempo. Se incluyó el efecto rebote para los pacientes en tratamiento con Rituximab, los efectos adversos y la interrupción de tratamiento por eventos adversos serios. Debido a la propia activación del mercado se escogió el esquema de descuentos en el costo de los medicamentos. Se hizo algunos ajustes para algunos medicamentos debido a la presentación del mercado y su uso por dosis en base de peso y periodicidad, de tal manera que se le asignó precios en proporción a la cantidad requerida por el modelo.
RESULTADOS
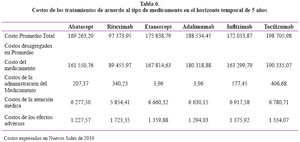
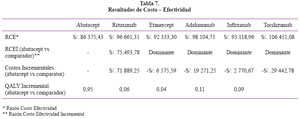
Los resultados de efectividad se muestran en la Tabla 5. Los resultados de costos se muestran en la Tabla 6. Los resultados incrementales se muestran en la Tabla 7.
Resultados de efectividad
Los resultados estimados de efectividad que nos arroja el modelo, nos señala que en términos de Años de Vida Ajustados por Calidad de Vida (AVAC) ganados, Abatacept es el medicamento que tiene un mayor logro para este indicador en los 5 años de plazo del estudio; es decir que con Abatacept se logra 1,96 años de vida ajustados por calidad de vida, le sigue Adalimumab con 1,92 AVAC, Etanercept con 1,90 AVAC, Tocilizumab con 1,87 AVAC, Infliximab con 1,85 AVAC y Rituximab con 1,01 AVAC. Así entonces, el mayor resultado de efectividad, medido en AVAC, en pacientes que tienen artritis reumatoide y que han tomado otros medicamentos para tratar su enfermedad y no han mejorado, lo logra Abatacept, que gana 1.96 AVAC, en el marco de estudio de simulación de 5 años para una cohorte de 1 000 pacientes del Seguro Social de Salud (EsSalud).
Resultados de Costos
Los resultados de los costos, examinados desde la perspectiva de la Seguridad Social de Salud (EsSalud), para un paciente con artritis reumatoide y que ha tomado otros medicamentos para tratar su enfermedad y no ha mejorado, el costo promedio (a precios de 2010) de la atención para los 5 años de estudio sería de S/. 198 705 si se tratara con Tocilizumab, S/. 188 534,45 si se tratara con Adalimumab, S/. 175 838,79 si se tratara con Etanercept, S/. 172 033,87 si el tratamiento fuera con Infliximab, S/. 169 263,20 si el tratamiento fuera con Abatacept y S/. 97 373,95 si fuera con Rituximab.
Entonces, el tratamiento menos costoso sería con Rituximab durante los 5 años de estudio.
La razón costo – efectividad de las alternativas (medicamentos comparadores) analizadas, nos señala que Abatacept es más costo – efectiva, es decir implicaría un uso más eficiente de recursos para lograr un mayor bienestar en la población. Así, con Abatacept cada año de vida ganado ajustado por calidad de vida costaría S/. 86 375,43.
Resultados Incrementales
Respecto de la Razón costo – efectividad incremental, nos señala que Abatacept tiene dominancia fuerte, es decir, es menos costoso y tiene una mayor efectividad, respecto de DARMEs biológicos Etanercept, Adalimumab, Infliximab y Tocilizumab.
Por otra parte, no existe dominancia de Abatacept respecto de Rituximab, pero tampoco es en sentido inverso, es decir no existe dominancia de Rituximab respecto de Abatacept. Lo que ocurre es que Abatacept es más efectivo (1,96 AVAC), pero más costoso (S/. 169 263,20) frente a Rituximab que es menos efectivo (1,01 AVAC) y menos costoso (S/. 97 373,95).
Así entonces, pasar de administrar Rituximab para ganar un año de vida ganado ajustado por calidad de vida y lograr el nivel alcanzado por Abatacept, a EsSalud le costaría un pago adicional de S/. 75 493,78 por AVAC en 5 años. Es decir un pago adicional de S/. 15 098,76 anual por paciente.
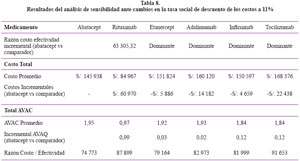
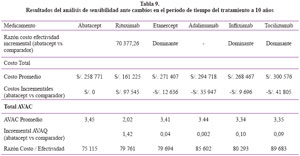
Análisis de Sensibilidad
El análisis de sensibilidad con tasa de descuento de 11% para los costos se muestra en la Tabla 8 y con un horizonte temporal de 10 años en la Tabla 9. Se realizaron dos análisis de sensibilidad entre Abatacept y los comparadores, primero se planteó un cambio en la tasa social de descuento para los costos, pasando de 3,5% a una de 11%, ello en virtud a lo señalado por el Ministerio de Economía y Finanzas del Perú para los estudios de inversión dentro del Sistema Nacional de Inversión Pública45, y segundo, se amplió el plazo de evolución llevándolo a 10 años de atención a los pacientes.
En ambos casos Abatacept continúa siendo la opción más costo – efectiva y siendo una alternativa dominante respecto a los comparadores Etanercept, Adalimumab, Infliximab y Tocilizumab. Asimismo tampoco tiene dominancia respecto de Rituximab, pero ante los cambios señalados, Abatacept es más costo efectivo.
Realizado el análisis de sensibilidad, se puede señalar la validez interna de los resultados de costo efectividad hallados en el estudio, confirmando que Abatacept es la alternativa más costo – efectiva con dominancia sobre los otros medicamentos comparadores, a excepción de Rituximab, aunque éste último no domine a Abatacept.
DISCUSIÓN
Abatacept es un modulador selectivo de la co-estimulación del linfocito T que se comercializa en Perú desde el año 2007, está aprobado en Perú, para reducir los signos y síntomas, inducir una respuesta clínica importante, inhibir la progresión del daño estructural y mejorar la función física en pacientes adultos con AR activa de grado moderado a grave que no han tenido una respuesta adecuada a uno o más DARMEs, tales como MTX o anti-TNF. Como toda terapia innovadora, se debe de establecer no sólo la efectividad a través de los estudios clínicos sino que debe de demostrar valores agregados como su costo efectividad en distintos ámbitos.
La simulación a través de modelos de costo efectividad, es ampliamente usada en estos tiempos, ya que permite reproducir la realidad y tratar virtualmente a miles de pobladores, a diferencia de los ensayos clínicos regulares en donde el reclutamiento de una muestra significativa, muchas veces es difícil.
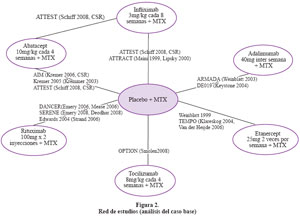
El modelo empleado en nuestro estudio, implica que los pacientes son clonados a partir de 3 secuencias de tratamiento distintas, iniciando Abatacept frente a otros DARME biológico de inicio; este modelo sitúa a Abatacept, dentro de la secuencia, en primera línea de biológico frente a falla a Metotrexato. En el estudio ATTEST, Abatacept demostró su efectividad clínica, frente a placebo, como primer biológico en comparación a Infliximab frente a placebo. El tipo de paciente óptimo para el uso de Abatacept en el contexto de EsSalud no está especificado ya que el uso de la droga depende del racional del médico reumatólogo a cargo del paciente. Un valor a resaltar es su perfil de seguridad comparable al placebo dentro del desarrollo clínico de Abatacept.
Así mismo es importante resaltar la virtud del presente estudio en donde se emplea la perspectiva de EsSalud como único financiador de la salud de la población incluida en el modelo. Es bien sabido que los financiadores de salud buscan utilizar recursos de la manera más eficiente posible, esto debe ser realizado en medida sin perjuicio de los usuarios o clientes, razón por la cual los estudios de costo-efectividad son necesarios de realizar, ya que estos no buscan señalar la alternativa más barata para tomar una decisión, sino que representan una brújula para los financiadores, en donde los recursos sean menos derrochados e invertidos de una manera racional, basado en evidencia no sólo científica sino también económica.
Bajo lo antes mencionado, nuestro estudio indica que Abatacept es el medicamento más costo - efectivo frente a los comparadores Rituximab, Etanercept, Adalimumab, Infliximab y Tocilizumab ello aplicado a la perspectiva de EsSalud como principal financiador de la salud de los pacientes del estudio.
Su costo efectividad es de S/. 86 375,43 por AVAC a lo largo de los 5 años del estudio.
El presente estudio ha sido bastante amplio al aplicar las tasas de descuento en 3,5% e incluir los costos de los medicamentos, de la atención, de la administración y de los eventos adversos.
Con respecto a la no dominancia sobre Rituximab, podemos decir que es importante recordar la perspectiva del presente estudio. De los datos revisados EsSalud, consume esta droga como genérica, razón por la cual se presenta como una alternativa menos costosa a lo largo del presente estudio y por ende una tecnología no dominada luego del análisis.
En nuestra realidad los estudios de costo efectividad no son llevados a cabo por la complejidad y los costos que involucran. La única data comparativa del uso de diferentes terapias biológicas para AR la obtenemos del estudio de Hinojosa y Battilana en el 2006 donde para la obtención de un paciente que alcance un ACR 50 con Rituximab costaría S/. 89 358 mientras que con el resto de comparadores (etanercept, infliximab y adalimumab) dicho costo fluctúa entre los S/. 123 000 hasta los S/. 210 000 aproximadamente. Definitivamente con un periodo de diferencia de 4 años, entre la publicación de tal estudio, frente a los índices obtenidos en el presente trabajo se prueba que Abatacept sigue siendo una alternativa eficiente para la inversión de los recursos destinados a la financiación del tratamiento de la AR.
El presente modelo tiene diversos puntos para discutir. Inicialmente el relacionado a la comparación con el uso de MTX. Los tratamientos comparadores fueron enteramente DARMEs biológicos y en la secuencia se aceptaba el uso de otras drogas sintéticas concomitante a la terapia biológica, pero en los diferentes estudios revisados, incluyendo el estudio AIM (base del presente modelo), existe un grupo de pacientes que recibe placebo asociado a MTX luego de una respuesta inadecuada al mismo, dicho en otras palabras que persisten fallando a MTX y continúan en tratamiento con dicha droga. Estos pacientes que tienen una respuesta fallida a MTX y que se les trata con placebo asociado a MTX muestran una mejoría ≥0,22 en el HAQ-DI en el orden del 44% luego de 1 año de tratamiento cuando hacia el sexto mes se permite el ingreso de otros DARMEs sintéticos para su tratamiento. Si bien es cierto que lo que se busca probar es la diferencia significativa entre el DARME biológico frente a placebo con MTX, hay un reducido grupo de pacientes que luego de la falla pueden responder y mejorar en poca cantidad con MTX como monoterapia.
Así mismo el análisis de sensibilidad no modifica bajo ningún escenario los resultados obtenidos con el análisis de costo-efectividad anterior. Importante de remarcar el hecho que se aplicó la tasa de descuento de 11% para los recursos y de 3,5% para la salud y se amplió el horizonte de tratamiento de 5 a 10 años. Este análisis tiene su fundamento de acuerdo a las indicaciones del Ministerio de Economía y Finanzas sobre el Sistema de Inversiones Públicas y así mismo por el tiempo de tratamiento que un paciente con AR puede llegar a recibir una terapia, considerando que hasta la fecha no existe un consenso para la descontinuación de la terapia biológica cuando el paciente ha alcanzado un estado de remisión.
CONCLUSIÓN
De acuerdo al presente modelo y los datos ingresados en el, Abatacept es dominante frente a Etanercept, Adalimumab, Infliximab y Tocilizumab, desde la perspectiva del Seguro Social de Salud (EsSalud) para el tratamiento de pacientes con AR moderada a severamente activa que han fallado a MTX.
CONFLICTOS DE INTERES:
De acuerdo a la normatividad COPE se cumple con declarar que César Benites Chacaltana es Gerente Médico de Inmunología y Virología Bristol Myers Squibb. Lima Perú. Eleonora Aiello es Gerente Regional de Economía de la Salud e Investigación de Resultados Bristol Myers Squibb. Buenos Aires, Argentina. Carolina Zingoni es Gerente Regional de Inmunología y Virología Bristol Myers Squibb. Buenos Aires, Argentina. Gert Bergman es parte de Mapi values. Trabajó como consultor de BMS y Roche en el campo de la artritis reumatoide y otras compañías farmacéuticas para otras indicaciones. Pieter Drost es Director Asociado de Economía de la Salud e Investigación de Resultados Bristol Myers Squibb. Braine-lAlleud, Bélgica.
REFERENCIAS BIBLIOGRÁFICAS
1. National institute for health and clinical excellence. Technology appraisal guidance 195: Adalimumab, etanercept, infliximab, rituximab and abatacept for the treatment of rheumatoid arthritis after the failure of a TNF inhibitor. Reino Unido: NICE 2009 ago.
2. Kenneth H. Nuevos tratamientos para la artritis reumatoidea: Drogas antireumáticas de acción lenta y prometedoras. Rev Cubana Med 2000;39(3):180-9.
3. Kvein T. Epidemiology and burden of illness of rheumatoid arthritis. Pharmacoeconomics 2004;22(1)1-12.
4. Carmona L, et al. The prevalence of rheumatoid artritis in the general population of Spain. Rheumatology 2002;41:88-95.
5. Abello M. Epidemiología e impacto de la artritis reumatoide. Rev colomb reuma 2000;7(2):82-88.
6. Valencia J et al. Epidemiología de la artritis reumatoide en el Hospital de la Fuerza Aérea del Perú mayo 1976 – junio 1992. An Fac Med 1995;56(1)13-6.
7. Gamboa R, et al. Prevalencia de enfermedades reumatológicas y discapacidad en una comunidad urbano-marginal: resultados del primer estudio COPCORD en el Perú. Rev Per Reuma 2009;15(1)40-46.
8. Quevedo H, Vidal L, Castañeda L. Artritis Reumatoide: Una enfermedad con prevalencia homogénea. Rev Per Reuma 1995;(1)1:40-1.
9. Whalley D, McKenna S, De Jong Z, Van der Heijde D. Quality of life in rheumatoid arthritis. Brit Journ Rheum 1997;36:884-888.
10. Alfaro J. En busca de un diagnóstico temprano para artritis reumatoidea. Rev Per. Reuma 2003;9:55-9.
11. Brand C, Elkadi S, Amatya B. A literature review of public health interventions for reheumatoid artritis, osteoarthritits & osteoporosis. [Internet]. Australia: Clinical epidemiology and health service evaluation unit; 2005 feb [visitado el 07 de noviembre 2010]. Disponible en http://www.health.vic.gov.au/healthpromotion/downloads/arthritis_report.pdf
12. Fan P, Leong K. The use of biological agents in the treatment of rheumatoid arthritis. Ann Acad Med Singapore 2007;36:128-34.
13. Mariette X. Emerging biological therapies in rheumatoid arthritis. Joint Bone Spine 2004;71(6):470-474.
14. Siegel J. Comparative effectiveness of treatments for rheumatoid arthritis. Ann Int Med 2008;148(2):162-163.
15. Singh R, Robinson D, El-Gabalawy H. Emerging biologic therapies in rheumatoid artritis: Cell targets and cytokines. Curr Opin Rheumatol. 2005;17(3):274-279.
16. Leombruno J, Einarson T, Keystone E. The safety of anti-tumor necrosis factor treatments in rheumatoid arthritis: meta and exposure-adjusted pooled analyses of serious adverse events. Ann Rheum Dis 2009;68:1136-1145.
17. Edwards C. Immunological therapies for rheumatoid arthritis. Br Med Bull 2005;73-74(1):71-82.
18. Shankar S, Handa R. Biological agents in rheumatoid arthritis. Jour PG Med 2004;50(4)293-299.
19. Mok C. Biological therapies for rheumatoid arthritis: beyond TNF-α blockade. APLAR Jour Rheuma 2006;9:200-205.
20. Azizul Haque M, Saifuddin Ekram A, Taikul Islam Q. Role of biological response modifiers in the treatments of rheumatoid arthritis-A review. TAJ 2004;17(1)14-20.
21. Olser N, Stein M. New drugs for rheumatoid arthritis. N Eng J Med 2004;350:2167-2179.
22. Klinkhoff A. Biological agents for rheumatoid arthritis: targeting both physical function and structural damage. Drugs 2004;64:1267-83.
23. Cabello C. Artritis reumatoide como enfermedad de alto costo. Rev Colomb Reumatol 2004;11(3):225-231.
24. Honojosa R, Battilana C. Costo global de los tratamientos para artritis reumatoidea. Rev Diag 2006; 45:31-3.
25. Chigne O, Calvo A, Berrocal A, Huamanchumo R. Costos en pacientes con artritis reumatoidea en monoterapia con metotrexate según respuesta terapéutica y calidad de vida. Rev Per Reuma 2004; 10:6-18.
26. Maquera Colque H, Romero Paca P. Estimación de costos y flujos de beneficios de las inversiones en las prestaciones de salud de alto costo [Internet]. Lima: FISSAL; 2009 jul [visitado el 03 de noviembre 2010]. Disponible en http://www.fissal.org.pe/img/Informe%20Inversion%20en%20Prestaciones%20de%20Salud%20de%20Alto%20Costo.pdf
27. Moreland LW, Alten R, Van den Bosch F, et al. Costimulatory blockade in patients with rheumatoid arthritis: a pilot dose finding, double blind, placebo controlled trial evaluating CTLA4Ig and LEA29Y eighty-five days after the first infusion. Arthritis Rheum 2002;46:1470-9.
28. Kremer JM, Westhovens R, Leon M, et al. Treatment for rheumatoid arthritis by selective inhibition of T-cell activation with protein fusion CTLA4Ig. N Eng J Med 2003;349:1970-1915-
29. Kremer JM, Dougados M, Emery P, et al. Treatment of rheumatoid arthritis with the selective costimulation modulator abatacept: twelve-month result phase IIb, double blind randomized, placebo-controlled trial. Arthritis Rheum 2005;52:2263-71.
30. Kremer JM, Genant HK, Moreland LW, et al. Effects of abatacept in patients with methotrexate.resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med 2006;144:865-76.
31. Genovese MC, Becker JC, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N Eng J Med 2005;15(353):1114
32. Genovese MC, Schiff M, Luggen M, et al. Efficacy and safety of the selective costimulation modulator abatacept following 2 years of treatment in patients with rheumatoid arthritis and an inadequate response to anti tumor necrosis factor therapy. Ann Rheum Dis 2008;67:547-54.
33. Bristol Myers Squibb. Label information for Orencia® (abatacept) approved 2005.
34. Vera-Llonch M, Massarotti E, Wolfe F, et al. Cost-effectiveness of abatacept in patients with moderately to severely active rheumatoid arthritis and inadequate response to methotrexate. Rheumatology 2008;47:535-541.
35. Russell A, Beresniak A, Bessette L, et al. Cost-effectiveness modeling of abatacep versus other biologic agents in DMARDS and anti-TNF inadequate responders for the management of moderate to severe rheumatoid arthritis. Clin Rheumatol 2009;28:403-412.
36. Yuan Y, Trivedi D, Maclean R, et al. Indirect sot-effectiveness analices of abatacept and rituximab in patients with moderate-to-severe rheumatoid arthritis in the United States. J Med Econ 2010;13(1):33-41.
37. Drummond M, OBrian B, Stoddart G, et al. Métodos de evaluación para la evaluación de los programas de asistencia sanitaria. 2da Edición 2001. Ed. Diaz de los Santos. España.
38. Badía X, Rovira J. Evaluación económica de los medicamentos: Un instrumento para la toma de decisiones en la práctica clínica y la política sanitaria. 1era Edición. 1994. Luzán S.A. España.
39. Sacristán JA, Badía X, Rovira J. Farmacoeconomía: Evaluación económica de medicamentos. 1ra edición 1995. Editores Médicos S.A. España.
40. Fries JF, Spitz PW, Youn DY. The dimensions of health outcomes: The Health Assessment Questionnaire, Disability and Pain scales. J Rheumatol 1982;9:789-93
41. Wolfe F, Mitchell DM, Sibley JT, et al. The mortality of rheumatoid arthritis. Arthritis Rheum 1994;4:481-494.
42. Bansback NJ, Brennan A, Ghatnekar O. Cost effectiveness of adalimumab in the treatment of patients with moderate to severe rheumatoid arthritis in Sweden. Ann Rheum Dis 2005; 64(7):995-1002.
43. EsSalud. Resolución de Gerencia Central de Finanzas N°028-GCF-OGA-ESSALUD-2010. Expedido Lima, 29 de marzo del 2010.
44. EsSalud. Resolución de Gerencia General N°549-GG-ESSALUD-2007. Expedido Lima, 27 de marzo 2009.
45. Ministerio de Economía y Finanzas. Directiva General del Sistema Nacional de Inversión Pública Resolución Directoral N° 009-2007-EF/68.01.Anexo SNIP 09.
CORRESPONDENCIA
Felipe Becerra Rojas
Recibido: 05/06/11
Arbitrado: Sistema por pares
Aprobado: 01/07/11