Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.29 no.2 Lima Apr./Jun. 2012
Artículo de revisión
Probióticos, prebióticos y simbióticos en el síndrome de intestino irritable
Probiotics, prebiotics, and symbiotics in the irritable bowel syndrome
Edson Guzmán Calderón1,3, Pedro Montes Teves1,2,3, Eduardo Monge Salgado1,2,3,4
1. Médico Asistente del Departamento del Aparato Digestivo del Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú.
2. Médico Asistente del Servicio de Gastroenterología del Hospital Nacional Daniel Alcides Carrión. Lima, Perú
3. Profesor de la Escuela de Medicina de la Universidad Peruana de Ciencias Aplicadas (UPC). Lima, Perú.
4. Profesor de la Facultad de Medicina la Universidad Peruana Cayetano Heredia. Lima, Perú
RESUMEN
El síndrome del intestino irritable es un trastorno común que afecta a millones de personas en todo el mundo. Dicho transtorno tiene un impacto significativo en la calidad de vida de las personas que lo padecen afectando en mayor o menor medida la esfera sociolaboral de estos individuos con el consecuente sufrimiento individual e impacto macroeconómico por aumento en las tasas de ausentismo y rendimiento laboral. Los prebióticos y probióticos son suplementos de la dieta no digerible, elementos químicos y microorganismos vivos (bacterias o levaduras de la flora comensal intestinal) que al consumirlos en volúmenes óptimos (tratamiento simbiótico), resultan beneficiosos para la salud humana. La mucosa intestinal es sin duda la mayor superficie del organismo humano expuesta al medio externo, ademas de contener una alta densidad de células inmunitarias. La alteración de la homeostasis entre los microorganismos beneficiosos y potencialmente nocivos de la microflora intestinal se expresa en un incremento del riesgo a padecer infecciones y enfermedades inmunoinflamatorias y, en este sentido, los pre y probióticos ayudan a mantener esta armonía.
Palabras clave: Prebióticos, probióticos, simbióticos, síndrome del colon irritable. (DeCS/MeSH).
SUMMARY
Irritable intestine syndrome is a common condition that affects millions of persons all over the world. It has a significant impact in the quality of life of affected persons, influencing their social and working environments and leading to individual suffering and a macroeconomic impact because of increased absenteeism and poor working performance. Prebiotics and probiotics are supplements of nondigestible diet, made up of some chemicals and live microorganisms (bacteria or yeasts from the intestinal commensal flora), which, when ingested in optimal amounts (symbiotic therapy), are beneficial for human health. With no doubt, the intestinal mucosa is the greatest surface in the human body exposed to external stimuli, and it also contains a high proportion of immune cells. Any alteration in homeostasis between beneficial and potentially harmful microorganisms in the intestinal microflora is expressed as an increased risk for the occurrence of infectious and immune and inflammatory diseases; therefore, prebiotics and probiotics may help to maintain a harmonic environment in the intestine.
Key words: Prebiotics, probiotics, symbiotics, irritable colon syndrome.(DeCS/MeSH).
INTRODUCCIÓN
El Síndrome de intestino Irritable (SII), es un desórden funcional común del tracto gastrointestinal, el cual tiene un impacto en la calidad de vida de la persona que la padece y una repercusión ulterior en el ámbito social.
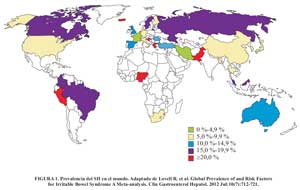
La prevalencia estimada de la enfermedad en países industrializados está entre el 15% al 20 %, por este motivo el impacto macroeconómico en la economía de los países se ve afectado ya que la enfermedad conlleva a un mayor ausentismo y disminución del rendimiento laboral. Una revisión reciente de la prevalencia global del SII , menciona que los porcentajes de prevalencia varían de acuerdo a cada país o región, así como los criterios que se usaron para su diagnóstico.
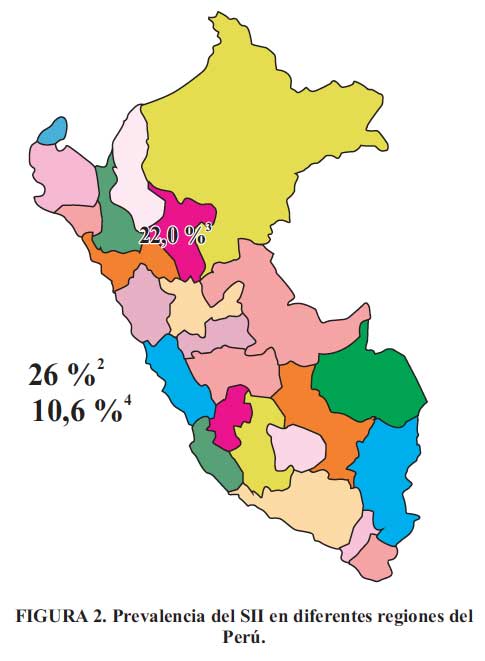
En este estudio se menciona que la prevalencia del SII en el Perú es del 24% (Figura 1); este valor es producto de estudios realizados en diferentes poblaciones y regiones del Perú. Campos Hurtado , en el 2001, estudió la asociación entre el SII y síntomas depresivos en 5 distritos de Lima con nivel socioeconómico alto, encontrando una prevalencia del 29,7 %. Curioso , en el 2002, realiza un estudio en la selva peruana, y encuentra una prevalencia del 22 %, mientras que en junio de 2006 el Dr. Prochazka hizo una encuesta siguiendo los Criterios de Roma II para detectar casos de SII entre los estudiantes de Ciencias de la UPCH; de 197 estudiantes evaluados, encontró una prevalencia general de 10,66 % (Figura 2).
DEFINICIÓN Y CARACTERÍSTICAS CLÍNICAS DEL SII
El síndrome de intestino irritable (SII) es un trastorno intestinal funcional recurrente, en ausencia de causas orgánicas detectables. Su definición se basa en que la defecación se acompaña de dolor o molestia abdominal y alteraciones del hábito del movimiento intestinal. Los síntomas no son específicos, ya que pueden presentarse ocasionalmente en cualquier individuo .
CRITERIOS DIAGNÓSTICOS
Para distinguir el SII de síntomas intestinales pasajeros, debemos tener en cuenta su naturaleza crónica y recurrente. Hay dos maneras de enfocar el diagnóstico del SII; una muy práctica, el ABC del síndrome:
a. Abdomen doloroso.
b. Balonamiento abdominal.
c. Cambio en el hábito defecatorio.
En contraparte está la más formal, que ha sido propuesta por el Consenso de Roma III, cuyos criterios diagnósticos con base en la frecuencia de aparición de dichos síntomas son:
-
Instalación de los síntomas por lo menos 6 meses antes del diagnóstico.
-
Dolor o molestia abdominal recurrente durante > 3 días por mes en los últimos 3 meses.
-
Por lo menos dos de las siguientes características:
- Mejoría del dolor con la defecación.
- Se acompaña de alteraciones de la frecuencia de las deposiciones.
- Se acompaña de variaciones de la forma de las deposiciones.
CUADRO CLÍNICO
No es fácil reconocer los síntomas del SII debido a que no hay una presentación única ni uniforme. Con la historia clínica debemos discernir primero que el problema es intestinal; y en segundo lugar, obtener datos que nos indiquen que las causas son funcionales y no orgánicas .
Los síntomas que pueden presentar los pacientes con SII, abarcan un amplio rango en la sensación subjetiva del dolor abdominal, desde cuadros leves hasta severos.
Además, pueden presentar manifestaciones como distensión abdominal, flatulencias, borborigmos y alteraciones en el hábito defecatorio, así como la sensación de evacuación incompleta y heces con mucosidad .
Además, se pueden presentar síntomas no intestinales , los pacientes pueden referir otros síntomas no explicables, usualmente del tracto gastrointestinal superior y del tracto urinario junto a los síntomas típicos del SII y al no estar anatómicamente relacionados hacen pensar en somatización y problemas psicosociales. Estos pueden ser:
- Pirosis.
- Llenura posprandial.
- Náusea.
- Síntomas urinarios como urgencia y frecuencia miccional y la sensación de vaciamiento incompleto.
- Trastornos psicológicos: ansiedad, depresión, estrés.
- Fibromialgias: 20 a 50% de los pacientes .
- Fatiga crónica: Hasta en el 51% de los pacientes con SII .
- Trastornos de la articulación temporomandibular: hasta en el 64 % .
- Dolor pélvico crónico: Hasta en el 50 % .
Clasificación del SII
De acuerdo a los criterios de Roma III , que consideran las características de las heces del paciente, el SII se puede clasificar en los siguientes grupos:
1. SII a predominio diarrea (SII-D):
- Deposiciones disminuidas de consistencia > 25% del tiempo y deposiciones duras < 25% del tiempo.
- Hasta un tercio de casos.
- Más frecuente en hombres.
2. SII a predominio constipación (SII-C):
- Deposiciones duras > 25% de las veces y deposiciones disminuidas de consistencia < 25% de las veces.
- Hasta un tercio de casos.
- Más común en mujeres.
3. SII con hábitos intestinales mixtos o patrones cíclicos (SII-M):
- Deposiciones duras y blandas > 25% de las veces.
- Un tercio a la mitad de casos.
Sin embargo, es importante mencionar que muchos de los pacientes frecuentemente pasan de un subgrupo a otro, como también en algunos pacientes con SII es frecuente que se interpreten equivocadamente los síntomas de diarrea y constipación. Existen otras subclasificaciones que pueden estar en base a:
-
Síntomas:
- SII en el que predomina la disfunción intestinal.
- SII en el que predomina el dolor.
- SII en el que predomina la hinchazón.
-
Factores precipitantes:
- Posinfeccioso (SII-PI).
- Inducido por alimentos (inducido por las comidas).
- Vinculado al estrés.
Sin embargo, excepto por el SII-PI, que está bastante bien caracterizado, aún no se ha logrado definir la pertinencia de cualquiera de estas clasificaciones con respecto al pronóstico o la respuesta al tratamiento, sin embargo esta última variedad constituye la base inicial del mecanismo fisiopatológico mediante el cual los probióticos, prebióticos y simbióticos pueden ser utilizados en el tratamiento del SII.
En países de Latinoamérica, una forma de presentación bastante común y por la cual acuden muchos pacientes a la consulta con SII es aquella en la cual predomina el balonamiento, distensión o hinchazón abdominal y es importante que el médico piense en SII cuando asista a un paciente con balonamiento crónico.
DIAGNÓSTICO DIFERENCIAL
El SII es una patología que no presenta síntomas patognomónicos por lo cual es imprescindible descartar otras enfermedades orgánicas antes de etiquetar a un paciente como SII . Las patologías que se deben diferenciar son:
- Enfermedad celiaca.
- Intolerancia a la lactosa.
- Enfermedad inflamatoria intestinal.
- Carcinoma colorrectal.
- Colitis microscópica.
- Diarrea infecciosa.
- Sobrecrecimiento bacteriano.
- Enfermedad diverticular de colon.
- Endometriosis.
- Enfermedad inflamatoria pélvica.
- Cáncer de ovario.
BASES FISIOPATOLOGICAS PARA EL TRATAMIENTO DEL SII CON PROBIÓTICOS
El mayor problema para el tratamiento del SII es el pobre conocimiento que se tiene sobre sus aspectos fisiopatológicos. Existen muchas hipótesis y muchos mecanismos descritos y se han desarrollado múltiples intentos de tratamiento poco satisfactorios para cada uno de ellos. La disregulación del eje cerebro intestino es el concepto más estudiado que a la vez se subdivide en diversas teorías ya que las señales entre el tracto gastrointestinal y el cerebro están reguladas por factores neurales, hormonales e inmunológicos, los cuales son importantes para el mantenimiento de un equilibrio de este eje, que si se altera llevaría al desarrollo de la enfermedad .
La hipersensibilidad visceral, la percepción alterada del sistema nervioso central ante el estímulo visceral, los mecanismos psicopatológicos, la inflamación y la infección son actualmente considerados importantes factores fisiopatológicos . Además de estos, la flora bacteriana cobra importancia dentro de la construcción del eje cerebro intestino, por lo cual se ha considerado como parte de los objetivos terapéuticos el uso de antibióticos y probióticos .
ROL DE LA MICROFLORA EN EL SII
La microflora gastrointestinal humana es un complejo ecosistema que comprende aproximadamente 300-500 especies bacterianas y casi 2 millones de genes ("microbioma"). El número de bacterias en el intestino es aproximadamente 10 veces mayor que la de todas las células en el cuerpo humano. Al nacer, el tracto intestinal es estéril y las bacterias entran en el intestino con la primera lactancia. Las concentraciones pueden llegar a ser altas dependiendo de la región en el tubo digestivo, llegando incluso a valores de 10 unidades formadoras de colonias/ml, sobre todo en el colon.
La microflora está compuesta principalmente de anaerobios como Bacteroides, Porphyromonas, Bifidobacterium, Lactobacillus, y Clostridium, las bacterias anaerobias sobrepasan a las aerobias en una proporción de 100-1000:1. La composición de la microflora está influenciada por la edad, la menopausia, el estrés, algunas enfermedades del colon (enfermedad inflamatoria intestinal, diarrea, colitis pseudomembranosa), la dieta, las condiciones socioeconómicas y, sobre todo, el uso de antibióticos .
Es conocido que la microflora intestinal juega un rol importante en la modulación de las funciones gastrointestinales como: la motilidad, secreción, flujo sanguíneo, permeabilidad intestinal, inmunidad de la mucosa y sensaciones viscerales. Existe un equilibrio entre la flora intestinal, el epitelio intestinal y el tejido linfoide intestinal el cual es muy importante para mantener la homeostasis intestinal .
PROBIÓTICOS
La palabra "probiótico" deriva etimológicamente del griego "por la vida". Probióticos por definición son "microorganismos vivos que, al administrarse en cantidades adecuadas, confieren un beneficio a la salud del huésped , mediante la formación de un componente mayor de la microflora intestinal, mejorando las propiedades de la microflora nativa. Las especies probióticas más conocidas son los Lactobacillus, Bifidobacterias, Saccharomyces boulardii, y Streptococcus thermophilus .
Existen las llamadas bacterias productoras de ácido láctico (BAL), una clase funcional de bacterias fermentadoras no patógenas, no toxigénicas, Gram positivas, caracterizadas por producir ácido láctico a partir de carbohidratos, lo que las hace útiles para la fermentación de alimentos. En este grupo se incluyen las especies de Lactobacillus, Lactococcus, y Streptococcus thermophilus.
Dado que el género Bifidobacterium no produce la fermentación de alimentos y es taxonómicamente diferente de las otras BAL, habitualmente no se lo agrupa entre éstas. Muchos probióticos también son BAL, pero algunos probióticos (tales como ciertas cepas de E. coli, formadoras de esporas, y levaduras usadas como probióticos) no lo son .
MECANISMO DE ACCIÓN DE LOS PROBIÓTICOS
Los probióticos actúan por diferentes mecanismos (Ver Figura 3), que podemos clasificar en:
a. Mecanismos intraluminales:
- Incrementa la secreción mucosa e inhibición de la adherencia de las bacterias patógenas.
- Acidificación del colon por fermentación de nutrientes.
b. Mecanismos epiteliales:
-Incremento de la función de barrera del epitelio.
-Disminuye la permeabilidad favoreciendo el cierre de las uniones intercelulares.
c. Mecanismo inmunomoduladores:
-Acciones inmunomoduladoras.
-Secreción de bacteriocinas.
-Estimula la respuesta mucosa al estrés.
-Inhibición de la hipersensibilidad visceral.
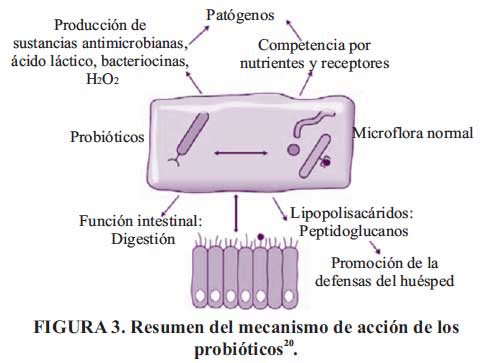
Es evidente que los probióticos tienen una potencia diferente en relación con cualquiera de estas acciones, algunos son productores ávidos de péptidos antibacterianos y puede llegar a ser participantes activos en la lucha contra ciertas infecciones; otros son potentes agentes antiinflamatorios y otros mejoran la función de la barrera epitelial a través de efectos directos sobre la expresión de la mucina, proteínas del citoesqueleto y las uniones intercelulares estrechas y efectos indirectos que emanan de las interacciones entre la bacteria, la mucosa, y el tejido linfoide asociado a la mucosa. En conclusión, el mecanismo de acción de los probióticos es multifactorial.
PREBIÓTICOS
Los prebióticos son sustancias no digeribles que brindan un efecto fisiológico beneficioso al huésped, estimulando selectivamente el crecimiento favorable o la actividad de un número limitado de bacterias autóctonas. Estas modifican el balance de la microflora intestinal, estimulando el crecimiento y/o la actividad de organismos beneficiosos y suprimiendo potencialmente bacterias nocivas. Estos suplementos incluyen lactulosa, lactitol, oligosacáridos (fructoligosacáridos o FOS y galactoligosacáridos o GOS, que son abundantes en la leche materna) fueron extraídos de varios alimentos como la achicoria, ajos, cebollas, alcachofas, etc. e inulina .
La acción de los prebióticos es promover la proliferación de las Bifidobacterias en el colon y también de algunos Lactobacilos en el intestino delgado.
En comparación con los probióticos, que introducen bacterias exógenas en el colon, los prebióticos estimulan el crecimiento preferencial de un número limitado de especies. Algunas sustancias, como los suplementos de fibra y la lactulosa, que han sido ampliamente empleados en el tratamiento del estreñimiento, ejercen efectos prebióticos.
SIMBIÓTICOS
Simbióticos son definidos como una combinación de un probiótico y un prebiótico, con el objetivo de aumentar la supervivencia y la actividad de los probióticos in vivo, así como estimular las Bifidobacterias y Lactobacilos autóctonas. Los datos de eficacia en la enfermedad humana son escasos, aunque algunos estudios pequeños en SII son prometedores .
Una condición para tales efectos, es que las bacterias ácido lácticas usadas tengan la propiedad para metabolizar simultáneamente los prebióticos suplementarios, que casi siempre no es el caso, especialmente cuando se suman diferentes oligosacáridos.
En los últimos años se están ofertando comercialmente combinaciones de prebióticos y probióticos, con diferentes tipos de formulaciones , por ejemplo:
- Probióticos con una simple cepa.
- Probióticos multicepas.
- Simbióticos con cepa única / fibra única.
- Simbióticos multicepa / multifibra.
- Reemplazo total de flora a partir de flora de individuos sanos.
LOS PROBIÓTICOS, PREBIÓTICOS Y SIMBIÓTICOS EN EL SII
El manejo del SII incluye una amplia variedad de medicamentos (antiespasmódicos, antidiarreicos, laxantes osmóticos, procinéticos y muchos más); sin embargo, como lo dice Whitehead, el nivel de satisfacción de médicos y pacientes con la terapia en uso actual no superó el 40% en el mejor de los casos. Esto hace que estemos permanentemente en busca de nuevas terapias o terapias complementarias a las ya existentes para controlar esta enfermedad .
Hay muchas bacterias que son utilizadas para la fabricación de probióticos sobre todo bacterias ácido lácticas como Lactobacillus, Bifidobacteria, Enterococcus, Streptococcus y Bacillus. La interpretación de los datos disponibles sobre los probióticos son confundidos por la variabilidad en la cepa de selección, la dosis, los excipientes y la evaluación de la viabilidad y la eficacia. Por consiguiente el control de calidad sigue siendo un verdadero problema con los probióticos ya que pueden existir dos probióticos dentro de la misma especie, pero las diferentes cepas pueden tener efectos muy diferentes, incluso antagonistas.
Aunque los estudios de los probióticos en el SII se vienen realizando desde hace varios años, sólo recientemente se ha observado que la respuesta a organismos bien caracterizados han sido evaluados en ensayos de alta calidad. Lactobacillus GG, Lactobacillus plantarum, L. acidophilus, Lactobacillus casei, el probiótico"Cóctel" de VSL # 3, y Bifidobacterium animalis, han demostrado aliviar los síntomas del SII individuales, tales como hinchazón, flatulencia y estreñimiento, pero sólo unos pocos productos han demostrado que alivian el dolor y los síntomas globales en el SII .
PROBIÓTICOS Y DOLOR ABDOMINAL
La cepa probiótica Bifidobacterium infantis 35624 (una cápsula por día) ha demostrado reducir el dolor, la hinchazón, y la dificultad en la defecación, además de normalizar el hábito de tránsito intestinal en los pacientes con SII, independientemente del hábito predominante; sin embargo, a la fecha sólo se encuentra disponible en Estados Unidos . Según la evidencia encontrada por Clarck , se observó que 20 de 34 estudios evaluados encontraron al menos algún beneficio de los probióticos sobre el placebo; la mayor evidencia como se mencionó previamente es con Bifidobacterium infantis 35624.
Otro estudio multicéntrico demostró la eficacia de los probióticos sobre el dolor abdominal y el disconfort (36 % vs 17 %) comparado con el placebo . Lactobacillus acidophilus demostró en un estudio la disminución del dolor abdominal y el disconfort de 24% con respecto al placebo , el mecanismo probable para esta respuesta se basa en que se ha demostrado que Lactobacillus acidophilus puede sobreregular los receptores y los receptores cannabinoides en las líneas celulares epiteliales colónica de roedores .
EN LA DISTENSIÓN Y BALONAMIENTO DEL SII
Se han hecho ensayos clínicos que muestran la eficacia de algunas cepas específicas, como Bifidobacterium lactis DN - 16310 y el cóctel probiótico VSL#3, para hinchazón, distensión, y flatulencia. Otros, tales como Bifidobacterium infantis 35624, reducen la hinchazón principalmente .
EN LA CONSTIPACIÓN
La cepa probiótica Bifidobacterium lactis DN- 16310 ha demostrado acelerar el tránsito gastrointestinal y aumentar la frecuencia de las deposiciones entre los pacientes con SII con constipación.
EVENTOS ADVERSOS DE LOS PROBIÓTICOS
Los eventos adversos de los probióticos son extremadamente raros. Existen series que reportan tasas < 0,1 %. En una serie de estudios se ha demostrado que la mayoría manifiestan mínima información de eventos adversos por probióticos; en un metaanálisis reportado por Mc Farland , se encontró que 17 de 20 estudios incluidos (es decir el 85 %) daban escasa información acerca de los eventos adversos de los probióticos y que en 14 mencionaron que no hubo reacciones adversas severas, sin embargo no se averiguaron los tipos de reacciones encontradas. Tres de los estudios reportaron reacciones adversas limitadas como incremento de los síntomas intestinales, epistaxis, ansiedad y angina .
CONTRAINDICACIONES
A pesar que los probióticos tienen un excelente récord de seguridad en general, se debe utilizar con precaución en pacientes con ciertas características, sobre todo recién nacidos prematuros o con inmunodeficiencia. Se examinaron los informes de casos de abscesos, de endocarditis y bacteriemia en relación con el uso de probióticos sobre todo con S. boulardii .
CONCLUSIÓN
El SII es una entidad sumamente frecuente con una etiología aún no aclarada pero donde el rol de la microflora intestinal viene adquiriendo cada día más importancia. El desequilibro de la microbiota puede llevar a cambios en la motilidad, secreción de mucus y defensinas así como a mayor permeabilidad del epitelio intestinal y colónico.
Puede asimismo conducir a inapropiadas respuestas del sistema inmune intestinal y al consecuente incremento de linfocitos y otras células inflamatorias en la mucosa colónica. Todo esto ha llevado al creciente interés en el rol que pueden cumplir los probióticos y simbióticos en el manejo del SII.
La evidencia con la que contamos sugiere que los probióticos y simbióticos pueden jugar un importante rol en el control de dolor, diarrea y balonamiento que son parte del SII.
Queremos terminar citando a Ciorba y su Guía para gastroenterólogos en el uso de probióticos, quien dice que se ha acumulado suficiente información acerca de probióticos para que sea el momento de probar su uso en una serie de entidades digestivas entre las que se encuentra el SII .
REFERENCIAS BIBLIOGRÁFICAS
1. Lovell R, Ford A. Global Prevalence of and Risk Factors for Irritable Bowel Syndrome: A Meta-analysis. Clin Gastroenterol Hepatol. 2012 ; 10(7):712-21.
2. Campos G, León Barúa R, Villarreal J. et al. Asociación entre síndrome de intestino irritable y síntomas depresivos en una población de nivel socioeconómico alto de Lima. Rev gastroenterol Perú. 2001; 3(21):198-204.
3. Curioso W, Donaires N, Bacilio C. et al. Prevalencia y asociación de la dispepsia y el síndrome de intestino irritable en una comunidad de la Selva Peruana. Rev gastroenterol Perú.2002; 2(22): 129-140.
4. Alejandro Buselleu. Sindrome de colon irritable. En: Avances en Gastroenterología y Hepatología. Lima: Alejandro Bussalleu Rivera, Alberto Ramírez Ramos, Martin Tagle Arróspide, Editores. UPCH / Sociedad Gastroenterologica del Perú ; 2008.
5. Quigley E, Fried M, Gwee K.A, et al. Guía Práctica de la Organización Mundial de Gastroenterología. Síndrome de Intestino Irritable: una perspectiva mundial. Gastroenterol. latinoam 2011; Vol 22(2): 106-118.
6. Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology.2006; 130:1480-1491.
7. The functional gastrointestinal disorders. Rome III. Ed. DA. Drossman. Degnos Associates. McLean, Virginia. USA 2006.
8. Soriano C. Sindrome de Intestino Irritable. Cuadro Clínico y Diagnóstico. Diagnóstico.[Revista en línea] 2003 setiembre - diciembre. [acceso 19 de abril de 2012]; 42 (5 y 6). Disponible en: http://www.fihu-diagnostico.org.pe/revista/numeros/2003/setdic03/227-230.html
9. Clarke G, Cryan JF, Dinan TG, et al. Review article: probiotics for the treatment of irritable bowel syndrome--focus on lactic acid bacteria. Aliment Pharmacol Ther. 2012; 35(4):403-13.
10. Forbes AL, Hunter JO. Irritable bowel syndrome. Medicine. 2007; 35: 267-71.
11. Cryan JF, O'Mahony SM. The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterol Motil. 2011; 23: 187-92.
12. Quigley EM. Changing face of irritable bowel syndrome. World J Gastroenterol. 2006; 12: 1-5.
13. Quigley EM. Antibiotics for irritable bowel syndrome: hitting the target, but what is it? Gastroenterology. 2011; 141: 391-3.
14. Quigley EM. Bacterial flora in irritable bowel syndrome: role in pathophysiology, implications for management. J Dig Dis .2007; 82-7.
15. Quigley EM, Flourie B. Probiotics and irritable bowel syndrome: a rationale for their use and an assessment of the evidence to date. Neurogastroenterol Motil. 2007; 19: 166-72.
16. Quigley EM. Probiotics in functional bowel disorders getting it right. J Clin Gastroenterol 2011; 45: 481-2.
17. Shanahan F. Probiotics in perspective. Gastroenterology. 2010; 139: 1808-12.
18. Rhee SH, Pothoulakis C, Mayer EA. Principles and clinical implications of the brain-gut-enteric microbiota axis.
19. Spiller R. Probiotics and prebiotics in irritable bowel syndrome. Aliment Pharmacol Ther. 2008; 28; 385-96.
20. Guarner F, Khan A, Garisch J. et al. Guías prácticas de la OMGE Probióticos y prebióticos. Mayo 2008.
21. Whelan K. Probiotics and prebiotics in the management of irritable bowel syndrome: a review of recent clinical trials and systematic reviews. Curr Opin Clin Nutr Metab Care. 14:581- 587.
22. Quigley EM. Prebiotics and Probiotics: Their Role in theManagement of Gastrointestinal Disorders in Adults. Nutr Clin Pract. 2012; 27: 195-200.
23. Whitehead W, Levy R, Von Korff M. The usual medical care for irritable bowel syndrome. Aliment Pharmacol Ther. 2004; 20: 1305-15.
24. Nikfar S, Rahimi R, Rahimi F, Derakhshani S, Abdollahi M. Efficacy of probiotics in irritable bowel syndrome: a metaanalysis of randomized, controlled trials. Dis Colon Rectum. 2008; 51:1775-80.
25. McFarland LV, Dublin S. Meta-analysis of probiotics for the treatment of irritable bowel syndrome. World J Gastroenterol. 2008; 14:2650-2661.
26. Hoveyda N, Heneghan C, Mahtani KR, et al. A systematic review and meta-analysis: probiotics in the treatment of irritable bowel syndrome. BMC Gastroenterol. 2009; 9:15.
27. Moayyedi P, Ford AC, Talley NJ, et al. The efficacy of probiotics in the therapy of irritable bowel syndrome: a systematic review. Gut. 2010; 59:325-32.
28. Brenner DM, Moeller MJ, Chey WD, Schoenfeld PS. The utility of probiotics in the treatment of irritable bowel syndrome: a systematic review. Am J Gastroenterol. 2009; 104:1033-49.
29. Whorwell PJ, Altringer L, Morel J, et al. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol. 2006; 101: 1581-90.
30. Sinn DH, Song JH, Kim HJ, et al. Therapeutic effect of Lactobacillus acidophilus-SDC 2012, 2013 in patients with irritable bowel syndrome. Dig Dis Sci 2008; 53: 2714-8.
31. Rousseaux C, Thuru X, Gelot A, et al.Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med. 2007; 13: 35-7.
32. McFarland L. et al. Meta-analysis of probiotics for the treatment of irritable bowel syndrome. World J Gastroenterol. 2008; 7; 14(17): 2650-61.
33. David R. Snydman. The safety of probiotics. Clin Infect Dis. 2008;46 Suppl 2: S104 S111; discussion S144-51.
34. Ciorba M. A Gastroenterologist's Guide to Probiotics. Clin Gastroenterol Hepatol. 2012. Apr 10. (Epub ahead of print).
CORRESPONDENCIA
Edson Guzmán Calderón