Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.29 n.4 Lima oct./dic. 2012
Reporte de caso
Anemia perniciosa y atrofia gástrica
Pernicious anemia and gastric athropy
Victor Mechán1 , Julio Ramírez2 , Gustavo Cerrillo3 , Luis Ticse4 , Teresa Ramos5
1. S. Hematología. Hospital Nacional Dos de Mayo (HNDM). Lima Perú.
2. Servicio de Medicina. HNDM.
3. Jefe de Servicio de Anatomía Patológica. HNDM.
4. Administración de Salud. Auditoría Médica. H. Loayza. Lima-Perú.
5. Interna de Medicina. Universidad N. Federico Villarreal. Lima-Perú.
RESUMEN
Varón de 84 años agricultor, diagnosticado el 2001 de anemia megaloblástica asociada a deficiencia de vitamina B12, polineuropatía sensitivo-motora en miembros inferiores y atrofia gástrica (AG) con metaplasia intestinal. Fue tratado con combinaciones de ácido fólico 1000 mcg y cianocobalamina 8mcg, mejora y normaliza cifras de hemoglobina trás 2 meses de terapia. Un año después, abandona el tratamiento, por sentirse mejor. La anemia y la signología de polineuropatía sensitivo motora con inadecuada percepción gustativa de los sabores normales reaparecen el 2008. Por esta época los estudios demuestran : pancitopenia, anemia megaloblástica severa, deficiencia de Vit B12, atrofia gástrica, pólipos y xantomas en la superficie gástrica, metaplasia intestinal, alteraciones de lípidos séricos, xerosis facial y máculas blancas (2-3 mm) generalizadas. Recibió tratamiento con cianocobalamina parenteral, el paciente persiste (2012) con su AG, aunque la polineuropatía sensitivo-motora desapareció y sus niveles de hemoglobina son normales
Keywords: Gastritis atrófica, anemia megaloblástica, anemia perniciosa, vitamina B12 . (DeSC)
SUMMARY
We present the case of an 84-year old male farmer, who was diagnosed in 2001 with megaloblastic anemia associated to vitamin B12 deficiency, sensory-motor polyneuropathy in his lower limbs and gastric atrophy with intestinal metaplasia. The patient was treated with a combination including 1000 mcg folic acid and 8 mcg cyanocobalamin. He improved his hemoglobin levels back to normal after 2 months of therapy. One year later, he stooped therapy because he was feeling better. In 2008, anemia and the sensorial motor polyneuropathy reappeared, together with an inadequate perception of normal flavor. At this time studies showed the following: pancytopenia, severe megaloblastic anemia, vitamin B12 deficiency, gastric atrophy, gastric polyps and xanthomas, intestinal metaplasia, serum lipid abnormalities, facial xerosis and generalized white spotted macular lesions (2-3 mm). He was treated with parenteral cyanocobalamin, and the patient now still has gastric atrophy, although the sensorial-motor polyneuropathy had disappeared and his hemoglobin levels are once again normal.
Keywords: Gastric atrophy, anemia megaloblastic, anemia pernicious, vitamin B1 (MeSH)
INTRODUCCIÓN
La deficiencia de vitamina B12 es multicausal. El término anemia perniciosa (AP), se aplica cuando la deficiencia vitamínica se asocia a atrofia gástrica crónica (AGC), inducida por mecanismos autoinmunes . Ramírez Ramos et al , tras estudiar 1406 pacientes -sin lesiones ulceradas- encontraron AG en 8,25% de estos, siendo el 78,5% positivo a H.pylori. Otro estudio realizado por Castillo et al, en 100 pacientes sin lesiones endoscópicas, detectó 14 % de casos de AG , encontrándose en este último grupo metaplasia intestinal en 80% de pacientes.
En el artículo de Castillo, se esboza una hipótesis sobre la progresión de la gastritis superficial hacia AG, siendo la secuencia menos clara la que podría conducir a un cáncer, paso en el que las intervenciones terapéuticas serían más factibles. Algunos estudios dan cuenta de 1,9 % de afectados por AP no diagnosticada en mayores de 60 años . La enfermedad que permanece silente durante muchos años, se presenta en latinos y otras razas. Habiendo sido descrita por Addison en 1847 , hoy se sabe que la AP es secundaria a la presencia de autoanticuerpos contra las células parietales y al factor intrínseco , impidiendo la absorción de la vitamina B12. Presentamos una AP que normaliza sus niveles de hemoglobina al ser tratada con ácido fólico, persistiendo sin embargo, los signos de polineuropatía sensitivo-motora (que desaparece tras la administración de cianocobalamina) y la AG. El artículo incluye una discusión del significado de la aparición de metaplasia intestinal en pacientes con anemia perniciosa y atrofia gástrica severa, distinta a la sugerida por la mayoría de patólogos.
REPORTE DE CASO
2001: Varón de 76 años, agricultor, natural y procedente de Huancayo/Sicaya/Perú, quien presenta polineuropatía sensitivo-motora, anemia, AG, agudeza visual disminuida a la visión cercana, hiporexia, disnea, sialorrea, a lo que se agrega 3 meses después, sensación de que todos los alimentos ingeridos son salados y llenura precoz. 2 meses antes de su ingreso al HNDM presentó dolor en ambos muslos que se incrementaba con la deambulación. Perdió 10 kg de peso en 1 año. FV: PA: 80/50, FC: 60/min, FR: 16/min. Peso: 43 kg. Múltiples adenopatías inguinales, bilaterales, de 1 cm de diámetro. 4 ganglios epitrocleares. Tórax, abdomen y sistema CV: Normales. Neurológico: ROT abolidos. Neuropatía periférica en ambos miembros inferiores. Exámenes auxiliares: Endoscopia digestiva alta con estómago distensible, Fondo: punteado petequial moderadosevero, marcada disminución del número de pliegues gástricos, vasos submucosos visibles. Antro con: palidez marcada, vasos submucosos visibles. Tinción para H. pylori: negativo. Hb : 5,5 gr/dl. Plaquetas : 112 000/mm3. Leucocitos : 1900/mm3. Vit B12, sérica: 68,8 pg/ml (N: 211-911). Ácido fólico en suero: 7 ng/dl (5-24). Médula ósea: anemia megaloblástica severa. Heces: Endolimax nana. Biopsia gástrica: AG severa tipo A. De alta con: dieta hiperproteíca y combinaciones de 1000 mcg de acido fólico y 8 mcg de cianocobalamina parenteral. Tras 2 meses de tratamiento: Hb: 12,6 gr/dl. Plaquetas: 289 000/mm3. Leucocitos: 6100/mm3 y sensación de bienestar, por lo que abandona el tratamiento (Ver Figura 1).
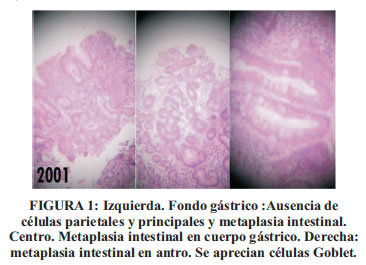
Enfermedad actual (2008)
Desde hace 2 meses presenta hiporexia, baja de peso, palidez, disnea a medianos esfuerzos, incapacidad para reconocer variedad de sabores, neuropatía periférica en miembros inferiores. Antecedentes familiares: Padre fallecido, padecía de hipertiroidismo autoinmune. Alimentación a predominio de carbohidratos, ingiere abundante café. Examen general: Adelgazado, conectado en tiempo espacio y persona, colabora con el examen. Palidez e ictericia. Lengua roja, depapilada. Piel adelgazada con áreas de xerosis y máculas blanquecinas, pequeñas (2-3 mm), generalizadas. Cabello cano, bien implantado. Escasos dientes cariados. Sistemas cardiovascular, tórax y abdomen: normal. Neurológíco: Hipoalgesia en codos y rodillas. Prueba: talón-rodilla: movimientos disminuidos asociados a discreto temblor. Hipoparestesia distal en 4 miembros. ROT disminuidos generalizados. Exámenes auxiliares: Endoscopía digestiva alta. Fondo y cuerpo: ausencia de pliegues, mucosa pálida, vasos submucosos visibles. Duodeno y 2da. porción del bulbo: normal. Biopsia de estómago: Atrofia gástrica severa, tipo A, metaplasia intestinal, ausencia de células parietales y principales en glándulas gástricas. Tinción gástrica para H.pylori: negativo. Hb: 8,1 gr/dl. Leucocitos: 3030/mm3. Plaquetas: 139 000/mm3. VCM: 131 fl (Hasta 100). Segmentados: 1878/mm3. Linfocitos: 1060/mm3. Velocidad de Sedimentacion: 90 mm/h. Polisegmentacion de neutrófilos y macroovalocitosis de G. Rojos. T de Sangria: 2 min. TP: 14,5" (N:10-14). TTP: 41" (22-50). Fibrinógeno: 413 mg/dl (200-400). Triglicéridos: 67 mg/dl (Menos de 200). Colesterol Total : 136 mg/dl (Menos de 200). HDL colesterol: 34 mg/dl (Más de 40). LDL colesterol: 13,4 mg/dl (25-40). Úrea, creatinina: Normales. Prot.totales: 6,2 gr/dl. Alb: 3,6 gr/dl. Glob :2,6 gr/dl. Bil total: 1,7 mg %. B.Directa: 0,3 mg %. B.Indir : 1,4 mg %. Orina: Hematíes: 20-30 xc. Leucocitos: 2-3 xc. Antic IgG a HIV: No reactivo. HBsAg:no reactivo. Serológicas (RPR): No reactivo. Parásitos y Thevenon: negativo. Vit. B12: 56 pg/ml (211-911/ECLIA). Ácido fólico: 11 ng/dl (5-24). Mielograma: anemia megaloblástica severa. IgA, suero : 441 mg/dl (N:70- 420). Autoanticuerpos a factor intrínseco: 35,4 UE/ml (> de 25: positivo). Autoanticuerpos a células parietales: Negativo (> de 25 UE/ml:positivo). El tratamiento fue con cianocobalamina:100 mcg IM/10 días, luego 1 mensual, normalizando los niveles de hemoglobina del paciente, mejora sustancialmente su polineuropatía sensitivo-motora, pero no los síntomas de AG (Ver Figura 2).
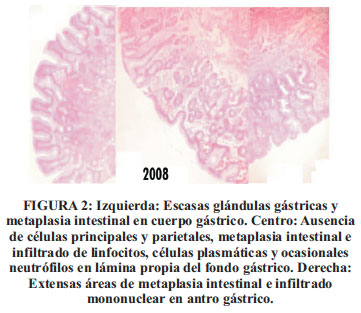
DISCUSIÓN
En primer término, presentamos este caso porque permite evolucionar una atrofia gástrica (AG), tipo A (palidez gástrica, vasos sanguíneos visibles, pérdida de pliegues mucosos, adelgazamiento de mucosa gástrica) , asociada a anemia perniciosa (anticuerpos anti-factor intrínseco, destrucción histológica visible de células parietales) hacia mayores grados de severidad (mayor adelgazamiento de la mucosa, desarrollo de pólipos y xantomas gástricos). Aunque este paciente presenta un test de anticuerpos anticélulas parietales negativo, Toh refiere que un 10% de pacientes con AP, muestran esta negatividad debido a : unión completa del anticuerpo con el antígeno -no quedando autoanticuerpos circulantesinsuficiencia de producción del anticuerpo o desaparición del anticuerpo por desaparición del antígeno en el tiempo de la medición. Es notorio en las biopsias gástricas la extensa destrucción de las células parietales.
En menores de 50 años, un número importante de casos incipientes de gastritis atrófica asociadas a deficiencia de B12, revierten con el tratamiento : restablecimiento de pliegues, engrosamiento de la mucosa gástrica porque las causas no son inmunes, sino bacterianas, parasitarias o farmacológicas. Aunque en este caso no se demostró H pylori, algunos investigadores sostienen que en un número no despreciable de casos de AG secundarias a H. pylori, la administración de cianocobalamina y antibióticos, también normaliza la deficiencia de Vit B12, revierte la incipiente AG e impide el desarrollo de metaplasia intestinal y su potencial evolución a malignidad.
La segunda razón, tiene que ver con las consecuencias de ciertas terapias vitamínicas locales. Ya sea por escasez de cianocobalamina o ignorancia, algunos profesionales prescriben medicamentos conteniendo mezclas de: 1000 mcg de acido fólico y 8 mcg de cianocobalamina, a quienes requieren exclusivamente B12. Como tales combinaciones producen rápido bienestar físico en el afectado, éste descontinúa el tratamiento. El bienestar físico es consecuencia del rápido ascenso de la hemoglobina, inducida por el ácido fólico . Estas combinaciones, sin embargo, no mejoran ni la AG, ni la degeneración subaguda combinada (DSC), de nervios craneales y periféricos, que requieren dosis diarias de 100 mcg de cianocobalamina y luego dosis más espaciadas a lo largo de un año. En el presente caso, tras la administración continua de cianocobalamina, el paciente restableció su Hb a niveles normales, desapareciendo la sintomatología DCS, persistiendo sin embargo hasta el 2012 con AG. Ante ausencia de malignización gástrica, se administrará al paciente prednisolona o azatriopina mas cianocobalamina de por vida, esperando disminuir la metaplasia intestinal e incrementar el tejido gástrico normal. Las biopsias gástricas del 2008, muestran al lado de un creciente proceso de metaplasia intestinal, incremento leve del número de glándulas gástricas (claros intentos auto-regenerativos).
La tercera razón para discutir este caso es el pleno desarrollo de metaplasia intestinal en áreas gástricas denudadas de células parietales y zimogénicas. La mayoría de investigadores opinan que el adenocarcinoma gástrico tipo intestinal es precedido por eventos histológicos, que iniciándose con una gastritis crónica difusa que eventualmente avanza hacia una AG, continúa con metaplasia intestinal, displasia (de estar implicado el H. pylori, participaría en la inducción de inflamación gástrica) y progresión final hacia cambios neoplásicos .
Contraria o alternativamente a la secuencia anterior, nosotros opinamos que la metaplasia intestinal más que un definitivo evento preneoplásico, es el último esfuerzo natural para mantener la funcionalidad de la débil y adelgazada capa gástrica, evitando su transformación en cáncer gástrico o tumores carcinoides. Aunque conocemos, por revisiones bibliográficas pertinentes, que en las AG crónicas, la totalidad de la adelgazada y agredida mucosa gástrica es terreno fértil para el desarrollo de cáncer gástrico y símiles y, que en pacientes con AP, el riesgo de cáncer gástrico se incrementa 3 a 4 veces por encima con respecto a la población general , lo real es que este paciente no solo no ha desarrollado cáncer gástrico, sino que convive con su GA, lo que concuerda con nuestra teoría.
Así, en las anemias perniciosas las células parietales gástricas destruidas por procesos autoinmunes y la respuesta natural del organismo: metaplasia intestinal gástrica, han devenido en un modelo terapéutico copiado por las intervenciones quirúrgicas de rutina actuales: extirpación del estómago canceroso y su reemplazo por intestino adyacente repleto de células intestinales, con excelentes resultados .
Tocante al origen de la metaplasia intestinal en casos de AG asociadas a AP, existen 2 posibilidades: migración de células totipotenciales intestinales de la médula ósea hacia el estómago o gesta in situ de células intestinales en fondo y cuerpo gástrico a partir de células madre preexistentes. Todo sugiere que las células gástricas sufren una transformación in situ. . Según Rubin , la metaplasia intestinal es una respuesta adaptativa a injurias crónicas (gastritis, etc), en las que se trata de suplir al epitelio gástrico deficiente, por un tejido parecido (aunque deficiente en número de células secretoras de moco y nula secreción de HCl) .
CONFLICTO DE INTERÉS
Los autores del artículo, declaramos no tener ningún conflicto de interés y que la publicación de las biopsias gástricas son conocidas y consentidas por el paciente, a quien hemos manifestado nuestro deseo de publicarlas.
REFERENCIAS BIBLIOGRÁFICAS
1.Toh B-H, Van Driel IR and Gleeson PA. Pernicious Anemia. NEJM. 1997; 337: 1441-1448.
2. Ramirez-Ramos A, Recavarren S, Arias Stella J, Gilman RH y col. Helicobacter pylori, gastritis crónica, úlcera gástrica y úlcera duodenal: Estudio de 1638 pacientes. Rev Gastroenterol Perú 1999;19: 196-201.
3. Castillo T, Navarrete J y Celestino A. Gastritis crónica y metaplasia intestinal. Rev Gastroenterol Perú 1989; 9: 123-130.
4. Carmel R. Prevalence of undiagnosed pernicious anemia in the elderly. Arch Intern Med 1996;156:1097-100.
5. Carmel R, Johnson CS. Racial patterns in pernicious anemia: early age at onset and increased frequency of intrinsic-factor antibody in black women.N Engl J Med 1978;298:647-50.
6. Castle WB. Development of knowledge concerning the gastric intrinsic factor and its relation to pernicious anemia. N Engl J Med 1953;249:603-14.
7. Taylor KB. Inhibition of intrinsic factor by pernicious anaemia sera. Lancet 1959;2:106-8.
8. Taylor KB, Roitt IM, Doniach D, Couchman KG, Shapland C. Autoimmune phenomena in pernicious anaemia: gastric antibodies. BMJ 1962; 2:1347-52.
9.- KR Dholakia, TS Dharmarajan, D Yadav, S Oiseth, EP Norkus, CS Pitchumoni. Vitamin B12 deficiency and gastric histopathology in older patients. World Journal Gastrenterology. 2005. 11 (45): 7078-7983.
10. KR Dholakia, TS Dharmarajan, D Yadav, S Oiseth, EP Norkus, CS Pitchumoni. Vitamin B12 deficiency and gastric histopathology in older patients. World Journal Gastrenterology. 2005. 11 (45): 7078-7983.
11. Hala MT El-Zimaity. Gastric atrophy, diagnosing and staging. World J Gastroenterol 2006 September 28; 12(36): 5757-5762 .
12. Rosch W, Demling L, Elster K. Is chronic gastritis a reversible process? Follow-up study of gastritis by step-wise biopsy. Acta Hepatogastroenterol (Stuttg) 1975; 22: 252-255.
13. Ayala E, Frisancho O y Chacón YP. Cambios histológicos del íleon distal en diarrea crónica asociada con anemia megaloblástica. Rev. Gastroenterologia del Perú.2004;24:117- 121.
14. Meyer M Leo. Folic acid in the treatment of perniciuous anemia.1947.2:50-62.
15. James G. Fox and Timothy C. Wang. Inflammation, atrophy, and gastric cancer . J Clin Invest. 2007;117(1):60-69
16. Chacaltana A; Rodríguez C; Urday C; Ramon W ; Espinoza J ; Héctor Velarde H et al. Lesiones gástricas preneoplásicas y H. pylori en despistaje endoscópico para cáncer gástrico en población de nivel socioeconómico medio y alto. Rev. gastroenterol. Perú. 2009;29 (3):218-225.
17. Pérez TE; Abdo FJM, Zavala SMR, Badillo VGY, Casillas GGB. Tratamiento quirúrgico del cáncer gástrico en el Servicio de Gastroenterología del Hospital General de México. REVISTA MEDICA DEL HOSPITAL GENERAL.2010; 73 (1): 9 - 15.
18. Rubin Enmanuel, Farber L John. Essential Pathology. 1990. JB Lippincot Company Philadelphia/New York.
19. Silva S, Filipe MI, Pinho A. Variants of intestinal metaplasia in the evolution of chronic atrophic gastritis and gastric ulcer. A follow up study. Gut 1990; 31: 1097-1104.
CORRESPONDENCIA
Victor Mechan Mendez













