Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.29 n.4 Lima oct./dic. 2012
Artículo de revisión
Actualización en el tratamiento de la Hepatitis C
An update in the therapy of hepatitis C
Javier Díaz Ferrer1
1. Servicio de Hepatología HNERM
RESUMEN
La hepatitis C es una enfermedad infectocontagiosa causada por 6 genotipos del virus del virus del mismo nombre que pueder responder de manera distinta al tratamiento. El virus de 30 a 38 nm de tamaño, posee una envoltura y una sola cadena de ARN (+), pertenciendo a la familia Flaviviridae. La hepatitis C constituye una grave problema de salud pública se calcula que las tasas de infectados en la mayoría de los países se encuentra entre el 1,5 y el 3 %, siendo su tratamiento complejo.
Palabras clave: Hepatitis C, salud pública, terapeútica. (DeSC)
SUMMARY
Hepatitis C is a communicable disease caused by 6 genotypes of the hepatitis C virus, and this condition may have a variable response to therapy. Viral particles are 30-38 nm long, they have an envelope and single-stranded RNA. The virus belongs to the Flaviviridae family. Hepatitis C is a severe public health problem. It has been estimated that the rate of infected persons in most of the countries lies between 1,5 to 3 per cent, and its therapy is quite complex.
Keywords: Hepatitis C, public health, therapy. (MeSH)
INTRODUCCIÓN
La infección por el virus de la Hepatitis C (VHC) es un problema de salud pública alrededor del mundo, las tasas de infectados crónicamente oscilan en la mayoría de los países entre el 1,5 y el 3 % . En nuestro país, aunque no existen datos en la población general, se han reportado cifras de 1,16 % en trabajadores de salud y creemos que estas cifras podrían incrementarse en los siguientes años.
Hasta hace poco tiempo, el tratamiento convencional para la infección por VHC era la combinación de Interferón pegilado (PEG IFN) y Ribavirina (RBV); con esta terapia dual se lograba una Respuesta Virológica Sostenida (RVS) en aproximadamente 42-52 % de pacientes infectados con genotipo 1 y de 67-84 % en pacientes infectados con genotipos 2 y 3; la duración del tratamiento era usualmente 48 semanas para la infección por VHC genotipo 1 y 24 semanas para VHC genotipos 2 y 3. Sin embargo, a partir del 2011, fueron aprobados por la Food and Drug Administration (FDA) y European Medicines Agency (EMA), dos nuevos medicamentos (Telaprevir y Boceprevir) antivirales de acción directa (AAD) que son inhibidores de la proteasa para el tratamiento de la Hepatitis crónica C Genotipo 1.
Actualmente el tratamiento consiste en terapia triple que, además de PEG IFN y RBV, incluye una antiproteasa frente a la proteasa NS3/4 del VHC. Con este nuevo esquema de tratamiento, se logrará obtener una tasa de curación del 75% en los enfermos que no habían recibido nunca ningún tratamiento (enfermos naïve) y del 50 % en los que había fracasado un tratamiento previo .
Los AAD no están actualmente indicados en el tratamiento de la Hepatitis crónica C causada por otros genotipos que no sean genotipo 1.
La terapia triple tiene una eficacia superior a la del tratamiento clásico (PEG-IFN + RBV), pero ocasiona más efectos secundarios, lo que implica la necesidad de una evaluación más completa de los pacientes quienes se tienen que tratar en centros especializados y un seguimiento más frecuente. Estos hechos pueden tener un impacto negativo en los centros que atienden pacientes con Hepatitis C, porque pueden verse sometidos a una mayor presión asistencial a la actual, ya que deberán de atender pacientes con Hepatitis crónica C que se vayan diagnosticando y que tendrán que ser evaluados ante la posibilidad de recibir terapia triple, además de los pacientes que fracasaron a un tratamiento previo con PEG IFN y RBV y siguen siendo evaluados en la consulta externa de los hospitales.
La incorporación de AAD incrementará la eficacia y acortará la duración del tratamiento, pero también aumentará notablemente el costo, el número y la intensidad de sus efectos adversos. En consecuencia, parece razonable hacer una reflexión sobre que forma permitiría la máxima eficiencia y la mayor seguridad de los pacientes (prevención de los efectos adversos y acción lo más rápida posible cuando aparezcan). Es responsabilidad de la comunidad médica establecer las normas y fijar las recomendaciones; pero seguirlas, es una obligación ética individual de los médicos. La máxima eficiencia se conseguirá aplicando las siguientes medidas: 1) Prescribir el tratamiento convencional (PEG IFN y RBV), sin añadir AAD, a los pacientes que tienen muchas posibilidades de curarse con el tratamiento doble (IL28 CC, Fibrosis F0-F1 y baja carga viral), 2) Prescribir el tratamiento triple a los pacientes que seguramente no presentarían una respuesta viral sostenida con tratamiento convencional (IL28 TT, Fibrosis F3-F4, carga viral alta). La máxima seguridad se puede conseguir de la siguiente manera: 1) Cumpliendo con las indicaciones de la ficha técnica, en cuanto a las contraindicaciones absolutas y relativas de los AAD, y 2) Cumplir con los criterios de suspensión del tratamiento. Especial relevancia tiene la valoración de interacciones potenciales con otros fármacos, que pueden contraindicar el tratamiento o exigir ajustar las dosis, y la posibilidad de consulta con especialistas que puedan abordar el manejo de problemas extrahepáticos, como depresión o manifestaciones cutáneas.
Evaluación clínica de los enfermos con Hepatitis crónica C previa a la decisión de tratamiento
La buena praxis médica justifica las siguientes consideraciones, cuando nos encontramos frente a un paciente con Hepatitis crónica C en quien se prevée la aplicación de un tratamiento antiviral: 1) Determinación del genotipo del virus y de la carga viral para establecer la estrategia terapéutica más conveniente, 2) Estimación del grado de fibrosis hepática del paciente, a través de cualquiera de los siguientes procedimientos: a) Biopsia hepática reciente, aplicando un sistema de puntuación histológica de la fibrosis como METAVIR u otro, b) Fibroscan (aún no disponible en nuestro medio) considerando que hay fibrosis significativa a partir de un valor de 7,6 kPa, c) Alguno de los métodos bioquímicos indirectos de uso común (Fibrotest, APRI, Forns, etc) , 3) Determinar el polimorfismo de la IL 28 B para saber si el paciente presenta el genotipo favorable (CC) que se asocia a una mayor respuesta al tratamiento con PEG IFN + RBV, u otro no favorable (los genotipos CT y TT) , 4) Clasificar los enfermos con hepatitis crónica C en alguna de las siguientes categorías, según si habían recibido o no un tratamiento previo con PEG IFN y RBV y, en caso afirmativo, cuál fue el resultado: a) Enfermos previamente no tratados o naïve, b) Recaídas después de un tratamiento previo con PEG IFN + RBV, c) No respondedores con respuesta parcial y No respondedores absolutos (respondedores nulos) a PEG IFN + RBV
Telaprevir (TVR)
Los ensayos clínicos en fase III han demostrado unas tasas de RVS del 75 % con la combinación T12PR24/48 (Telaprevir, Interferón pegilado y Ribavirina durante 12 semanas seguidas de otras 12 ó 36 semanas de PR en pacientes nunca tratados previamente [naïve]) . En pacientes previamente respondedores nulos, respondedores parciales o con recaída a tratamientos previos, la combinación T12PR48 (triple terapia durante 12 semanas seguidas de 36 semanas de PR) obtuvo tasas de RVS del 26, 59 y 83 %, respectivamente . Las tasas de respuesta fueron inferiores en pacientes con fibrosis avanzada o cirrosis, que en general se benefician de pautas más largas de tratamiento. Así pues, la pauta recomendada de tratamiento con Telaprevir incluye 12 semanas de triple terapia, seguidas de 12-36 semanas más de Interferón pegilado y Ribavirina en función de la existencia y respuesta a tratamientos previos y el estadio de fibrosis basal , tal como se muestra en la Figura 1. La dosis aprobada de Telaprevir es de 750 mg cada 8 h y el fármaco está disponible en comprimidos de 375 mg, por lo que al tratamiento estándar con Interferón pegilado y Ribavirina se deberán añadir 6 nuevos comprimidos. Los niveles séricos de Telaprevir aumentan de una manera muy importante cuando se ingiere con una comida calórica, recomendándose por lo tanto, tomar la medicación con una pequeña cantidad de alimentos ricos en grasas .
Boceprevir (BOC)
Los ensayos en fase III de Boceprevir mostraron que la combinación durante 24 - 44 semanas de Boceprevir, Interferón pegilado y Ribavirina (BOC-PR) precedida de una fase de lead-in de 4 semanas de PR resulta en tasas de RVS del 67 % en pacientes no tratados previamente; mientras que, BOC-PR durante 32-44 semanas precedida de 4 semanas de lead-in obtuvo tasas de RVS del 69-75 % en pacientes con recaída a tratamientos previos con PR, y del 40-52% en pacientes con respuesta parcial a previos tratamientos con PR (no se incluyeron pacientes con respuesta nula previa en los estudios con Boceprevir) .
De manera similar a la triple terapia con Telaprevir, los pacientes con fibrosis más avanzada presentaron una menor respuesta al tratamiento, por lo que en este grupo de pacientes se recomiendan pautas más largas de terapia. En estos estudios se objetivó, que el descenso en la carga viral de más de un logaritmo, tras el periodo de 4 semanas de PR (lead-in) es un buen predictor de RVS, especialmente en pacientes no respondedores a un tratamiento previo, por lo que la cinética viral durante esta fase podría utilizarse como criterio para decidir la duración del tratamiento triple o incluso si éste no está indicado (p. ej., en pacientes cirróticos con caída de la carga viral menor a un logaritmo en estas 4 semanas de lead-in, cuyas probabilidades de respuesta con triple terapia están probablemente en torno al 10-15 %).
En la figura 2 se presenta la pauta recomendada de tratamiento triple con Boceprevir. Boceprevir está disponible en forma de cápsulas duras de 200 mg y la dosis aprobada es de 800 mg cada 8 h combinado con Interferón pegilado alfa-2b y Ribavirina, por lo que el tratamiento supone añadir 12 cápsulas al tratamiento habitual durante 24, 32 ó 44 semanas en función de la cinética de aclaramiento viral, del grado de fibrosis basal y si el paciente había recibido o no tratamientos previos . La ingesta con alimentos aumenta la exposición al fármaco, por lo que se recomienda tomar la medicación con algo de comida que no debe tener ninguna composición especial . Como se explicará más adelante, los riesgos que supone la falta de respuesta, hacen que sea extremadamente importante que los pacientes esten concientes de la importancia de cumplir correctamente la dosis indicada del tratamiento con inhibidores de proteasa. Por este motivo, el compromiso del médico en asegurar la adherencia al régimen prescrito, es de gran relevancia. Para ello, además de valorar la potencial aparición de efectos adversos, es recomendable realizar frecuentes visitas de seguimiento en los pacientes con tratamiento triple, siendo éstas especialmente importantes en las primeras semanas del tratamiento. En general, sería recomendable evaluar a los pacientes al menos en las semanas 2, 4, 8 y 12 luego de iniciar la terapia triple, mientras que posteriormente la frecuencia de las visitas se podría realizar cada 4-8 semanas, si no se producen efectos adversos relevantes.
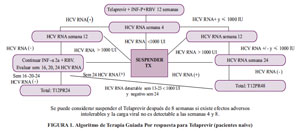
Diferencias en el Paradigma del tratamiento
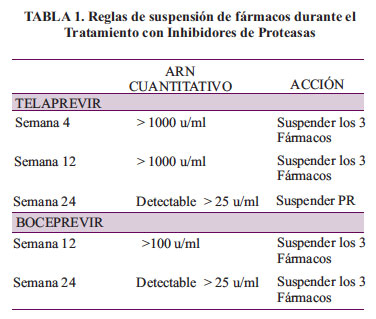
Una de las principales diferencias, es el hecho de que Telaprevir es iniciado junto con PEG IFN y RBV y es usado sólo por 12 semanas; en tanto que, Boceprevir se inicia después de 4 semanas de INF-P/RIB, midiendo la carga viral a la semana 4, para valorar la respuesta al Interferón. En ambos, Telaprevir y Boceprevir, los estudios demuestran que el VHC-ARN no detectable a la semana 4 tiene una muy alta tasa de respuesta virológica sostenida, muy semejante a la de la terapia doble con PEG IFN y RBV, por lo que siempre se debe preguntar "si en estos pacientes es necesaria la terapia triple ". Otra diferencia importante son las pautas de suspensión del tratamiento, que se muestran en la tabla1.
Interacciones Medicamentosas
Dado el hecho de que los pacientes con Hepatitis C, reciben frecuentemente otros tipos de medicamentos adicionales a los propios de su tratamiento por VHC y debido a que los Inhibidores de proteasas (IP) pueden inhibir la enzimas hepáticas asociadas al metabolismo de drogas como la citocromo P450 2C (CYP2C), CYP3A4, o CYP1A, ambos BOC y TVR, han sido estudiadas por sus potenciales interacciones con drogas coadministradas. Estas incluyen: estatinas, inmunosupresores, drogas usadas para tratar la coinfección VIH, gastrocinéticos, ansiolíticos, etc. De tal modo que algunas de estas drogas, pueden ser contraindicadas si van a ser administradas simultáneamente, tal sería el caso para : amiodarona, astemizol y sildenafilo (que pueden provocar arritmia cardiaca), ergotamina (Isquemia periférica), lovastatina, atorvastatina, simvastatina (rabdomiolisis) o midazolam (depresión respiratoria) . Es particularmente importante, que el médico que va a iniciar tratamiento triple pueda conocer esta información.
Efectos Adversos
Los efectos adversos ocurren más frecuentemente en pacientes tratados con IP, que en los tratados con INF-P y RBV. En los estudios con BOC, anemia y disgeusia han sido los efectos adversos más frecuentes y en los estudios con RVT fueron los más comunes rash, prurito, náusea y diarrea; el rash fue típicamente eczematoso y maculopapular, leve o moderado en la gran mayoría de los casos, pero en cerca de 1% de los pacientes pueden desarrollar un síndrome de Steven Johnson o un síndrome de DRESS (Drug-Related Eruption with Systemic Symptoms) , que obliga a la suspensión del tratamiento. El monitoreo cercano de los pacientes y el conocimiento de los efectos adversos posibles, permitirán al médico oportuna identificación y correcto manejo, tratando en la medida de lo posible evitar la suspensión de los medicamentos.
Costo
Una consideración importante, a tener en cuenta, es el costo de estos nuevos medicamentos y aunque aún no sabemos los costos de comercialización en nuestro país, en EEUU para el Telaprevir es de alrededor de 50,000 USD, para las 12 semanas de tratamiento y de 1,100 USD por semana ó $ 26400, $ 35200 y $48400 para 24, 32 y 44 semanas de tratamiento respectivamente ; por lo que el costo podría ser similar en pacientes que requieren 44 semanas de tratamiento con Boceprevir, pero significativamente menor en pacientes que se beneficiarían de terapias acortadas y que recibirían 24 semanas determinadas por una RVR o un polimorfismo genético positivo (CC), datos muy importantes a tener en cuenta en países o pacientes con limitados recursos económicos.
CONCLUSIONES
Los nuevos esquemas de tratamiento que incluirán PEGIFN, RBV y un inhibidor de la proteasa como Telaprevir o Boceprevir resultarán en mejores tasas de respuesta que nos permitirán ver con optimismo la posibilidad de curación en nuestros pacientes; sin embargo, para conseguir este objetivo debemos tener en cuenta los efectos adversos, así como las interacciones de estas nuevas drogas y respetar las reglas que obligan a su suspensión a fin de evitar futuras resistencias. Del mismo modo, los médicos estamos obligados a realizar una adecuada selección de los pacientes que serían los mejores candidatos para recibir estos tratamientos, debido a los costos considerables, para países como el nuestro.
GLOSARIO DE TÉRMINOS
- Respuesta Virológica Rápida (RVR): Carga viral no detectable a la semana 4 del tratamiento.
- Respuesta Virológica Temprana (RVT): Carga viral no detectable a la semana 12 del tratamiento.
- Respuesta Virológica al Final del Tratamiento (RVFT): carga viral no detectable al finalizar el tratamiento
- Respuesta Virológica Sostenida (RVS): Carga viral no detectable 24 semanas después de finalizado el tratamiento
REFERENCIAS BIBLIOGRÁFICAS
1. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol. 2011;55:245-64.
2. Bruguera M, Esteban R, Forns X, Planas R, Quer JC, Sola R, Vergara M. Documento de posicionamiento de la Societat Catalana de Digestología: tratamiento triple de la hepatitis crónica C genotipo 1. Gastroenterología y Hepatología.2012 ;35( 9): 667-674
3. Ghany M, Nelson D, Strader B,Thomas Dand Seeff L. An Update on Treatment of Genotype 1 Chronic Hepatitis C Virus Infection: 2011 Practice Guideline by the American Association for the Study of Liver Diseases. Hepatology. 2011; 54( 4)1433- 44
4. Colichón Yeroch A, Figueroa R, Moreno A, et al. Serologic prevalence of HCV antibodies in health personnel in Perú. Rev Gastroenterol Perú.2004:24:13-20
5. Crespo G y Lens S. Uso de boceprevir y telaprevir en pacientes con VHC (aspectos prácticos). Gastroenterol Hepatol. 2012;35(5):337---343
6. Jacobson IM, McHutchison JG, Dusheiko G, Di Bisceglie AM, Reddy KR, Bzowej NH, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med. 2011;364:240516.
7. Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med. 2011;364:2417-28.
8. Shiffman M, and Esteban R. Triple therapy for HCV genotype 1 infection: telaprevir or boceprevir? .Liver International.2012; 32: supl.32-38
9. Poordad F, McCone Jr J, Bacon BR, Bruno S, Manns MP, Sulkowski MS, et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med. 2011;364:1195---206.
10. Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med. 2011;364:1207---17.
11. Kwo PY, Lawitz EJ, McCone J, Schiff ER, Vierling JM, Pound D, et al. Efficacy of boceprevir, an NS3 protease inhibitor, in combination with peginterferon alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis C infection (SPRINT-1): an open-label, randomised, multicentre phase 2 trial. Lancet. 2010;376:705-16.
12. Boceprevir (Victrelis®). Información de producto. Disponible en www.ema.europa.eu
13. Carrión JA, Navasa M, Buti M, Torras X, Xiol X, Vergara M, Planas R, Solà R, Forns X. Elastografía hepática. Documento de posición de la Sociedad catalana de Digestologia. Gastroenterol Hepatol. 2011;34:504---10.
14. Castéra L, Sebastiani G, Le Bail B, de Lédinghen V, Couzigou P, Alberti A. J Hepatol. 2010 Feb;52:191---8; Prospective comparison of two algorithms combining noninvasive methods for staging liver fibrosis in chronic hepatitis C. Gastroenterology. 2011 Jun;140:1970-9.
15. Martínez SM, Crespo G, Navasa M, Forns X. IL28B polymorphisms and chronic hepatitis C. Hepatology. 2011;53:325-335.
16. Arun B. Jesudian, Gambarin-Gelwan, and Jacobson I. Advances in the Treatment of Hepatitis C Virus Infection. Gastroenterology & Hepatology.2012; 8:91-101
17. US Food and Drug Administration. Information for patients and patient advocates: Approval of Victrelis (boceprevir) a direct actingantiviral drug (DAA) to treat hepatitis C virus (HCV). http://www.da.gov/ForConsumers/ByAudience/ForPatientAdvocates.
18. US Food and Drug Administration. Information for patients and patient advocates: Approval of Incivek (telaprevir), a direct actingantiviral drug (DAA) to treat hepatitis C (HCV). http://www.fda.gov/ForConsumers/ByAudience/ForPatientAdvocates.
19. Lange CM, Sarrazin C, Zeuzem S. Specifically targeted anti-viral therapy for hepatitis C-a new era in therapy. Aliment Pharmacol Ther. 2010;32:14-28.
20. Sherman KE, Flamm SL, Afdhal NH, Nelson DR, Sulkowski MS, Everson GT, et al. Telaprevir in combination with peginterferon alfa2a and ribavirin for 24 or 48 weeks in treatment-na?ve genotype 1 HCV patients who achieved an extended rapid viral response: Final results of phase 3 ILLUMINATE Study . Hepatology 2010;52:106ª
21. Leise D M,Ray Kim,Canterbury K, and Poterucha J. Drug Therapy: Telaprevir. HEPATOLOGY;2011: 54:1463-1469
22. Liapakis A and Jacobson I. Telaprevir user's guide. Liver International.2012; 32:supls1: 17-26
23.Maddur H and Kwo P. Boceprevir. Hepatology.2011; 54:2254-2257
CORRESPONDENCIA
Javier Díaz Ferrer













