Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana vol.30 no.4 Lima oct./dic. 2013
Artículo original
Factores de riesgo asociados a mortalidad por nueva influenza A (H1N1) en la región Cusco-Perú
Risk factors associated to mortality by novel Influenza A (H1N1) in Cusco-Peru
Pablo F. Grajeda Annca , Oscar Filipo Niño de Guzmán1,2, Manuel Montoya Lizarraga1,3, Yuri Guevara Fernández1
1. Universidad Nacional San Antonio Abad del Cusco. Cusco. Perú.
2. Hospital Antonio Lorena del Cusco. La Convención. Cusco. Perú.
3. Hospital Regional del Cusco. Cusco. Perú.
4. FETP Perú
RESUMEN
Introducción: En la Región Cusco durante el 2009, se reportaron 395 casos confirmados de nueva influenza A(H1N1) y 15 defunciones. La tasa de letalidad del 3.8%, estuvo muy por encima de reportes nacionales e internacionales, constituyéndose en serio problema de salud pública. Objetivo: Determinar los factores de riesgo asociados a mortalidad por nueva influenza A(H1N1). Material y metodo: Se realizo un estudio de Casos y Controles en 3 Hospitales de la ciudad del Cusco, entre las Semanas Epidemiológicas 18-34, 2009. Se identificaron 15 casos y 45 controles confirmados por PCRtr. Considerándose caso todo caso confirmado de nueva influenza A(H1N1), hospitalizado y fallecido y control, todo caso confirmado de nueva influenza A(H1N1), hospitalizado y dado de alta vivo. Resultados: De 24 factores de riesgo asociados a mortalidad por Nueva influenza A(H1N1) estudiados, se identificaron los siguientes: Tiempo de inicio de tratamiento antiviral mayor de 3 días (p=0.001); tiempo de terapia corticoide mayor de 5 días (p=0.00001); tiempo de (p=0.0003) hospitalización mayor de 7 días (p=0.0003); tiempo de terapia antibiótica mayor de 10 días (p=0.0001); tiempo de medidas de soporte mayor de 10 días (p=0.001); compromiso de conciencia moderadograve según Score APACHE II (p=0.0000000); hipertensión arterial (p=0.001); anemia (p=0.01); hipokalemia (p=0.01); hipoxia (p=0.0005) y leucocitosis (p=0.01). El análisis de regresión logística mostró que un sujeto incluido en el estudio con terapia antibiótica mayor de 10 días (p<0.007), tiempo de terapia corticoide mayor de 5 días (p<0.05) e inicio del tratamiento antiviral mayor de 3 días (p<0.05) tuvo elevada probabilidad de morir del 84%. Conclusiones: Los factores de riesgo más importantes para mortalidad por nueva influenza A(H1N1) identificados fueron: Inicio del tratamiento antiviral mayor de 3 días, tiempo de terapia corticoide mayor de 5 días y terapia antibiótica mayor de 10 días; habiéndose comunicado los resultados de la investigación al personal de salud, se observó el mejoramiento de la identificación temprana de estos factores de riesgo e intervenir sobre ellos o tratar de evitarlos y mejorar los procesos de calidad de atención de los pacientes; no habiéndose presentado ninguna otra muerte durante el 2009.
Palabras claves: Virus de la influenza A, influenza aviar, gripe humana, subtipo H1N1 del virus de la influenza A, control de riesgos. (DeSC).
RESUMEN
Introduction: 395 confirmed cases of new influenza A (H1N1) cases and 15 deaths were reported in the Cusco Region during 2009. The case fatality rate of 3.8%, was well above national and international reports, becoming serious public health problem. Objective: To determine the risk factors associated with mortality novel influenza A (H1N1). Material and methods: a study of cases and controls was conducted in 3 hospitals in the city of Cusco, between Epidemiological Weeks 18-34, 2009. 15 confirmed cases and 45 controls were identified PCRtr. Considering "case" all confirmed case of novel influenza A (H1N1) hospitalized and died and "control" means a confirmed case of novel influenza A (H1N1) hospitalized and discharged alive. Results: Of 24 risk factors associated with mortality from New influenza A (H1N1) studied, the following were identified: start time greater antiviral treatment of 3 days (p = 0.001), while higher corticosteroid therapy 5 days (p = 0.00001), time (p = 0.0003) increased hospitalization of 7 days (p = 0.0003), time of antibiotic therapy greater than 10 days (p = 0.0001), time measures more support 10 days (p = 0.001) , moderate to severe commitment consciousness as APACHE II Score (p = 0.0000000), hypertension (p = 0.001), anemia (p = 0.01), hypokalemia (p = 0.01), hypoxia (p = 0.0005) and leukocytosis (p = 0.01). The logistic regression analysis showed that a subject included in the study more than 10 days antibiotic therapy (p <0.007), while higher corticosteroid therapy 5 days (p <0.05) and initiation of antiviral treatment more than 3 days (p <0.05) had high probability of death of 84%. Conclusions: The most important risk factors for mortality novel influenza A (H1N1) were identified: Home antiviral treatment more than 3 days, more time corticosteroid therapy 5 days and more 10 days antibiotic therapy, having communicated the results of research to health workers, improving early identification of these risk factors and intervene on them or try to avoid them and improve the quality of care processes of patients was observed, not having submitted any other death in 2009.
Keywords: Influenza A virus, Influenza in Birds, influenza Human, Influenza A Virus, H1N1 Subtype,Risk Management. (MeSH).
INTRODUCCIÓN
La influenza estacional es una de las enfermedades infecciosas que produce cada año una elevada carga de enfermedad, en virtud de las epidemias que ocasiona en todo el mundo.
A fines del siglo pasado, en 1997, se empezaron a presentar en países del sureste asiático casos de influenza humana producidos por el virus de la influenza A (H5N1) de origen aviar, con una letalidad muy alta. Desde entonces, la amenaza de una pandemia de influenza producida por ese virus ha estado latente, a pesar de que hasta ahora se ha reportado su baja capacidad de transmisión de persona a persona1,2.
Entre marzo y abril del 2009, se presentaron casos de síndrome respiratorio agudo grave asociados a gripe extraña descritos en México y Estados Unidos, las que luego dieron lugar a la identificación de un nuevo sub tipo del virus influenza A, el que se transmitía de persona a persona, en forma muy similar a como se propagan los virus de la influenza estacional que se diseminó rápidamente en el orbe3. El jueves 23 de abril del 2009, la Secretaria de Salud del Gobierno de México comunicó al mundo, la aparición de una nueva enfermedad, a la que inicialmente se le denominó como gripe o influenza porcina, y luego se le dio la denominación oficial de nueva influenza A (H1N1).
El día 24 de abril, la Dirección General de Epidemiología del Ministerio de Salud del Perú, emite la alerta epidemiológica, dando a conocer esta situación, lo que generó inmediatamente la alerta epidemiológica en el ámbito de la Dirección Regional de Salud del Cusco.
En respuesta a los casos de la Nueva Influenza A (H1N1) reportados en México, la Directora General de la Organización Mundial de la Salud (OMS), Dra. Margaret Chan convocó a una reunión del Comité de Emergencias de la OMS, para que evaluara la situación, de conformidad con lo dispuesto en el Reglamento Sanitario Internacional del 2005.
La primera reunión se celebró el sábado 25 de abril del 2009, donde la OMS declaró a la epidemia como una Emergencia de Salud Pública Internacional; y el 27 de abril del 2009, elevó el nivel de alerta pandémica a Fase 4, transmisión sostenida de un nuevo virus de Influenza animal o animal-humana de persona a persona que pueda producir brotes a nivel de la comunidad de manera sostenida.
El 29 de abril del 2009, la OMS elevó a fase 5 el nivel de alerta ante una posible pandemia, a la que denomino Periodo de Alerta Pandémica. Se hizo un llamado a todos los países a estar preparados para poner en práctica sus planes de contingencia. La fase 5 se establece como: Uno o varios conglomerados más grandes, con transmisión de persona a persona aún localizada, lo cual indica que el virus se adapta cada vez mejor a los seres humanos, produciendo brotes comunitarios sostenidos en dos o más países de una región de la OMS, pero tal vez no es todavía plenamente transmisible (riesgo pandémico considerable) .
El 02 de junio del 2009, Keiji Fukuda, asesor de la Directora de la OMS, hizo por primera vez una modificación en la manera de calificar a la enfermedad y pasó a calificarla de Gravedad Moderada. La causa es que, los datos que se disponían no reflejaban el estado real de la infección.
Además, hay características que la hacen especial, se está propagando por el Norte con la llegada del calor, afecta más a menores de 60 años, los enfermos más graves (los fallecidos o que desarrollan neumonías que necesitan incluso el uso de respiradores) tienen mayoritariamente entre 20 y 40 años y una parte importante de los fallecidos no pertenecen a grupos de riesgo (ni son mayores, ni tenían enfermedades crónicas previas, ni eran mujeres embarazadas).
El 11 de junio del 2009, se celebró la Cuarta Reunión del Comité de Emergencias, el cual con la información disponible sobre la transmisión de la nueva influenza A (H1N1), llegó a la conclusión de que se cumplían los criterios que definen a una pandemia.
La Directora General de la OMS, decidió elevar el nivel de alerta de pandemia de Influenza a la fase 6, reservada para la situación más grave, la de una expansión mundial8. La fase 6 (Fase pandémica), se caracteriza por los criterios que definen la fase 5, además de brotes a escala de la comunidad en al menos otro país de una región diferente de la OMS. La declaración de ésta fase indica que está en marcha una pandemia mundial9, 10, la cual fue considerada "incontrolable".
Posteriormente se determinó que el primer caso de la nueva influenza A (H1N1) habría sido detectado el 18 de marzo del 2009 en México, extendiéndose en un mes por varios estados (Distrito Federal, Estado de México y San Luis Potosí) y luego a Estados Unidos (Texas y California), dos de estos casos iniciales de gripe inusual fueron reportados en EEUU el 18 de abril. Luego surgieron numerosos casos en otros países de pacientes que habían viajado a México, lo demás es historia que ya se conoce9.
La nueva influenza A (H1N1), es una enfermedad respiratoria aguda altamente contagiosa, que apareció por primera vez en México, en marzo del 2009; es causada por un nuevo subtipo del virus de la influenza, que no había circulado nunca en la especie humana y no tiene ninguna relación con otros virus gripales estacionales, que han afectado anteriormente o están afectando al hombre.
Este nuevo virus, en un comienzo fue mal llamado virus de la gripe o influenza porcina porque las pruebas de diagnóstico en laboratorios indicaron que muchos de los genes presentes eran muy similares a los virus de la Influenza que afectan con regularidad a los cerdos de Norteamérica.
Sin embargo, estudios adicionales han indicado que este virus es muy diferente a los que comúnmente circulan entre estos cerdos. Tiene dos genes de cepas de virus de la influenza que circulan comúnmente en cerdos en Europa y Asia, así como un gen de cepa aviar y un gen de cepa humana trasmisible al hombre, por lo que los científicos lo denominaron virus reordenado cuádruple.
En la Región Cusco, el día 30 de abril del 2009, el Comité Regional de Defensa Civil del Gobierno Regional del Cusco y del Consejo Regional de Salud Cusco aprobaron el Plan de Contingencia y Respuesta frente a la nueva influenza A (H1N1) en la Región Cusco y se declaró en emergencia de salud de la población del Cusco.
A nivel mundial, hasta el 04 de enero del 2010, se habían notificado oficialmente 13, 290 casos de fallecimiento por infección con el virus de la pandemia de la nueva nfluenza A (H1N1), en 137 de los 192 países afectados por la pandemia.
Desde el 20 de julio del 2009, ya no contamos con un número total de casos, solo los casos estudiados y comprobados, que son severos se reportan.
En América, hasta el 01 de enero del 2010, se reportaron más de 190 765 casos, y se notificaron un total de 6 880 defunciones entre los casos confirmados en 28 países de la región14,15. Así mismo en el Perú, hasta el 01 de enero del 2010, se reportaron 9 284 casos confirmados y 208 defunciones por la Nueva Influenza A (H1N1), con una letalidad de 2,24%.
Los casos están distribuidos en todos los departamentos del Perú, el mayor número ha sido reportado en Lima con 3 506 casos, seguido por Arequipa con 1 052 casos. Cusco reportó un total de 480 casos confirmados y 15 defunciones15. En el Perú, el primer caso se reportó en la ciudad de Lima, el 14 de mayo del 200916; en tanto que en Cusco, oficialmente el primer caso se reportó el 14 de junio del 2009.
La decisión de desarrollar esta investigación se dio al finalizar la Semana epidemiológica 34 del 2009, ya que entre las Semanas epidemiológicas (SE) 18-34 del 2009; en la Región Cusco, se habían reportado 395 casos confirmados de nueva influenza A (H1N1), con 15 defunciones y una alta tasa de letalidad del 3,79%; por lo que constituía un serio problema de salud pública en la Región Cusco, que requería pronta respuesta; lo que se agravaba más pues los medios de comunicación sobredimensionaron la magnitud del problema sanitario, que en un momento ocasionó pánico en la población, colapsando los servicios de salud, particularmente los hospitales por un incremento de la demanda de pacientes con síndrome gripal.
Además, la nueva influenza A (H1N1) es una enfermedad emergente sobre la cual hay que generar conocimiento sobre sus características, su evolución y particularmente sobre los factores de riesgo que estén asociados a la mortalidad; porque la infección por el virus de la nueva influenza A(H1N1), puede complicarse y dar lugar a una infección respiratoria aguda grave (IRAG) y síndrome de sistress respiratorio agudo (SDRA) que pueden ocasionar elevada morbimortalidad caracterizado por un inicio agudo, hipoxemia e infiltrados pulmonares bilaterales.
El SDRA es la respuesta del pulmón a una agresión local o sistémica, en la que se genera una inflamación local y una alteración de la coagulación, que conduce a un edema inflamatorio pulmonar; que requerirán atención intensiva, lo que podría exceder la capacidad de las unidades de cuidados intensivos y afectar la atención de otros daños a la salud.
En ese sentido, el objetivo de la presente investigación fue determinar los factores de riesgo y pronóstico asociados a la mortalidad por nueva influenza A (H1N1) en la Región Cusco, 2009.
MATERIAL Y MÉTODOS
Se desarrolló un estudio observacional, tipo de Casos y controles, en los 3 hospitales de la ciudad del Cusco (el Hospital Regional, el Hospital Antonio Lorena y el Hospital Adolfo Guevara Velasco de EsSALUD), entre las Semanas epidemiológicas 18-34 del 2009. Se identificaron un total de 15 casos y 45 controles confirmados por PCRrt.
Se considero como caso, a todo caso confirmado de nueva influenza A (H1N1), hospitalizado y fallecido; y como control, a todo caso confirmado de nueva influenza A (H1N1), hospitalizado y dado de alta vivo. La confirmación laboratorial fue hecha por el Instituto Nacional de Salud, en la ciudad de Lima.
Los factores de riesgo y pronóstico asociados a mortalidad por nueva influenza A (H1N1), estudiados fueron: sexo, grupo etario, ocupación, hábito nocivo, sobrepeso, obesidad, desnutrición, comorbilidad, gestación y puerperio, EPOC, hipertensión arterial, taquicardia, taquipnea, hipoxia, compromiso del nivel de conciencia según valoración por Escala APACHE II, tiempo de inicio del tratamiento antiviral, alcalosis y acidosis del pH arterial, hipernatremia, hiponatremia, hipokalemia, hiperkalemia, hipercreatinemia, anemia, Policitemia, leucocitosis, leucopenia, tiempo de medidas de soporte, tiempo de terapia antiviral, tiempo de hospitalización, tiempo de terapia antibióticas y tiempo de terapia corticoide.
El estudio se realizó mediante la revisión de las historias clínicas tanto de los casos como de los controles identificados; se utilizó fichas de recolección de datos validada por 03 médicos especialistas, que tenían relación con el manejo del daño en estudio.
Todos los procedimientos se realizaron en cumplimiento de las Normas Internacionales de Ética en la investigación y la Normas de Ética Médica en la investigación, establecidas por el Colegio Médico del Perú, teniendo en consideración que este estudio es de Riesgo Mínimo, se respeto la privacidad y la confidencialidad de la información.
Las limitaciones del estudio podrían de algún modo estar relacionadas sobretodo al número de casos, esto a pesar que todos los casos que llegaron a fallecer, que fueron 15 han sido considerados en el estudio; sin embargo, dado que no existía referencias en la bibliografía internacional, consideramos de importancia los resultados encontrados, y que servirán de base para estudios futuros más amplios y de diferentes naturaleza.
En base a los datos recolectados en las fichas de investigación, se realizó una base de datos en Excel MS, y para el análisis de la asociación de las variables cualitativas en estudio, se elaboró tablas tetracóricas 2x2, las que fueron analizadas a través del paquete estadístico EPI INFO 6.0, para calcular el O.R. y así evaluar la fuerza de la asociación de las variables; el Chi cuadrado (p<0,05), y los intervalos de confianza para evaluar la significancia estadística de la asociación. Se utilizo el Software Statical Package For Social Studies (SPSS) versión 17.0, para el análisis de regresión y correlación respectivos.
RESULTADOS
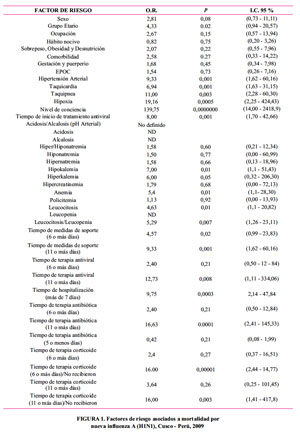
Se estudiaron 24 probables factores de riesgo y pronóstico de mortalidad. Los factores de riesgo y pronóstico identificados fueron: tiempo de inicio de tratamiento antiviral más de 3 días de iniciada la enfermedad (OR=8,00,[95% IC=1,70-42,66], p=0,001); Hipertensión arterial (OR=9,33,[95% IC=1,62-60,16], p=0,001); Taquicardia (OR=6,94,[95% IC=1,63-31,15], p=0,001); Taquipnea (OR=11,00,[95% IC=2,28-60,30], p=0,003); Hipoxia (OR=19,16,[95% IC=2,25-424,43], p=0,0005).
Compromiso de conciencia moderado-grave según Score APACHE II (OR=139,75,[95%IC=14,00-2418,9], p=0,0000000); Hipokalemia (OR=7,00,[95% IC=1,10- 51,43], p=0,01); Anemia (OR=5,40,[95% IC=1,10- 28,30], p=0,01); Leucocitosis (OR=4,63,[95% IC=1,10- 20,82], p=0,01); Tiempo de terapia corticoide mayor de 5 días (OR=16, 00, [95%IC=2, 44-14, 77] , p=0,00001).Tiempo de terapia antibiótica prolongada (OR=16,63,[95%IC=2,41-145,33], p=0,0001) y Tiempo de hospitalización mayor de 7 días (OR=9,75,[95%IC=2,14-47,84], p=0,0003).
Respecto a los hábitos nocivos, haber tenido o no hábitos nocivos en cualquier momento de la vida no mostró diferencia entre los dos grupos (OR: 0,82, CI 95%:0,20- 3,25). De los hábitos nocivos, se encontró consumo de alcohol (OR: 0,84), tabaquismo (OR: 0,93) y finalmente el consumo de café (OR: 0,70).
Respecto a estado nutricional, en este estudio encontramos que 53,3% de los casos tuvo alguna alteración en el estado nutricional (sobrepeso, obesidad y desnutrición), comparado con 26,6% de los controles (OR: 2,07 CI 95%: 0,55-7,96).
En relación con el tiempo de inicio de tratamiento antiviral, se encontró que existía asociación altamente significativa con la mortalidad (OR: 8,00 IC 95%: 1,70–42,66); asimismo el promedio de días entre el inicio del cuadro clínico y el inicio de la atención hospitalaria fue de 6,44 días, y la mediana de seis días, con un rango de 1 a 14 días de los casos.
Un total de 9 casos, 60,0% recibió atención médica hospitalaria por arriba de la mediana y dos de ellos incluso a partir del día 10.
Solo 3 de los casos, 20%, recibió atención hospitalaria en los primeros tres días (primeras 72 horas) después de iniciar con síntomas de influenza, lo que significa que 80% se hospitalizó después de las 72 horas; y sin embargo, 29 controles, 64,4% recibió terapia dentro de los 3 primeros días.
Respecto al tiempo de antibioticoterapia, se encontró similitud con el tiempo de terapia antiviral, teniendo que 80,0% de los casos recibió una terapia mayor a los 5 días, comparado con 55,5% de los controles. Sin embargo, se encontró una mayor asociación con mortalidad, cuando la terapia antibiótica era de 11 días o más (OR: 16,63 CI 95%: 2,41-145,33). El tiempo prolongado se debió también a la falta de respuesta clínica incluso usándose antibióticos como ceftazidima, vancomicina e imipenem en los casos y controles.
Después de haber realizado el análisis de regresión logística multivariada, de manera importante, se encontró que un sujeto incluido en el estudio y con terapia antibiótica prolongada (p<0,007) e inicio tardío del tratamiento antiviral (p<0,05) tiene una elevada probabilidad de morir (84%).
Sobre el tiempo de oxigenación y ventilación mecánica, encontramos que el total de casos recibieron oxigenoterapia, registrándose un tiempo prolongado de oxigenoterapia comparado. Los controles recibieron oxigenoterapia los 5 primeros días, con buena respuesta. El 33,7% de los controles no recibieron oxigenoterapia.
La mayoría de casos terminó recibiendo ventilación mecánica (12 casos) y solo 3 no llegaron a recibir por tener un cuadro muy abrupto de enfermedad; se tuvo un tiempo de ventilación mecánica de regular a prolongada, pero la mortalidad fue del 100.0%.
En cuanto al periodo transcurrido entre la hospitalización y el fallecimiento, la mediana fue de ocho días y el rango de 2 a 15 días. Cabe destacar que 2 casos (13,3%) ocurrieron dentro de las 72 horas. Los controles en su mayoría estuvieron 7 días, teniendo una estancia hospitalaria regular; la máxima estancia hospitalaria fue de 39 días. Teniendo mayor complicaciones los pacientes con mayor tiempo de estancia hospitalaria. Ver Figura 1.
DISCUSIÓN
Con la llegada de esta nueva enfermedad a nuestro país y región, aparecieron incertidumbres por parte de la comunidad por lo que el Ministerio de Salud elaboró un Plan de manejo y tratamiento frente a la potencial pandemia que representaba la nueva influenza A (H1N1); cuya aplicación fue limitada en la práctica, debido a la inoportunidad en su aplicación y debido a que no se contaban con los medios más apropiados para enfrentar esta enfermedad, de manera importante en la fase inicial; lo que se agravó debido a la presencia de los primeros casos de defunción, trayendo consigo un incremento considerable en la demanda en los servicios de salud, que en muchos casos generó el colapso de los servicios de emergencia, consulta externa y unidad de cuidados intensivos de los hospitales de la ciudad del Cusco.
En nuestro estudio respecto al estado nutricional no se encontró ninguna asociación relacionado a sobrepeso y obesidad. Este resultado difiere con los datos encontrados en los estudios realizado en los países de 18 España , Mexico19,20 y Argentina21 que reportan una asociación mayor con la obesidad de 31,2%, 36,2% y 17,8% respectivamente todos los pacientesque ingresaron a la unidad de Ciudadanos Intensivos (UCI). Así mismo, es necesario destacar que en este estudio se encontró que solo 6,7% de los sujetos en estudio presentó obesidad, y sobrepeso en 33,3% de ellos; mostrándose que el estado nutricional en nuestro estudio difiere mucho de lo observado en otros países.
En relación a la comorbilidad, encontramos que 93,3% de los casos tuvo alguna comorbilidad, comparado con 84.4% de los controles (OR: 2,58 CI 95%:0,33-14,22); este resultado es mayor que en México19,20 donde 58,2% de los casos tenían alguna comorbilidad considerándose como patología asociada la enfermedad pulmonar obstructiva crónica (OR: 1,54 IC 95% 0,26-7,16), gestación y puerperio (O.R.: 1,68 IC 95%:0,34-7,98) y finalmente otras comorbilidades (OR: 2,52 IC 95%:0,27- 23,43). Estos resultados se diferencian de los encontrados en los estudios18-21 en las que, la obesidad, las enfermedades pulmonares crónicas, como asma y EPOC y la cardiopatía fueron las más frecuentes.
El tiempo medio de retraso fue elevado, entre 4 y 8 días en iniciar el tratamiento antiviral con oseltamivir desde el inicio de la sintomatología; siendo estos hallazgos un aspecto común con los estudios.
En cuanto a la frecuencia cardíaca, los resultados respecto a la taquicardia como factor de riesgo para mal pronóstico y mortalidad por influenza A (H1N1), lo confirmó este estudio teniendo 60% de los casos taquicardia, comparado con 17,8% de los controles (OR: 6,94 CI 95%: 1,63-31,15) lo cual muestra la importancia de llevar un adecuado control de la frecuencia cardíaca y lograr que se adopten medidas de mayor control.
Respecto a la relación entre la frecuencia respiratoria y el pronóstico de mortalidad por influenza A (H1N1), en este estudio encontramos que 80% de los casos presentó taquipnea, comparado con 26,7% de los controles (OR: 11,0 CI 95%: 2,28-60,30), resultados en términos de frecuencia respiratoria que muestran similitud con la taquicardia.
Acerca del nivel de oxigenación, en este estudio encontramos que la hipoxia (OR: 19,16 CI 95%: 2,25 - 424,43), se presentó en 14 casos, 93,3%, comparado con 42,2% de los controles; en realidad es un indicador directo de la mala evolución del paciente ya que menos del 7% realmente contó con una saturación de oxígeno adecuada.
Con respecto a la relación de la puntuación del score APACHE II, con la gravedad del pronóstico de mortalidad por Influenza A (H1N1), en este estudio encontramos que un puntaje mayor o igual a 12 puntos para todos los casos y menor o igual de 11 puntos para todos los controles. El pronóstico de mortalidad estuvo entre 14,6% y 42,4% de los casos y el pronóstico de los controles estuvo entre 5,8% y 12,9%. Todos los casos contaron con un APACHE II completo pero los controles no (38,3%), por no contar con algunos exámenes de laboratorio de esta nueva enfermedad. Teniendo APACHE II con una media de 17+/-5 para los casos y un APACHE II 8+/-3 para los controles; estos resultados son similares de los encontrados en los estudios de Pérez- Padilla14, Domínguez-Cherit20 y Rello13. El estudio mostró una asociación entre nivel de conciencia alterado de manera importante con la mortalidad (OR: 139,75 CI 95%: 14,00-2418,9).
Respecto al esquema de tratamiento más usado por los médicos del Cusco, para enfrentar esta nueva enfermedad, todos recibieron el esquema de terapia con: medidas de soporte (MS), antibióticos (ATB), antiviral (ATV), corticoides (CORT) y oxigenoterapia (OXIG) y el 80,0% asociado a ventilación mecánica (VM). En comparación solo el 8,9% de los controles recibió este esquema de terapia. Entre los diversos esquemas de terapia recibida por los controles predomina el uso de medidas de soporte, antibiótico y antiviral. No recibieron antiviral 13,3% (6 controles) siendo en su mayoría gestantes. Además solo 4,4% (2 controles) no recibieron antibióticos en su esquema de terapia.
Respecto al tiempo de antibioticoterapia, se encontró similitud con el tiempo de terapia antiviral, teniendo que 80,0% de los casos recibió una terapia mayor a los 5 días, comparado con 55,5% de los controles. Sin embargo, se encontró una mayor asociación con mortalidad, cuando la terapia antibiótica era de 11 días o más (OR: 16,63 CI 95%: 2,41-145,33). El tiempo prolongado se debió también a la falta de respuesta clínica incluso usándose antibióticos como ceftazidima, vancomicina e imipenem en los casos y controles. Acerca del tiempo de terapia con corticoides y el pronóstico de mortalidad por nueva influenza A (H1N1), se encuentra una asociación positiva. Al igual que los anteriores el tiempo prolongado es de mayor riesgo.
Los resultados acerca del lugar de hospitalización, muestran que la mayoría de casos terminó permaneciendo en Unidad de Cuidados Intensivos luego de estar hospitalizados en otro servicio 73,3% (11 casos). Solo el 6,7 (1 caso) permaneció en UCI desde un inicio. El 88,89% de los controles estuvo hospitalizado en el servicio de medicina. Respecto a los días que pasaron en hospitalización que llegó a UCI, se tuvo una mediana de 3 días, similar al estudio de Rello18, en la mayoría por neumonía viral primaria con insuficiencia respiratoria y necesidad de intubación para pasar a ventilación mecánica.
Todo lo anterior y de manera amplia, nos debe hacer entender que la nueva influenza A (H1N1), es una enfermedad que ha venido para quedarse con nosotros y que se va a diseminar como cualquier gripe común; afortunadamente no es tan destructiva como se pensó, pues su grado de letalidad y mortalidad es menor a lo que se esperaba; sin embargo, debemos de saber cómo actuar para lograr la menor mortalidad posible, teniendo en cuenta en el manejo de casos cuales son los factores asociados al mal pronóstico y mortalidad de esta nueva enfermedad.
Finalmente, después de haber realizado el análisis de regresión logística multivariada, de manera importante, se encontró que un sujeto incluido en el estudio y con terapia antibiótica prolongada (p<0,007) e inicio tardío del tratamiento antiviral (p<0,05) tiene una elevada probabilidad de morir (84%).
CONCLUSIONES Y RECOMENDACIONES
Los factores de riesgo y pronóstico identificados deben ser considerados en el manejo de casos desde la identificación de los casos sospechosos de nueva influenza A (H1N1), y más aún sí estos se confirman; y en el caso particular permitieron realizar la retroalimentación de información al personal de salud involucrado en la atención de pacientes con nueva influenza A (H1N1), fortalecer el sistema de vigilancia epidemiológica para la detección temprana de estos factores y mejorar los procesos de calidad de atención de estos pacientes; no habiéndose presentado ninguna otra muerte durante el 2009.
REFERENCIAS BIBLIOGRÁFICAS
1. Adé MP, Aguilera X. Consulta de expertos de OPS/OMS, Organización Panamericana de la Salud Washington, USA Organización Panamericana de la Salud Washington, USA. Consideraciones y recomendaciones provisionales para el manejo clínico de la Influenza pandémica (H1N1) 2009., 16 de julio de 2009. [ Links ]
2. Bresee. J, Clifton RD; La Gripe A (H1N1) 2009 ("gripe porcina") y Usted. CDC: Centros para el Control y la Prevención de Enfermedades. 12 de ene. de 2010, Atlanta, GA 30333, USA 800-CDC-INFO (800-232-4636) TTY: (888) 232- 6348. Disponible en URL: http://espanol.cdc.gov/enes/(H1N1)flu/qa.htm [ Links ]
3. Camarena S. / M. R. E. / A. R. Alarma en México y EE UU por una rara Influenza porcina. Publicado en ElPaís.com (abril de 2009). Influenza Porcina en México. México / Madrid - 25/04/2009, Disponible en URL: http://www.elpais.com/articulo/sociedad/Alarma/Mexico/EE/UU/rara/Influenza/porcina/elpepusoc/20090425elpepusoc_1/Tes [ Links ]
4. Centro Nacional de Información de Ciencias Médicas Preparing for the second wave: lessons from current outbreaks., Ginebra, 28 de agosto de 2009, Disponible en URL:http://www.who.int/csr/disease/swineflu/notes/(H1N1)_second_wave_0090828/en/index.html [ Links ]
5. Chan M. El nivel de alerta de pandemia de gripe porcina pasa a la fase 4 Declaración de la Directora General de la OMS sobre Gripe porcina, 27 de abril de 2009 Disponible en URL: http://articulos.sld.cu/influenzaporcina/2009/04/27/ [ Links ]
6. Conferencia Justo en tiempo. Brote de influenza porcina A (H1N1) en EUA y México: Potencial para una pandemia. Versión 1 de la conferencia JET el 28 de Abril del 2009. [ Links ]
7. Cunha BA. Influenza: historical aspects of epidemics and pandemics. Infect Dis Clin North Am. 18 Marzo 2004; (1):141- 55. [ Links ]
8. Dirección Regional de Salud Cusco, Declaratoria de Alerta Epidemiológica. Oficio circular Nro.: 0437 2009 – GR Cusco – DRSC. DEUS-EPI 27 de Abril del 2009. [ Links ]
9. Directiva Sanitaria N° 027-MINSA/DGSP.V.01. Directiva Sanitaria para la Atención, Diagnóstico y Tratamiento de Influenza en los Establecimientos de Salud a Nivel Nacional en la Etapa de Mitigación de la Pandemia Influenza por Virus A (H1N1). [ Links ]
10. Lipsitch M, Riley S, Cauchemez S, ET AL. Manejo y control de la incertidumbre en una pandemia emergente de gripe. NEJM 2009;361:121-114 [ Links ]
11. ONG CWM, Ho Ky, Hsu Ly. ¿Cómo enfrentaron los países de Asia la epidemia?. The Lancet 2009:9,397-398 [ Links ]
12. EMOL.MUNDO. Laboratorio suizo produce primer lote de vacunas contra Influenza humana, viernes 12 de junio de 2009, Disponible en URL: http://www.emol.com/noticias/internacional/detalle/detallenoticias.asp?idnoticia=362464 [ Links ]
13. Garulo DC, Ortega GD. Pruebas para la detección rápida del virus de la Influenza, MIR-Pediatría, Servicio de Urgencias. Hospital Infantil Universitario Niño Jesús, Febrero 2009, Madrid, colaborado por: Guía ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico. Disponible en URL: http://infodoctor.org/gipi/guia_abe/ [ Links ]
14. Gómez BJ. Especialista en Medicina General Integral y en Epidemiología de Campo Coordinador GT Enfermedades Zoonóticas e Influenza, La Pandemia de la Gripe A (H1N1): ¿Que debemos saber? Situación mundial y en el Perú de la influenza A (H1N1) 06 de agosto 2009. [ Links ]
15. Gotuzzo E. ¿Qué lecciones tenemos en la Pandemia actual y qué hacer?, Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia Hospital Nacional Cayetano Heredia, 06 de Agosto del 2009. [ Links ]
16. Martino O. La situación de la epidemia de Influenza A (H1N1): 6 de Julio 2009. Más reflexiones acerca de la Influenza Ecuménica: 27 de Julio 2009. INTRAMED [ Links ]
17. Microbiología Clínica. Dispersión de los microorganismos: Reservorios y fuentes de infección. El contagio y su prevención. Vías y modos de transmisión microorganismos., Grupo de Investigación de Genética y Microbiología, Curso 2004 – 2005, disponible en URL: http://www.unavarra.es/genmic/microclinica/tema06.pdf [ Links ]
18. Rello J, Rodríguez A, Ibañez P et al. Intensive care adult patients with severe respiratory failure caused by Influenza A (H1N1) in Spain.Crit Care. 2009;13(5):R148. [ Links ]
19. Domínguez-Cherit G, Lapinsky SE, Macias AE et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 2009 Nov 4;302(17):1880-7. [ Links ]
20.Rogelio Perez-Padilla, Daniela de la Rosa-Zamboni, Samuel Ponce de Leon etal. Pneumonia and Respiratory Failure from Swine-Origin Influenza A (H1N1) in Mexico. N Engl J Med 2009; 361:680-689 [ Links ]
21.Comisión para la Contingencia de Influenza A (H1N1), Hospital Nacional Profesor Alejandro Posadas. Epidemia de influenza A(H1N1) en la Argentina: Experiencia del Hospital Nacional Profesor Alejandro Posadas. Medicina (B. Aires). 2009; 69(4): 393-423. Disponible en <http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802009000500001&lng=es&nrm=iso>. accedido en 19 dic. 2013.
CORRESPONDENCIA
Pablo F. Grajeda Ancca