Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.30 no.4 Lima Oct./dic. 2013
Artículo original
Interacciones farmacológicas de las hojas de Maytenus macrocarpa o chuchuhuasi con fármacos inhibitorios y estimuladores de la motilidad intestinal
Pharmacological interactions from the leaves of Maytenus macrocarpa "chuchuhuasi" with inhibitory and stimulating bowel motility drugs
Meléndez-Espíritu S1,2, Huaccho-Rojas J1,2, Santos-Cajahuanca F1,2, Abanto-Cabeza C1,2, Jáuregui-Farfán J1,2, Mendoza-Toribio J1,2, Morales-Zenteno E1,2, Salgado-Silva L1,2, Sueyoshi-Hernández H1,2, Robles-Ojeda M1,2, Loja- Herrera B1,2, Alvarado-Yarasca A1,Salazar-Granara A.1,2
1. Centro de Investigación de Medicina Tradicional y Farmacología de la Facultad de Medicina Humana de la Universidad de San Martín de Porres. Lima, Perú.
2. Sociedad Científica de Estudiantes de Medicina de la Universidad de San Martin de Porres. Lima, Perú.
RESUMEN
Objetivo: Determinar las posibles interacciones farmacológicas de las hojas de Maytenus macrocarpa, con fármacos estimulantes e inhibitorios de la motilidad intestinal. Métodos: Se utilizaron 110 ratones albinos machos, con pesos medios de 25 g, se empleó el método de Arbos y col, se administró carbón activado al 5 % vía oral, dosis de 0.1ml/10g, como marcador intestinal. Los grupos experimentales fueron: control (agua destilada 0,3ml), hojas de chuchuhuasi 1 (500mg/kg), hojas de chuchuhuasi 2 (3000mg/kg), atropina (1,5mg/kg), loperamida (5mg/kg), neostigmina (0,4mg/kg), metoclopramida (10mg/kg), hojas de chuchuhuasi 1 con metoclopramida, hojas de chuchuhuasi 1 con loperamida, hojas de chuchuhuasi 2 con metoclopramida y hojas de chuchuhuasi 2 con loperamida. Para la validación estadística se usó la prueba de Wilconxon, ANOVA y Tukey. Resultados: El porcentaje de recorrido intestinal de carbón activado fue de 27,04, 34,15, 31,66, 25,57, 15,89, 43,30, 33,99, 32,40, 27,90, 49,34 y 25,36 respectivamente, el test de ANOVA de dos colas revelo una p=0,0007. El test de Tukey indico p<0.05 versus el control para neostigmina, loperamida y la interacción chuchuhuasi 3000 mg/kg con metoclopramida, en este último, el test de Wilconxon presento un valor p<0,05. Conclusiones: Se observó interacciones farmacológicas de antagonismo sobre la motilidad intestinal, entre chuchuhuasi y Loperamida y sinergismo entre chuchuhuasi y metoclopramida.
Palabras claves: Interacciones de drogas, motilidad intestinal, sinergismo, antagonismo, medicina tradicional, plantas medicinales, Maytenus, loperamida, metoclopramida.
SUMMARY
Objectives: To determine the possible pharmacological interactions from the leaves of Maytenus macrocarpa with inhibitory and stimulating bowel motility drugs. Methods: We used 110 male albino mice with average weight of 25g, Arbos and others method was applied. Activated charcoal was administered at 5 % at dose of 0.1ml/10g, as an intestinal marker. The experimental groups included 0.1 ml/10 g of distilled water, leave extract of M. macrocarpa 1 (500mg/kg), leave extract of M. macrocarpa 2 (3000 mg/kg), 1,5mg/kg of atropine, 5mg/kg of loperamide, 0.4mg/kg of neostigmine, 10mg/kg of metoclopramide, leave extract of M. macrocarpa 1 with metoclopramide, leave extract of M. macrocarpa 1 with loperamide, leave extract of M. macrocarpa 2 with metoclopramide and leave extract of M. macrocarpa 2 with loperamide. The statistical validation was based on Wilconxon, ANOVA and Tukey test. Results: The intestinal charcoal run percentage was 27.04, 34.15, 31.66, 25.57, 15.89, 43.30, 33.99, 32.40, 27.9, 49.34 and 25.36 respectively. The ANOVA test result in p= 0.0007. The Tukey test indicated p <0.05 versus the control group for neostigmine, loperamide, and the interaction between leave extract of M. macrocarpa 2 with metoclopramide, for the last the Wilcoxon test result in p <0.05. Conclusions: It was observed antagonism drug interactions on gastrointestinal motility between leaves extract of M. macrocarpa with loperamide and synergism interactions with metoclopramide.
Keywords: Drug, Interactions, Gastrointestinal Motility, Synergism, Antagonism, Traditional Medicine, Medicinal Plant, Maytenus, Loperamide, Metoclopramide.
INTRODUCCIÓN
En la región amazónica del Perú, es común el uso de las plantas medicinales, entre estas destaca la especie M. macrocarpa o chuchuhuasi, árbol distribuido en los departamentos de Loreto, Amazonas, Huánuco, Pasco, San Martín, Ucayali y Madre de Dios; en estas regiones, el uso tradicional del chuchuhuasi es conservado en las comunidades nativas, sin embargo, en la actualidad también lo emplean los habitantes de zonas urbanas.
Las principales aplicaciones medicinales tradicionales que se le atribuyen al chuchuhuasi son: acción tonificante, revitalizante, energética, analgésica, antirreumática, antiartrítica, antidisentérica, antihemorroidal, antitumoral, antitusígena, afrodisíaca, reconstituyente después del parto, entre otras.
En contraste, se ha demostrado en investigaciones previas, efectos farmacológicos del chuchuhuasi, tales como analgésico, antiinflamatorio, antipirético, sobre la presión arterial, la frecuencia cardíaca y sobre la motilidad intestinal.
Un aspecto poco explorado en regiones de Sudamérica y particularmente en el Perú, es la posibilidad de interacciones farmacológicas entre plantas medicinales y medicamentos, evento que cuenta con evidencia clínica y pre-clínica, que ha revelado potenciales reacciones adversas, inclusive mortales.
Por ejemplo, hoy en día, es prácticamente contraindicado el consumo concomitante de warfarina y plantas como Ginkgo biloba y Panax ginseng, pues está demostrado, que esta acción puede conllevar a la muerte por hemorragias severas; otra interacción, es entre el antihipertensivo propranolol y el ajo, terapéutica que puede producir depleción de la presión arterial, etc.
Por lo tanto, en este contexto, es posible que las personas estén consumiendo chuchuhuasi, en conjunto con medicamentos comunes, ignorando los potenciales riesgos por interacciones farmacológicas patentes.
El presente trabajo se centró en evaluar, las posibles interacciones farmacológicas del extracto etanólico de las hojas de M. macrocarpa o chuchuhuasi, con fármacos estimulantes e inhibitorios de la motilidad intestinal en ratón albino.
MATERIALES Y MÉTODOS
Tipo de estudio, espacio y tiempo. Experimental, exploratorio y analítico, realizado en el Centro de Investigación de Medicina Tradicional y Farmacología (CIMTFAR) de la Facultad de Medicina Humana de la Universidad de San Martín de Porres (FMH-USMP); durante el periodo de julio a noviembre de 2010.
Muestra vegetal. Se utilizó las hojas de la especie M. macrocarpa; conocida como chuchuhuasi, ésta fue recolectada en Pucallpa (Ucayali-Perú). La colecta y certificación taxonómica de esta especie fue hecha bajo los criterios del método de Cerrate, E.1969.
Muestra biológica. Se utilizaron 110 ratones Mus musculus albinos machos, con peso entre 20 y 30 gr, procedentes del Centro Nacional de Productos Biológicos del Instituto Nacional de Salud del Perú. Siguiendo los lineamientos éticos del International Guiding Principles for Biomedical Research Involving Animal (1985)30, los ratones fueron separados y colocados en jaulas amplias, provistas de alimento balanceado y agua ad libitum.
La aclimatación, se dio en el bioterio de la FMH-USMP, a una temperatura de 22°C, con humedad promedio de 30- 70%, ciclos de luz/oscuridad de 12 horas y niveles de ruido menores a 70 db. Para la distribución y asignación aleatorizada de los grupos experimentales, se empleó la técnica de moneda sesgada31.
Muestra química. Loperamida tabletas de 2 mg, lote 09D089, registro sanitario (RS) E-12251, vencimiento 10/2011; metoclopramida ampollas de 10mg/2ml, lote 100-105, RS EG-4972, vencimiento 01/2013; Atropina, ampollas de 0,25mg/1ml, lote 105-230, RS N-3169, vencimiento 05/2013; neostigmina, ampollas de 0,1mg/1ml, lote 108-203, RS E-6951, vencimiento 12/2012 y agua destilada en ampollas, con lote 080707, RS E-01209, vencimiento de 07/2011.
Preparación del extracto etanólico. Se realizó a partir del material seco y molido, de las hojas de M. macrocarpa, macerado durante una semana en etanol al 70 %; posteriormente, la mixtura fue filtrada y se puso en un rotavapor. El residuo obtenido, fue secado en estufa por 48 horas.
La muestra secada se molió en el mortero, hasta obtener un polvo muy fino, el cual se almacenó en envases herméticos en un refrigerador, para su posterior uso en el experimento de motilidad intestinal.
Evaluación de la motilidad gastrointestinal. Se utilizó el método de Arbos32. 24 horas antes del inicio del experimento, se privó de alimentos a los roedores y se continuó con agua ad libitum.
Posteriormente, se administraron las sustancias en estudio, por la vía probable. Transcurridos 30 minutos, se procedió a administrar por vía oral (V.O.) el marcador carbón activado al 5 % a dosis de 0.1 ml/10 gr de peso. Luego de 30 minutos, se procedió a sacrificar a los animales por dislocación cervical.
Seguidamente, se realizó disección tipo laparotomía y se extrajo el intestino delgado, desde la porción pilórica hasta el colon y se procedió a medir la distancia recorrida del carbón activado, que contuvo por lo menos 1cm continuo de carbón, entre la porción pilórica y la unión ileocecal. La distancia se expresó como la media del porcentaje de la longitud total del intestino recorrida por el carbón ± error estándar. La medición del recorrido intestinal del carbón activado, fue hecha independientemente por dos operadores y se mantuvo un diseño a dos ciegos, en que el administrador de la sustancia problema y el operador, no conocían el origen de ésta.
Los grupos experimentales fueron: 1) Agua destilada, 0.1 ml/10g de peso corporal (PC) por VO, 2) neostigmina, 0.4 mg/kg PC por vía subcutánea (SC), 3) sulfato de atropina, 1,5 mg/kg por VO, 4) hojas de M. macrocarpa 1,500 mg/kg P.C. por VO, 5) hojas de M. macrocarpa 2, 3000 mg/kg P.C. por VO, 6) loperamida, 5 mg/kg P.C. por VO, 7) metoclopramida, 10 mg/kg P.C. por VO, 8) hojas de M. macrocarpa 1 con hoperamida, 9) hojas de M. macrocarpa 2 con loperamida, 10) hojas de M. macrocarpa 1 con metoclopramida y 11) hojas de M. macrocarpa 2 con metoclopramida.
Análisis estadístico. Los resultados se expresaron como medias +/- desviación estándar para las variables cuantitativas. Para la validación estadística, se aplicó el test de ANOVA de dos colas junto con la prueba de comparación de Tukey, asignando diferencias significativas para un valor p < 0,05. También se aplicó el test de Wilconxon, para determinar la distribución de la población según Gauss y a su vez, se usó como soporte informático, Microsoft Office Excel 2010 y el programa estadístico GraphPad Prism Versión 5.01.
RESULTADOS
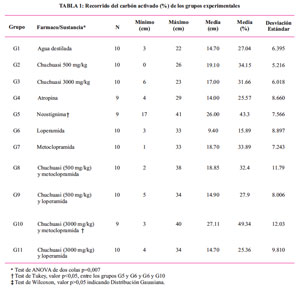
En la Tabla 1, se aprecia los porcentajes correspondientes a la motilidad intestinal, obtenida con las dosis de chuchuhuasi y fármacos estimulantes (neostigmina y metoclopramida), observándose un mayor efecto en la administración de chuchuhuasi 3000 mg/kg con metoclopramida (49,34%), superior a neostigmina y al grupo que recibió agua destilada. Asimismo, el efecto procinético fue mayor, a la dosis de chuchuhuasi de 500 mg/kg (34,15%), que a 3000 mg/kg (31,66%).
Por otra parte, la administración de chuchuhuasi y fármacos inhibidores de la motilidad intestinal, como atropina y loperamida, evidenció una disminución de la motilidad de 15.89% con loperamida y 25,57 % con atropina. Asimismo, que el efecto de loperamida disminuyó cuando se administra conjuntamente con chuchuhuasi, sea a dosis de 500 mg/kg (27,90%), o 3 000 mg/kg (25,36%).
DISCUSIÓN
Estudios previos de la hoja de M. macrocarpa, han corroborado la actividad estimulante sobre la motilidad intestinal y su relación con la dosis, siendo mayor el efecto en dosis menores; en la presente investigación se reafirman ambos eventos.
En contraste, estudios de la especie M. rigida, muestra un efecto de inhibición de la motilidad intestinal ligado a dosis mayores de la planta, corroborando el efecto observado de M. macrocarpa en el presente estudio; posiblemente sentando la actividad sobre la motilidad intestinal para el género Maytenus.
Sobre el chuchuhuasi hay investigaciones que demostraron su actividad anticonceptiva y la posible intermediación de receptores opioides, al revertir su efecto analgésico con clorhidrato de naloxona, en el modelo de contorsiones abdominales en roedor.
En este estudio se observó antagonismo sobre la motilidad intestinal, tras la administración conjunta de M. macrocarpa y loperamida, hecho que podría tener relación con una probable acción de algún metabolito secundario presente en M. macrocarpa, planta que presenta una gran variedad de alcaloides y flavonoides, entre otras sustancias.
Considerando que loperamida ejerce su efecto al actuar sobre receptores opioides ubicados en el plexo mientérico de la capa muscular longitudinal del intestino34,35, es posible plantear que M. macrocarpa, presenta un mecanismo de acción de agonista/antagonista sobre la motilidad intestinal, por acción sobre receptores opioides µ y/o δ, situaciones que deberán indagarse en futuras investigaciones.
Por otra parte, existen investigaciones de las especies M. rígida y M. ilicifolia13-15, que demuestran el efecto de inhibición de la motilidad intestinal, contrarrestando in vitro, la acción espasmogénica de la Histamina, el carbacol y cloruro de bario en contraste, in vivo, se ha demostrado la reversión de la acción sobre la motilidad intestinal de la especie M. Ilicifolia, por acción del betanecol, estos hallazgos, también podrían explicar el antagonismo observado entre loperamida y M. macrocarpa; pero además, permiten plantear para futuros estudios, un probable mecanismo de acción de M. macrocarpa o de sus metabolitos secundarios, sobre receptores de histamina y acetilcolina en el intestino.
Asimismo, investigaciones de M. macrocarpa y M. krukovii21,22, demostraron su efecto de disminución sobre la presión arterial, planteando la posibilidad de una acción relajante del músculo liso de los vasos, bajo la hipótesis de acción agonista y antagonista de receptores adrenérgicos, evento que también deberá explorarse a futuro, con el fin de explicar los mecanismos de antagonismo observado entre loperamida y M. macrocarpa.
Por otra parte, la interacción entre M. macrocarpa y metoclopramida, resultó en un efecto de sinergismo, evento esperado, considerando las investigaciones que demuestran un actividad estimulante de la motilidad intestinal en dosis bajas, tanto de M. macrocarpa, como de otras especies como M. rigida y M. ilicifolia.
Sin embargo, plantear una acción de M. macrocarpa sobre los receptores de serotonina, sitio de acción intestinal de la metoclopramida, es algo que se podría cuestionar considerando que hay investigaciones de la especie M. ilicifolia13,14 que demuestran que el efecto sobre la motilidad intestinal de la planta no es revertido por la metoclopramida; por tanto, es probable que el mecanismo de sinergismo observado pueda deberse a la acción de M. macrocarpa en receptores intestinales muscarínicos o dopaminérgicos, hipótesis que deberán ser comprobadas en futuros trabajos. Finalmente, la evidencia de interacciones farmacológicas entre plantas medicinales y medicamentos, principalmente proviene de estudios realizados en regiones de América del Norte, Europa y Asia23-28,36-38; mostrando de alguna forma el riesgo del consumo de sus plantas medicinales nativas en combinación con medicamentos.
Esta práctica terapéutica, se da ante la presunción de que es voluntaria, pero también que es ocultada por el paciente al momento de la consulta con el médico, o inclusive, cabe la posibilidad de que el médico recomiende también el consumo conjunto; así, sea cual sea la forma en que ocurra, se asume erróneamente, que la planta medicinal por provenir de la naturaleza es inocua.
Este estudio, demuestra una interacción farmacológica sobre la motilidad intestinal, al combinar M. macrocarpa chuchuhuasi con loperamida y metoclopramida; es recomendable, emplear como el aporte de estos resultados, su inmediata aplicación en la praxis clínica, sobre todo para alertar a la comunidad médica y al usuario de las plantas medicinales y los potenciales riesgos que podrían ocasionar tal práctica terapéutica.
Por otra parte, se denota un vacío en la literatura científica, acerca del uso de las plantas medicinales peruanas y sus potenciales interacciones con medicamentos, lo cual lleva a recomendar que se continúen con las investigaciones de laboratorio y de campo, a fin de generar más conocimientos que se reflejen en una práctica racional de la Medicina Tradicional peruana.
CONCLUSIONES
Se demuestra la interacción farmacológica de antagonismo sobre la motilidad intestinal en roedor, entre las hojas de M. macrocarpa y loperamida, y de sinergismo con la metoclopramida.
AGRADECIMIENTOS
Por su apoyo inmensurable y colaboración: al Dr. Frank Lizarazo Cáparo, Decano de la Facultad de Medicina Humana de la Universidad de San Martin de Porres, al Dr. Benjamín Castañeda Castañeda, Director del Instituto de Investigación de la FMH-USMP y al Técnico Carlos Pante Medina, Bioterio de la FMH-USMP. .
FINANCIAMIENTO
Co-financiamiento entre los autores y la Facultad de Medicina Humana de la Universidad de San Martin de Porres.
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Kvist LP, Oré I, Gonzáles A, Llapapasca C. Estudio de plantas medicinales en la Amazonía Peruana: Una evaluación de ocho métodos etnobotánicos. Folia Amazónica. 2001; 12(1-2): 53- 71. [ Links ]
2. Stagegaard J, Sorensen M, Lars Peter Kvist. Estimations of the importance of plant resources extracted by inhabitants of the Peruvian Amazon flood plains. Perspect. Plant Ecol. Evol. Syst. 2002; 5(2): 103-122. [ Links ]
3. Kvist LP, Andersen MK, Stagegaard J, et al. Extraction from woody forest plants in flood plain communities in Amazonian Peru: use, choice, evaluation and conservation status of resources. For Ecol Manage. 2001; 150(1-2): 147-174. [ Links ]
4. Sanz-Biset J, Campos-de-la-Cruzb J, Epiquién-Rivera MA, et al. A first survey on the medicinal plants of the Chazuta valley (Peruvian Amazon). J Ethnopharmacol. 2009; 122(2):333-62. [ Links ]
5. Instituto de investigaciones de la Amazonía Peruana. Plantas medicinales de la Amazonía Peruana. [Internet]. [Citado el 23 de Mayo de 2013]. En: http://www.iiap.org.pe/cdpublicaciones2011/documentos/pdf/libros/34.pdf [ Links ]
6. Mejía K, Rengifo E. Plantas medicinales de uso popular en la Amazonia Peruana. 1995 [Internet]. [Citado 23 de Mayo de 2013] En: http://www.iiap.org.pe/Upload/Publicacion/L017.pdf [ Links ]
7. Villar M, Villavicencio O. Manual de Fitoterapia. Lima: EsSalud-Organización Panamericana de la Salud; 2001 [ Links ]
8. Schultes R, Raffauf R. La selva sanadora: plantas medicinales y toxicas del noroeste del Amazonas. Revista de Estudios Sociales.2009; 1(32): 126-142. [ Links ]
9. Santa María J, Zimic C, Salinas I, Sánchez L, Arrambide J, Salazar A. et al. Antinocicepción opioide del extracto metanólico del Maytenus krukovi en un modelo de dolor visceral en ratón. Revista Horizonte Médico 2006; 6(2) [ Links ]
10. Alosilla-Uscamaita A, Ascaño-Ramírez A, Chavez- Palomares F, et al. Efecto del extracto etanólico de las hojas de chuchuhuasi (Maytenus macrocarpa) en la motilidad gastrointestinal in vivo. Catálogo de Resúmenes de Investigación. Perú: Instituto de Investigación, FMH-USMP; 2008. [ Links ]
11. Vanda Lucia dos Santos; Costa, Viviam Bruna Machado Costa; Maria de Fátima Agra; Bagnólia Araújo da Silva; Leônia Maria Batista. Pharmacological studies of ethanolic extracts of Maytenus rigida Mart (Celastraceae) in animal models. Rev. bras. farmacogn. vol.17 no.3, July/Sept. 2007 [ Links ]
12. Emendörfer F, Emendörfer F, Bellato F, Noldin VF, Niero R, et al. Evaluation of the relaxant action of some Brazilian medicinal plants in isolated guinea-pig ileum and rat duodenum. J Pharm Pharm Sci. 2005, Mar 18;8(1):63-8. [ Links ]
13. Baggio CH, Freitas CS, Twardowschy A, dos Santosa AC, Mayer B, et al. In vivo/in vitro studies of the effects of the type II arabinogalactan isolated from Maytenus ilicifolia Mart. ex Reissek on the gastrointestinal tract of rats. Z Naturforsch C. 2012 Jul-Aug; 67(7-8):405-10. [ Links ]
14. Baggio CH, Freitas CS, Mayer B, Dos Santos AC, Twardowschy A, et al. Muscarinic-dependent inhibition of gastric emptying and intestinal motility by fractions of Maytenus ilicifolia Mart ex. Reissek. J Ethnopharmacol. 2009 Jun 25;123(3):385-91. [ Links ]
15. da Rocha MB, Souza FV, dos Santos Estevam C, Pizza C, et al. Antispasmodic effect of 4'-methylepigallocatechin on guinea pig ileum. Fitoterapia. 2012 Oct; 83(7):1286-90. [ Links ]
16. Oliveira MG, Monteiro MG, Macaúbas C, et al. Pharmacologic and toxicologic effects of two Maytenus species in laboratory animals. J Ethnopharmacol. 1991; 34(1):29-41. [ Links ]
17. Gonzalez JG, delle Monache G, delle Monache F, et al. Chuchuhuasha - a drug used in folk medicine in the Amazonian and Andean areas. A chemical study of Maytenus laevis. J Ethnopharmacol. 1982 Jan;5(1):73-7. [ Links ]
18. Da Silva G, Taniça M, Rocha J, et al. In vivo antiinflammatory effect and toxicological screening of Maytenus heterophylla and Maytenus senegalensis extracts. Hum Exp Toxicol. 2011; 30(7): [ Links ]
19. Crestani S, Rattmann YD, Cipriani TR, et al. A potent and nitric oxide-dependent hypotensivo effect induces in rats by semi-purified fraction from Maytenus ilicifolia. Vascul Pharmacol. 2009; 51(1):57-63. [ Links ]
20. El Deeb K, Al-Haidari A, Mossa J, et al. Phytochemical and pharmacological studies of Maytenus forsskaoliana. Saudi Pharmaceutical Journal. 2003; 11(4):184-91. [ Links ]
21. Huaccho Rojas J, Cavero Aguilar E, Quezada Rojas M, et al. Efectos sobre la temperatura, frecuencia respiratoria, frecuencia cardiaca y electrocardiograma de Maytenus macrocarpa (Ruiz & Pav.) Briq. (chuchuhuasi). Rev Cubana Plant Med 2012, Sep; 17(3): 233-243. [ Links ]
22. Salazar-Granara A, Milla-Flores D, Morales-Gutiérrez V, et al. Evaluación de la actividad hipotensora del Maytenus krukovii chuchuhuasi en rata consciente. Rev Horiz Méd. 2008;8(2):41-7. [ Links ]
23. Hussin A. Adverse Effects of herbs and drug-herbal interactions. Malaysian Journal of Pharmacy. 2001; 1(2):39-44. [ Links ]
24. Alonso MJ. Plantas medicinales: del uso tradicional al criterio científico.. Concordia de Barcelona. 2010. [ Links ]
25. INFITO. Investigación sobre los hábitos de consumo de plantas con fines terapéuticos en España. 2008. [ Links ]
26. Nota informativa de la Agencia Española del Medicamento: Suspensión de la comercialización de la especialidad farmacéutica Exolise®: extracto etanólico de Camelia sinensis (té verde). Ref. 2003/03. [ Links ]
27. European Medicines Evaluation Agency. Position paper on the risks associated with the use of herbal products containing Aristolochia species. 2002; EMEA/HMPWP/23/00. [Internet]. [Citado 23 de Mayo de 2013]. En: http://www.emea.europa.eu/docs/en_GB/document_library/Position_statement/2009/11/WC500015537.pdf [ Links ]
28. Basheeruddin Asdaq SM, Naseeruddin Inamdar M. Pharmacodynamic and pharmacokinetic interactions of propranolol with garlic (Allium sativum) in rats. J Evid Based Complementary Altern Med. 2010; 11(11): 11. [ Links ]
29. Cerrate E. Manera de preparar plantas para un herbario. Lima: Museo de Historia Natural, Universidad Nacional Mayor de San Marcos; 1969. [ Links ]
30. International Guiding Principles for Biomedical Research Involving Animals, 1986. Andrología, 18: 553–54.
31. Quintana C. Elementos de Inferencia Estadística. San José: Universidad de Costa Rica; 1996. [ Links ]
32. Arbos, J.; Cegrí, A.; Lopez-Soriano, F.R.J.; Argiles, J.M. A simple method for determining the rate of gastrointestinal transit in the rat. Arch. Intern. Physiol. Bioch. Biophys. 1993; 101:113-115. [ Links ]
33. Villegas E, Marino C, Novoa L, et al. Actividad dosis respuesta sobre la motilidad intestinal in vivo e in vitro del extracto de las hojas de Maytenus macrocarpa. Catálogo de Resúmenes de Investigación. Perú: Instituto de Investigación, FMH-USMP; 2009. [ Links ]
34. Velásquez P. Lorenzo. Farmacología Básica y Clínica. 18° edición. Editorial Madrid: Médica Panamericana. Buenos Aires, 2004. Pg. 583-590. [ Links ]
35. Goodman-Gilman. Las bases Farmacológicas de la Terapéutica. 11º edición. Editorial: McGraw-Hill Interamericana. 2006 pag.570-571. [ Links ]
36. H.-H. Tsai, H.-W. Lin, A. Simon Pickard, H.-Y. Tsai, G. B. Mahady. Evaluation of documented drug interactions and contraindications associated with herbs and dietary supplements: a systematic literature review. International Journal of Clinical Practice. Volume 66, Issue 11, pages 1056–1078, November 2012 [ Links ]
37. Gardiner P., Phillips R., Shaughnessy A. Herbal and Dietary Supplement–Drug Interactions in Patients with Chronic Illnesses. American Family Physician, January 1, 2008, Volume 77, Number 1 [ Links ]
38. Mohammad Y., Mohammad I. Herb-Drug Interactions and Patient Counseling. International Journal of Pharmacy and Pharmaceutical Sciences, Vol. 1, Supply 1, Nov.-Dec. 2009 [ Links ]
CORRESPONDENCIA
Alberto Salazar Granara