Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. peruana vol.30 no.4 Lima Oct./dic. 2013
Reporte de caso
Transplante de epiplón para la enfermedad de Parkinson: Reporte de 3 casos
Omentum tranplant for Parkinson´s disease: Report of 3 cases
Hernando Rafael , Juan Oscar David , Antonio Santiago Vilca , José Luis Aservi1, Ronald Viera2, Andrey Medvedyev1
1. Clínica Santa Mónica .Lima-Perú.
2. Clínica San Marcos. Lima-Perú.
3. Hospital Nacional Hipólito Unanue. Lima-Perú.
RESUMEN
Introducción: Desde 1990, hemos postulado que la causa primaria de la enfermedad de Parkinson (EP) es de origen isquémico iniciado en el tegmento mesencefálico. Sin embargo, hasta la fecha, casi todos los investigadores consideran que la etiología es desconocida. Objetivo: Demostrar que la EP puede ser mejorada por medio de un transplante de epiplón. Material y Método: Presentamos 3 pacientes con EP avanzado. A través de una craneotomía temporal localizamos la bifurcación carotídea y el espacio perforado anterior (EPA). Aquí encontramos:1) aterosclerosis en las carótidas supraclinoideas, 2) ausencia de la arteria coroidea anterior o de la comunicante posterior, 3) varias arterias perforantes anteriores y posteriores exsangües y 4) aterosclerosis en la bifurcación basilar. El epiplón fue colocado sobre el EPA y fosa interpeduncular. Resultados: La mejoría neurológica fue observada después del tercer día y evidente en las primeras semanas del postoperatorio. Actualmente, 10 y 23 meses después de la cirugía, dos pacientes requieren medicación antiparkinsoniana a dosis reducidas y además, reciben aspirina y clonazepan. Todos los pacientes realizan actividades cotidianas sin asistencia familiar. Conclusiones: Nuestros resultados indican que la EP es causada por isquemia progresiva en el territorio de las arterias perforantes posteriores; porque, en contraste a esto, su revascularización por medio del omento produjo mejoría neurológica. Así mismo, creemos que el uso regular de aspirina y clonazepan puede ayudar a esta enfermedad.
Palabras claves: Enfermedad de Parkinson, isquemia esencefálica, epiplón, transplante, aspirina. (DeSC).
SUMMARY
Introduction: Since 1990, we have postulated that the primary cause of Parkinson´s disease (PD) is of ischemic origin initiated in the mesencephalic tegmentum. However, up to date, almost all researchers consider that the etiology is unknown. Objetive.To demonstrates that PD can be improved by means of omental transplantation. Material and Method: We present 3 patients with advanced PD. Through a temporal craniotomy we located the carotid bifurcation and anterior perforated space (APS). Here we found: 1) atherosclerosis at the supraclinoid carotids; 2) absence of anterior choroidal or posterior communicating arteries; 3) several exsanguine anterior and posterior perforating arteries,and 4) atherosclerosis at the basilar bifurcation. The omentum was placed on the APS and interpeduncular fossa. Results: Neurological improvement was observed after the third day and evident in the first weeks postoperatively. At present, 10 and 23 months after surgery, two patients require incomplete antiparkinsonian medication and besides, they receive aspirin and clonazepan. All of them carry out daily activity without assistance familiar. Conclusions: Our results indicate that PD is caused by progressive ischemia in the intraparenchymal territory of the posterior perforating arteries; because, in contrast to this, its revascularization by means of omentum produced neurological improvement .Likewise we believe that the regular use of aspirin and clonazepan may help to this disease.
Keywords: Parkinson´s disease. Mesencephalic ischemia. Omental transplantation. Aspirin.
INTRODUCCIÓN
La enfermedad de Parkinson (EP) es conocida como una enfermedad neurodegenerativa del sistema dopaminérgico mesencefálico, cuya etiología podría ser multifactorial.
Sin embargo, en base al patrón microvascular del mesencéfalo3-5 y de experiencias quirúrgicas6-8, desde septiembre de 1990 postulamos que la causa primaria de esta enfermedad es de origen isquémico en el territorio intraparenquimatoso de las arterias perforantes posteriores (APPs), provocado por aterosclerosis en el extremo distal de la arteria basilar.
Reportamos 3 pacientes con EP avanzado, quienes recibieron transplante de epiplón sobre el espacio perforado anterior (EPA) y fosa interpeduncular. A diferencia de pacientes operados previamente7,8, nuestros casos reportados aquí no recibieron médula adrenal al putamen.
REPORTE DE CASO
Caso 1: Paciente masculino de 55 años de edad, ingeniero agrónomo.
En mayo del 2004, inició con lentitud de movimiento en miembro superior izquierdo y meses después, en el miembro inferior homolateral. Al inicio la lentitud fue de aparición ocasional, luego se hizo frecuente y finalmente constante. Cuatro años después, se agregó temblor de reposo en los miembros izquierdos. Cinco meses antes de su hospitalización presentó torpeza en la pierna derecha y arrastre de los pies durante la marcha. Además, comenzó a presentar trastornos del sueño. Durante estos años de enfermedad, el paciente recibió levodopa/benserazide (600/150 mg diarios) y vitamina E.
El examen en fase ON y OFF según la escala de Hoehn- Yahr (H/Y)9, estuvo caracterizado por facies hipomímica, lenguaje lento, disártrico y de poca intensidad, dificultad para levantarse de la silla, rigidez del cuello, marcha lenta y arrastrando los pies, tronco inclinado hacia adelante, miembro superior izquierdo flexionado al tórax y signo de la rueda dentada en codos y muñecas. Imagen de resonancia magnética (IRM) y tomografía axial computada (TAC) de cráneo, mostraron aterosclerosis en las carótidas supraclinoideas, en arteria basilar y en segmento V4 de las arterias vertebrales.
El parénquima cerebral se encontró normal. Con el diagnóstico de EP en fase IV de H/Y, y previo consentimiento informado, el paciente recibió un transplante de epiplón en el hemisferio derecho, el 17 de octubre del 2011.El cuadro clínico fue documentado en videotape.
Caso 2: Mujer de 55 años de edad, químico farmacéutica. En julio del 2005, inició con temblor de reposo en la mano izquierda, de curso ascendente hacia el hombro. Tres años después el temblor se extendió a la cabeza y casi simultáneamente, al miembro inferior homolateral. Cinco meses más tarde, se agregó temblor en los miembros superior e inferior derechos. En el último año presentó deterioro de la memoria reciente y trastorno del sueño. Recibió tratamiento antiparkinsoniano desde el principio de su enfermedad.
En los últimos meses estuvo recibiendo levodopa/carbidopa (750/75 mg por día) y biperideno. El examen estuvo caracterizado por facies hipomímica, disfasia motora, dificultad para levantarse de la cama y silla, marcha lenta y a pasos cortos, temblor moderado en reposo, que aumentaba por estrés (de predominio izquierdo). La TAC de cráneo reveló aterosclerosis en las carótidas supraclinoideas, arterias cerebrales medias y en la arteria basilar. Con el diagnóstico de EP en fase IV de H/Y la paciente fue operada, el 13 de marzo del 2012, del hemisferio izquierdo.
Caso 3: Paciente masculino de 64 años de edad, empresario en la fabricación de zapatos. Dos años antes de su hospitalización inició con temblor de reposo en la mano derecha, inconstante durante el día y aumentaba con el estrés.
Un año después, comenzó a caminar a pasos cortos, arrastrar los pies y a inclinar el tronco. Seis meses antes de su hospitalización, los familiares observaron facies hipomímica, depresión, aislamiento y deterioro de la memoria reciente. Recibió tratamiento para esta enfermedad en los últimos seis meses, pero de manera inconstante y a dosis pequeñas. Tuvo antecedente de fumador crónico y de usar solventes orgánicos en su trabajo.
El examen neurológico, sin tratamiento antiparkinsoniano mostró facies hipomímica, marcha a pasos cortos y con ligera inclinación del tronco, subía y bajaba escaleras con ayuda, temblor leve en ambas manos y signo de rueda dentada en codos y muñecas. La TAC de cráneo reveló aterosclerosis en las carótidas supraclinoideas, arterias cerebrales medias y posteriores, y arteria basilar. Ver Figura 1.
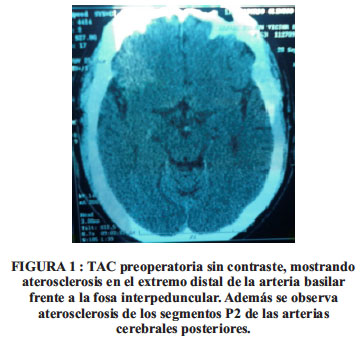
Con el diagnóstico de EP en fase III de H/Y el paciente fue operado, el 14 de diciembre del 2012, del hemisferio derecho.
Procedimiento quirúrgico
Bajo efectos de anestesia general con intubación orotraqueal, los pacientes fueron colocados en posición supina, con la cabeza lateralizada a la izquierda o derecha. Dos equipos de cirujanos realizamos una laparotomía y craneotomía, simultáneamente. La técnica quirúrgica fue la misma que la publicada en artículos previos; excepto que los tres casos reportados aquí, no recibieron médula adrenal (tejido cromafín) al putamen.
En abdomen, se realizó una laparotomía supraumbilical para extraer un segmento de epiplón conteniendo 4 cm de la arcada gastroepiploica y vasos epiploicos. En cráneo, mediante incisión tipo Walker y previo aislamiento de la arteria temporal superficial, realizamos una craneotomía temporal centrada sobre la cisura de Silvio. La dura fue abierta en forma de "Y" y con ayuda del microscopio quirúrgico, localizamos la bifurcación carotídea y el EPA. Durante la cirugía encontramos: 1) aterosclerosis moderada o severa en las carótidas supraclinoideas, 2) ausencia de una arteria coroidea anterior, 3) ausencia de una arteria comunicante posterior, 4) varias arterias perforantes anteriores y posteriores exsangües y 5) aterosclerosis moderada o severa en la bifurcación basilar y sus ramas terminales. Previa anastomosis termino –terminal por invaginación entre la arteria temporal superficial con la arteria gastroepiploica del omento, un segmento de epiplón fue colocado sobre el EPA y el otro, depositado en la fosa interpeduncular.
RESULTADOS
La mejoría neurológica en los tres pacientes ocurrió a partir del segundo a tercer día del transplante y fue evidente en las primeras semanas de la operación.
Actualmente, los tres pacientes realizan sus actividades personales sin asistencia familiar y dos de ellos están trabajando.
En el caso 1, la bradicinesia y rigidez experimentaron una mejoría del 70% durante los primeros 15 meses y sin medicación antiparkinsoniana; pero sí utilizó aspirina 500 mg por día (250 mg después del almuerzo y 250 mg después de la cena) y clonazepan 1 mg por las noches. Pero suspendió voluntariamente ambos medicamentos por 4 meses y poco después, reaparecieron algunos signos de Parkinson. Por esta razón, reinició con levopoda/benserazide (300/75 mg por dia), así como aspirina y clonazepan. Actualmente (septiembre 2013), con este tratamiento la marcha es casi normal, realiza gestos faciales de acuerdo a sus emociones, es independiente en su atención personal y realiza algunas actividades de su profesión.
En el Caso 2, esta paciente experimentó mejoría del temblor en un 80% durante 4 meses y sin recibir tratamiento antiparkinsoniano.
Luego la EP reapareció y una TAC de control postoperatorio reveló una reducción del tamaño del injerto intracraneal. La paciente suspendió la aspirina desde el principio por sensación nauseosa y mareos. Pero, desde el sexto mes, reinició con levodopa/carbidopa (250/25 mg por día), aspirina 500 mg por día y 1 mg de clonazepan por las noches. Actualmente, con esta modalidad de tratamiento, la paciente realiza labores domésticas y es independiente en su atención personal.
Caso 3, la mejoría fue evidente desde el tercer día, tanto en la marcha como en el movimiento de sus extremidades. Desde el principio recibió aspirina y clonazepan. Una TAC de control postoperatorio (febrero 2013), reveló al epiplón sobre el quiasma óptico, EPA, corteza temporal, fosa interpeduncular y zona subgaleal temporal. Ver Figura 2.
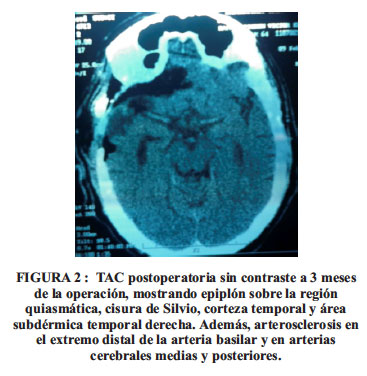
Actualmente, 10 meses después de la cirugía, los familiares consideran una mejoría del 80 al 90%; camina largas distancias, puede marchar de punta y talones, sube y baja escaleras, hay mejoría en su estado emocional y memoria, así como es independiente en su atención personal. Solamente recibe aspirina y clonazepan.
DISCUSIÓN
La mejoría neurológica en estos 3 pacientes, apoya nuestra hipótesis en el sentido que la causa primaria de la EP es de origen isquémico, en el territorio parenquimatoso de las APPs. Pero, a diferencia del doble transplante (médula adrenal + epiplón); con solo el transplante de epiplón, la mejoría fue un poco más tardía. Esto debido probablemente, a la ausencia de noradrenalina y dopamina liberadas por el tejido cromafín implantado con la primera técnica6, 8, 16. Por ello, deseamos comentar las razones de estos resultados.
Primero: En el mesencéfalo se localizan 4 núcleos dopaminérgicos con acción inhibitoria, derivados del mismo complejo nuclear4,13: 1) grupo periretrorrubral (núcleo A8); 2) sustancia nigra pars compacta (SNpc o núcleo A9) integrada por cerca de 450, 000 neuronas al nacimiento y de 275, 000 a los 60 años de edad4,14; 3) área tegmental ventral (núcleo A10) y 4) sustancia nigra pars lateral (SNpl). De estos 4 grupos celulares se originan sistemas de proyección ascendente e ipsilaterales. De los núcleos A9 y SNpl nacen fibras dopaminérgicas que terminan esencialmente en el putamen y, en menor grado, en el núcleo caudado.
El deterioro de esta vía es causa esencial de la fase preclínica y clínica temprana de la EP6,15. Mientras que de los núcleos A8 y A10 nacen fibras dopaminérgicas que finalizan como: 1) mesohipotalámicas, para terminar en la capa externa de la eminencia media, 2) mesolímbicas, para distribuirse en algunos núcleos de la región subcomisural y a través del fórnix, en la lóbulo temporal medial (hipocampo, complejo subicular y corteza entorrinal) y 3) mesocortical, para finalizar en la corteza prefrontal y cingular anterior.
Segundo: Además de la SNpc y Snpl, la sustancia negra está integrada por la sustancia nigra pars reticular (Snpr)4,13. Las neuronas de éste núcleo, morfológica y funcionalmente son similares a las neuronas del segmento pálido medial (SPM) del núcleo lenticular y ambos (SPM y SNpr), envían axones GABAérgicos con acción inhibitoria al núcleo ventral anterior (VA),ventral lateral (VL), ventral intermedio (Vim) y centromediano del tálamo. Así mismo, los núcleos VL y Vim reciben axones contralaterales desde el núcleo dentado del cerebelo (dentotalámicas) y núcleo rojo parvocelular (rubrotalámicos). Ambas vías ascendentes ejercen acción excitatoria17,18 sobre neuronas de la porción ventral del núcleo Vim (relacionados con las manos y pies) y otros axones, desde los núcleos profundos (globoso y emboliforme), para terminar en la porción dorsal del núcleo Vim (relacionado con el tronco)15,18. Por tanto, normalmente los núcleo Vim del tálamo reciben aferencias inhibitorias desde el SPM y SNpr y aferencias excitatorias, desde el cerebelo.
Tercero: El núcleo subtalámico, estructura muy pequeña (7mm x 3mm) y muy vascularizada, es otro núcleo que participa en la modulación del control motor18,19. Recibe aferencias glutamatérgicas desde la corteza cerebral e inhibitorias procedentes de los núcleos rafé dorsal (vía serotoninérgicas), del segmento pálido lateral (SPL) y Snpr (vía GABAérgica). Por contraste, envía fibras excitadoras (glutamatérgicas) al globo pálido (SPM y SPL), putamen y Snpr.
Es decir, normalmente los núcleos subtalámicos reciben fuerte influencia inhibitoria GABAérgica y serotoninérgica, y envían axones glutamatérgicos al núcleo lenticular y a la Snpr. La isquemia o estimulación eléctrica leve de este núcleo produce bradicinesia o rigidez y por contraste, su destrucción o neuroestimulación de alta frecuencia, reduce la rigidez19-21. En otras palabras, la neuroestimulación de éste núcleo, solo mejora la hipertonía de la EP, pero no los demás síntomas.
Cuarto: El locus coeruleus (LC) y el subcoeruleus (núcleos A6 y A7)22,23 son estructuras noradrenérgicas localizadas en la parte superior del tegmento protuberancial y ventrolateral a la sustancia gris central. Ambos núcleos envían axones ascendentes e ipsilaterales para finalizar en la corteza cerebral (alrededor del 95% axones) y el resto, terminan en los núcleos septales y a través del fórnix, en el lóbulo temporal medial. A este nivel, en el asta de Ammón y complejo subicular, los axones noradrenérgicos ejercen un efecto inhibitorio23-25. Es decir, en condiciones normales incrementan el umbral convulsivo en la fase REM del sueño25.
Quinto: Los núcleos del rafe están integrados por grupos celulares localizados en el tegmento del tallo cerebral y alrededor de la formación reticular. De estos, los núcleos del rafe dorsal y central superior (localizados en la parte más inferior del mesencéfalo y tercio superior de la protuberancia) envían axones serotoninérgicos con acción inhibitoria a los núcleos septales, subtalámicos, hipocampo, corteza órbitofrontal y cingular anterior 23,25. La mayoría de las fibras dopaminérgicas, noradrenérgicas, serotoninérgicas, adrenérgicas y colinérgicas ascienden ipsilateralmente como haz medial del cerebro anterior, para distribuirse por el diencéfalo, corteza cerebral y sistema límbico.
Sexto: El mesencéfalo, subtálamo y núcleos ventrales del tálamo (VL, Vim y ventrocaudal parvocelular, Vcpc) por arriba,y los núcleos LC, subcoeruleus y núcleos del rafe dorsal y central superior por abajo reciben flujo sanguíneo a través de las APPs originadas desde el extremo distal de la arteria basilar y sus ramas, y en menor cuantía, desde la mitad distal de las arterias comunicantes posteriores (ACoPs) y arterias coroideas anteriores (AChAs)4,16. De este modo, la parte ventral del tálamo, subtálamo, hipotálamo posterior, pie peduncular, tegmento mensencefálico y protuberancial alto reciben irrigación de las APPs originadas desde la mitad posterior del polígono de Willis. Sin embargo, debemos tener en mente que en alrededor del 55 % de casos, esta parte posterior del polígono presenta variantes anatómicas y por tanto, el origen y calibre de las APPs son igualmente diferentes.
Las APPs largas del grupo anterior o diencefálico no son terminales26,28,31 sino se anastomosan con algunas arterias perforantes anteriores (APAs) y con arterias del grupo medial de las arterias lenticuloestríadas. Otras APPs que toman un curso descendente hacia los núcleos A6 y A7, núcleos del rafe dorsal y central superior, se anastomosan con ramos terminales de las arterias circunflejas de la arteria basilar.
Séptimo: Dentro del tegmento mesencefálico y protuberancial alto, la angioarquitectura en los núcleos dopaminérgicos, noradrenérgicos y serotoninérgicos son similares4,5,16,32. En todos, la red capilar establece contactos íntimos con la superficie neuronal y sin interposición glial. Es decir, los contactos neuronovasculares en la SNpc de cerebros normales son de capital importancia para la viabilidad y función de las neuronas dopaminérgicas. A través de estos contactos, las neuronas nigrales reciben oxígeno y nutrientes necesarios para la síntesis de dopamina y noradrenalina. La L-tirosina penetra la membrana plasmática de la neurona por diferencia de concentración y el oxígeno es requerido para la primera etapa de la biosíntesis de la dopamina5,16. Es decir, para la formación de L-dopa en el citoplasma de las neuronas dopaminérgicas, es indispensable la L-tirosina y oxígeno, entre otros.
En la EP, esta relación neurono-vascular está perdida por infiltración glial y gránulos de pigmento alrededor de las arteriolas y capilares. Por tanto, hay una relación directa entre esta ruptura neurono-vascular con la pérdida neuronal progresiva y comienzo de la EP4,16,28. Una vez establecida la enfermedad, la patología es evidente (gliosis y muerte neuronal), esencialmente en la porción caudomedial y lateral del núcleo A9; es decir, en la porción nuclear vascularizada por las APPs originadas desde la bifurcación basilar, arterias mesencefálicas (segmento P1) y parte proximal del segmento P2 de las arterias cerebrales posteriores4,16,30. Mientras que la porción rostromedial del núcleo A9, es vascularizada por las ACoPs y AChAs.
Octavo: En aproximadamente el 8% de las personas mayores de 35 años de edad, hay diferentes grados de estenosis en el extremo distal de la arteria basilar y sus ramas, causado por aterosclerosis15,30,33. Esta patología que aumenta con la edad, provoca reducción del flujo sanguíneo progresivo en el territorio de las APPs, debido a la presencia de placas ateromatosas localizadas en las bocas de estas arterias perforantes8,15. Deterioro vascular que se hace más temprano y evidente, cuando están asociados a variantes anatómicas en la mitad posterior del polígono de Willis.
Los hallazgos arriba señalados, el comienzo de los síntomas (temblor o bradicinesia), hallazgos quirúrgicos y la evolución postoperatoria de nuestros pacientes; confirman nuestra hipótesis que la EP se inicia en la región subtalámica uni o bilateral, debido a isquemia progresiva en el territorio distal de las APPs largas del grupo diencefálico. De este modo, se daña inicialmente la zona incerta, el haz medial del cerebro anterior, la sustancia negra, los núcleos subtalámicos, VL,Vim y Vcpc del tálamo. Así, el deterioro GABAérgico de la SNpr desencadena un incremento relativo de tipo excitatorio de la vía dentorrubrotalámica sobre el núcleo Vim, provocando temblor de reposo en las manos o pies; mientras que la hiperactividad del subtálamo19 y el daño isquémico a la SNpc, provocan bradicinesia o rigidez e hipertonía secundaria al deterioro de la función dopaminérgica, sobre las terminaciones glutamatérgicas de las neuronas subtalámicas, a nivel del neoestríado. Es de esperar, que la extensión de la isquemia pueda acompañarse también de zonas en penumbra isquémica y/o de microinfartos en el diencéfalo, mesencéfalo y sus proyecciones corticales, en pacientes con EP en fase V de H/Y con o sin demencia.
Por el contrario, la mejoría neurológica en nuestros pacientes con EP avanzado, indica revascularización de estructuras diencefálicas (porción ventral del tálamo, subtálamo, hipotálamo posterior y núcleo lenticular) y mesencefálicas (sustancia negra, haz medial del cerebro anterior, locus coeruleus y núcleos del rafe), así como recanalización de algunas arterias perforantes. Esto debido a que el epiplón colocado sobre el EPA y la fosa interpeduncular, promueven la neoformación de vasos sanguíneos (revascularización) y a través de estos, transporta un incremento en flujo sanguíneo, oxígeno, neurotransmisores, factores neurotróficos, adipocitokinas y células madre al tejido nervioso residual subyacente y adyacente4,6,8,12,15,34. Es posible que nuestros resultados serían mejores si la misma técnica quirúrgica se realizara en etapas tempranas de la enfermedad; semejante al resultado obtenido en pacientes con enfermedad de Alzheimer (EA)35 y esclerosis lateral amiotrófica (ELA).
La aterosclerosis, enfermedad inflamatoria crónica en la pared interna de las arterias37, es causa primaria de varias enfermedades denominadas "neurodegenerativas".
Evidencias clínicas previas, sugieren que la aspirina y otras drogas anti-inflamatorias no esteroideas, parecen ser efectivas en mejorar el flujo sanguíneo (recanalización) diencefalo-mesencefálico en pacientes con hipertensión esencial38, EP39,40 y ataques isquémicos transitorios; secundario al efecto anti-inflamatorio y antiaterogénico de la aspirina, en las bocas de las APAs y/o APPs. Nuestros pacientes reportados aquí, apoyan el uso regular de aspirina en dosis altas, en contra de estas enfermedades.
Así mismo usamos clonazepan, con la finalidad de reducir el estrés y los desórdenes del sueño25,35,38. Ya que el clonazepan actúa en receptores GABAérgicos y benzodiacepínicos distribuidos en el sistema límbico, en especial sobre el lóbulo temporal medial (revascularizado también con el injerto). De este modo, el clonazepan disminuye o bloquea la excitabilidad de las neuronas glutamatérgicas durante el sueño REM, que actúan sobre los núcleos hipotalámicos.
CONCLUSIONES
La mejoría neurológica obtenida en estos 3 pacientes con EP avanzado, confirma nuestra hipótesis que la EP es causada por isquemia progresiva o abrupta en el territorio intraparenquimatoso de las APPs, secundario a aterosclerosis y variantes anatómicas en la parte posterior del polígono de Willis. Por tanto, la EP, la EA y la ELA no son enfermedades neurodegenerativas, sino de origen microvascular. Por otro lado, a diferencia de la isquemia en el tejido nervioso afectado en la EA y ELA, el deterioro vascular en las neuronas monoaminérgicas del tegmento mesencefálico y protuberancial alto son más susceptibles al daño isquémico que los núcleos del nervio motor ocular común y troclear, debido a la angio-arquitectura y función especializada de los núcleos dopaminérgicos, noradrenérgicos y serotoninérgicos.
REFERENCIAS BIBLIOGRÁFICAS
1. Lees AJ, Hardy J, Revesz T. Parkinson´s disease. Lancet 2009 ;373:2055-2066. [ Links ]
2. Cereda E, Barichelia M, PedrolliC, Pezzoli G. Diabetes and risk of Parkinson´s disease:A systematic review and metaanalysis. Diabetes Care 2011;34:2614-2623. [ Links ]
3. Rafael H,Ayulo V. Consideraciones sobre la etiología de la enfermedad de Parkinson.Mundo Médico (Méx ) 1990;17(197):11-17. [ Links ]
4. Rafael H. Deterioro de la microcirculación en la sustancia negra como causa de la enfermedad de Parkinson. Rev Méd IPSS 1995;4(2):51-56. [ Links ]
5. Rafael H, Moromizato P, Ayulo V. The dopamine transporter gene and PD in a Chinese population. Neurology 1999;52(2): 429-430. [ Links ]
6. Rafael H.El epiplón: Trasplante al sistema nervioso. Capítulo 10. México DF, Editorial Prado 1996. [ Links ]
7. Rafael H, Moromizato P, Espinoza M, Ayulo V, González- Portillo M. Transplantation of adrenal medulla and omentum to the putamen by a transinsular pathway for Parkinson´s disease. Neurosurgery 1991;28(3):481 (letter). www.neurosurgeryonline.com [ Links ]
8. Rafael H. Mesencephalic ischemia and Parkinson´s disease. J Neurol Neurosurg Psychiat 2003;75(3):511 (letter). www.jnnp.com [ Links ]
9. Hoehn MM,Yahr MD. Parkinsonism : Onset, progression ,and mortality .Neurology 1967;17(5):427-442. [ Links ]
10. Rafael H. Transsylvian and transinsular approach. Turk Neurosurg 1995;5:53-56. www.Turkishneurosurgery.org [ Links ]
11. Rafael H, Moromizato P, Espinoza M, Lara R. Doble transplante de tejido dopaminérgico-epiplón para la enfermedad de Parkinson. Diagnóstico (Perú) 1996;35(4):38- 41. [ Links ]
12. Rafael H, Moromizato P, Lara R. Surgery for Parkinson´s disease.Neurology 1993;43(10):2154. [ Links ]
13. Fallon JH,Loughlin SE. Substantia nigra. In Paxinos G(ed).The rat nervous system .Vol 2. Sydney, Academic Press Inc 1985:353-374. [ Links ]
14. McGeer PL, Itagaki S, Akiyama H, McGeer EG. Rate of all death in parkinsonism indicates activity neuropathological process. Ann Neurol 1988;24:574-576. [ Links ]
15.Rafael H,Mego R. Ablative surgery and deep brain stimulation for Parkinson´s disease. Neurosurgery 1999;45(1):199-200(letter) [ Links ]
16. Rafael H.Patogénesis de la enfermedad de Parkinson.Un análisis microvascular y neuroquímico. An Fac Med UNMSM 1996;57(4):168-273. [ Links ]
17. Rafael H. Nervios Craneanos .Capítulo 9.Tercera edición .México DF, Editorial Prado 2009. [ Links ]
18. Adams RD,Victor M,Ropper AH.Principles of neurology. Chapter 5. Sixth edition. New York; McGraw-Hill 1997 [ Links ]
19. Mendez-Herrera CR. El núcleo subtalámico en la fisiología de la enfermedad de Parkinson y su rol como diana quirúrgica. Rev Chil Neuro-psiquiat 2011;49:62-68. [ Links ]
20.Schuepbach WMM, Rau J, Knudsen K,et al. Neurostimulation for Parkinson´s disease with early motor complications. N Engl J Med 2013;368:610-622. [ Links ]
21. Starr PA,Vitek J,Bakay RAE. Ablative surgery and deep brain stimulation for Parkinson´s disease. Neurosurgery 1998;43:989-1015. www.neurosurgery-online.com [ Links ]
22. BakerKG,Tork I, Hornung JP,HalaszP. The human locus coeruleus complex :An immunohistochemical and three dimensional reconstruction study.Exp Brain Res 1989;77:257- 270 [ Links ]
23. Loughlin SE,Fallon JH. Locus coeruleus. In Paxinos G (ed).The rat nervous system. Chapter 4. Vol 1 . Sydney, Academic Press Inc 1985. [ Links ]
24. Rafael H.Patogenia de la enfermedad de Parkinson con demencia. Mundo Médico (Méx) 1997;25(283):29-34. [ Links ]
25. Rafael H, Valadez MT. Disfunción cerebral mínima.II: Etiología y fisiopatología. Salud Pública Méx 1986;28:495- 503. [ Links ]
26. Pedroza A,Dujovny M ,Ausman JI, et al .Microvascular anatomy of the interpeduncular fossa. J Neurosurg 1986;64:484-493. [ Links ]
27. Percheron G. Les artéres du thalamus human I: artéres et territoire thalamique polaires de l'artere communicante postérieure. Rev Neurol (Paris ) 1976; 132(5):297-307. [ Links ]
28. Finley KH. Angio-architecture of the substantia nigra and its pathogenic significance .Arch Neurol Psychiat 1936 ;36:118- 127. [ Links ]
29. Hassler O. Arterial pattern of human brain stem: Normal appearance and deformation in expanding supratentorial conditions. Neurology 1967;17:368-375. [ Links ]
30. Gonzalo R,Carvalhal G, Gómez-Llata S, De Oliveira E. Microsurgical anatomy of the posterior cerebral artery in threedimensional images. World Neurosurg 2011;75(2):233-257. [ Links ]
31. Rosner SS,Rhoton AL, Barry M. Microsurgical anatomy of the anterior perforation arteries. J Neurosurg 1984;61:468-485. [ Links ]
32. Felten DI,Crutcher KA. Neuronal-vascular relationships in the raphe nuclei,locus coeruleus,and substantia nigra in primates. Am J Anat 1979;155:467-472. [ Links ]
33. Flora GC,Baker AB, Loewenson RB, Klassen AC. A comparative study of cerebral atherosclerosis in males and females. Circulation 1968;38:859-869. [ Links ]
34. García-Gómez I,Goldsmith HS,Angulo J,et al. Angiogenic capacity of human Omental stem cells.Neurol Res 2005;27(8):807-811. [ Links ]
35. Rafael H,Mego R, Valadez MT. Omental transplantation on the carotid bifurcation and anterior perforated space for Alzheimer´s disease. Rev Hosp Juá Méx 2012;79(1):25-30. www.imbiomed.com.mx [ Links ]
36. Rafael H, David JO, Vilca AS, y Cols. Esclerosis lateral amiotrofica: Experiencia quirúrgica en 13 pacientes. Acta Méd Per 2013;30(2):79-85. www.cmp.org.pe [ Links ]
37. Ross R. Atherosclerosis. An inflammatory disease. N Eng J Med 1999;340:115-126. [ Links ]
38. Rafael H, Rodriguez J. Drogas anti-inflamatorias noesteroideas para la hipertensión esencial. Rev Fac Med UNAM 2009;52(5):227-229. www.medigraphic.org.mx [ Links ]
39. Wahner AD, Bronstein JM, Bordelon YD,Ritz B. Nonsteroidal anti-inflammatory drugs may protect against Parkinson´s disease. Neurology 2007;69:1836-1842. [ Links ]
40. Gagne JJ,Power MC. Anti-inflammatory drugs and risk of Parkinson´s disease: A meta-analysis. Neurology 2010;74(12):995-1002. [ Links ]
CORRESPONDENCIA
Hernando Rafael.













