Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana vol.33 no.2 Lima abr./jun. 2016
ARTÍCULO ORIGINAL
Mortalidad en pacientes con infección por VIH/SIDA en tratamiento antiretroviral en Huancayo, Perú 2008-2015
Mortality in patients with HIV / AIDS on antiretroviral treatment in Huancayo, Peru 2008-2015
Raúl Montalvo1, Jhonatan Mejía2,a, Percy Ramírez2,a, Eder Rojas2,a, Henry Serpa2,a, Mercedes Gomez2,a, Frank Quispe1
1 Departamento de Enfermedades Infecciosas Tropicales y Dermatológicas, Hospital Daniel Alcides Carrión. Huancayo, Perú.
2 Sociedad Cientifica de Estudiantes de Medicina Humana, Universidad Nacional del Centro del Perú. Huancayo, Perú.
a Estudiante de medicina
RESUMEN
Objetivo: Evaluar la mortalidad en pacientes con infección por VIH/SIDA que reciben tratamiento antirretroviral (TAR) en un hospital público de Perú. Materiales y métodos: Se realizó un estudio observacional de cohorte retrospectivo de los pacientes con diagnóstico de infección por VIH/SIDA que recibieron tratamiento antirretroviral. Resultados: De 428 pacientes estudiados, la media de edad fue 37 años y la media del recuento de CD4 al inicio del TAR en el grupo de fallecidos fue 87,2 cels/uL frente a 153,2 cels/uL en el grupo de vivos, fallecieron 66 pacientes (15,4%) después de iniciar TAR. La mayoría (48,5%) de estos pacientes tenían recuento de CD4 menor de 200 cel/uL, 59,1% desarrollaron infección oportunista y 16,7% cambiaron de esquema antirretroviral en algún momento del TAR. La mortalidad durante los primeros 3 meses de TAR fue 32,6%; el análisis con múltiples variables se encontró asociación con tener CD4 mayor de 100 cel/mL (HR:0,57; IC95%: 0,29-1,11), la presencia de infección oportunista (HR: 1,1; IC95% 1,06-1,16) y tener una alta carga viral (HR 1,17; IC95%:1,07-1,48). La probabilidad de sobrevida de los pacientes con CD4 menor de 100 cel/mL a los 8 años en TAR es 68%. Conclusiones: El mayor número de muertes de los pacientes con infección por VIH/SIDA ocurre durante los tres primeros meses de TAR y está asociado a un diagnóstico tardío (alta carga viral, bajo CD4 y presencia de enfermedades oportunistas). Sugerimos la implementación de terapia supervisada durante los primeros meses de TAR en pacientes con CD4 menor de 100 cel/mL, para identificar en forma temprana las infecciones oportunistas.
Palabras clave: Mortalidad; VIH; Síndrome de inmunodeficiencia adquirida; Terapia antirretroviral (fuente: DeCS BIREME).
ABSTRACT
Objective: To evaluate mortality in patients with HIV / AIDS receiving antiretroviral therapy (ART) in a public hospital in Peru. Materials and Methods: An observational retrospective cohort study of patients diagnosed with HIV / AIDS receiving antiretroviral treatment was performed. Results: Of 428 patients studied, the mean age was 37 years and the average CD4 count at ART initiation in the group of death was 87.2 cells / uL vs. 153.2 cells / uL in the group of living , they died 66 patients (15.4%) after starting ART. Most (48.5%) of these patients had CD4 counts less than 200 cells / uL, 59.1% developed opportunistic infection and 16.7% changed their antiretroviral regimen sometime in the ART. Mortality during the first 3 months of ART was 32.6%; Multivariate analysis found association have more than 100 CD4 cells / mL (HR: 0.57; 95% CI: 0.29 to 1.11), the presence of opportunistic infection (HR: 1.1; 95% CI 1.06 to 1.16) and have a high viral load (HR 1.17; 95% CI: 1.07 to 1.48). The probability of survival of patients with less than 100 CD4 cells / mL at 8 years in ART is 68%. Conclusions: The highest number of deaths of patients with HIV / AIDS occurs during the first three months of ART and is associated with late diagnosis (high viral load, low CD4 and presence of opportunistic infections). We suggest the implementation of supervised therapy in patients with less than 100 CD4 cells / mL during the first months of ART, to identify early opportunistic infections.
Palabras clave: Mortality; HIV; Acquired immunodeficiency syndrome; Antiretroviral therapy (source: MeSH NLM).
INTRODUCCIÓN
Cuando se introdujo la terapia antirretroviral (TAR) en 1996, la frase golpear primero y fuerte "hit hard and hit early" fue la clave para decidir el inicio del TAR [1], actualmente se esta evidenciando el mayor beneficio con el inicio de tratamiento si el nivel de CD4 es menor a 500 cel/mL.
En el Perú, mas de 32 200 casos con infección por VIH han sido notificados desde 1983 hasta 2014, con incidencia acumulada 4,18/100 000 habitantes [2]. Desde febrero del 2004 el Ministerio de Salud inicio el TAR de manera gratuita con la aprobación de la norma técnica de tratamiento antirretroviral de gran actividad (TAR), 9 años después de la notificación del primer caso de SIDA en Lima; por coincidencia, ese mes y año (mayo de 1983) en Francia, el Dr. Luc Montagneir descubría el agente causal del SIDA [3]. A partir de marzo del 2005 el hospital Carrión de Huancayo inició TAR a los pacientes con infección por VIH como parte del programa de control de infecciones de transmisión sexual.
En los inicios de la epidemia, la sobrevida de los pacientes sintomáticos se medía en semanas y meses, a pesar del rápido reconocimiento de las complicaciones oportunistas y la prevención o tratamiento de la mayoría de ellas. A mediados de la década siguiente a la aparición de VIH, surgieron los medicamentos antirretrovirales que combinados con el nuevo conocimiento de la dinámica viral permitieron el desarrollo e implementación de la terapia antirretroviral moderna. La introducción de la triterapia antiviral de alta efectividad (TAR) ha llevado a un significativo aumento en la sobrevida de los pacientes infectados por el VIH, transformándose en una enfermedad crónica [3].
El TAR es efectivo en reducir la mortalidad en pacientes con inmunosupresión avanzada quienes presentan infecciones oportunistas [4,5]; sin embargo, actualmente las causas de mortalidad en pacientes con TAR prologando son patologías crónicas como enfermedad coronaria, insuficiencia renal, déficit cognitivos, neoplasias y enfermedades hepáticas, esto puede estar relacionado a citoquinas proinflamatorias inducidas por el VIH, aunque la carga viral declina rápidamente con el TAR, estos marcadores de activación inmune no llegan a normalizarse a pesar de varios años de tratamiento [6-8].
Alguno estudios desarrollados en Latinoamérica y Europa, muestran que la mortalidad y supervivencia en pacientes portadores del VIH, varía dependiendo del nivel de CD4 inicial, estadio clínico, accesibilidad y tipo de tratamiento antirretroviral [9,10]. En este estudio evaluamos la mortalidad a los ocho años de tratamiento antirretroviral en un hospital público de Perú según el grado de inmunosupresión.
MATERIALES Y MÉTODOS
Diseño
Se realizó un estudio de cohorte retrospectivo de los pacientes que iniciaron tratamiento antirretroviral en el periodo enero del 2008 a diciembre del 2015 en el hospital Daniel Alcides Carrión-Huancayo, centro hospitalario de referencia regional para la administración de tratamiento antiretroviral de todos los pacientes con infección por VIH/SIDA de la región Junín, excepto los pacientes asegurados por ESSALUD.
Población y muestra
Se incluyó a todos los pacientes mayores de 18 años que iniciaron TAR en el periodo 2008 a 2015, y que forman parte de la base de datos de seguimiento epidemiológico instaurado por el hospital para la evaluación periódica de los pacientes con infección por VIH/SIDA. Fueron excluidos los pacientes que abandonaron el tratamiento o fueron referidos a otro establecimiento de salud debido a la pérdida del seguimiento y datos faltantes (Figura 1).
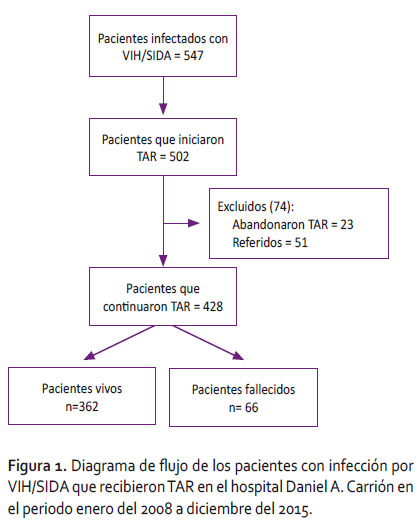
Variables
La mortalidad fue evaluada a partir de las fichas de defunción, información sobre mortalidad disponible en la historia clínica con la colaboración de la Estrategia Sanitaria Nacional de Prevención y control de ITS VIH/SIDA y Hepatitis B, quienes hacen seguimiento específico de cada paciente.
Se midió otras variables como género (varón/mujer), edad categorizada en <40 años de 40 a 59 y de 60 a más, el recuento de CD4 inicial fue categorizado en menor de 100, 100 a 200 y mayor de 200 células/mL [11,12] y los valores de carga viral inicial fueron categorizados en terciles (bajo <53 200, medio 53200 a 311800, y alto >311800), presencia de infección oportunista (sí/no), procedencia (urbano/rural), si cambio de esquema de TAR (sí/no). El tiempo de seguimiento fue categorizado en 0-3, 3-6, 6-12, 12-24 y mayor de 24 meses en tratamiento antirretroviral, priorizándose el primer año debido a la considerable mortalidad poco después de comenzar el TAR [13,14].
Procedimientos
Los pacientes con infección por VIH que inician tratamiento antirretroviral cuentan con CD4 y carga viral basal los cuales son realizados en forma gratuita por el Instituto Nacional de Salud, la atención médica es periódica y mensual durante el primer año de tratamiento con el objetivo de identificar efectos adversos, infecciones oportunistas y otras comorbilidades; posteriormente las evaluaciones médicas son cada tres meses y los exámenes de laboratorio como perfil lipídico, hepático, hematológico, bioquímico conteo de CD4 y carga viral son solicitados cada seis meses. Estos datos fueron registrados en nuestra base de datos.
Aspectos Éticos
El estudio fue aprobado por el Comité de Ética e Investigación del Hospital Nacional Daniel A. Carrión, se mantuvo la confidencialidad de los pacientes mediante código de registro. El consentimiento informado fue exceptuado de realizar con permiso del Comité de Ética por ser una revisión de historias clínicas.
Análisis de datos
Los datos fueron procesados en el paquete estadístico STATA v11.0. Las variables categóricas fueron expresadas en frecuencias relativas, y las numéricas con media y desviación estándar y posteriormente categorizadas según estándares o por terciles. La mortalidad acumulada fue ponderada en gráficos de Kaplan-Meier según recuento inicial de CD4. Se calculó las diferencias entre variables categóricas y el tiempo a muerte usando la prueba de log-rank, y la magnitud de asociación con el Hazart ratio (HR) usando la regresión de Cox simple con intervalos de confianza al 95%. En aquellas variables con asociación significativa se calcularon los HR ajustados usando la regresión de Cox múltiple. Se consideró un p<0,05 como significativo.
RESULTADOS
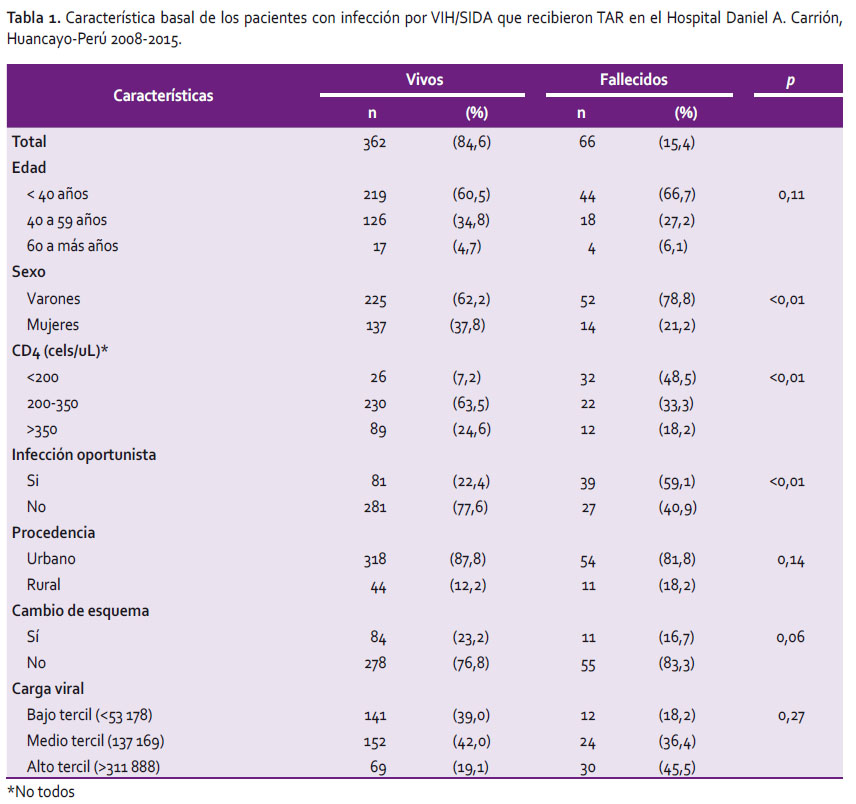
El análisis final incluyó 428 pacientes con infección por VIH; 52,6% fueron varones, 13,1% eran de zonas rurales, la media de edad fue 37 años y la media del recuento de linfocitos CD4 al inicio del TAR en el grupo de fallecidos fue 87,2 cels/uL frente a 153,2 cels/uL en el grupo de vivos (Tabla 1), 15,4% fallecieron después de iniciar TAR; 48,5% de estos pacientes tenían recuento de CD4 menor de 200 cel/uL (p<0,01); 59,1% desarrollaron infección oportunista durante el TAR (p<0,01) y 16,7% cambiaron de esquema antirretroviral al menos en una oportunidad (p=0,06).
En cuanto a la distribución de mortalidad según el mes de tratamiento antiviral, 33,3% de los pacientes fallecieron los primeros tres meses mostrando la exagerada mortalidad en los inicios del tratamiento antirretroviral; los pacientes con CD4 menor de 100 evidenciaron la mayor mortalidad (77,3%) en los 3 primeros meses de TAR.
La alta mortalidad de los pacientes con CD4 menor de 100 cel/uL durante los 3 primeros meses de tratamiento se observa en la Tabla 2, esta mortalidad va reduciéndose conforme va incrementándose el recuento de CD4. La proporción de muertes es mas alta en los primeros meses de inicio del TAR, la edad de los pacientes de 30 a 45 años representan la mayor proporción de fallecimientos (46,9%). El análisis logarítmico de la carga viral muestra que los pacientes con mayor carga viral fallecen durante los primeros tres meses de TAR, asimismo 30,4% de los fallecidos en los primeros 3 meses presentaban estadio clínico avanzado (Tabla 2).

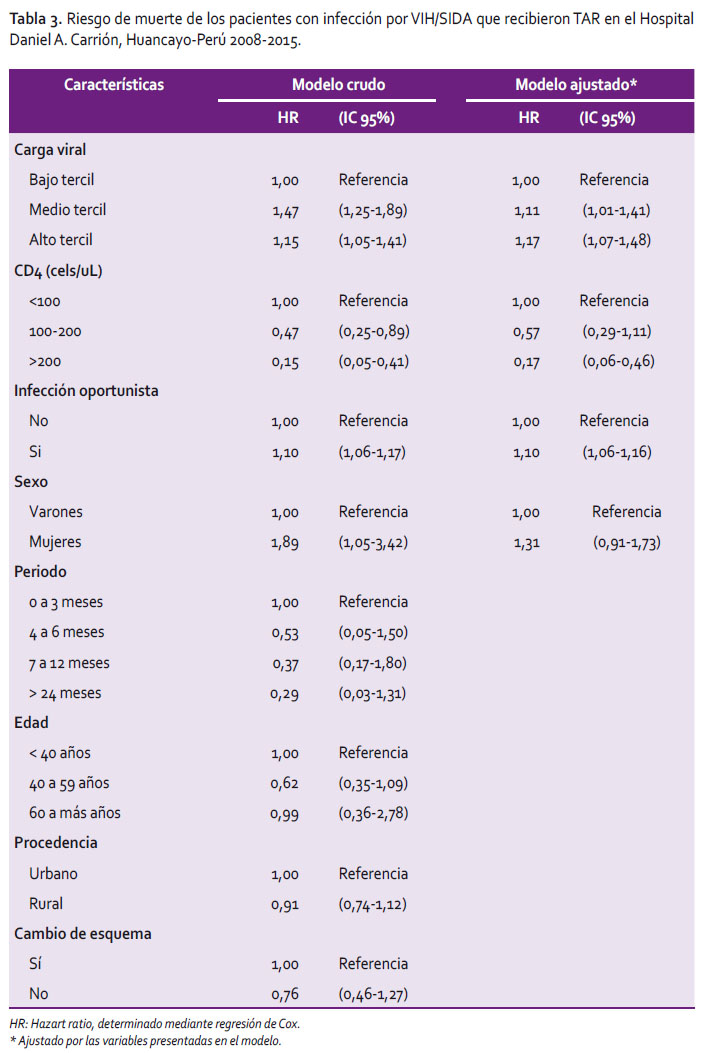
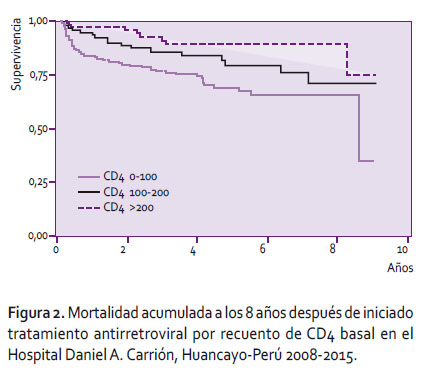
La probabilidad de sobrevida de los pacientes con infección por VIH en TAR se demuestra en la gráfica de Kaplan-Meier (Figura 2), el recuento de CD4 agrupa a los pacientes en tres categorías: menor de 100, de 100 a 200, y mayor de 200 cel/mL. El grupo con mayor mortalidad son los pacientes que iniciaron TAR con nivel de CD4 menor de 100 cel/mL cuya probabilidad de sobrevida a los 8 años es 68%, los pacientes con CD4 mayor de 200 cel/mL es el grupo con menor mortalidad representando la probabilidad de sobrevida 82% a los 8 años de terapia antirretroviral. El análisis multivariado (Tabla 3) mostró que los pacientes con CD4 mayor de 100 cel/mL presentaron HR 0,57 (IC95%: 0,29-1,11), la presencia de infección oportunista evidenció HR: 1,1 (IC95% 1,06-1,16), mientras que los pacientes con carga viral con tercil alto (>311 888) presentaron HR 1,17 (IC95% 1,07-1,48).
DISCUSIÓN
Nosotros encontramos que la mortalidad en los pacientes con infección por VIH durante los primeros tres meses de tratamiento antirretroviral es 4 veces mas alto si el conteo de CD4 es menor de 100 cel/ml en comparación con los pacientes con CD4 mayor de 200 cel/ml, así mismo las mortalidad después de los tres primeros meses de TAR independientemente del conteo de CD4 se mantiene constante en el tiempo, estas cifras son similares a las tasas de mortalidad reportadas en algunas enfermedades crónicas como diabetes mellitus o hipertensión arterial [15,16]. Aunque el grupo de pacientes que iniciaron TAR con CD4 mayor de 200 cel/mL fueron los que presentaron mayor sobrevida, esto fue principalmente por la ausencia de infecciones oportunistas.
En nuestro estudio la mortalidad de los pacientes que reciben TAR fue 15%, este valor es menor que un estudio realizado en una zona rural de Tanzania que mostró la mortalidad 21% (95% CI: 2-36%) a los tres años de seguimiento [17], en Malawi en cinco años de seguimiento fue de 17 a 42 [18].
El análisis demostró que los hombres tiene mayor proporción de mortalidad que las mujeres, similar a un estudio en Sud Africa donde encontraron la mortalidad 8,7% en varones vs 5,7% en mujeres [19], nosotros creemos que es por la diferencias en las características basales antes de iniciar TAR principalmente por que son el grupo con menor nivel de CD4 basal lo que refleja el mayor estado de inmunosupresión lo que condicona el retardo en la recuperación inmunológica en los hombres.
A pesar que en Perú el TAR es gratuito y disponible en todas las regiones, todavía se siguen reportando altas tasas de mortalidad debido al diagnóstico tardío.
La mortalidad temprana se produce principalmente por la inmunosupresión severa al inicio de TAR, en algunos casos la carga de la enfermedad supera los recursos de los centros de salud, o debidos a la presencia de comunidades marginadas con limitado acceso que exacerban el retraso a la atención médica especializada, con posibles contribuciones de patógenos oportunistas que sugieren que la mayoría de las muertes se deben a enfermedades definitorias de SIDA [20].
El enfoque analítico sobre los factores de riesgo asociados a mortalidad demostró que la presencia de infección oportunista, el conteo de CD4 menor de 100 cel/mL y la alta carga viral al inicio de TAR son los factores asociados a mayor mortalidad.
El estudio tiene limitaciones, hubo 23 pacientes que abandonaron y no se pudo encontrar información sobre si seguían vivos o no, por lo que la mortalidad podría ser aun mayor. Hay variables que no pudieron ser evaluadas en los potenciales factores de riesgo para mortalidad como adherencia al tratamiento y otras conocidas incluso en el contexto peruano y mundial [21,22]. Finalmente el tiempo de seguimiento de la cohorte fue bastante corto al incluir pacientes con poco tiempo de seguimiento como los que empezaron tratamiento el año 2015; sin embargo, esta información refleja el estado basal de esta cohorte de un hospital de referencia regional con un importante porcentaje de pacientes rurales y con diagnóstico tardío [23].
El mayor número de muertes de pacientes con infección por VIH/SIDA ocurrió durante los tres primeros meses de la terapia atirretroviral y con recuento de CD4 menor de 100 cel/mL, posteriormente la proporción de fallecidos se mantuvo constante. Sugerimos al programa nacional de control de enfermedades de transmisión sexual y VIH/SIDA (ESNITS) la implementación de la terapia supervisada diaria durante los tres primeros meses de TAR en pacientes con nivel de CD4 menor de 100 cel/mL, para identificar en forma temprana las infecciones oportunistas que surgan con el inicio de TAR para su diagnóstico y tratamiento oportuno y disminuir la mortalidad en este grupo de pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1 Ho DD. Time to hit HIV, early and hard. N Engl J Med. 1995;333(7):450-1. [ Links ]
2. Dirección General de Epidemiología. Análisis de la situación epidemiológica del HIV/SIDA en el Perú. Bases epidemiológicas para la prevención y control. Lima: Ministerio de Salud del Perú; 2015. [ Links ]
3. Kilmarx PH. Global epidemiology of HIV. Curr Opin HIV AIDS. 2009;4(4):240-6. [ Links ]
4. Zolopa A, Andersen J, Powderly W, Sanchez A, Sanne I, Suckow C, et al. Early antiretroviral therapy reduces AIDS progression/death in individuals with acute opportunistic infections: a multicenter randomized strategy trial. PLoS One. 2009;4(5):e5575. [ Links ]
5. Havlir DV, Kendall MA, Ive P, Kumwenda J, Swindells S, Qasba SS, et al. Timing of antiretroviral therapy for HIV-1 infection and tuberculosis. N Engl J Med. 2011;365(16):1482. [ Links ]
6. Neuhaus J, Angus B, Kowalska JD, La Rosa A; Sampson J; Wentworth D, et al. Risk of all-cause mortality associated with nonfatal AIDS and serious non-AIDS events among adults infected with HIV. AIDS. 2010;24(5):697-706. [ Links ]
7. Moore RD, Gebo KA, Lucas GM, Keruly JC. Rate of comorbidities not related to HIV infection or AIDS among HIV-infected patients, by CD4 cell count and HAART use status. Clin Infect Dis. 2008;47(8):1102-4. [ Links ]
8. Gandhi RT, Spritzler J, Chan E, Asmuth DM, Rodriguez B, Merigan TC, et al. Effect of baseline- and treatment-related factors on immunologic recovery after initiation of antiretroviral therapy in HIV-1-positive subjects: results from ACTG 384. J Acquir Immune Defic Syndr. 2006;42(4):426-34. [ Links ]
9. Wilson G, Wolff M. Una década de terapia anti-retroviral: Perfil de pacientes con 10 años de triterapia de alta efectividad. Rev Chilena Infectol. 2012;29(3):337-43. [ Links ]
10. Schomaker M, Gsponer T, Estill J, Fox M, Boulle A. Non-ignorable loss to follow-up: correcting mortality estimates based on additional outcome ascertainment. Stat Med. 2014;33(1):129-42. [ Links ]
11. Rodriguez F, Iribarren J, Arrizabalaga J, von Wichmann M. Protocolo diagnóstico de las infiltraciones pulmonares en pacientes con infección por el VIH. Medicine. 2010;10(59):4088-92. [ Links ]
12. Pérez A, Henández M, Gutiérrez F, Dronda F. Infecciones bacterianas, micobacterianas y micóticas oportunistas en el inmigrante infectado por el VIH: diagnóstico y tratamiento. Enferm Infecc Microbiol Clin. 2008;26 Supl 5:22-30. [ Links ]
13. Torralba M, Méndez R, Guerri A, Rodríguez M. Protocolo terapéutico de la tuberculosis multirresistente. Protocolos de práctica asistencial. Medicine. 2010;10(56): 3865-9. [ Links ]
14. Cornejo M, Sifuentes E, Ríos I, Cárdenas S. Protocolo de profilaxis infecciosa en la infección por el VIH. Medicine. 2014;11(49):2920-3. [ Links ]
15. Malhão TA, Brito ADS, Pinheiro RS, Cabral C da S, Camargo TMCR de, Coeli CM. Sex differences in diabetes mellitus mortality trends in Brazil, 1980-2012. PloS One. 2016;11(6):e0155996. [ Links ]
16. Redon J, Mourad J-J, Schmieder RE, Volpe M, Weiss TW. Why in 2016 are patients with hypertension not 100% controlled? A call to action. J Hypertens. 2016;34(8):1480-8. [ Links ]
17. Chifundo Kanjala, Denna Michael, Jim Todd, Emma Slaymaker, Clara Calvert, Raphael Isingo, et al. Using HIV-attributable mortality to assess the impact of antiretroviral therapy on adult mortality in rural Tanzania. Glob Health Action. 2014;7:21865. [ Links ]
18. Chihana M, Floyd S, Molesworth A, Crampin AC, Kayuni N, Price A, et al. Adult mortality and probable cause of death in rural northern Malawi in the era of HIV treatment. Trop Med Int Health. 2012;17(8): e74-83. [ Links ]
19. Cornell M, Schomaker M, Belen Garone D, Giddy J, Hoffmann CJ, Lessells R, et al. Gender differences in survival among adult patients starting antiretroviral therapy in south africa: a multicentre cohort study. PLoS Med. 2012;9(9):e1001304. [ Links ]
20. Boulle A, Schomaker M, May MT, Hogg RS, Shepherd BE, Monge S, et al. Mortality in patients with HIV-1 infection starting antiretroviral therapy in South Africa, Europe, or North America: a collaborative analysis of prospective studies. PLoS Med. 2014;11(9):e1001718. [ Links ]
21. Tuboi SH, Schechter M, McGowan CC, Cesar C, Krolewiecki A, Chan P, et al. Mortality during the first year of potent antiretroviral therapy in HIV-1-infected patients in 7 sites throughout Latin America and The Caribbean. J Acquir Immune Defic Syndr. 2009;51(5):615-23. [ Links ]
22. Gupta A, Nadkarni G, Yang WT, Chandrasekhar A, Gupte N, Bisson GP, et al. Early mortality in adults initiating antiretroviral therapy (ART) in low-and middle-income countries (LMIC): a systematic review and meta-analysis. PLoS One. 2011;6(12):e28691. [ Links ]
23. Vela Fachin HF. Características clínicas epidemiológicas en pacientes con VIH/SIDA fallecidos en el Hospital Regional de Loreto enero 2011 diciembre 2013. [Tesis] Iquitos, Facultad de Medicina, Universidad Nacional de la Amazonía Peruana; 2014 [ Links ]
Correspondencia: Raúl Montalvo Otivo, otivo3@hotmail.com
Recibido: 14/04/2016
Aprobado: 02/06/2016













