Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. Peru vol.33 no.3 Lima jul./Set. 2016
REPORTE DE CASO
Fracaso de dosis única de triclabendazole para el tratamiento de fasciolosis humana
Failure of single-dose triclabendazole in the therapy of human fasciolasis
Angélica Terashima1,2, Luis A. Marcos1,3
1 Laboratorio de Parasitología, Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Departamento de Enfermedades Infecciosas, Tropicales y Dermatológicas, Hospital Nacional Cayetano Heredia. Lima, Perú.
3 Departments of Medicine, Microbiology and Molecular Genetics, Global Health Institute, Stony Brook University. Stony Brook, NY, EE UU.
RESUMEN
La fasciolosis humana es prevalente en zonas ganaderas del Perú. La única droga efectiva para tratar a la infección por Fasciola hepatica en la práctica clínica es el triclabendazole (TCBZ). Sin embargo, se ha reportado recientemente resistencia de la F. hepatica al TCBZ en Perú tanto en humanos como en animales. Este problema ya se sospechaba anteriormente en vista que una dosis única de triclabendazole no curaba (eliminación de huevos de Fasciola en heces) en algunos pacientes. Aquí reportamos 11 de 12 casos humanos infectados por F. hepatica que no respondieron a dosis única de TCBZ 10 mg/kg vía oral. En vista de estos resultados observados en la práctica clínica, recomendamos considerar por lo menos dos dosis de TCBZ
para los infectados. Creemos que el tratamiento de fasciolosis se ha convertido en un problema emergente desde el punto de vista farmacológico. Se necesitan nuevos regímenes de terapia o drogas contra F. hepática.
Palabras clave:
Fasciola hepática; Triclabendazole; Resistencia; Heces (fuente: DeCS BIREME).
ABSTRACT
Human fascioliasis is prevalent in cattle raising areas in Peru. The only effective drug against Fasciola hepatica infections in clinical practice is triclabendazole (TCBZ). However, the occurrence of TCBZ-resistant F. hepatica both in humans and animals has recently been reported in Peru. This issue was previously suspected, due to treatment failure (presence of Fasciola eggs after treatment) in some patients receiving a single dose of TCBZ. Here, we report 11 of 12 human cases infected by F. hepatica who did not respond to TCBZ administered in a single 10 mg/Kg oral dose. Given these results observed in clinical practice, we recommend the use of at least two doses of TCBZ for human fascioliasis. Nowadays, the treatment for fascioliasis has become an emergent problem from the pharmacological point of view. New therapies against Fasciola
are urgently needed.
Key words:
Fasciola hepatica; Triclabendazole; Resistance; Feces (source: MeSH NLM).
INTRODUCCIÓN
Fasciolosis, una enfermedad causada por el tremátodo Fasciola hepatica o F. gigantica, afecta típicamente a animales y humanos ubicados en zonas ganaderas (1), y puede ocasionar fibrosis del hígado y ocasionalmente cirrosis hepatica (2). La actual droga de elección para el tratamiento de la fasciolosis es el triclabendazole (TCBZ), pero el problema de la resistencia a esa droga por parte de F. hepatica se ha venido reportando en forma progresiva en animales principalmente (3), lo cual es sumamente preocupante pues los humanos podrían adquirir la infección por F. hepatica por una cepa resistente al TCBZ. Por ejemplo, se han reportado casos humanos con fasciolosis que no han respondido al TCBZ en los Países Bajos (1 caso) (4) y Perú (7 casos) (5). Además, Perú es uno de los países con las más altas tasas de infección por F. hepatica en humanos en el mundo (6,7). Así como TCBZ fue incorporado al Petitorio Nacional de Medicamentos Esenciales del Ministerio de Salud en Perú en el año 2006, es necesario el monitore o de resistencia a esta droga. El objetivo de este estudio es reportar 11 casos de infección por F. hepatica que no respondieron a una dosis única de TCBZ.
REPORTE DE CASO
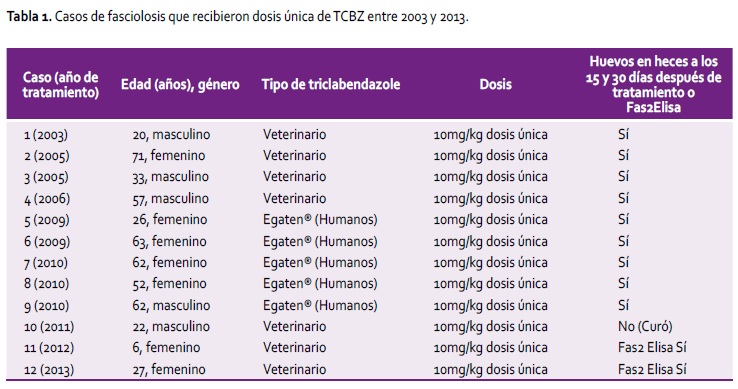
Este es un estudio retrospectivo de casos clínicos con la infección por F. hepatica quienes fueron atendidos entre 2003 y 2013 en Consulta Externa del Departamento de Enfermedades Infecciosas, Tropicales y Dermatológicas del Hospital Nacional Cayetano Heredia, Lima, Perú; quienes recibieron una dosis única de TCBZ 10 mg/kg (junto con comida) y que continuaron teniendo huevos de F. hepatica en heces en el seguimiento o serología Fas2-Elisa positiva (Tabla 1). Algunos casos recibieron TCBZ de uso veterinario (no había disponible el uso en humanos en Perú en ese momento en cuatro pacientes; tres recibieron en otros establecimientos de salud) (Fasinex suspension, Novartis Animal Health Ltd., Surrey, UK). Diez casos fueron diagnosticados en base a la presencia de huevos de F. hepatica mediante examen parasitológico en heces y dos de ellos mediante la técnica de Fas 2 Elisa (sensibilidad 92,4-96,7% especificidad 83,6% -100%) (8,9) reconocida como el método de elección para la fase aguda en el Report of the WHO Informal Meeting (10). La definición de no respuesta a este régimen de TCBZ fue la presencia de huevos de F. hepatica en heces durante los días 15 y 30 del primer mes después del tratamiento o persistencia del Fas2 Elisa altamente positivo y sin variación serológica. Se realizaron dos exámenes parasitológicos a cada individuo dentro del primer mes de tratamiento. El medicamento fue tomado por el paciente en presencia del médico. La definición de cura fue tener negativos los exámenes de heces para huevos de F. hepatica dentro de los primeros 90 días después del tratamiento o la prueba del Fas2 Elisa negativo. La prueba parasitológica empleada fue la prueba Técnica de Sedimentación Rápida de Lumbreras (11) la cual se ejecuta de manera rutinaria en el Laboratorio de Parasitología del Instituto de Medicina Tropical Alexander von Humboldt. Un total de 12 pacientes recibieron dosis única vía oral de triclabendazole 10 mg/kg entre 2003 y 2013, solo uno (caso #10) cumplió con criterio de cura (8,3%). Los mismos paci entes si respondieron a un segundo o tercer curso de TCBZ.
DISCUSIÓN
En este estudio hemos encontrado que una sola dosis de TCBZ para el tratamiento de fasciolosis en humanos no fue suficiente para cumplir con el criterio de cura parasitológica. Solo 8,3% de un total de 12 casos pudo curar con esta dosis única. Aun no podemos precisar si existe resistencia al TCBZ por parte de F. hepatica, pero si podemos asegurar que existe fracaso al tratamiento por usar una dosis única según nuestros resultados. Por lo tanto, no recomendamos el uso de dosis única como régimen empírico en las Normas Técnicas, Guías o Directivas Nacionales o Regionales para tratar fasciolosis, pues podría conducir a la aparición y emergencia de cepas de F. hepatica resistentes al TCBZ a larga escala. Este fenómeno de resistencia tiene que ser examinado a nivel genético y celular para la identificación de los mecanismos de resistencia que conlleva a que la F. hepatica sobreviva durante el tratamiento con TCBZ, lo cual conduciría a abrir nuevas opciones terapéuticas en la lucha contra esta infección parasitaria a cual afecta generalmente a los más pobres.
La resistencia de F. hepatica al TCBZ se ha reportado en animales del Perú (12) y otros países (3,13). El tratamiento correcto y efectivo de fasciolosis es sumamente importante y necesario para evitar las complicaciones clínicas por esta infección tales como colangitis, fibrosis del hígado, hematoma subscapular del hígado, anemia y cirugías innecesarias (14-16). En áreas donde la resistencia al TCBZ aun no ha sido reportada, las tasas de curación alcanzan casi el 100% (17). No obstante, se han reportado casos humanos de resistencia al TCBZ en algunas zonas de Sudamérica (5,18). Recientemente, se ha reportado resistencia al TCBZ en zonas del norte de Perú (12) donde el TCBZ ha sido empleado extensivamente por décadas para el tratamiento de fasciolosis en ganado vacuno y ovino. El monitoreo de cepas resistencias al TCBZ debe ser uno de los objetivos en cualquier lugar donde el uso de TCBZ se emplee de manera masiva en animales o humanos. No existen muchas otras alternativas terapéuticas para fasciolosis. El Artemether es una droga que mostró resultados interesantes contra F. hepatica durante estudios iniciales in vitro, pero lamentablemente mostró una escasa actividad contra fasciolosis durante un ensayo clínico en fase 2 (19). En la actualidad, el arsenal terapéutico en contra de fasciolosis es muy limitado y es urgente la necesidad de tener nuevas drogas efectivas contra este tremátodo.
Diversos estudios han tratado de estudiar el mecanismo de resistencia de Fasciola al TCBZ pero ninguno ha logrado aun aclarar el mecanismo preciso. En el pasado se había mostrado que un polimorfismo único de nucleótido (A T687G) en el gen de la glicoproteína-P del parasito era el responsable de la resistencia al TCBZ, pero esto no fue corroborado en otro estudio en Australia (20), por lo tanto esta hipótesis fue rechazada. Se sabe que la resistencia de los nematodos a las drogas de la familia benzimidazole está ligada a una substitución de un aminoácido (phenilalanina a tirosina) en la posición 200 de la molécula Beta-tubulina, pero en Fasciola no se ha encontrado tal hallazgo a pesar que la tubulina estaba intacta en aquellos parásitos resistentes al TCBZ a comparación de los no resistentes, estos últimos tenían la tubulina destruida por acción del TCBZ (21). Otro estudio trato de comparar los haplotipos de los genes NAD1 y COX1 de Fasciola en diferentes poblaciones y no pudo encontrar una diferencia signifi cativa entre poblaciones de parásitos procedentes de distintos hospederos (22). Futuros estudios son necesarios para aclarar el mecanismo de acción de resistencia lo cual posiblemente contribuiría al hallazgo de nuevas armas para el tratamiento de esta zoonosis.
En nuestra experiencia, de un total de 88 pacientes, el esquema de dos dosis de TCBZ a 10 mg/kg dosis única en el 1er y 3er día tuvo una curación del 100% (n=19). Una dosis de 10 mg/kg al día en dos días continuos, la cura fue del 93,02% (n=43). Una dosis de 10 mg/kg vía oral repetida a las 12 h solo curo 50% (n=12). Una dosis de 15 mg/kg vía oral repartida en dos partes curo 85,7% (n=14) (Terashima et al, publicación en preparación). En este estudio se notó que la eficacia del esquema de dosis de TCBZ a 10 mg/kg dosis única en 1er y 3er día cayó del 100% durante 1995-2001 a 37% durante 2014-2015. Desafortunadamente, no hay terapias efectivas para Fasciola en la actualidad.
Si bien esta es una serie de casos de un solo centro de referencia (no se puede comparar con los resultados de otro centro porque en ningún otro se emplea la Técnica de Sedimentación Rápida de Lumbreras para diagnóstico de fasciolosis), consideramos que no es recomendable el uso de una dosis única de TCBZ para el tratamiento de fasciolosis por lo menos en el Perú. Se necesitan estudios para evaluar nuevas drogas o estrategias terapéuticas para el tratamiento de fasciolosis.
Fuente de financiamiento:
Los autores declaran no haber recibido ninguna financiación para la realización de este trabajo.
Conflicto de intereses:
Los autores declaran no tener conflicto de intereses con la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Mas-Coma S. Epidemiology of fascioliasis in human endemic areas. J Helminthol. 2005;79(3):207-16. [ Links ]
2. Machicado C, Machicado JD, Maco V, Terashima A, Marcos LA. Association of Fasciola hepatica infection with liver fibrosis, cirrhosis, and cancer: a systematic review. PloS Negl Trop Dis. 2016;10(9):e0004962. [ Links ]
3. Fairweather I. Reducing the future threat from (liver) fluke: realistic prospect or quixotic fantasy? Vet Parasitol. 2011;180(1-2):133-43. [ Links ]
4. Winkelhagen AJ, Mank T, de Vries PJ, Soetekouw R. Apparent triclabendazole-resistant human Fasciola hepatica infection, the Netherlands. Emerg Infect Dis. 2012;18(6):1028-9. [ Links ]
5. Cabada MM, Lopez M, Cruz M, Delgado JR, Hill V, White AC Jr. Treatment failure after multiple courses of triclabendazole among patients with fascioliasis in Cusco, Peru: a case series. PLoS Negl Trop Dis. 2016;10(1):e0004361. [ Links ]
6. González LC, Esteban JG, Bargues MD, Valero MA, Ortiz P, Náquira C, et al. Hyperendemic human fascioliasis in Andean valleys: an altitudinal transect analysis in children of Cajamarca province, Peru. Acta Trop. 2011;120(1-2):119-29. [ Links ]
7. Marcos LA, Terashima A, Leguia G, Canales M, Espinoza JR, Gotuzzo E. Fasciola hepatica infection in Peru: an emergent disease. Rev Gastroenterol Peru. 2007;27(4):389-96. [ Links ]
8. Espinoza JR, Maco V, Marcos L, Saez S, Neyra V, Terashima A, et al. Evaluation of Fas2-ELISA for the serological detection of Fasciola hepatica infection in humans. Am J Trop Med Hyg. 2007;76(5):977-82. [ Links ]
9. Maco V, Marcos LA, Terashima A, Samalvides F, Miranda E, Espinoza J, et al. Fas2-ELISA y la Técnica de Sedimentación Rápida modificada por Lumbreras en el diagnóstico de la infección por Fasciola hepatica. Rev Med Hered. 2002;13(2):49-57. [ Links ]
10. World Health Organization. Report of the WHO Informal Meeting on use of triclabendazole in fascioliasis control. Geneva: WHO; 2006. [ Links ]
11. Lumbreras H, Cantella R, Burga R. Acerca de un procedimiento de sedimentación rápida para investigar huevos de Fasciola hepatica en las heces, su evaluación y uso en el campo. Rev Med Per. 1962;31:167-74. [ Links ]
12. Ortiz P, Scarcella S, Cerna C, Rosales C, Cabrera M, Guzmán M, et al. Resistance of Fasciola hepatica against Triclabendazole in cattle in Cajamarca (Peru): a clinical trial and an in vivo efficacy test in sheep. Vet Parasitol. 2013;195(1-2):118-21. [ Links ]
13. Brockwell YM, Elliott TP, Stanton R, Spithill TW, Sangster NC. Confirmation of Fasciola hepatica resistant to triclabendazole in naturally infected Australian beef and dairy cattle. Int J Parasitol Drugs Drug Resist. 2013;4(1):48-54. [ Links ]
14. Marcos LA, Terashima A, Gotuzzo E. Update on hepatobiliary flukes: fascioliasis, opisthorchiasis and clonorchiasis. Curr Opin Infect Dis. 2008;21(5):523-30. [ Links ]
15. Marcos LA, Tagle M, Terashima A, Bussalleu A, Ramirez C, Carrasco C, et al. Natural history, clinicoradiologic correlates, and response to triclabendazole in acute massive fascioliasis. Am J Trop Med Hyg. 2008;78(2):222-7. [ Links ]
16. Hawramy TA, Saeed KA, Qaradaghy SH, Karboli TA, Nore BF, Bayati NH. Sporadic incidence of Fascioliasis detected during hepatobiliary procedures: a study of 18 patients from Sulaimaniyah governorate. BMC Res Notes. 2012;5:691. [ Links ]
17. Maco V, Marcos L, Delgado J, Herrera J, Nestares J, Terashima A, et al. Efficacy and tolerability of two single-day regimens of triclabendazole for fascioliasis in Peruvian children. Rev Soc Bras Med Trop. 2015;48(4):445-53. [ Links ]
18. Gil LC, Díaz A, Rueda C, Martínez C, Castillo D, Apt W. Fascioliasis hpática humana: Resistencia al tratamiento con tricabendazol. Rev Med Chile. 2014;142(19):1330-3. [ Links ]
19. Keiser J, Sayed H, el-Ghanam M, Sabry H, Anani S, el-Wakeel A, et al. Efficacy and safety of artemether in the treatment of chronic fascioliasis in Egypt: exploratory phase-2 trials. PLoS Negl Trop Dis. 2011;5(9):e1285. [ Links ]
20. Elliot TP, Spithill TW. The T687G SNP in a P-glycoprotein gene of Fasciola hepatica is not associated with resistance totriclabendazole in two resistant Australian populations. Mol Biochem Parasitol. 2014;198(1):45-7. [ Links ]
21. Robinson MW, Trudgett A, Hoey EM, Fairweather I. Triclabendazole-resistant Fasciola hepatica: beta-tubulin and response to in vitro treatment withtriclabendazole. Parasitology. 2002;124(Pt 3):325-38. [ Links ]
22. Elliott T, Muller A, Brockwell Y, Murphy N, Grillo V, Toet HM, et al. Evidence for high genetic diversity of NAD1 and COX1 mitochondrial haplotypes among triclabendazoleresistant and susceptible populations and field isolates of Fasciola hepatica (liver fluke) in Australia. Vet Parasitol. 2014;200(1-2):90-6. [ Links ]
Correspondencia
Angélica Terashima maria.terashima@upch.pe
Recibido: 15/08/2016
Arbitrado por pares
Aprobado: 07/09/2016
Citar como: Terashima A, Marcos LA. Fracaso de dosis única de triclabendazole para el tratamiento de fasciolosis humana. Acta Med Peru. 2016;33(3):228-31