Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. Peru vol.34 no.3 Lima July/Sep. 2017
ARTÍCULO DE REVISIÓN
Desarrollo de guías de práctica clínica basadas en evidencia en Perú desde el sector público
The development of evidence-based clinical practice guidelines in Peru for public healthcare facilities
Jorge A García-Mostajo1,2,3, Carlos Alva-Díaz1,3, Víctor Suárez3, Raúl Timaná3, Carlos Canelo-Aybar4,5
1 Red de Eficacia Clínica y Sanitaria. Lima, Perú.
2 Hospital Guillermo Kaelin de la Fuente. Lima, Perú.
3 Instituto de Evaluación de Tecnologías en Salud e Investigación, Seguro Social de Salud. Lima, Perú.
4 Centro Cochrane Iberoamericano, Instituto de Investigación Biomédica Sant Pau. Barcelona, España.
5 Facultad de Ciencias de la Salud, Universidad Peruana de Ciencias Aplicadas. Lima, Perú.
RESUMEN
En el Perú, la elaboración de guías de práctica clínica tiene exigencia normativa desde el año 2005 (NT N° 027-MINSA/DGSP-V.01); sin embargo, su desarrollo ha ténido poco énfasis en la calidad metodológica de las mismas, prefiriendo el tipo narrativo. Desde hace varios años se realizan esfuerzos dispersos para mejorar la calidad metodológica, principalmente que su elaboaración esté basada en evidencias científicas. Actualmente se cuenta con una nueva normativa (NT N° 302-2015/MINSA) que pone mayor enfasis en esta exigencia y algunas instituciones ya trabajan para adecuarse a estandares internacionales y poder generar impactos positivos en nuestro sistema de salud a través del adecuado desarrollo de guias de practica clínica en nuestro pais.
Palabras clave: Guías de práctica clínica como asunto; Medicina basada en la evidencia; Adhesión a directriz (fuente: DeCS BIREME).
ABSTRACT
There has been a regulation for generating clinical practice guidelines in Peru since 2005 (NT N° 027-MINSA/DGSP-V.01), which was issued by the Ministry of Health. However, its use has had little emphasis in the methodological quality of such guidelines, and a narrative style was preferred. Some isolated efforts aiming to improve the quality of such guidelines have taken place, especially with respect to have such documents produced based on evidence. Now we have a new regulation (NT N° 302-2015/MINSA), which places more emphasis in this requirement; and some institutions are already working in such way, in order to comply with international standards and be able to generate a positive impact in our healthcare system through the adequate development of clinical practice guidelines in our country.
Keywords: Practice guidelines as topic; Evidence-based medicine; Guideline adherence (source: MeSH NLM).
INTRODUCCIÓN
Las guías de práctica clínica (GPC) son definidas por el Instituto de Medicina (IOM, del inglés Institute of Medicine) (USA) como "declaraciones que incluyen recomendaciones destinadas a optimizar la atención al paciente que elaboraron mediante la revisión sistemática de las evidencias existentes y la evaluación de riesgos y beneficios de las diferentes opciones de cuidados" (1). Las GPC sustentan el manejo adecuado de patologías prevalentes en cada país, brindando soporte a los profesionales de la salud para el uso de intervenciones de beneficio comprobado (2,3); cuando una GPC presenta alta calidad metodológica tiene más probabilidades de contar con recomendaciones pertinentes y apropiadas (3,4).
Para que una GPC sea confiable, el IOM recomienda que debe: 1) basarse en una revisión sistemática de la evidencia existente; 2) ser desarrollado por un grupo de expertos bien informado y multidisciplinario y representantes de los grupos claves afectados; 3) considerar importantes subgrupos y preferencias de los pacientes; 4) basarse en un proceso explícito y transparente que minimice las distorsiones, prejuicios y conflictos de interés; 5) proporcionar explicaciones claras de la relación entre las opciones alternativas de cuidado y los resultados de salud, y proporcionar calificaciones tanto de la calidad de la evidencia como de la fuerza de las recomendaciones; y 6) reconsiderar y revisar de forma conveniente cuando nuevas evidencias justifican la modificación de recomendaciones (1).
CALIDAD Y DISCORDANCIA ENTRE GPC
Las guías sobre un mismo tema o patología de diferentes instituciones no siempre son concordantes en sus recomendaciones incluso cuando se utilizan las mismas fuentes de evidencia (5). Estas discordancias podrían explicarse debido a las diferentes prevalencias de las enfermedades de los paises, diferentes tipos de evidencias utilizadas o en la evaluación de calidad de las mismas, elección en los descenlaces clínicos de interés que guían las recomendaciones asi como por preferencias y conflictos de interés de los elaboradores (6). Estas discordancias en las recomendaciones entre las GPC también se explican por diferencias en la calidad de su elaboración y de las evidencias utilizadas. Se ha estimado que hasta un 94% de la variación en el nivel de calidad de las GPC podrían explicarse por la calidad de las evidencias utilizadas para su desarrollo. Además, se ha reconocido que las GPC basadas en evidencia presentan una mejor calidad que las GPC basadas en consenso y que el uso explícito de evidencias de alta calidad puede conducir a una mejor concordancia de las recomendaciones entre guías (7).
Para resolver estos problemas, se propone que las GPC armonicen su proceso de elaboración mediante el uso de metodologías estandarizadas, reduzcan al mínimo posible los sesgos financieros o intelectuales de los elaboradores mediante la declaración completa de los conflictos de interés, acuerden previamente los descenlaces clínicos críticos e importantes para evaluar la eficacia de las intervenciones diagnósticos y terapéuticas, y generen propuestas de nuevas investigaciones que permitan resolver las areas de incertidumbre donde exista discordancia por la ausencia de evidencias sólidas (6).
DESARROLLO DE GPC BASADAS EN EVIDENCIA
El desarrollo de una GPC se inicia por la priorización sistemática y explícita de temas que es un proceso complejo y se realiza mediante la aplicación de diferentes criterios como los efectos de las intervenciones sobre la salud, sobre los costos y la política sanitaria de los países (8).
Luego se seleccionan las preguntas a resolver que deben de ser claras, precisas y específicas para facilitar la búsqueda y revisión de la evidencia científica (9). Se recomienda el uso del formato PICO (por sus siglas en inglés, patient, intervention, comparison and outcome) o el PIPOH (por sus siglas en inglés, population, intervention, professionals, outcome and health care) de la colaboración ADAPTE para el desarrollo de GPC adaptadas (10). Estas preguntas guian la busqueda exhaustiva y explícita de todas las evidencias pertinentes de bases de datos como la biblioteca Cochrane, Medline, Embase, otras específicas según el tema en desarrollo u organizaciones recopiladores como el Centro Nacional de Guías de Estados Unidos (NGC, de sus siglas en inglés National Guideline) (11,12).
Una vez realizada la búsqueda bibliográfica es necesario evaluar la calidad de la evidencia y formular las recomendaciones. La calidad de la evidencia debiera estar íntimamente relacionada con la fuerza de las recomendaciones (13). El método GRADE (por sus siglas en inglés, Grading of Recommendations Assessment, Development and Evaluation) permite la evaluación de la evidencia y formulación de recomendaciones; es el más reconocido a nivel internacional con más de 100 organizaciones que lo usan o han adoptado sus principios, incluyendo la Organización Mundial de la Salud, la Colaboración Cochrane y el Instituto Nacional de Excelencia para la Salud y los Cuidados (NICE, por sus siglas en inglés National Institute for Health and Care Excellence) (14). Este método categoriza los desenlaces de interés y su importancia relativa, evalúa la calidad de las evidencias y obtiene una calidad global, y gradúa la fuerza de las recomendaciones (15).
Finalmente, para la adaptación o adopción de una GPC es necesario valorar su calidad global. Para ello se recomienda utilizar el AGREE (por sus siglas en inglés, Appraisal of Guidelines for Research & Evaluation) (16) y su actualización el AGREE II que son instrumentos validados internacionalmente y traducidos a mas de 33 idiomas para evaluar el rigor metodológico de las GPC (17,18).
Las GPC no nacieron basadas en evidencia y su desarrollo ha ido mejorando a través del tiempo. Se estimó que de 431 GPC realizadas en Estados Unidos y publicadas en MEDLINE, entre enero de 1988 y julio de 1998, el 67% no reportó ninguna descripción de los usuarios, 88% no informó sobre la estrategia de búsqueda utilizada y 82% no dio ninguna clasificación explícita de su sistema de recomendaciones. Solo 22 (5%) GPC evaluaron estos tres criterios de calidad. Sin embargo, hubo una mejora en el tiempo en sus estrategias de búsqueda (de 2% al 18%, p <0,001) y en su sistema de recomendación (de 6% a 27%, p <0,001) (19). Los resultados de Alonso Coello et al. tambien muestran una evolución positiva en cuanto a los criterios de calidad del instrumento AGREE en el desarrollo de las GPC identificadas en MEDLINE desde 1988 hasta el 2007. A pesar de un cierto aumento progresivo en la calidad de las GPC, sus niveles, según lo medido con el instrumento AGREE, se han mantenido de moderados a bajos en las últimas dos décadas (20).
REGLAMENTACIÓN PARA DESARROLLO DE GPC EN PERÚ
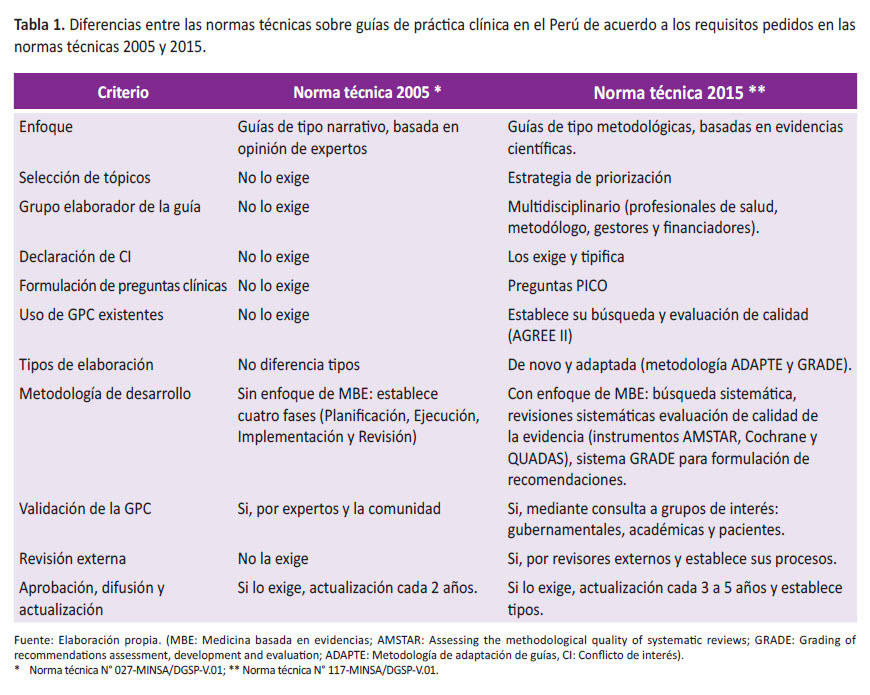
En el Perú, en el año 2005, el Ministerio de Salud (MINSA) emitió la primera norma técnica que establecía la metodología para la elaboración de guías de práctica clínica, el ámbito de aplicación, responsabilidades en su difusión e implementación, entre otros aspectos, con el objetivo de estandarizar la elaboración de GPC, tanto en instituciones públicas como privadas.
En ella se establecían los niveles de evidencia según la clasificación del US Preventive Task Force, ampliamente reconocida para entonces, pero descuidaba aspectos de importancia como los relacionados al proceso de selección de preguntas a responder o la posibilidad de adaptar GPC ya existentes. Así mismo, establecía una estructura extensa y poco práctica que no necesariamente se ajustaba a lo establecido internacionalmente para el desarrollo de una GPC de calidad (21).
En el año 2015, el Ministerio de Salud (MINSA) aprobó la norma técnica de salud para la elaboración y uso de GPC, desarrollada en conjunto con el Instituto Nacional de Salud (INS), que actualizó la norma previa y contemplaba, a diferencia de la anterior, la elaboración de GPC de novo y adaptadas, organización para el proceso de elaboración, ciclo de producción normativa, pasos para la elaboración de GPC, aprobación ante situaciones de emergencia o urgencias, e incluía responsabilidades a nivel nacional, regional y local (22). En la misma se establece el desarrollo de GPC siguiendo una metodología de alta calidad y de acuerdo a estándares internacionales (preguntas PICO, bases de datos biomédicas, estrategia de búsqueda, evaluación de la evidencia y formulación de recomendaciones mediante el sistema GRADE (Tabla 1) (23).
Asimismo, el Seguro Social de Salud (EsSalud) desarrolló una directiva interna que operativiza para su institución, respecto a las responsabilidades y procesos, la norma del 2015 del MINSA. El aporte de esta norma radica en la posibilidad de desarrollar guías adoptadas, que se refieren a elaborar GPC las cuales siguen un proceso que consiste en elegir la mejor guía disponible, aceptar y adecuar las recomendaciones tal cual se presentan en la misma al contexto local (24).
También existe el Reglamento de Establecimientos de Salud y Servicios Médicos de Apoyo que indica que los establecimientos de salud y servicios médicos de apoyo deben contar, en cada área, unidad o servicio, con GPC (25) y la Norma Técnica de Salud para la Acreditación de Establecimientos de Salud y Servicios Médicos de Apoyo, aprobada en el 2007, que establece como uno de los aspectos a evaluar que los servicios de internamiento cuenten con GPC de atención de las diez patologías más frecuentes atendidas por cada servicio (26). No obstante, resulta paradójico este pedido, al tomar en cuenta que la elaboración de una sola GPC implica una gran logística, altos costos, experticia y un equipo multidisciplinario, recursos con los que no se cuenta en la mayoría de establecimientos de salud por lo que el desarrollo de GPC debierán dirigirse y desarrollarse para el marco nacional.
INSTITUCIONES QUE DESARROLLAN GPC BASADAS EN EVIDENCIA EN EL MUNDO Y LA REGIÓN
Existen diversas instituciones reconocidas internacionalmente que elaboran GPC de calidad y siguiendo una rigurosa metodología como el NICE (27). La Red Escocesa Intercolegiada sobre Guías de Práctica Clínica (SIGN, por sus siglas en inglés) que desarrolla GPC para el Servicio Nacional de Salud de Escocia (28). A nivel regional destaca desarrollo de GPC realizado por el Centro Nacional de Excelencia Tecnológica en Salud (CENETEC) de México y el trabajo realizado por el Instituto de Evaluación Tecnológica en Salud (IETS) de Colombia (29,30).
DESARROLLO DE GPC BASADAS EN EVIDENCIA EN EL SECTOR SALUD DE PERÚ
Las investigaciones sobre el impacto económico para los sistemas de salud de paises desarrollados y en vías de desarrollo que genera la implementacion de guias clínicas basadas en evidencias muestran un significativo ahorro económico sobre los costos de las intervenciones que dependen de los clínicos en hospitales (31).
Sin embargo, el desarrollo de GPC que seguían las pautas recomendadas por la norma técnica del año 2005 han mostrado una pobre calidad metodológica, al ser evaluadas con el instrumento AGREE II, como lo muestra una reciente publicación sobre GPC desarrolladas en Perú para el manejo de hipertensión arterial y diabetes mellitus 2, aprobadas para uso a nivel nacional por el MINSA, donde se concluye que estas GPC no cumplian con los esta´ndares internacionales aceptados y recomendados (32).
Por lo tanto, en el Perú el desarrollo de guias a sido mínimo, disperso y aislado. Instituciones como la Unidad de Ana´lisis y Generacio´n de Evidencias en Salud Pu´blica (UNAGESP) del Centro Nacional de Salud Pública del INS han realizado esfuerzos para la generación de evidencias que contribuyan al desarrollo de GPC de relevancia para la salud pública del País. Además, EsSalud que para diciembre del 2015 tenía una población asegurada activa de casi 11 millones (33), desde mayo del 2015 constituyó el Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), que tiene entre sus funciones evaluar y aprobar GPC, y elaborar las mismas en caso se traten de temas priorizados en Essalud. En ese sentido, el IETSI aprobó las condiciones clínicas a ser priorizadas para la elaboración de GPC en EsSalud, de las cuales actualmente se vienen desarrollando las guías de cáncer de mama, lumbalgia y trastornos minerales y óseos en pacientes con enfermedad renal crónica (34,35). Asimismo, el IETSI ha aprobado l a GPC para el diagnóstico y tratamiento de la hemofilia; la primera guía aprobada y publicada que cumple todo el rigor metodológico que exige la norma técnica del 2015 del MINSA (36).
CONCLUSIONES
Las modificaciones normativas están dando impulso al desarrollo de GPC con un enfoque de calidad y eficiencia y que en el futuro debería lograr un gran impacto en la mejoría de las prestaciones de servicios de salud. Tambien es tiempo que, de manera similar a otros países tanto en Latinoamérica y el Caribe y el mundo, las GPC sean elaboradas no por cada hospital o establecimiento de salud, sino por instituciones que tengan un mayor alcance, como el MINSA y Essalud, con esfuerzos compartidos y se incluyan otras organizaciones (universidades, institutos y sociedades científicas) para lograr que éstas se desarrollen con alta calidad metodológica y se apliquen en todas las instituciones de acuerdo a sus niveles de complejidad y finalmente podamos estandarizar y mejorar los procesos de atención en salud.
Fuentes de financiamiento: Ninguna
Conflictos de interés: Los autores declaran no tener ningún conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Institute of Medicine Committee on Standards for Developing Trustworthy Clinical Practice G. In: Graham R, Mancher M, Miller Wolman D, Greenfield S, Steinberg E, editors. Clinical practice guidelines we can trust. Washington, DC: National Academies Press; 2011. [ Links ]
2. McAlister FA, van Diepen S, Padwal RS, Johnson JA, Majumdar SR. How evidence-based are the recommendations in evidence-based guidelines? PLoS Med. 2007;4(8):e250. [ Links ]
3. Chen Y, Hu S, Wu L, Fang X, Xu W, Shen G. Clinical practice guidelines for hypertension in China: a systematic review of the methodological quality. BMJ Open. 2015;5(7):e008099. [ Links ]
4. Alvarez-Vargas ML, Galvez-Olortegui JK, Galvez-Olortegui TV, Sosa- Rosado JM, Camacho-Saavedra LA. Clinical practice guidelines in hypertension: a review. Medwave. 2015;15(9):e6290. [ Links ]
5. Paschke R, Hegedus L, Alexander E, Valcavi R, Papini E, Gharib H. Thyroid nodule guidelines: agreement, disagreement and need for future research. Nat Rev Endocrinol. 2011;7(6):354-61. [ Links ]
6. Sobieraj-Teague M, Eikelboom JW, Hirsh J. How can we reduce disagreement among guidelines for venous thromboembolism prevention? J Thromb Haemost. 2010;8(4):675-7. [ Links ]
7. Cruse H, Winiarek M, Marshburn J, Clark O, Djulbegovic B. Quality and methods of developing practice guidelines. BMC Health Serv Res. 2002;2(1):1. [ Links ]
8. Reveiz L, Tellez DR, Castillo JS, Mosquera PA, Torres M, Cuervo LG, et al. Prioritization strategies in clinical practice guidelines development: a pilot study. Health Res Policy Syst. 2010;8:7. [ Links ]
9. Alonso-Coello P, Asensio del Barrio C, Briones Pérez de la Blanca E, Casariego-Vales E, Díaz Del Campo P, Estrada M. Elaboracio´n de Gui´as de Pra´ctica Cli´nica en el Sistema Nacional de Salud. Madrid: Ministerio de Sanidad y Consumo; 2007. [ Links ]
10. Guideline Adaptation: A Resource Toolkit (Internte). Perth: The ADAPTE Collaboration; 2009 (citado el 24 de setiembre de 2016). Disponible en: http://www.g-i-n.net [ Links ]
11. Cook DJ, Greengold NL, Ellrodt AG, Weingarten SR. The relation between systematic reviews and practice guidelines. Ann Intern Med. 1997;127(3):210-6. [ Links ]
12. National Guideline Clearinghouse. Rockville, Maryland: Agency for Healthcare Research and Quality; c2016 (citado el 2 de abril de 2016). Disponible en: http://www.guideline.gov [ Links ]
13. Guyatt GH, Oxman AD, Kunz R, Vist GE, Falck-Ytter Y, Schunemann HJ. What is "quality of evidence" and why is it important to clinicians? BMJ. 2008;336(7651):995-8. [ Links ]
14. Alonso-Coello P, Schunemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016;353:i2016. [ Links ]
15. Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336(7650):924-6. [ Links ]
16. Development and validation of an international appraisal instrument for assessing the quality of clinical practice guidelines: the AGREE project. Qual Saf Health Care. 2003;12(1):18-23. [ Links ]
17. Makarski J, Brouwers MC; AGREE Enterprise. The AGREE Enterprise: a decade of advancing clinical practice guidelines. Implement Sci. 2014;9:103. [ Links ]
18. Brouwers M, Browman G, Burgers J, Cluzeau F, Davis D, Feder G. Instrumento AGREE II: Instrumento para la evaluación de guías de práctica clínica (Internet). Madrid: Consorcio AGREE; 2009 (citado el 24 de setiembre de 2016). Disponible en: http://www.agreetrust.org/wp-content/uploads/2013/06/AGREE_II_Spanish.pdf [ Links ]
19. Grilli R, Magrini N, Penna A, Mura G, Liberati A. Practice guidelines developed by specialty societies: the need for a critical appraisal. Lancet. 2000;355(9198):103-6. [ Links ]
20. Alonso-Coello P, Irfan A, Sola I, Gich I, Delgado-Noguera M, Rigau D, et al. The quality of clinical practice guidelines over the last two decades: a systematic review of guideline appraisal studies. Qual Saf Health Care. 2010;19(6):e58. [ Links ]
21. Norma técnica para la elaboración de guías de práctica clínica. Norma técnica N° 027-MINSA/DGSP-V.01. [ Links ] Resolución Ministerial N° 422-2005/MINSA (1 de junio de 2005).
22. Norma técnica para la elaboración y uso de guías de práctica clínica. Norma técnica N° 117-MINSA/DGSP-V.01. Ministerio de Salud. Resolución Ministerial N° 302-2015/MINSA (14 de mayo de 2015). [ Links ]
23. Documento técnico: Metodología para la elaboración de guías de práctica clínica. [ Links ] Resolución Ministerial N° 414-2015/MINSA (1 de julio de 2015).
24. Resolución de Instituto de Evaluación de Tecnologías en Salud e Investigación N° 12-IETSI-ESSALUD-2016 (Internet). Lima, Perú: Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI); 2016 (citado el 24 de setiembre de 2016). Disponible en: http://www.essalud.gob.pe/ietsi/index.html [ Links ]
25. Reglamento de establecimientos de salud y servicios médicos de apoyo. Decreto Supremo N° 013 – 2006 – SA (25 de junio de 2006). [ Links ]
26. Norma técnica de salud para la acreditación de establecimientos de salud y servicios médicos de apoyo. Resolución Ministerial N° 456-2007/MINSA (4 de junio de 2007). [ Links ]
27. National Institute for Health and Care Excellence (Internet). London: NICE; c2016 (citado el 24 de setiembre de 2016). Disponible en: http://www.nice.org.uk [ Links ]
28. Scottish Intercollegiate Guidelines Network. Edinburgh: SIGN; c2016 (citado el 24 de setiembre de 2016). Disponible en: http://www.sign.ac.uk [ Links ]
29. Instituto de Evaluación Tecnológica en Salud. Bogotá: IETS; c2016 (citado el 24 de setiembre de 2016). Disponible en: http://www.iets.org.co [ Links ]
30. Centro Nacional de Excelencia Tecnológica en Salud. México: CENETEC Salud; c2016 (citado el 24 de setiembre de 2016). Disponible en: http://www.cenetec.salud.gob.mx [ Links ]
31. Kosimbei G, Hanson K, English M. Do clinical guidelines reduce clinician dependent costs? Health Res Policy Syst. 2011;9:24. [ Links ]
32. Neira-Sanchez ER, Malaga G. ¿Son las guías de práctica clínica de hipertensión arterial y diabetes mellitus tipo 2 elaboradas por el MINSA, confiables? Rev Peru Med Exp Salud Publica. 2016;33(2):377-9. [ Links ]
33. Estadística institucional de Essalud. Lima: Essalud; 2015 (citado el 3 de abril de 2016). Disponible en: http://www.essalud.gob.pe/estadistica-institucional/ [ Links ]
34. Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI). Reglamento de Organización y Funciones. Lima: EsSalud; 2015. [ Links ]
35. Resolución de Instituto de Evaluación de Tecnologías en Salud e Investigación N° 10-IETSI-ESSALUD-2015 (Internet). Lima, Perú: Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI); 2015 (citado el 24 de setiembre de 2016). Disponible en: http://www.essalud.gob.pe/ietsi/index.html [ Links ]
36. Resolución de Instituto de Evaluación de Tecnologías en Salud e Investigación N° 32-IETSI-ESSALUD-2016 (Internet). Lima, Perú: Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI); 2016 (citado el 24 de setiembre de 2016). Disponible en: http://www.essalud.gob.pe/ietsi/index.html [ Links ]
Correspondencia
Jorge García Mostajo
Recibido: 14/05/2017
Aprobado: 19/07/2017
Citar como: García-Mostajo JA, Alva-Díaz C, Suárez V, Timaná R, Canelo-Aybar C. Desarrollo de guías de práctica clínica basadas en evidencia en Perú desde el sector público. Acta Med Peru. 2017;34(3):203-7