Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. Peru vol.34 no.3 Lima jul./set. 2017
ARTÍCULO ESPECIAL
Normatividad relacionada al control de calidad analítica en los laboratorios clínicos del Perú
Regulations related to quality control of the tests performed by clinical laboratories in Peru
Luis Edgardo Figueroa-Montes1,2,3
1 Servicio de Patología Clínica, Hospital III Suárez Angamos, EsSalud. Lima, Perú.
2 Asociación Médica Peruana de Patología Clínica. Lima, Perú.
3 Asociación Americana de Química Clínica. Washington, Estados Unidos.
RESUMEN
El presente artículo especial tiene como propósito detallar las normas y regulaciones, elaboradas por instituciones peruanas, involucradas con la calidad analítica de los laboratorios cínicos. Además, refuerza la importancia de las responsabilidades de los gestores y profesionales de la medicina de laboratorio, en su rol de entregar resultados confiables y con calidad analítica, que permitirán una toma de decisiones clínicas por parte del profesional de la salud y así realizar una intervención oportuna al paciente, en beneficio de su diagnóstico, monitoreo o tratamiento.
Palabras clave: Gestión de la calidad total; Técnicas de laboratorio clínico; Control de calidad; Regulación gubernamental (fuente: DeCS BIREME).
ABSTRACT
This special paper aims to show the norms and regulations prepared by Peruvian institutions with respect to quality control of the tests performed in clinical laboratories. We also emphasize the importance of the responsibility of both managers and personnel from the labs, with respect to deliver reliable results with good quality, which may allow proper decision making for health care professionals and perform timely interventions for patients, with the benefit of a good diagnosis, monitoring and therapy.
Keywords: Total quality management, Clinical laboratory techniques; Quality control; Government regulation (source: MeSH NLM).
INTRODUCCIÓN
Actualmente, nuestras sociedades experimentan cambios importantes y los modelos de atención de los sistemas de salud deben evolucionar para adaptarse al nuevo marco epidemiológico. El aumento de la esperanza de vida nos lleva a un progresivo envejecimiento de la población y a un aumento en la prevalencia e incidencia de las enfermedades crónicas (1). Por otro lado, el contexto económico actual obliga a buscar la máxima eficiencia en la gestión de los limitados recursos disponibles, con el fin de llegar a un equilibrio financiero, fundamental para mantener las prestaciones sanitarias (1). Por lo tanto, debemos entender, que el paciente se transforma en el centro de la asistencia sanitaria y la seguridad del paciente debe ser una prioridad, para evitar causar daños innecesarios a los pacientes como consecuencia de la mala asistencia sanitaria que reciben (1).
Los pacientes no son ajenos a esta realidad. Una encuesta realizada a 18 029 personas en 25 países alrededor del mundo, con el fin de conocer sus mayores preocupaciones, demuestra que, a los peruanos, los temas del sector salud no son ajenos, ubicándolo en el sexto lugar con un 16%, por debajo de temas como la inseguridad ciudadana, corrupción, educación, desempleo e inequidades sociales (2). Por otro lado, la Organización Mundial de la Salud, a través de los últimos 17 objetivos y 169 metas para el desarrollo sostenible, planteados como agenda mundial hasta el 2030, refiere que el personal sanitario es imprescindible para el logro de estos objetivos (3).
En ese sentido, los profesionales de la medicina de laboratorio, deben contribuir a posicionar al paciente en el centro de la atención sanitaria, y contribuir con los mejores resultados de laboratorio, para su correcta intervención clínica, ya sea para su prevención, diagnóstico, seguimiento, monitorización o tratamiento (4).
Es aquí, donde cada gestor de los laboratorios clínicos públicos o privados, en su compromiso y competencia, deberán implementar o acoger las regulaciones o normas obligatorias o voluntarias por ejemplo, mediante un sistema de gestión de la calidad o de la gestión clínica que permitan consolidar el proceso total del test (pre-preanalitica, preanalítica, analítica, posanalítica y pos-posanalítica), para que sus resultados sean robustos y confiables, en beneficio de los médicos y pacientes (5-7).
Por esta razón, en esta publicación se busca revisar la normatividad nacional, vinculada al control de calidad analítica en los servicios de patología clínica, detallando los alcances de sus normas y regulaciones nacionales.
TERMINOLOGÍA EN GESTIÓN DE LA CALIDAD
Los principios de la gestión de la calidad, permiten conducir y operar una organización en forma exitosa; estableciendo que ésta se dirija y controle en forma sistemática y transparente. Considerando esta temática es importante definir algunos términos que permitan una mayor comprensión (8-11).
Calidad: grado en el que un conjunto de características inherentes cumple con los requisitos. El término "calidad" puede utilizarse acompañado de adjetivos tales como pobre, buena o excelente. El término "inherente", en contraposición a "asignado", significa que existe en algo, especialmente como una característica permanente.
Sistema de gestión: sistema para establecer la política y los objetivos. Para lograr dichos objetivos, un sistema de gestión de una organización podría incluir diferentes sistemas, tales como un sistema de gestión de la calidad, un sistema de gestión financiera o un sistema de gestión ambiental.
Sistema de gestión de la calidad: sistema de gestión para dirigir y controlar una organización con respecto a la calidad.
Control de la calidad: parte de la gestión de la calidad enfocada a alcanzar los requerimientos de la calidad. En los exámenes vinculados a la salud, el conjunto de procedimientos diseñados para monitorear el método de prueba y los resultados para asegurar el desempeño apropiado del sistema de prueba. El propósito del control de la calidad es asegurar que todos los requerimientos de la calidad sean alcanzados. El conjunto de mecanismos, procesos y procedimientos diseñados para monitorear el sistema de medición para asegurar que los resultados sean confiables para el uso clínico deseado.
Control estadístico de la calidad: procedimiento en el cual se miden muestras estables y los resultados obtenidos se comparan con límites que describen la variación esperada cuando el sistema se encuentra funcionando apropiadamente.
Corrida analítica: un intervalo (por ejemplo, un período de tiempo o serie de mediciones) dentro del cual la exactitud y precisión del sistema de medida se espera sea estable; entre estos intervalos podrían ocurrir eventos que hagan que el método sea más susceptible (por ejemplo, mayor riesgo) a errores que son importantes detectar.
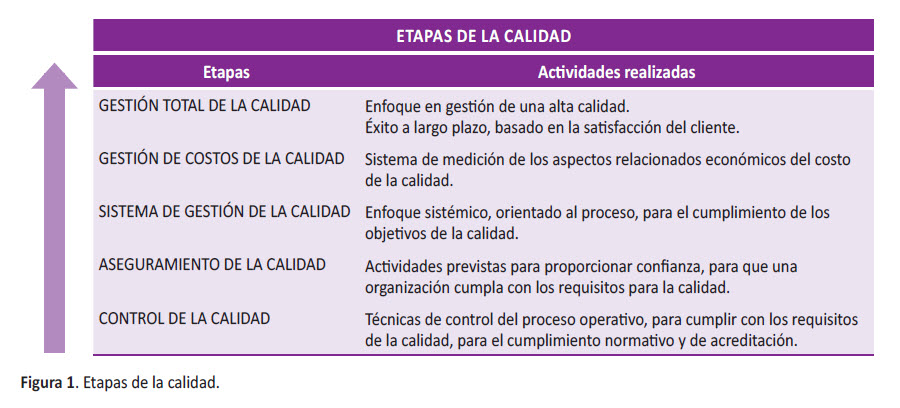
ETAPAS DE LA CALIDAD
El Clinical Laboratory Standards Institute (CLSI), en su guía Quality Management System: A Model for Laboratory Services, detalla los 12 elementos esenciales de un sistema de calidad, que son universales y aplicables a cualquier laboratorio, ya sea simple o complejo y en cualquier área del laboratorio. Esta guía describe las etapas de la calidad (Figura 1), en la cual podemos observar que el control de la calidad es la base de este esquema, dando inicio a todas las etapas posteriores, culminando en la satisfacción plena de los usuarios internos o externos (12).
IMPACTO DEL CONTROL DE LA CALIDAD ANALÍTICA
Actualmente, la industria diagnóstica y los profesionales de laboratorio, están contribuyendo significativamente con la disminución de errores generados en el proceso total de los test de laboratorio clínico. Estas intervenciones, han logrado en estas últimas décadas disminuir las tasas de error analítico (validez analítica).
La industria diagnóstica de los dispositivos in vitro para el laboratorio clínico, por su parte impulsan las mejoras en la tecnología de los reactivos (menos pasos, menos reacciones) y los equipos automatizados, detectando coágulos, burbujas, hemólisis o lipemias altas, sistemas informáticos de laboratorio más robustos (LIS), códigos de barra, agitación ultrasónica y otros procedimientos para favorecer la calidad analítica.
Los profesionales del laboratorio, cada vez toman más conciencia sobre el impacto de aplicar guías o directrices, que contribuyan significativamente en disminuir la imprecisión y mejorar la veracidad de los métodos analíticos, en beneficio de disminuir el error total analítico, en comparación con nuestro requerimiento de calidad analítico.
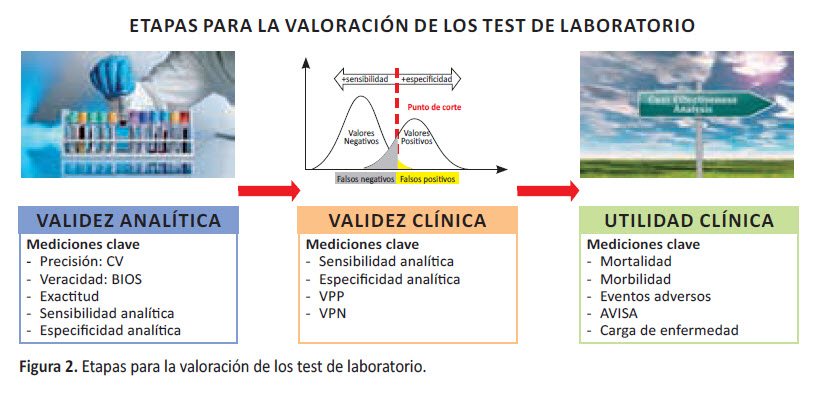
Sin embargo, un tema pendiente es avanzar hacia intervenciones, que no solo vean la validez analítica, debemos también evaluar la validez clínica (sensibilidad, especificidad, otros) y la utilidad clínica de los exámenes de laboratorio (costo beneficio, carga de enfermedad, análisis de económico de la salud) (13) (Figura 2).
CIFRAS NACIONALES EN SALUD
Según la página oficial de la Superintendencia Nacional de Salud (SUSALUD), al 10 de julio de 2017, observamos un 84,2% de ciudadanos con una cobertura de aseguramiento en salud (26 520 979 de afiliados). Del total de afiliados, el 56,9% pertenecen al Seguro Integral de Salud (SIS), el 33,4% a la seguridad social (EsSalud) y el resto de afiliados a otros tipos de aseguradoras (Fuerzas Armadas y Policiales, Entidades Prestadoras de Salud, otros). En relación a las Instituciones Prestadoras de Servicios de Salud (IPRESS) observamos que existen 20 600 establecimientos de salud y centros de apoyo activos, de los cuales el 57,1% pertenecen al sector privado y el 42,9% al sector público. En Lima, observamos un total de 7 274 establecimientos de salud (14).
EsSalud por ejemplo en el año 2016, realizó 52 953 956 exámenes de laboratorio a nivel nacional según su reporte estadístico (15). Esta cifra podría proyectarnos un promedio anual entre 200 a 400 millones de exámenes de laboratorio anuales en el Perú; estando todos estos exámenes directamente relacionados a un adecuado control de calidad analítica.
NORMATIVIDAD PERUANA EN RELACIÓN AL CONTROL DE CALIDAD ANALÍTICA
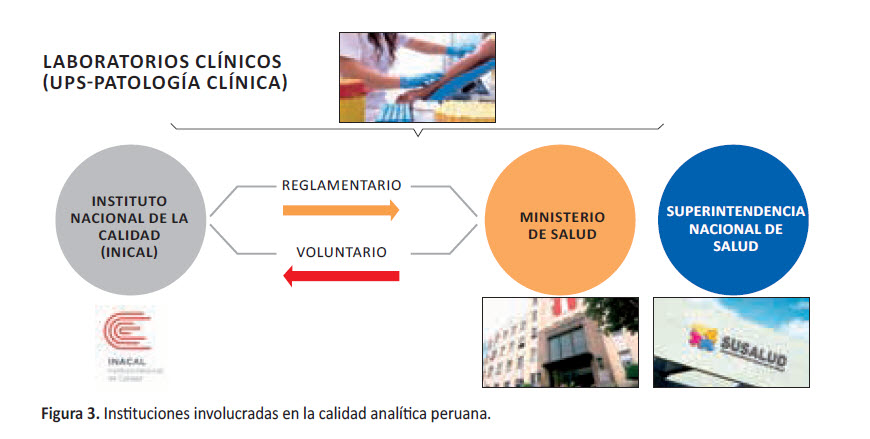
En Perú, las unidades productoras de servicios de salud de patología clínica, tienen tres instituciones que tutelan su normatividad en relación al control de calidad analítico, dos de ellas son reglamentarias, es decir de obligatorio cumplimiento y aplicación: Ministerio de Salud y Superintendencia Nacional de Salud. Y la otra institución, el Instituto Nacional de la Calidad (INACAL), la emisión de normas emitidas es para cumplimiento voluntario, es decir que dependerá de los laboratorios clínicos su aplicación o adopción. (Figura 3).
Normas del Ministerio de Salud (MINSA)
El 11 de setiembre de 2008, el MINSA emitió la Norma Técnica de Salud de la Unidad Productora de Servicios de Patología Clínica, NTS N° 072 MINSA - DGSP-V.01 -Ministerio de Salud, mediante la resolución ministerial RM Nº 627-2008/MINSA (16,17).
El objetivo de esta norma es mejorar la calidad de atención en los servicios de patología clínica públicos y privados, estableciendo criterios de organización y funcionamiento, para una adecuada gestión; regulando las condiciones de infraestructura, equipamiento y recursos humanos; estableciendo criterios de gestión, organización y prestación del servicio, con criterios de calidad, seguridad y oportunidad; y asegurando el flujo adecuado de los recursos destinados a la atención, así como su uso racional.
Esta norma, incluye instrumentos de gestión, divididos en 15 instrumentos técnicos administrativos y siete técnicos asistenciales. También refiere que el gestor clínico, responsable del laboratorio clínico, debe implementar y desarrollar las políticas, programas y procedimientos de la gestión de la calidad.
Entonces bajo este criterio, los laboratorios clínicos del país deben implementar un sistema de gestión de la calidad, dentro de su organización. Al respecto, esta norma tiene como bibliografía a la NTP-ISO 15189:2004 Laboratorios Médicos, sobre requisitos particulares para la calidad y competencia. Esta norma fue adoptada como norma peruana por el Organismo de Normalización-Instituto Nacional de Defensa de la Competencia y de la Protección de la Propiedad Intelectual (INDECOPI) en el año 2004 (18).
En esta norma, se incluyen los conceptos de control de calidad interno y externo, como partes de la fase analítica:
Control interno: es prospectivo y valida el análisis procesado. El objetivo del control interno de la calidad es detectar la eventual existencia de anomalías en el proceso de medida, debe además ser especialmente eficaz en la detección de errores que superen el máximo tolerable, es decir asegurar que los resultados obtenidos no presenten más error que el característico del procedimiento, o errores adicionales que comprometan la calidad de los resultados.
Control externo: es retrospectivo y estima el error sistemático. El control externo de la calidad abarca diferentes procesos mediante los cuales se ejerce la evaluación de la calidad y exactitud de los resultados gracias a la intervención de una organización ajena, a través de un programa de evaluación externa o evaluación interlaboratorial.
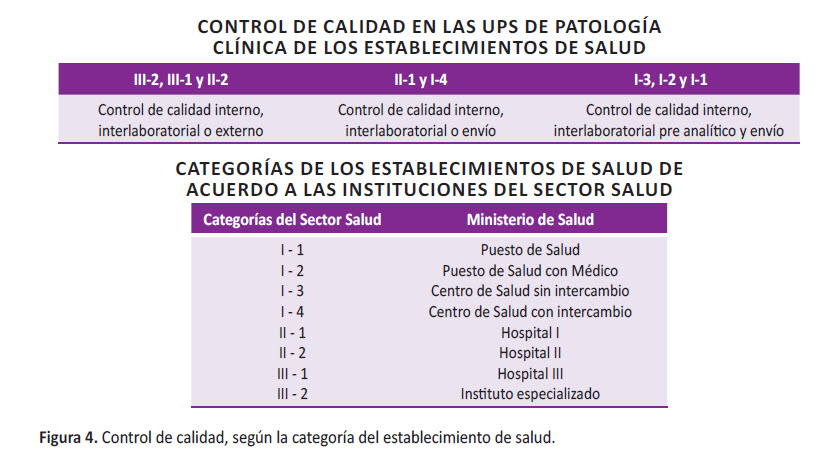
Además, se menciona que la aplicación del control de calidad analítico dependerá del nivel asistencial de los establecimientos de salud (Figura 4).
Normas de la Superintendencia Nacional de Salud (SUSALUD)
SUSALUD, tiene como objetivo proteger los derechos en salud de cada peruano. Orienta sus acciones a empoderar y colocar al ciudadano en el centro del sistema de salud nacional, sin importar donde se atienda o su condición de aseguramiento. Además, tiene la potestad para actuar sobre todas las IPRESS, así como las Instituciones Administradoras de Fondos de Aseguramiento en Salud (IAFAS) sean públicas, privadas o mixtas (19).
En enero de 2015, SUSALUD, según la Resolución de Superintendencia N° 006-2015-SUSALUD/S, aprobó el instrumento de supervisión selectiva, aplicable a las Unidades Productoras de Servicios de Salud (UPSS) de Patología Clínica. Actualmente, este instrumento está siendo aplicado en las UPSS de Patología Clínica públicas y privadas en nuestro país (20). Este instrumento está conformado por 69 verificadores asistenciales y administrativos. Después de que los laboratorios son fiscalizados o supervisados por SUSALUD, emiten un informe final, estableciendo el riesgo con relación al cumplimiento de los verificadores: menor de 60% de cumplimiento (alto riesgo), entre 60% y 80% (moderado riesgo) y mayor del 80% (bajo riesgo). Después del informe remitido a la IPRESS, el laboratorio clínico elabora un plan de mitigación de riesgos, para la implementación de las mejoras a favor del levantamiento de las observaciones, ya sea transfiriendo, asumiendo o minimizando el riesgo. Con este modelo de supervisión, en base al cumplimiento normativo y gestión del riesgo operativo, SUSALUD busca garantizar la seguridad de la atención en salud y el mejoramiento continuo de la calidad de los servicios (21).
Asimismo, este instrumento contiene verificadores de preanalítica, analítica y posanalítica; con anexos para evaluar las características de los ambientes, indicadores, temas de ingeniería clínica y equipamiento no analítico. Sin embargo, no se toman en cuenta los verificadores pre-preanalíticos y pos-posanalíticos.
A pesar de que incluyen términos como "mitigación del riesgo", este modelo se aleja de los modelos o herramientas establecidas para la gestión de riesgos en los laboratorios clínicos, que son recomendados en la actualidad (22).
Normas del Instituto Nacional de la Calidad (INACAL)
El INACAL es un organismo público técnico especializado, adscrito al Ministerio de la Producción y es el ente rector y máxima autoridad técnico-normativa del Sistema Nacional para la Calidad, responsable de su funcionamiento en el marco de lo establecido en la Ley N° 30224; la misma que crea, en julio del año 2014, el Sistema Nacional para la Calidad y el Instituto Nacional de Calidad (23).
En su estructura orgánica, cuenta con cuatro direcciones: acreditación, normalización, metrología y desarrollo estratégico de la calidad. A la fecha, esta institución ha creado dos comités técnicos, relacionados a las actividades que desarrollan los laboratorios clínicos en nuestro país.
• Comité Técnico de Acreditación de Laboratorios Clínicos. Este comité está bajo la tutela de la dirección de acreditación. Esta dirección es la instancia competente para administrar la política y gestión de la acreditación, y ejerce funciones a nivel nacional. La acreditación es el reconocimiento formal de la competencia técnica, que recibe un organismo de evaluación de la conformidad, luego de someterse a una auditoría para demostrar que cumple con las normas y directrices internacionalmente reconocidas. El INACAL, en febrero de 2017, lanzó el "Programa de Acreditación de Laboratorios Clínicos" con la finalidad de mejorar los sistemas de gestión de calidad de los laboratorios. Refiere que más del 80% de las decisiones médicas se basan en datos proporcionados por un laboratorio clínico, por lo cual estos resultados se emplean para el diagnóstico, tratamiento y seguimiento de enfermedades. Pero ¿qué sucede cuando el laboratorio no tiene implementado sistemas de gestión de calidad?, la respuesta es preocupante, su resultado clínico no es confiable. Un estudio realizado en el Perú, por el organismo de Cooperación Internacional PTB (Physikalisch Technische Bundesanstalt - Instituto Nacional de Metrología de Alemania), menciona que aumenta la preocupación de la situación en los laboratorios clínicos. Los resultados dan cuenta que solo el 10% de estos establecimientos opera con sistemas basados en procesos y sistemas de gestión de la calidad, el 84% no conoce la norma de acreditación aplicable a su rubro la ISO 15189, el 90% de los laboratorios clínicos no realiza un aseguramiento de la calidad, mientras que el 92% no conoce o no emplea los servicios de metrología de las empresas o instituciones acreditadas por INACAL, que permitan asegurar la calibración de los instrumentos o equipos clínicos que utilizan. Ante esta situación, el INACAL ha puesto en marcha el programa de acreditación de laboratorios clínicos, un esfuerzo de la empresa privada y del estado para cambiar esta dura realidad y que permitirá que los laboratorios clínicos trabajen con estándares de calidad que generen confianza en los resultados de sus análisis (24).
Actualmente en la página web del INACAL, podemos descargar documentos específicos elaborados por el comité técnico, para los laboratorios públicos o privados que deseen solicitar su acreditación en el país (25). Entre los documentos disponibles se encuentran:
- Directriz para la acreditación de laboratorios clínicos.
- Directriz para la estimación y expresión de la incertidumbre de la medición en laboratorios clínicos.
- Directriz de criterios para la participación en ensayos de aptitud - comparaciones interlaboratorios.
- Directriz de criterios para la trazabilidad de las mediciones.
• Comité Técnico de Normalización de Pruebas de Laboratorio Clínico y Sistemas para Diagnóstico In Vitro. Este comité está bajo la tutela de la dirección de normalización. Esta dirección es la instancia responsable del desarrollo de las actividades de normalización en el ámbito nacional y goza de autonomía técnica y funcional, y se sujeta a lo establecido en el Acuerdo sobre Obstáculos Técnicos al Comercio de la Organización Mundial del Comercio y los acuerdos internacionales sobre normalización. En relación a los laboratorios clínicos, la participación en normalización internacional se realiza en el Organismo Internacional de Normalización (ISO). En setiembre de 2016, se instaló el Comité Técnico de Normalización de Pruebas de Laboratorio Clínico y Sistemas para Diagnóstico In Vitro, con el objetivo de elaborar Normas Técnicas Peruanas (NTP), que brinden soporte para la implementación de la norma de NTP-ISO 15189 que serán utilizados por los laboratorios clínicos en el desarrollo de sus sistemas de gestión de la calidad y en la mejora de su competencia técnica. Las normas técnicas ayudarán a que los laboratorios clínicos cuenten con actividades normalizadas, sobre todo aquellas que impactan en la confiabilidad de los resultados hacia los usuarios; asimismo, la gestión de calidad, procedimientos de pre y posanalítica, rendimiento analítico, sistemas de referencia y garantía de calidad. El equipo de trabajo será un comité espejo del comité ISO/TC 212 denominado Prueba Clínicas de Laboratorio y Sistemas de Prueba para Diagnóstico In Vitro. Actualmente este comité técnico ya realizó la revisión y traducción de dos normas: ISO 15190 y 15195 (26).
DISCUSIÓN
En una reciente publicación de la Sociedad Americana de Patología Clínica, refiere que Estados Unidos tiene aproximadamente 250 000 laboratorios clínicos acreditados por sus entidades acreditadoras (27). Este escenario, se aleja mucho de la realidad en Latinoamérica, tal como lo indica un estudio, en donde se reporta que no existe información en el Perú, sobre laboratorios clínicos acreditados (28). Sin embargo, esta situación podría cambiar en el corto plazo, si consideramos que el programa de acreditación oficialmente fue lanzado por el INACAL en febrero del presente año.
En relación a la Norma Técnica de Salud de la Unidad Productora de Servicios de Patología Clínica, NTS N°072 MINSA - DGSP-V.01, se debe tener en cuenta que, fue publicada en el 2008 y está por cumplir una década de vigencia. Sin embargo, el escenario de la Patología Clínica, ha presentado muchos cambios, debido a las mejoras en las tecnologías de los reactivos, equipos y guías en las diferentes áreas del laboratorio, en especial en el campo de la calidad analítica cuantitativa y cualitativa. También la norma ISO 15189, que fue la base para su elaboración, tiene una nueva versión 2012. La norma ISO 15189 se ha adoptado como guía de referencia de las entidades acreditadoras en los diferentes países, para ejecutar los procesos de evaluación de laboratorios clínicos, por lo que es utilizada a nivel mundial para propósitos de acreditación. La entidad acreditadora es la encargada de evaluar la conformidad de cumplimiento de los requisitos de la norma ISO 15189 y atestiguar la competencia del laboratorio para realizar tareas específicas de examen clínico o médico (29). Por lo tanto, una actualización de esta norma, con los diferentes actores clave, beneficiaría mucho a los laboratorios públicos y privados en nuestro país, más aún si consideramos el lamentable crecimiento de la economía informal en el sector salud (30).
En la actualidad existen diferentes metodologías en beneficio del control de calidad analítica cuantitativa o cualitativa, por eso es fundamental que los profesionales del laboratorio clínico aprendan, dominen y apliquen métodos de control de calidad (31). Asegurar un adecuado ambiente en el trabajo y manejo integral de los recursos humanos es importante, porque la calidad comienza y termina con la gente, permitiendo un buen servicio. El director o el gestor del laboratorio clínico es responsable de proporcionar el apoyo y estructura, para ayudar a los colaboradores a realizar lo correcto. Esta dirección debe definir las políticas de calidad y proporcionar procesos, procedimientos, herramientas y capacitación; que garantice la entrega de resultados previstos para la condición clínica de los pacientes (31).
En conclusión, debemos realizar un esfuerzo multidisciplinario, agrupando a los profesionales de los diferentes sectores públicos y privados, involucrando a las instituciones que tutelan las normas y regulaciones en el Perú: MINSA, SUSALUD, INACAL, con la finalidad de mejorar las normas o políticas actuales y abrazar sin temor el futuro de la medicina de laboratorio clínico centrada en el paciente.
Fuente de financiamiento: autofinanciado
Declaración de conflictos de interés: declaro no tener conflictos de interés durante el planteamiento, ejecución de la investigación y la elaboración del artículo para su publicación.
REFERENCIA BIBLIOGRÁFICAS
1. Sainz de Rozas A, Lekue Alkortab I. El paciente crónico en el centro del sistema sanitario. Farmaceuticos de Atencion Primaria. 2011;9 (Espec Congr):1-2. [ Links ]
2. What Worries the World - February 2017 (Internet). Londres: Ipsos; 2017 (12 de abril de 2017). Disponible en: https://www.ipsos.com/sites/default/files/migrations/en-uk/files/Assets/Docs/Polls/whatworries-the-world-feb-2017-slides.pdf [ Links ]
3. Organización Mundial de la Salud Internet). Objetivos de Desarrollo Sostenible (ODS). Ginebra: OMS; c2017 (citado el 10 de julio de 2017). Disponible en: http://www.who.int/topics/sustainabledevelopment-goals/es/ [ Links ]
4. Hallworth MJ, Epner PL, Ebert C, Fantz CR, Faye SA, Higgins TN, et al. Current evidence and future perspectives on the effective practice of patient-centered laboratory medicine. Clin Chem. 2015;61(4):589-99. [ Links ]
5. Lundberg GD. Acting on significant laboratory results (editorial). JAMA. 1981;245(17):1762-3. [ Links ]
6. Plebani M, Laposata M, Lundberg GD. The brain-to-brain loop concept for laboratory testing 40 years after its introduction. Am J Clin Pathol. 2011;136(6):829-33. [ Links ]
7. Westgard. Identifying failure modes (Internet). Wisconsin: Westgard QC; 2009 (citado el 11 de julio de 17). Disponible en: https://www.westgard.com/identifying-failure-modes.htm [ Links ]
8. Norma Internacional ISO 9000. Sistemas de gestión de la calidad - Fundamentos y vocabulario. Traducción certificada. Geneva: ISO; 2005. [ Links ]
9. Westgard JO. Sistemas de gestión de la calidad para el laboratorio clínico. Madison, WI: QC Westgard Inc.; 2014. [ Links ]
10. Westgard JO. Prácticas básicas de control de la calidad. Madison, WI: QC Westgard Inc.; 2013. [ Links ]
11. Clinical and Laboratory Standards Institute. C24: Statistical quality control for quatitative measurement procedures. Wayne, PA: CLSI; 2006. [ Links ]
12. Clinical and Laboratory Standards Institute. QMS01-A4: Quality management system: a model for laboratory services; approved. Guideline—Fourth Edition. Wayne, PA: CLSI; 2011. [ Links ]
13. The Value of Laboratory Medicine to Health Care. Chapter 1. In: The Lewin Group. Laboratory Medicine: A National Status Report. Atlanta: Centers for Disease Control and Prevention; 2008. p. 19-65. [ Links ]
14. Superintendencia nacional de Salud (Internet). Sistema de Información Gerencial SIG SALUD. Lima: Ministerio de Salud; c2017 (citado el 11 de julio de 2017). Disponible en: http://bi.susalud.gob.pe/QvAJAXZfc/opendoc.htm?document=QV%20Produccion%2FSIG_SUSALUD.qvw&host=QVS%40srvqlikias&anonymous=true [ Links ]
15. EsSalud (Internet). EsSalud en cifras: informativo mensual, definitivo a diciembre del 2016. Lima: Ministerio de Salud; c2017 (citado el 11 de julio de 2017). Disponible en: http://www.essalud.gob.pe/downloads/estadistica/e_c_def_diciembre2016.zip [ Links ]
16. Robles L. Una década de experiencia en el ejercicio de la función de regulación de la autoridad nacional de salud: Perú 2006 – 2015. Horiz Med. 2017;17(2):59-70. [ Links ]
17. Norma técnica de salud de la Unidad Productora de Servicios de Patología Clínica (NTS N° 072-Minsa-DGSP- V.01). Lima: Ministerio de Salud; 2009. [ Links ]
18. Instituto Nacional de Defensa de la Competencia y de la Protección de la Propiedad Intelectual. Infraestructura de la Calidad en el Perú (Internet). Lima: INDECOPI; 2014 (citado el 11 de julio de 2017). Disponible en: http://www.inacal.gob.pe/repositorioaps/data/1/1/5/jer/boletinmetrologia/files/Boletiin_%20IC_2014_INACAL.pdf [ Links ]
19. Superintendencia Nacional de Salud. ¿Qué es SUSALUD (Internet). Lima: SUSALUD; c2017 (citado el 13 de julio de 2017). Disponible en: http://portales.susalud.gob.pe/web/portal/nosotros [ Links ]
20. Superintendencia Nacional de Salud. Resolución de Superintendencia N.° 006-2015-Susalud/S, Instrumento de Supervisión Selectiva de IPRESS aplicable a las Unidades Productoras de Servicios de Salud Patología Clínica de las IPRESS públicas y privadas (promulgado 9 de enero de 2015). Lima, Perú: El Peruano, Normas Legales. 16 ene2015. p. 544853.
21. Benites-Zapata VA, Saravia-Chong HA, Mezones-Holguin E, Aquije- Díaz A, Villegas-Ortega J, Rossel-de-Almeida G, et al. Modelo de supervisión basado en el riesgo para instituciones prestadoras de servicios de salud como herramienta para la protección de los derechos en salud en Perú. Rev Peru Med Exp Salud Publica. 2016;33(3):401-10. [ Links ]
22. Figueroa-Montes LE. Gestión de riesgos en los laboratorios clínicos. Acta Med Peru. 2015:32(4):241-250. [ Links ]
23. Instituto Nacional de la Calidad. Sobre nosotros (Internet). Lima: INACAL; c2017 (citado el 14 de julio de 2017). Disponible desde: https://www.inacal.gob.pe/principal/categoria/acerca-de-inacal [ Links ]
24. Instituto Nacional de la Calidad. Solo el 10% de laboratorios clínicos en el Perú ofrece resultados confiables (Internet). Lima: INACAL; c2017 (citado el 14 de julio de 2017). Disponible en: http://www.inacal.gob.pe/principal/noticia/laboratoriosacreditados [ Links ]
25. Instituto Nacional de la Calidad. Documentos específicos para la acreditación de laboratorios clínicos (Internet). Lima: INACAL; c2017 (citado el 14 de julio de 2017). Disponible en: http://www.inacal.gob.pe/acreditacion/categoria/documentos-especificos [ Links ]
26. Instituto Nacional de la Calidad. Elaboraran normas técnicas peruanas para laboratorios clínicos y sistemas para diagnostico in vitro (Internet). Lima: INACAL; c2017 (citado el 17 de julio de 2017). Disponible en: http://www.inacal.gob.pe/principal/noticia/noti33 [ Links ]
27. Riley S. The Laboratory and Global Health. Critical Values. 2017;10(2):29-31. [ Links ]
28. Garzon AC. Sistemas de gestión en el laboratorio clínico en Latinoamérica. eJIFCC. 2015;26(4):221-5. [ Links ]
29. Norma Internacional ISO ISO 15189. Los laboratorios médicos - Requisitos para la calidad y la competencia. Geneva: ISO; 2012. [ Links ]
30. Vargas-Espejo V. Economía informal en Perú: Situación actual y perspectivas. Lima: Centro Nacional de Planeamiento Estratégico; 2016. [ Links ]
31. Westgard J, Westgard S. Quality control review: implementing a scientifically based quality control system. An Clin Biochem. 2016;53(1):32-50. [ Links ]
Correspondencia
Luis Edgardo Figueroa Montes
Recibido: 18/07/2017
Arbitrado por pares
Aprobado: 16/08/2017
Citar como: Figueroa-Montes LE. Normatividad relacionada al control de calidad analítica en los laboratorios clínicos del Perú. Acta Med Peru. 2017;34(3):237-43














