Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta Médica Peruana
versão On-line ISSN 1728-5917
Acta méd. Peru vol.35 no.1 Lima jan. 2018
ARTÍCULO ESPECIAL
La fiebre amarilla en Colombia: de calamidad pública a enfermedad desatendida
Yellow fever in Colombia: from public calamity to neglected disease
Juanita Hernández-Galvis1a, Ana Beatriz Pizarro2a, J. Andrés Cuestas1a, Camilo Castañeda-Cardona3b, Diego Rosselli1b
1 Facultad de Medicina, Pontificia Universidad Javeriana. Bogotá. Colombia.
2 Facultad de Enfermería, Pontificia Universidad Javeriana. Bogotá, Colombia.
3 NeuroEconomix. Bogotá, Colombia.
a Estudiante, b médico neurólogo.
RESUMEN
Desde su llegada al país a mediados del siglo XVII, la fiebre amarilla jugó un papel importante en la historia patria, primero con epidemias en los puertos del Caribe, y luego, con la navegación a vapor, remontando los ríos principales, sobre todo el Magdalena. Tanto el descubrimiento de los vectores involucrados en la transmisión como el desarrollo de la vacuna delegaron la preocupación a un segundo plano. Los brotes epidémicos de fiebre amarilla, esporádicos y en regiones apartadas, siguieron ocurriendo, para recrudecerse en 2016, en paralelo con lo que ocurre en países vecinos como Perú y Brasil. El vector principal, el Aedes aegypti, involucrado en la transmisión de otros arbovirus, se adapta y se extiende en muchos entornos urbanos del continente. Se cuenta, sin embargo, con una vacuna de relativo bajo costo y de alta efectividad que podría contribuir a la erradicación de la enfermedad.
Palabras clave: Fiebre amarilla; Enfermedades desatendidas; Aedes aegypti (fuente: DeCS BIREME).
ABSTRACT
Since its arrival to Colombia in the middle XVII century, yellow fever played an important role in its history; first with epidemics in the Caribbean ports, and later, when steamboats became available, by navigating upstream the Magdalena River. Both the discovery of the vectors involved in its transmission as well as the development of an effective vaccine led concerns about the disease to a secondary plane. Epidemic outbreaks of yellow fever continued occurring, particularly in very distant regions and also with prolonged time intervals. However, since 2016 there has been a recrudescence of such outbreaks, in parallel with what is going in our neighbor countries, Peru and Brazil. The main vector, Aedes aegypti, is also involved in the transmission of other arbovirus infections, and it is capable of adapting and extending its presence in many urban areas in South America. Nonetheless, a low-cost and highly effective vaccine is available, which may contribute to eradicate the disease.
Keywords: Yellow fever; Neglected diseases; Aedes aegypti (source: MeSH NLM).
EPIDEMIAS DE VÓMITO NEGRO
Las primeras descripciones en América de lo que se llamó entonces 'vómito negro' fueron hechas en Barbados en el año de 1647 y luego en Yucatán, México en 1648 (1). Su llegada a Colombia ocurrió por Cartagena de Indias, tres años más tarde. La denominación de vómito negro, dada por el sangrado gastrointestinal, se mantuvo hasta el año 1750 cuando, por el aspecto ictérico de piel y mucosas, pasó a conocerse como fiebre amarilla. En esas épocas, su etiología fue atribuida a los miasmas, teoría que sostenía incluso el ilustre médico gaditano José Celestino Mutis (1732-1808) (1).
Fue Luis Daniel Beauperthuy (1807-1871), médico de origen francés nacido en la isla caribeña de Guadalupe pero radicado en Venezuela, quien en 1854 sugirió la idea del mosquito como posible agente vector. Unos años después, en 1881, el cubano Carlos Finlay (1833-1915) propuso que el responsable de la transmisión de la fiebre amarilla sería el Stegomyia fasciata (luego llamado Aedes aegypti) (2). Como el mismo Finlay lo afirmó en la sesión de Real Academia de Ciencias Médicas, Físicas y Naturales de La Habana, el 14 de agosto de ese año: 'ha de ser insostenible cualquiera (sic) teoría que atribuya el origen o la propagación de esa enfermedad a influencias atmosféricas, miasmáticas, meteorológicas, ni tampoco al desaseo ni al descuido de medidas higiénicas generales' (3). El brigadier general y pionero de bacteriología en Estados Unidos George Sternberg (1838-1915), en su 'Reporte sobre la etiología y prevención de fiebre amarilla', publicado en 1890 (4), consideró la hipótesis de Finlay como la más probable.
La presunción histórica de que la cuna de la enfermedad se encuentra en el África Occidental ha sido estudiada recientemente mediante estudios filogenéticos del virus, que sitúan su origen hace unos 1500 años (5). Los esclavos africanos habrían traído una inmunidad que no poseían los europeos o los nativos americanos, lo que les ayudaría a poblar exitosamente las islas del Caribe. Es así que en la epidemia que azotó a La Habana en 1649 la lista de muertos incluyó a 536 blancos y 26 negros. Algo similar ocurrió en Río de Janeiro en la epidemia de mediados del siglo XIX; de los 14 545 casos reportados, solo 126 eran negros (2) -y, sin embargo, fue a ellos a los que se los culpó (6) -.
Hugo Sotomayor Tribín (2) describió así la propagación de la fiebre amarilla en Colombia: una primera fase, que se extendió desde su llegada al país en 1651 hasta el inicio de la navegación a vapor (1830), la enfermedad se limitó a la región Caribe y se presentaba en oleadas epidémicas esporádicas. Fue época de epidemias en muchos puertos del mundo, incluyendo Boston y Filadelfia (7) así como ciudades portuarias en España, Francia e Inglaterra (2).
Una segunda fase contempla el ingreso de la fiebre amarilla al interior de Colombia gracias a la navegación a vapor por el río Magdalena. No tardó en entrar también por otras vías fluviales, como los distantes ríos Catatumbo al oriente, en zona fronteriza con Venezuela; Putumayo en la cuenca amazónica y en límites con Ecuador y Perú; y Patía, en la cuenca del Pacífico. Se recuerdan epidemias que asolaron las ciudades de Santa Marta en 1906, Bucaramanga y Girón en 1910, Barranquilla en 1912 y El Socorro en 1929.
Aunque seguían presentándose grandes epidemias -como la que llevó a suspender la construcción del Canal de Panamá en 1885-, la enfermedad se estableció de forma endémica, en el piedemonte oriental de la cordillera Oriental, y la zona esmeraldífera de Boyacá. Fue al estudiar esa última región que el equipo que encabezaba Roberto Franco describió otro vector diferente al A. aegypti. Esa forma de la enfermedad pasó a llamarse fiebre amarilla selvática, que presentaba un comportamiento epidemiológico distinto y era transmitida por el Haemagogus janthinomys (2). Luego se agregaría al Aedes albopictus a la lista de vectores potenciales, que aunque tiene una capacidad de transmisión más baja, puede estar tanto en zonas urbanas como boscosas, del trópico, y abunda en regiones subtropicales (8).
Aunque los vectores se habían identificado muchos años antes, el reto de su prevención se mantenía. Los esfuerzos se concentrarían en dos frentes: el control del vector y la vacunación.
LA ERA DE LAS VACUNAS Y DE LA FIEBRE AMARILLA SELVÁTICA
La historia natural de la fiebre amarilla cambiaría a partir de 1937 cuando fue descubierta la vacuna por Max Theiler y Hugh Smith (9). Hoy en día la capacidad de seroconversión de la vacuna es cercana al 100% (10). El otro factor que cambió la epidemiología de la enfermedad fue la erradicación del A. aegypti, entre 1947 y 1972, cuando prácticamente fue eliminado de Centroamérica y la mayor parte de Sudamérica, y así desapareció la fiebre amarilla urbana (11).
En Colombia, las epidemias de fiebre amarilla selvática se siguieron presentando en la región del Catatumbo, fronteriza con Venezuela, en 1944, 1947 y 1952, así como en la península de La Guajira (San Juan del Cesar y Fonseca) en 1945. Ya para entonces la enfermedad estaba pasando a un segundo plano; no se veían las grandes epidemias que antes afectaban puertos y otros centros urbanos, y los casos, además de escasos y esporádicos, ocurrían en lugares apartados.
En 1958, el médico santandereano Augusto Gast Galvis, quien ya había hecho importantes contribuciones al estudio de la leishmaniasis y la malaria, publicó en el Boletín de la Oficina Sanitaria Panamericana (hoy Revista Panamericana de Salud Pública) un análisis de la epidemiología de la fiebre amarilla en Colombia (12). Gast mostró la distribución geográfica de los brotes epidémicos a lo largo del río Magdalena -que representaban 70% de los casos-, pero también en la Amazonia, el piedemonte llanero y la cuenca del río Catatumbo. También anotó que los brotes se presentaban sobre todo en el período seco de diciembre y enero, así como en julio, cuando las lluvias tendían a ceder.
La frecuencia de brotes a lo largo del río Magdalena se empezó a reducir primero cuando los motores a vapor y leña fueron reemplazados por motores diésel, luego cuando entró en servicio el ferrocarril en 1961, y la navegación se redujo de manera dramática. Y como para poner un cierre dramático a este período, el último de los grandes vapores del Magdalena se incendió en el puerto de Magangué, Bolívar, en 1962 (13).
En 1979 ocurrió un brote epidémico de fiebre amarilla selvática en el piedemonte de la sierra nevada de Santa Marta (14). Veinte casos fueron confirmados por examen histopatológico o por aislamiento viral, y en 36 no se hizo confirmación diagnóstica; 14 de los primeros fallecieron, así como 13 de los segundos. Los episodios aislados, o en pequeños brotes continuaron. En total, la Organización Panamericana de la Salud registró 198 casos confirmados en Colombia en el quinquenio 1976-1980, y 30 más entre 1981 y 1985 (15).
LA FIEBRE AMARILLA SE NIEGA A DESAPARECER
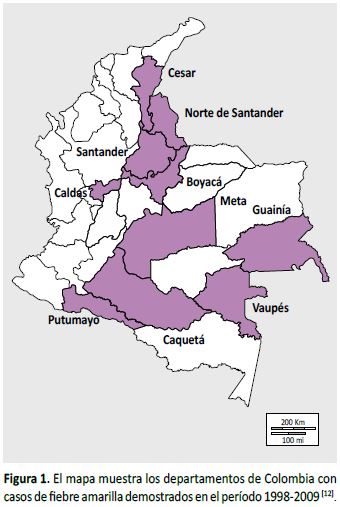
Un análisis epidemiológico publicado en el año 2013 por un grupo de investigadores de la Universidad CES (16), que como siempre ocurre en estos casos menciona la limitación potencial del subregistro, revisó la incidencia y la mortalidad atribuida a la fiebre amarilla ocurridas entre 1998 y 2009. En los 14 años previos (1985-98) se habían presentado cinco casos y cuatro muertes. A partir de entonces hubo un recrudecimiento. En 1999 ocurrieron dos casos, ambos mortales; en 2001, nueve casos y cinco muertes; en 2002 fueron 12 casos, ocho de ellos mortales, mientras que en 2003 se presentó la peor epidemia, con 101 casos y 45 muertes (según otra fuente (17) fueron 112 casos y 50 muertes); el 90% de los fallecidos fueron hombres, en su mayoría jóvenes y con baja escolaridad; el sitio más golpeado había sido norte de Santander (16) (Figura 1).
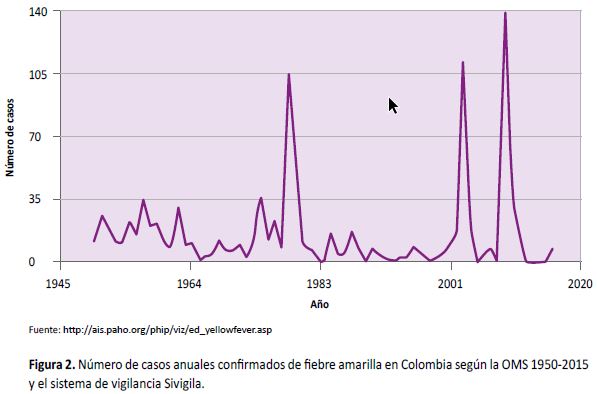
Algunos casos también se presentaron al otro lado del país, en el departamento de Guaviare (18). La Figura 2 muestra el número de casos confirmados en el lapso 1950 a 2015. Después de siete años sin notificar ningún caso, en 2016 se notificaron siete casos confirmados y cinco probables en los departamentos de Amazonas, Antioquia, Córdoba, Guainía, Magdalena, Meta, Vaupés y Vichada (19). Estos casos coinciden con un recrudecimiento epidémico en el Perú en donde, hasta la semana epidemiológica 21, se habían reportado 56 casos, nueve de ellos fatales; en su mayor parte (40 casos) eran procedentes del departamento de Junín (20).
LOS NUEVOS RETOS
Las denominadas 'enfermedades desatendidas' (neglected diseases), casi todas ellas de origen infeccioso y que ocurren predominantemente en países de bajos ingresos, tienen en común la falta de incentivos para su investigación, dado un mercado poco promisorio para la industria farmacéutica (21). Incluso en los países afectados, los recursos destinados a su investigación son reducidos (22).
Hoy la investigación en fiebre amarilla debe centrarse en varios frentes que permitan una prevención y control más eficaces. Eso incluye los estudios de los vectores, particularmente el A. aegypti involucrado en la transmisión de otras virosis, de los reservorios no humanos de la enfermedad, de los aspectos inmunológicos de la enfermedad y de los aspectos de salud pública que mejoren la cobertura de vacunación.
Además de los seres humanos, se han identificado otros reservorios de la fiebre amarilla selvática como el mono aullador (Alouatta seniculus) (23), el mono araña (Ateles sp.) (24), el mono ardilla (Saimiri sp.) (25), y el mono lechuza (Aotus trivirgatus) (23). En el 70% de los departamentos con antecedentes de fiebre amarilla hay presencia del mono aullador rojo (23). Se han mencionado también, aunque no encontramos referencias en la literatura indexada, a la zarigüeya (didelfimorfos), el agutí (género Dasyprocta), la paca (Cuniculus paca), y el chigüiro (Hydrochoerus hydrochaeris) (2).
De otro lado, se han identificado ejemplares de A. aegypti en lugares de Colombia no detectados anteriormente, como el municipio de La Pedrera, Amazonas (26) o a alturas superiores a los 1 800 metros de altitud (incluso 2 300 metros) en el departamento de Antioquia (27), lo que sin duda tendrá incidencia en la epidemiología de esta y otras enfermedades transmitidas por este vector.
Desde el año 2013, el Ministerio de Salud y Protección Social colombiano definió, a través la circular 0045, que solo era necesario la aplicación de una única dosis de vacuna contra la enfermedad, respaldado por los estudios realizados por la OMS que demostraban que una sola dosis confería inmunidad de por vida, adquiriendo su 99% de efectividad al día 10 de aplicada.
Las entidades del estado, las instituciones prestadoras de salud y las empresas prestadoras de planes y beneficios deben comprometerse, por ley, a cumplir con un esquema de vacunación gratuito a todos los infantes a los 18 meses de edad en todo el país, o a los 12 meses en zonas de alto riesgo. Adicionalmente, se requiere un certificado internacional de vacunación de la fiebre amarilla para viajar a zonas con alto número de casos, el cual será pedido en el aeropuerto previo al vuelo por parte de la aerolínea, y es requerido por la aeronáutica civil y sanidad aeroportuaria. Así mismo, las secretarías departamentales deben encargarse e llevar a cabo la respectiva y detallada notificación de los casos (28). El Programa Ampliado de Inmunizaciones dispone de puntos de vacunación en todo el territorio nacional. Los viajeros, y en general cualquier ciudadano, puede obtenerla allí de manera gratuita (29).
Dicho lo anterior, el Ministerio de Salud afirma que 'la vacuna contra la fiebre amarilla es la herramienta más costo/efectiva para la prevención y control de esta enfermedad, por lo tanto es indispensable mejorar las coberturas de vacunación existentes en las zonas de riesgo' y establece que la vacuna de fiebre amarilla está indicada una dosis para toda la población mayor de un año y menor de 60 años, que no tengan contraindicaciones (30). Esos aspectos teóricos, sin embargo, se deben analizar desde una realidad en donde el público en general no ve la necesidad de vacunarse, y desconoce la seriedad de la enfermedad y la eficacia y seguridad de la vacuna.
Si bien desde el año 2003, la vacuna de fiebre amarilla está incorporada en el PAI e incluye a todos los niños del territorio nacional. Los hombres adultos, en particular en zonas de frontera selvática, no están necesariamente recibiendo ese beneficio.
CONCLUSIÓN
La fiebre amarilla ha jugado un papel importante en la historia de América. De las grandes epidemias de los tiempos coloniales, y gracias tanto a las intervenciones de salud pública como a la vacunación, pasó por un tiempo a una tener frecuencia más larvada, casi inexistente para los sistemas de salud y para el público general. La amenaza, como lo demuestran los recientes brotes en Brasil, Perú y Bolivia, continúa, y los esfuerzos por erradicarla no deben desfallecer.
REFERENCIAS BIBLIOGRÁFICAS
1. McNeill JR. Yellow Jack and geopolitics: Environment, epidemics, and the struggles for empire in the American tropics, 1650-1825. OAH Mag Hist. 2004;18(3):9-13. [ Links ]
2. Sotomayor Tribín H. Aspectos históricos y geográficos de algunas enfermedades importantes en Colombia. Bogotá: Universidad Militar Nueva Granada; 2012. [ Links ]
3. Finlay CJ. El mosquito hipotéticamente considerado como agente de transmisión de la fiebre amarilla. Rev Cubana Salud Pública. 2011;37(Suppl 5):555-62. [ Links ]
4. Sternberg G. Report on the etiology and prevention of yellow fever. Washington: Government Printing Office; 1890. [ Links ]
5. Bryant JE, Holmes EC, Barrett AD. A molecular perspective on the Introduction of yellow fever virus into the Americas. PLoS Pathog. 2007;3(5):e75. [ Links ]
6. Kodama K. Antiescravismo e epidemia: O tráfico dos negros considerado como a causa da febre amarela. Hist Cienc Saude-Manguinhos. 2009;16(2):515-20. [ Links ]
7. Patterson KD. Yellow fever epidemics and mortality in the United States, 1693-1905. Soc Sci Med. 1992;34(8):855-65. [ Links ]
8. Monath T. Aedes albopictus, an exotic mosquito vector in the United States. Ann Intern Med. 1986;105(3):449-51. [ Links ]
9. Theiler M. The use of yellow fever virus modified by in vitro cultivation for human immunization. J Exp Med. 1937;65(6):787-800. [ Links ]
10. López P, Lanata CF, Zambrano B, Cortés M, Andrade T, Amemiya I, et al. Immunogenicity and safety of yellow fever vaccine (Stamaril) when administered concomitantly with a tetravalent dengue vaccine candidate in healthy toddlers at 12-13 months of age in Colombia and Peru: A Randomized Trial. Pediatr Infect Dis J. 2016;35(10):1140-7. [ Links ]
11. Tesh RB. Viral hemorrhagic fevers of South America. Biome´dica. 2002;22(3):287-95. [ Links ]
12. Gast-Galvis A. Incidencia de la fiebre amarilla en diferentes zonas de Colombia. Bol Oficina Sanit Panam. 1958;44(1):10-9. [ Links ]
13. Rosselli D. Historias de cien ciudades. Bogotá: Intermedio Editores; 2010. [ Links ]
14. Vidales H, Buitrago B, Sanín LH, Morales A, Groot H. Estudio de un brote epidémico de fiebre amarilla selvática en el pie de monte de la Sierra Nevada de Santa Marta, 1979. Biomédica. 1981;1(4):171-86. [ Links ]
15. Organización Panamericana de la Salud. Fiebre amarilla en las Américas, 1981-1985. Bol Epidemiol. 1986;7(3):1-9. [ Links ]
16. Segura A, Cardona D, Garzón M. Tendencias de la mortalidad por fiebre amarilla, Colombia 1998-2009. Biomédica. 2013;33(supl.1):52-62. [ Links ]
17. Houghton-Trivino N, Montana D, Castellanos J. Dengue-yellow fever sera cross-reactivity; challenges for diagnosis. Rev Salud Publica (Bogota). 2008;10(2):299-307. [ Links ]
18. Velandia MP. Fiebre amarilla y su control en Colombia 2002-2003. Infectio. 2004;8(3):210-9. [ Links ]
19. Instituto Nacional de Salud de Colombia. Comportamiento de los eventos de vigilancia en salud pública. Enfermedades transmitidas por vectores. Boletín Epidemiológico Semanal (Internet). 2016 (citado el 8 de octubre de 2017);(52):101-3. Disponible en: http://www.ins.gov.co/buscador-eventos/BoletinEpidemiologico/2016 Boletín epidemiológico semana 52 -.pdf
20. Medina-Collado CA, Mejía F. Fiebre amarilla, dos formas clínicas diferentes de una misma enfermedad: A propósito de 2 casos. Acta Med Peru. 2016;33(2):142-5. [ Links ]
21. Yamey G. The world's most neglected diseases: Ignored by the pharmaceutical industry and by public-private partnerships. BMJ. 2002;325(7357):176–7. [ Links ]
22. Sanabria-Rojas HA. Ensayos clínicos en enfermedades infecciosas desatendidas en contexto de la globalización: enfoque ético y de derechos humanos. Acta Med Peru. 2015;32(4):235-40. [ Links ]
23. Piedrahita-Cortés J, Soler-Tovar D. Distribución geográfica del mono aullador rojo (Alouatta seniculus) y la fiebre amarilla en Colombia. Biomédica. 2016;36(supl.2):116-24. [ Links ]
24. Karesh WB, Wallace RB, Painter RL, Rumiz D, Braselton WE, Dierenfeld ES, et al. Immobilization and health assessment of free-ranging black spider monkeys (Ateles paniscus chamek). Am J Primatol. 1998;44(2):107-23. [ Links ]
25. Arroyo JI, Apperson SA, Cropp CB, Marafino BJ Jr, Monath TP, Tesh RB, et al. Effect of human gamma interferon on yellow fever virus infection. Am J Trop Med Hyg. 1988;38(3):647-50. [ Links ]
26. Rojas Gil Y, Brochero H. Hallazgo de Aedes aegypti (Linnaeus 1762), en el casco urbano del corregimiento de La Pedrera, Amazonas, Colombia. Biomédica. 2008;28(4):587-96. [ Links ]
27. Ruiz-López F, González-Mazo A, Vélez-Mira A, Gómez GF, Zuleta L, Uribe S, et al. Presence of Aedes (Stegomyia) aegypti (Linnaeus, 1762) and its natural infection with dengue virus at unrecorded heights in Colombia. Biomédica. 2016;36(2):303-8. [ Links ]
28. Ministerio de Salud y Protección Social de Colombia, Unidad Administrativa Especial de Aeronáutica Civil. Circular conjunta No 000014 de 2017 (citado el 8 de octubre de 2017) Disponible en: https://www.minsalud.gov.co/Normatividad_Nuevo/Circular No. 0014 de 2017.pdf [ Links ]
29. Ministerio de Salud de Colombia. Viajeros a vacunarse contra la fiebre amarilla (Internet). Bogotá: Ministerio de Salud; 2017 (citado el 8 de octubre de 2017). Disponible en: https://www.minsalud.gov.co/Paginas/Viajeros-a-vacunarse-contra-la-fiebre-amarilla--.aspx [ Links ]
30. Ministerio de Salud de Colombia. Fiebre amarilla (Internet). Bogotá: Ministerio de Salud; 2017 (citado el 8 de octubre de 2017). Disponible en: https://www.minsalud.gov.co/salud/publica/PET/Paginas/Fiebre-amarilla.aspx. [ Links ]
Correspondencia
Diego Rosselli diego.rosselli@gmail.com
Recibido: 07/12/2017
Aprobado: 07/03/2018