Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. Peru vol.36 no.1 Lima ene./mar. 2019
ARTÍCULO ORIGINAL
Implementación de una unidad de mamovigilancia para el diagnóstico de cáncer de mama en una microred de la seguridad social, Lima-Perú
Implementation of a breast surveillance unit for diagnosing breast cancer in a micro-network from a Social Security facility in Lima-Peru
Luis E. Figueroa-Montes1,2a, Nicolás Eduardo Chávez-Altamirano3b, Giancarlo García-Espinoza4c.
1 Hospital III Suarez Angamos, EsSalud. Lima, Perú.
2 Asociación Médica Peruana de Patología Clínica. Lima, Perú.
3 Unidad de Referencia y Contrareferencia, Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú.
4 Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú.
a Médico Patólogo Clínico, b Médico Especialista de Administración en Salud, c Médico cirujano
Citar como: Figueroa-Montes LE, Chávez-Altamirano N, García-Espinoza G. Implementación de una unidad de mamovigilancia para el diagnóstico de cáncer de mama en una microred de la seguridad social, Lima-Perú. Acta Med Peru. 2019;36(1):11-8
RESUMEN
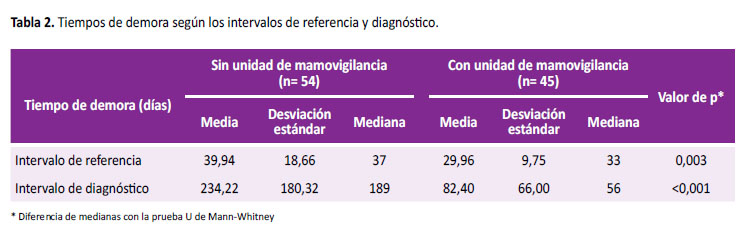
Objetivo: Medir los tiempos (días) antes y después de la implementación de una unidad de mamovigilancia, para el seguimiento de las pacientes con sospecha mamográfica de cáncer, hasta su diagnóstico anatomopatológico o intervención clínica. Materiales y métodos: Se diseñó un estudio cuasi experimental pre-post, para comparar la mediana de los tiempos (días) en los intervalos de referencia y diagnóstico, sin la implementación de una unidad de mamovigilancia en el 2014-2015 y con su implementación en el 2017, en el Hospital III Suarez Angamos - EsSalud. Se realizó un análisis no paramétrico con la prueba U de Mann- Whitney. Resultados: Se incluyeron 99 pacientes. El intervalo de referencia sin la unidad de mamovigilancia, tuvo una mediana de 37 días, en comparación a 33 días con la unidad implementada (p=0,003). Sobre el intervalo de diagnóstico, su mediana fue de 189 días sin la unidad y de 56 días con la unidad de mamovigilancia implementada (p<0,001). Conclusión: La implementación de una unidad de mamovigilancia disminuye los tiempos en días en beneficio del diagnóstico oportuno del cáncer en pacientes con sospecha mamográfica en la Red Asistencial Rebagliati-EsSalud.
Palabras clave: Mamografía; Detección precoz del cáncer; Neoplasias de la mama, Navegación de pacientes (fuente: DeCS BIREME).
ABSTRACT
Objective: To measure the time (days), before and after implementing a breast surveillance unit, for following-up patients with a mammography suspicious for breast cancer, until they had an anatomopathological diagnosis or a clinical intervention. Materials and methods: A quasi-experimental pre-post study was designed to compare the median times (days) for referral and diagnosis of breast cancer without the implementation of a breast surveillance unit in 2014-2015 and after its implementation in 2017, in third-level Suarez-Angamos Hospital – EsSalud (Peruvian Social Security). A nonparametric analysis was performed using the Mann-Whitney U test. Results: Ninety-nine patients were included. The time interval for referral without the breast surveillance unit had a 37.0 days median, compared to 33 days when the unit had been implemented (p= 0.003). With respect to the time for achieving a diagnosis, the median was 189 days without the unit and 56 days with the implementation of the breast surveillance unit (p<0.001). Conclusion: The implementation of a breast surveillance unit reduces the time for achieving an adequate and timely diagnosis of breast cancer in patients with suspicious mammography in the Rebagliati - EsSalud Healthcare Network.
Keywords: Mammography; Early Detection of cancer; Breast neoplasms; Patient navigation (source: MeSH NLM).
INTRODUCCIÓN
El cáncer de mama es el segundo cáncer más común en el mundo y, por lejos, el cáncer más frecuente entre las mujeres, con un estimado de 1,67 millones de nuevos casos de cáncer diagnosticados en el 2012 (25% de todos los cánceres). Además, es el cáncer más común en mujeres, con más casos en regiones de menor desarrollo (883 000 casos) que en regiones más desarrolladas (794 000). Las tasas de incidencia varían casi cuatro veces en todas las regiones del mundo, con tasas que van desde 27 por 100 000 en África central y Asia oriental hasta 92 por 100 000 en América del Norte [1]. En las Américas, el cáncer de mama es el tipo de cáncer más común y la segunda causa de muerte por cáncer entre las mujeres. Cada año se producen en la Región más de 462 000 casos nuevos y casi 100 000 muertes por cáncer de mama [2].
En el Perú este cáncer representa la segunda neoplasia más frecuente, afecta a la mujer adulta y es una causa importante de carga de enfermedad. En los últimos años se implementaron políticas de prevención y control de cáncer que contribuyeron a mejorar la atención de las neoplasias desde el aspecto financiero [3]. A pesar de haber incrementado el equipamiento de mamógrafos a nivel nacional, la cobertura y calidad de tamizaje en mujeres de 50 a 64 años es baja, por lo tanto los casos de cáncer de mama se diagnostican en etapas avanzadas con pobre sobrevida, generando un mayor impacto económico en los pacientes y familiares que deben trasladarse a la capital, abandonar su actividad laboral y a la larga desertar el tratamiento [3].
Una revisión sobre el estadio clínico del cáncer de mama en diez países de altos ingresos y 13 de bajos ingresos, mostró que, en los países de bajos ingresos, existen demoras muy largas y que se diagnostica a las pacientes en estadios avanzados. La escasa evidencia disponible para los países de ingresos bajos y medios, sugiere que las barreras de acceso y las deficiencias de calidad en la atención del cáncer son determinantes de estas demoras. Más del 70% de los pacientes con cáncer de mama en la mayoría de los países de altos ingresos altos se diagnostican en los estadios I y II, solo el 20% al 50% de los pacientes en la mayoría de los países de medianos y bajos ingresos se diagnostican en estos estadios. La evidencia reunida en esta revisión muestra que la mediana de este intervalo es de 30 a 48 días en los países de altos ingresos, pero de tres a ocho meses en los países de bajos y medianos ingresos [4]. Es necesario el diseño de políticas públicas que fortalezcan los sistemas de salud para hacer frente a este problema, en esta costosa y mortal enfermedad
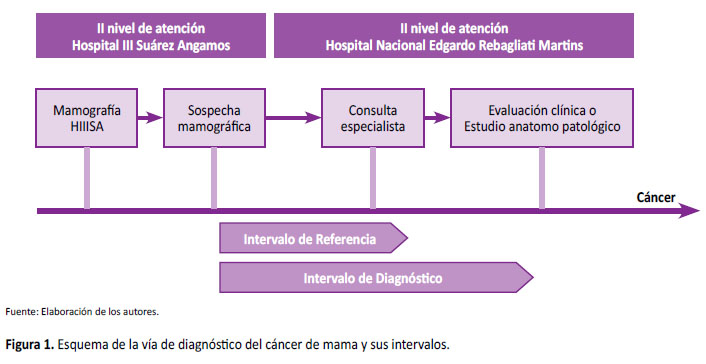
Según la directiva para la detección temprana del cáncer de mama elaborada por EsSalud, la paciente con signos y/o síntomas altamente sospechosos de cáncer de mama, BI-RADS (Breast Imaging Reporting and Data System) 4 o 5, resultado histopatológico de cáncer de mama, debe tener una referencia administrativa en un plazo no mayor de 72 horas, para otorgar cita en el nivel con capacidad resolutiva en un plazo no mayor de 15 días calendario. La paciente accede a la realización de los exámenes para complementar el estudio de avance de la enfermedad (estadificación) cuando corresponda en un plazo de 30 días calendario contados desde la referencia al establecimiento de salud con capacidad resolutiva [5]. Sin embargo, un estudio realizado en el Hospital III Suárez Angamos (HIIISA) durante el 2014 y 2015, al evaluar el tiempo de demora en el diagnóstico del cáncer de mama, después de una sospecha mamográfica (BIRADS 4 y 5), realizado en 54 pacientes, que fueron referidas al Hospital Nacional Edgardo Rebagliati Martins (HNERM), encontró tiempos de demora prolongados para la consulta médica especializada (intervalo de referencia) y para el diagnóstico anatomopatológico o decisión clínica (intervalo de diagnóstico). La media fue de 39 días para el intervalo de referencia y de 234 días para el intervalo de diagnóstico [6].
El objetivo de este estudio fue medir los tiempos (días) antes y después de la implementación de una unidad de mamovigilancia (UMV), para el seguimiento de las pacientes con sospecha mamográfica de cáncer, hasta su diagnóstico anatomopatológico o intervención clínica, realizando un seguimiento individualizado de cada paciente que tuviera una sospecha mamográfica (BIRADS 4 y 5) realizadas en el HIIISA (navegación). Asimismo, se describen las principales barreras de acceso reportadas por las pacientes incluidas en el estudio. Los resultados podrían ser útiles para otras redes de salud del país en la seguridad social, en las cuales no existan mecanismos de seguimiento al grupo poblacional objetivo, basados en la navegación de pacientes [7].
MATERIALES Y MÉTODOS
Diseño del estudio
Se diseñó un estudio cuasi-experimental pre-post, donde se compararon las medianas de los tiempos (días) para los intervalos de referencia y diagnóstico, sin la implementación de la UMV (2014-2015) versus los tiempos (días) con la implementación de la UMV (2017), en muestras independientes. La UMV fue implementada en el 2017 en el HIIISA.
Población de estudio
Las pacientes incluidas pertenecen a la Red Asistencial Reblagliati (RAR) de EsSalud en Lima-Perú. Todas tuvieron un resultado de mamografía con sospecha de cáncer de mama. Se realizó un muestreo no probabilístico por conveniencia. Los criterios de inclusión fueron: 1) pacientes con solicitud de mamografía, provenientes de la RAR, como parte del programa de tamizaje de prevención de cáncer de mama; 2) pacientes mujeres con solicitudes de mamografía, con diagnóstico mamográfico de BIRADS 4 (a, b, c) y 5, que se atendieron en el HIIISA en el 2017; 3) pacientes con diagnóstico mamográfico de BIRADS 4 (a, b, c) y 5, que fueron referidas del HIIISA al servicio de oncología ginecológica y mamaria del HNERM; y, 4) pacientes que acudieron a su cita en el HNERM y tuvieron alguna intervención médica: seguimiento imagenológico o un diagnóstico anatomopatológico, a través de un procedimiento invasivo quirúrgico, como una biopsia o tumorectomía.
Los criterios de exclusión fueron para las pacientes con diagnóstico mamográfico BIRADS 0, 1, 2, 3 y 6, y aquellas que no desearon participar del presente estudio.
Variables del estudio
Se utilizó una ficha de recolección de datos que incluyó información descriptiva de los pacientes como información demográfica, los tiempos de demora para los intervalos y las causas de estas demoras.
Al medir en el estudio los tiempos de demora, se definieron intervalos de tiempo para cuantificarlos y poder obtener la comparación de sus medianas en ambos periodos. Los tiempos para los intervalos, se plantearon según la directriz del Centers for Disease Control and Prevention [8], sobre el programa de detección temprana del cáncer de mama y cérvix. Los intervalos son dos: 1) intervalo de referencia: tiempo de demora, expresado en días, desde que el paciente obtuvo un resultado de mamografía con sospecha de cáncer de mama (BIRADS 4 o 5) y fue referido administrativamente para su primera evaluación en el servicio de oncología ginecológica y mamaria del HNERM; y, 2) intervalo de diagnóstico: tiempo de demora, expresado en días, desde que el paciente obtuvo un resultado de mamografía con sospecha de cáncer de mama (BIRADS 4 o 5) referido administrativamente para su primera evaluación en el servicio de oncología ginecológica y mamaria del HNERM, hasta su diagnóstico anatomopatológico o cuando se obtuvo una intervención clínica en relación a su sospecha mamográfica. En la Figura 1, se observa el esquema de la vía de diagnóstico del cáncer de mama y sus intervalos.
Para ambos intervalos, el tiempo máximo esperado, debe ser menor o igual a 60 días, según la directriz [8].
Recolección de datos
Los datos fueron registrados en una ficha por cada paciente. En ambos periodos (2014-2015 y 2017) se realizaron estos procedimientos:
1) Para obtener el listado de pacientes con mamografía y sospecha mamográfica de cáncer, se ingresó al aplicativo sistema de gestión hospitalaria (SGH- Telnet Win32 v2.0, 1999 - EsSalud). Aquí se obtuvo la relación nominal de las pacientes con resultado de mamografía analógica realizadas en el 2014-2015 y 2017. Se seleccionaron las pacientes BIRADS 4 (a, b, c) y 5.
2) Para obtener el intervalo de referencia, se ingresó al aplicativo Sistema de Referencia y Contrareferencia (SRC– versión 2016-05-06). De este aplicativo institucional, se obtuvieron las fechas de la referencia administrativa del HIIISA, mediante la cual las pacientes eran citadas para la consulta médica en el servicio oncología ginecológica y mamaria del HNERM.
3) Para obtener el intervalo de diagnóstico, se ingresó al aplicativo Rebanet (sistema de información interno, basado en tecnología Internet) del HNERM. De este aplicativo institucional, se obtuvieron las fechas de los resultados anatomopatológicos de las pacientes, después de la biopsia o tumorectomía definiendo el diagnóstico del paciente.
Intervención: periodo 2017, con la implementación de la UMVV
Implementación de la Unidad de Mamovigilancia, se diseñó un plan de trabajo que se consolidó en un manual de operaciones. Se integró de forma multidisciplinaria la intervención de todos los actores: servicios de radiología y de referencia y contrareferencia del HIIISA en el segundo nivel de atención, con los responsables de referencias y contrareferencias, servicio de radiología, servicio oncología ginecológica y mamaria; y anatomía patológica del HNERM en el tercer nivel.
Implementada la UMV en el HIIISA, se incluyó un componente de navegación a cargo de un profesional de la salud (técnico asistencial), para que reclute en el protocolo a las pacientes con sospecha mamográfica de cáncer de mama, registre los datos en la ficha, y las acompañe en el proceso del diagnóstico en el tercer nivel. Este profesional fue previamente capacitado en lo relacionado al cáncer de mama y las acciones que debería realizar en el proceso del diagnóstico. Al aceptar las pacientes su participación, fueron acompañadas individualmente hasta conocer sus intervalos de referencia y diagnóstico, conociendo en detalle los tiempos (días) y las diferentes barreras de acceso en nuestro proceso de atención, del segundo a tercer nivel de atención. Una revisión sistemática, respalda el papel de la navegación del paciente en el cáncer de mama, sobre los aspectos de su atención [9]. El concepto de navegación del paciente para el cuidado del cáncer, fue aplicado, como intervención a una presentación de cáncer en etapas tardías en afroamericanos, atribuida parcialmente, a la incapacidad de acceder a servicios de atención del cáncer [7].
La calidad de la información se respalda por la trazabilidad de las atenciones asistenciales y diagnosticas en nuestro sistema informático hospitalario y otros sistemas informáticos institucionales (estos registros informáticos no son manipulados desde su registro hasta su informe).
Aspectos éticos
El estudio fue aprobado por el Comité de Ética y Bioética e Investigación de la RAR (Carta Nº 03-CE-HIIISA-RDRESSALUD-2017 y Carta Nº 013-CE-HIIISA-RDR-ESSALUD-2018). Todas las pacientes incluidas en el periodo 2017 firmaron su consentimiento informado. Se garantizó la confidencialidad de los datos en todos los procesos. Se cumplieron los criterios de valor social, validez científica, selección adecuada de los participantes, evaluación del riesgo beneficio y no tener conflictos de interés [10,11].
Análisis estadístico
Al ser un estudio cuasiexperimental pre-post, los resultados del periodo 2014-2015 fueron comparados con los obtenidos en la segunda intervención del periodo 2017 (fecha de implementación de la UMV). Los datos de las fichas fueron ingresados en una matriz de sistematización construida en Excel 2010. Se calcularon medidas de tendencia central y desviación estándar para variables cuantitativas; para el análisis descriptivo de las variables cualitativas se usaron tablas de frecuencia y cálculos de porcentajes. Para el análisis de los tiempos de demora en ambos periodos, se realizó un análisis no paramétrico de las medianas obtenidas para calcular la prueba U de Mann-Whitney, para muestras independientes. Se consideró significativo un valor p<0,05. Se realizó el análisis con el software SPSS (PASW Statistics versión 25).
RESULTADOS
Se incluyeron un total de 99 mujeres con sospecha mamográfica de cáncer en ambas muestras, siendo 54 en el periodo 2014-2015 (mamografía analógica) y 45 en el periodo 2017 (mamografía digital). En el periodo de enero a diciembre del 2017, tuvimos tres pacientes que no desearon participar del estudio.
Características de la población
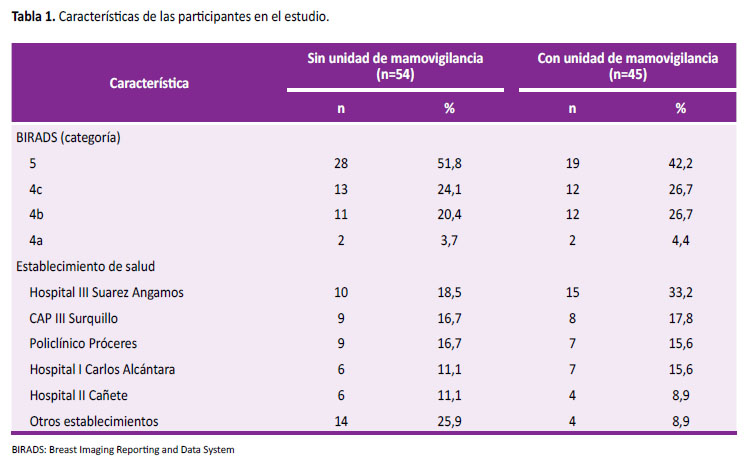
La Tabla 1 muestra las características de los pacientes que integraron ambas muestras (n=99). La mediana de edad fue de 59±12,73 años en el primer periodo, y en el segundo periodo de 57±13,22 años. La mayoría de los participantes presentaron BIRADS 5 en ambas muestras. La mayoría también eran pacientes del HIIISA, seguidas por el CAP III Surquillo y Policlínico Próceres en ambas muestras. Según el desenlace del seguimiento, observamos que el porcentaje de pacientes con diagnóstico de cáncer en ambos períodos supero el 50% después de una mamografía con sospecha de cáncer.
Intervalos de los tiempos de referencia y diagnóstico
Al evaluar, los tiempos según los intervalos, en la Tabla 2 observamos que el intervalo de referencia en el periodo sin UMV, tuvo una mediana de 37 días, en comparación a 33 días con la UMV. Sobre el intervalo de diagnóstico en el periodo sin UMV, su mediana fue de 189 días, en comparación a 56 días con la UMV implementada. Al evaluar si existen diferencias entre las medianas de los intervalos de referencia y diagnóstico, en los periodos sin y con la UMV, observamos al análisis exploratorio un comportamiento no paramétrico, no cumpliendo los supuestos de normalidad e igualdad de varianzas. Por esta razón se aplicó la prueba U de Mann-Whitney, para muestras no relacionadas. Se observa que existe una diferencia significativa entre las medianas de los intervalos de referencia (p=0,003) y diagnóstico (p<0,001) en los pacientes que conformaron la UMV en el 2017 en comparación con el periodo 2014-2015.
Desenlace del seguimiento
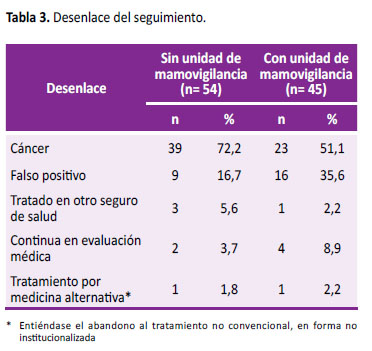
En la Tabla 3, al evaluar el desenlace del seguimiento de las pacientes en cada periodo, observamos que más del 50% de las pacientes tuvieron diagnóstico de cáncer. Sin embargo el número de pacientes con falsos positivos se incrementó en el periodo 2017 con 35,5% (16/45).
Prolongación de los tiempos por factores relacionados a las barreras de acceso a la salud
En la Tabla 4, se presentan las barreras del acceso a la salud que generan la prolongación de tiempos para la atención del paciente. Estos factores pudieron ser identificados por el personal responsable de la navegación, al acompañar a los pacientes en el periodo de mamovigilancia. Dentro de los factores relacionados al sistema de salud, se presentaron en 39/45 pacientes. Destacar que la oportunidad de atención para las citas de los médicos especialista o procedimientos fueron las principales. Dentro de los factores relacionados al paciente 6/45, los principales factores fueron no asistir a su cita programada y optar por tratamientos en seguros oncológicos en servicios de salud privados.
DISCUSIÓN
Los hallazgos del estudio muestran que la intervención de la implementación de una unidad de mamovigilancia en el HIIISA, donde cada paciente con sospecha mamográfica de cáncer de mama durante la muestra del 2017, fue acompañado en todo el proceso de atención hasta su diagnóstico, fue menor en comparación con la muestra del 2014-2015, donde no existía una UMV. La disminución más representativa fue de la mediana para el intervalo diagnóstico de 189 días (2014-2015) a 56 días (2017).
Diversos estudios demuestran que las intervenciones con la navegación del paciente con sospecha de cáncer de mama, en adición a los factores que generan la demora causados por el sistema de salud o propias del paciente, tiene beneficios sobre la supervivencia en la detección y la intervención temprana el cáncer de mama. Por lo tanto, existe una creciente necesidad de incluir la navegación del paciente desde la detección temprana y a lo largo de todo el proceso de diagnóstico y tratamiento del paciente [7,9,12,13].
Como resultados secundarios, en la muestra del 2017 por la presencia de una navegadora durante el proceso de referencia y diagnóstico, se obtuvo información y conocer algunas barreras al acceso de la salud. Se evidenció que la mayoría de las barreras fueron relacionadas a sistema de salud (39/45) para los pacientes referidos de la microred de tamizaje del HIIISA. Un estudio nacional, evaluó los factores asociados al paciente, que demoran el diagnóstico de cáncer de mama. El tiempo de demora entre el inicio de los primeros síntomas y la primera consulta tuvo una media de 8,9 meses, el 67,2% de los casos demoraron de tres a más meses. Concluye que el temor y el nivel de conocimiento inadecuado son los factores más importantes que demoran el diagnóstico de cáncer de mama [14].
En México, una revisión prospectiva de nuevos casos de cáncer de mama, evaluados en un hospital administrado por el Instituto Mexicano del Seguro Social, sugiere que el sistema de salud podría ser responsable de retrasar el diagnóstico y el inicio del tratamiento en estas pacientes. Sus tiempos fueron similares a los obtenidos en la primera muestra del 2014-2015. En promedio presentaron una demora de 7,8 meses para el diagnóstico. Recomiendan implementar estrategias para reducir las demoras en la detección precoz del cáncer de mama, adaptando mejor los recursos existentes [15].
Otro estudio en Brasil, describió las principales características de 288 pacientes ingresados para el tratamiento del cáncer de mama en dos centros de salud (uno público y otro privado). El tiempo entre la sospecha de cáncer y la confirmación del diagnóstico fue mayor a seis meses en el 42,7% y los estadios III y IV estuvieron en el 47,6% de pacientes. Encontraron que los principales factores asociados con el diagnóstico tardío de cáncer fueron la demora entre la sospecha y el diagnóstico confirmado, la ausencia de familiares con historia de cáncer de mama y no tener una mamografía [16]. Revisiones sistemáticas y diferentes estudios demuestran los potenciales factores que contribuyen en la demora del diagnóstico y tratamiento del cáncer de mama en las pacientes, así como diferentes estrategias que ayudarían a reducirlas en forma eficaz [17-21].
Las mamografías fueron realizadas por diferentes tecnologías en ambas muestras, siendo mamografía analógica durante el 2014-2015 y digital durante el 2017. Esto modificó el porcentaje de cáncer y falsos positivos en ambos periodos. Es importante destacar que la mamografía digital tiene como beneficio disminuir los falsos positivos en los casos de BIRADS 0 en mujeres jóvenes con mamas densas, sin embargo, en nuestra muestra del 2017 con esta tecnología tuvo un incremento en comparación con la muestra del 2014-2015. Existen diferentes estudios que explican las probables causas de este hallazgo, asociadas a sensibilidad de la mamografía, experticia del radiólogo, falsos negativos, sobre diagnóstico y otros [22-25].
En el Perú, el 57% de mujeres son diagnosticadas con cáncer de mama en estadios III o IV. La organización mundial PATH (Professional Association of Therapeutic Horsemanship International) colaboró con instituciones de salud peruanas a nivel local, regional y nacional para diseñar e implementar un modelo de atención para la detección temprana del cáncer de mama en Perú. Este modelo incluyó la capacitación de promotores de salud para la comunidad, profesionales para el examen clínico de los senos, médicos para realizar biopsias por aspiración con aguja fina y navegadores de pacientes para asegurar que los pacientes sigan con el tratamiento. Fue implementado en el norte del Perú, donde incluyeron a más de 400 profesionales y promotores que recibieron capacitación en detección temprana en dos fases. El estudio demostró que este modelo es eminentemente transferible con la adaptación adecuada y debería aplicarse en otros entornos dentro y fuera del Perú [26].
Considerando el incremento de la demanda de mamografías en EsSalud y la RAR, sumado a tiempos incrementados para diagnóstico y tratamiento sin unidades de mamovigilancia en los establecimientos de salud o redes asistenciales para el seguimiento de las mujeres con sospecha clínica o mamográfica de cáncer, la implementación de una unidad de evaluación de diagnóstico de mama (Breast diagnostic assessment units – DAUs) para todas las mujeres con sospecha de cáncer de mama, debería considerarse a nivel institucional. También el desarrollo de estudios con diseños que permitan controlar a pacientes con y sin UMV en su referencia al tercer nivel en los establecimientos de salud, acompañados de la navegación de las pacientes, sería otra alternativa [26-29].
Una limitación del estudio fue no obtener los tiempos (días) para conocer el intervalo de tratamiento, es decir desde la sospecha mamográfica hasta el inicio del tratamiento médico quirúrgico. Con el estadiaje de las pacientes con cáncer podríamos obtener la carga de enfermedad y realizar un análisis económico de toda la intervención, desde el tamizaje hasta la sobrevida del paciente. Otra limitación fue que al implementar la UMV en el 2017, no se pudo conocer las barreras de acceso a la salud en el periodo 2014-2015.
En conclusión, la intervención con la implementación de una UMV en el HIIISA, realizando intervenciones administrativas y sumada a la navegación de los pacientes con sospecha mamográfica de cáncer de mama durante la muestra del 2017, permitió conocer los nuevos tiempos de demora, en comparación con la muestra del 2014-2015 sin UMV. Esta intervención pudo reducir los tiempos en el 2017. Se recomienda la mejora de los procesos de atención de las pacientes con sospecha de cáncer (mama y cervix como prioridades sanitarias), y hacer que una vez diagnosticada la sospecha (clínica o imagenológica), su atención desde el primer nivel hasta el tercer nivel debe ser lo más rápido posible para su diagnóstico y tratamiento oportuno.
Agradecimiento: A nuestra navegadora Carla Ramírez Felipa, por su desempeño en el desarrollo del protocolo, que permitió conocer los detalles del proceso de mamovigilancia implementado en el HIIISA.
Contribuciones de autoría: LEFM realizó el planeamiento, la ejecución, discusión y conclusiones del manuscrito. NECA y GGE participaron en la ejecución y discusión del estudio.
Fuente de financiamiento: Este estudio fue financiado por el Instituto de Evaluación de Tecnologías en Salud e Investigación IETSI, EsSalud-Perú, a través del fondo económico Nº 37-IETSIESSALUD-2016, Premio Kaelin 2016.
Conflictos de interés: Los autores declaran no tener conflicto de intereses relacionado al presente estudio de investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Ghoncheh M, Pournamdar Z, Salehiniya H. Incidence and mortality and epidemiology of breast cancer in the world. Asian Pac J Cancer Prev. 2016;17(S3):43-6. [ Links ]
2. International Agency for Research on Cancer (IARC). GLOBOCAN 2018 [Internet]. Lyon, France: IARC; c2018 [citado 15 Set 2018]. Disponible en: http://gco.iarc.fr/ [ Links ]
3. Ministerio de Salud del Perú. Plan nacional para la prevención y control de cáncer de mama en el Perú 2017-2021. 1ra edición. Lima, Perú: Ministerio de Salud; 2017. [ Links ]
4. Unger-Saldaña K. Challenges to the early diagnosis and treatment of breast cancer in developing countries. World J Clin Oncol. 2014;5(3):465-77. [ Links ]
5. Seguro Social de Salud – EsSalud. Detección temprana del Cáncer de Mama en EsSalud. Directiva N⁰003-GG-EsSalud-2016. Lima, Perú: EsSalud; 2016. [ Links ]
6. Figueroa Montes L. Demora en el diagnóstico del cáncer de mama, por sospecha mamográfica, detectada en el Hospital III Suárez Angamos, 2014 - 2015 [Tesis de maestría]. Lima, Perú: Universidad Cesar Vallejo; 2018. [ Links ]
7. Freeman HP. Patient navigation: a community centered approach to reducing cáncer mortality. J Cancer Educ. 2006;21(1 Suppl):S11-4. [ Links ]
8. Centers for Disease Control and Prevention. NBCCEDP Program Manual: NBCCEDP Policies and Procedures Chapter. Atlanta, GA: CDC [Internet]. [citado 29 Oct 2016]. Disponible en: http:// pacificcancer.org/cancer-information/cancer-downloads/breast/ CDC_NBCCEDP_policies_procedures.pdf [ Links ]
9. Robinson-White S, Conroy B, Slavish KH, Rosenzweig M. Patient navigation in breast cancer: a systematic review. Cancer Nurs. 2010;33(2):127-40. [ Links ]
10. Argimon J. Métodos de investigación clínica y epidemiológica. 4ta Ed. Barcelona, España: Elseiver; 2013. [ Links ]
11. Emanuel EJ, Wendler D, Grady C. What makes clinical research ethical? JAMA. 2000;283(20):2701-11. [ Links ]
12. Lannin DR, Mathews HF, Mitchell J, Swanson MS, Swanson FH, Edwards MS. Influence of socioeconomic and cultural factor son racial differences in late stage presentations in breast cancer. JAMA. 1998;279(1):1801-7. [ Links ]
13. Shavers V, Brown M. Racial and ethnic disparities in the receipt of cancer treatment. J Natl Cancer Inst. 2002;94(1):334-57. [ Links ]
14. Contreras N, Valdeiglesias N. Demora en el diagnóstico de cáncer de mama: factores de la paciente, Hospital EsSalud Cuzco 1986-1999. SITUA. 2000;8(15):11-6. [ Links ]
15. Bright K, Barghash M, Donach M, de la Barrera MG, Schneider RJ, Formenti SC. The role of health system factors in delaying final diagnosis and treatment of breast cancer in Mexico City, Mexico. Breast. 2011;20 supl 2:S54-9. [ Links ]
16. Soares PB, Quirino Filho S, de Souza WP, Gonçalves RC, Martelli DR, Silveira MF, et al. Characteristics of women with breast cancer seen at reference services in the North of Minas Gerais. Rev Bras Epidemiol. 2012;15(3):595-604. [ Links ]
17. Piñeros M, Sánchez R, Perry F, García OA, Ocampo R, Cendales R. Demoras en el diagnóstico y tratamiento de mujeres con cáncer de mama en Bogotá, Colombia. Salud Publica Mex. 2011;53(6):478-85. [ Links ]
18. Ramirez AG, Pérez-Stable EJ, Talavera GA, Penedo FJ, Carrillo JE, Fernandez ME, et al. Time to definitive diagnosis of breast cancer in Latina and non-Hispanic white women: the six cities study. Springerplus. 2013;2(1):84. doi: 10.1186/2193-1801-2-84. [ Links ]
19. Sharma K, Costas A, Shulman LN, Meara JG. A Systematic review of barriers to breast cancer care in developing countries resulting in delayed patient presentation. J Oncol. 2012;2012:121873. doi: 10.1155/2012/121873. [ Links ]
20. Jones CEL, Maben J, Jack RH, Davies EA, Forbes LJL, Lucas G, et al. A systematic review of barriers to early presentation and diagnosis with breast cancer among black women. BMJ Open. 2014;4(2):e004076. http://dx.doi.org/10.1136/bmjopen-2013-004076. [ Links ]
21. Neal RD, Din NU, Hamilton W, Ukoumunne OC, Carter B, Stapley S, et al. Comparison of cancer diagnostic intervals before and after implementation of NICE guidelines: analysis of data from the UK General Practice Research Database. Br J Cancer. 2014;110(3):584- 92. doi: 10.1038/bjc.2013.791. [ Links ]
22. Carney P, Miglioretti DL, Yankaskas BC, Kerlikowske K, Rosenberg R, Rutter CM, et al. Individual and combined effects of age, breast density, and hormone replacement therapy use on the accuracy of screening mammography. Ann Intern Med. 2003;138(3):168-75. [ Links ]
23. Rosenberg RD, Hunt WC, Williamson MR, Gilliland FD, Wiest PW, Kelsey CA, et al. Effects of age, breast density, ethnicity, and estrogen replacement therapy on screening mammographic sensitivity and cancer stage at diagnosis: review of 183,134 screening mammograms in Albuquerque, New Mexico. Radiology. 1998;209(2):511-8. [ Links ]
24. Kerlikowske K, Grady D, Barclay J, Sickles EA, Ernster V. Likelihood ratios for modern screening mammography: risk of breast cancer based on age and mammographic interpretation. JAMA. 1996;276(1):39-43. [ Links ]
25. Silvestrini R, Daidone MG, Valagussa P, Salvadori B, Rovini D, Bonadonna G. Cells kinetics and prognosis in locally advanced breast cancer. Cancer Treat Rep. 1987;71(4):375-9. [ Links ]
26. Bain C, Constant TH, Contreras I, Burga Vega AM, Jeronimo J, Tsu V. Model for early detection of breast cancer in low-resource areas: the experience in Peru. J Glob Oncol. 2018;4:1-7. doi: 10.1200/ JGO.17.00006. [ Links ]
27. Jiang L, Gilbert J, Langley H, Moineddin R, Groome P. Effect of specialized diagnostic assessment units on the time to diagnosis in screendetected breast cancer patients. Br J Cancer. 2015;112(11):1744-50. [ Links ]
28. Chiarelli AM, Muradali D, Blackmore KM, Smith CR, Mirea L, Majpruz V, et al. Evaluating wait times from screening to breast cancer diagnosis among women undergoing organised assement vs usual care. Br J Cancer. 2017;116(10):1254-63. doi: 10.1038/ bjc.2017.87. [ Links ]
29. Honein-Abouhaidar G, Hoch JS, Dobrow MJ, Stuart-McEwan T, McCready DR, Gagliardi AR. Cost analysis of breast cáncer diagnostic assessment programs. Curr Oncol. 2017;24(5):e354-e360. doi: 10.3747/co.24.3608. [ Links ]
Correspondencia
Luis Edgardo Figueroa Montes
Recibido: 28/12/2018
Arbitrado por pares
Aprobado: 27/02/2019