Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. Peru vol.36 no.2 Lima abr./jun. 2019
ARTÍCULO ORIGINAL
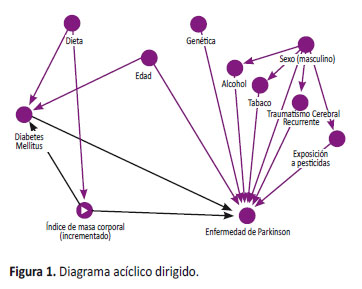
Malnutrición por exceso y enfermedad de Parkinson en un hospital peruano durante el periodo 2007-2017
Malnutrition linked to overeating and Parkinson’s disease in a Peruvian hospital during 2007-2017
Ysabel Lozano1,2a, Enver V. Palacios1,2a, Astrid R. Loza3b
1 Universidad Científica del Sur. Lima, Perú.
2 Servicio de Medicina Interna, Hospital María Auxiliadora. Lima, Perú.
a Especialista en Medicina Interna; b Médico cirujano
RESUMEN
Objetivo: Determinar la asociación entre malnutrición por exceso y enfermedad de Parkinson en pacientes de un hospital peruano durante el periodo 2007-2017. Materiales y métodos: Estudio de casos y controles; se hizo un análisis secundario de datos del estudio "Asociacion entre diabetes mellitus y enfermedad de Parkinson, Hospital María Auxilidora 2007-2017: un estudio de casos y controles". Se consideró como caso a aquel paciente mayor de 40 años con diagnóstico reciente de Parkinson realizado por neurólogo, como control aquel paciente mayor de 40 años que acudió al hospital para atención de una patología aguda, sin antecedente de diagnóstico de Parkinson. Se realizó el análisis descriptivo, bivariado y regresión logística simple y múltiple para calcular odds ratio crudos (OR) y ajustados (ORa). Resultados: Se evaluaron 230 pacientes (115 casos y 115 controles). Los casos fueron en su mayoría varones (56,9% vs 43,1%), de mayor edad (70 años vs 63 años) y mayor proporción de malnutridos por exceso (64,35% vs 49,57%), en comparación con los controles (p<0,05). Los pacientes con malnutrición por exceso (OR: 1,84, intervalo de confianza a 95% [IC 95%]: 1,08-3,12), edad (OR: 1,04; IC 95%: 1,02-1,07), sexo masculino (OR: 1,75; IC 95%: 1,04-2,95) y diabetes mellitus (OR: 2,07; IC 95%: 1,00-4,30) tuvo una mayor probabilidad de presentar enfermedad de Parkinson. La asociación de esta última con la malnutrición por exceso se mantuvo luego de ajustar por sexo, edad, diabetes mellitus, consumo de alcohol, café y tabaco (ORa: 2,11; IC 95%: 1,15-3,86). Conclusiones: La malnutrición por exceso es un factor asociado a la presencia de enfermedad de Parkinson.
Palabras clave: Enfermedad de Parkinson; Malnutrición; Sobrepeso; Obesidad (fuente: DeCS-BIREME).
ABSTRACT
Objective: To determine the association between malnutrition linked to excessive eating and Parkinson's disease in patients from a Peruvian Hospital during the 2007-2017 period. Materials and Methods: This is a case-control study in which a secondary analysis of the database of "Parkinson's disease and Diabetes Mellitus. Maria Auxiliadora Hospital 2007-2017, a case control study", was performed. Cases were defined as patients older than 40 years with a recent diagnosis of Parkinson's disease made by a neurologist. Controls were those patients who presented to the hospital for any acute condition, with no history of a diagnosis of Parkinson’s disease. Descriptive, bivariate and simple and multiple logistic regression analyses were performed aiming to calculate crude and adjusted odds ratios (ORs). Results: Two-hundred and thirty patients were assessed (115 cases and 115 controls). Cases were mostly males (56.9% vs. 43.1%), elderly (70 years vs. 63 years) and they had higher rates of malnutrition linked to excessive eating (64.35% vs. 49.57%) when compared with controls (p<0.05). Patients with malnutrition linked to excessive eating (OR= 1.84, 95% CI: 1.08-3.12), elderly age (OR= 1.04, 95% CI: 1.02-1.07), male sex (OR= 1.75, 95% CI: 1.04-2.95), and Diabetes Mellitus (OR= 2.07, 95% CI: 1.00-4.30) had a greater likelihood for presenting with Parkinson’s disease. This association was maintained after adjusting for sex, age, diabetes mellitus, alcohol consumption, coffee and tobacco use (aOR = 2.11, 95% CI: 1.15-3.86). Conclusions: Malnutrition linked to excessive eating is a risk factor for Parkinson's disease.
Keywords: Parkinson disease; Malnutrition; Overweight; Obesity (source: MeSH NLM).
INTRODUCCIÓN
La enfermedad de Parkinson es la segunda enfermedad neurodegenerativa más frecuente después de la enfermedad de Alzheimer [1]. La prevalencia de la enfermedad se estima en 0,3% de la población general, proporción que aumenta al 1% en el grupo de mayores de 60 años. La incidencia estimada es de 8 a 18 por 100.000 habitantes/año [1], generalmente no asociada a otra patología primaria. En el Perú, de un listado de 135 patologías, ocupa el puesto 48 como causa de carga de enfermedad [2].
Su etiología es desconocida. Diversos estudios sostienen que ocurriría producto de una interacción entre factores genéticos y ambientales, los cuales actuarían ya sea como agentes de susceptibilidad o precipitantes, o, en algunos casos, como protectores, evidenciándose una constante asociación entre el envejecimiento y el sexo masculino [3,4]; así, respecto a la edad, la incidencia pasa de 0,3 casos por cada 1000 personas-año (intervalo de confianza al 95% [IC95%]: 0,1-1,0) en el grupo etario de 55-65 años a 4,3/1000 personas-año (IC95%: 2,4-7,7) en los mayores de 85 años. En relación al sexo, en todos los grupos etarios se ve un predominio de casos en varones, con una razón global de 1,54 (IC95%: 0,95-2,51) [3], por lo que se propone que habría un posible efecto protector de los estrógenos en las mujeres.
Otros factores de riesgo asociados son la diabetes mellitus, con una asociación positiva en personas con larga data de enfermedad [5-7]; exposición a pesticidas, cuyo riesgo se incrementa a mayor tiempo de exposición [8-10]; otras variables como el antecedente de traumatismo craneoencefálico, dislipidemia, malnutrición por exceso (sobrepeso/obesidad) e hipertensión arterial muestran aún asociaciones contradictorias. Por otra parte, factores ambientales como consumo de café, alcohol, tabaco y uso de antiinflamatorios no esteroideos se presentarían como factores protectores; incluso su presencia conjunta tendría un efecto sumatorio de protección [10-12].
Con respecto a la malnutrición por exceso (índice de masa corporal [IMC] ≥ 25 kg/m2) como factor de riesgo asociado a la enfermedad de Parkinson, la evidencia científica es contradictoria e incluso describe que antes que factor predisponente sería una consecuencia de la evolución de la enfermedad –su presencia indicaría un pobre pronóstico. Así, un metaanálisis que incluyó a 10 estudios longitudinales encontró que un incremento de 5 kg/m2 en el IMC no estaba asociado con un mayor riesgo de desarrollar la enfermedad en comparación con un IMC normal; tampoco las categorías de sobrepeso, obesidad o ambas (IMC ≥25 kg/m2); no obstante, este estudio mostraba sesgo de selección y heterogeneidad en los estudios incluidos (I2:64,5%; P heterogeneidad=0,0003) [13].
Otros estudios prospectivos que evaluaron IMC, obesidad y perímetro de cintura abdominal igualmente no evidenciaron asociación [7,14]; sin embargo, un estudio de cohortes detalló que, aunque no había asociación entre obesidad y probabilidad de desarrollar Parkinson, si halló asociación con el índice de circunferencia abdominal y cadera [15]. Otros estudios tampoco encontraron asociación con los cambios en el IMC, duración de la enfermedad, ni tiempo de permanencia en sedestación [16-19].
Dado que la literatura científica muestra evidencia contradictoria sobre la asociación entre malnutrición por exceso y la enfermedad de Parkinson; el presente estudio evaluó si la malnutrición por exceso es un factor asociado al desarrollo de la enfermedad de Parkinson en los pacientes atendidos en el departamento de Medicina del Hospital María Auxiliadora durante el periodo 2007-2017 mediante la realización de un estudio tipo caso y control a partir del análisis secundario de una base de datos, y de esta manera valorar si será útil modificar estilos de vida desde etapas tempranas con el fin de disminuir el probabilidad de desarrollar la enfermedad.
MATERIALES Y MÉTODOS
Diseño y lugar de estudio
Se realizó un estudio observacional, analítico, tipo caso y controles a partir del análisis secundario de la base de datos del estudio primario: "Asociacion entre diabetes mellitus y enfermedad de Parkinson, Hospital Maria Auxiliadora 2007-2017: un estudio de casos y controles" [20]. Para esto se incluyó las observaciones del estudio madre que contaran con registros completos en la variable exposición.
Población y muestra
La población estuvo constituida por los pacientes atendidos en el departamento de Medicina del Hospital María Auxiliadora, Lima-Perú, durante el período de 2007 al 2017. Se realizó un muestreo no probabilístico consecutivo de los casos, una vez identificado el caso se seleccionó un control, no pareado, retrospectivo. Tanto los casos como los controles fueron obtenidos a partir del listado de las historias clínicas según código CIE 10 a partir de los registros clínicos electrónicos del hospital.
Criterios de selección
Se consideró como caso a todo paciente mayor de 40 años, con diagnóstico reciente de enfermedad de Parkinson realizado por un médico neurólogo y consignado en la historia clínica; se excluyeron aquellos pacientes que hayan consumido drogas neurolépticas o procinéticas por más de un mes, o que hayan sufrido un traumatismo craneoencefálico o infecciones del sistema nervioso central.
Los controles fueron pacientes mayores de 40 años que acudieron al departamento de Medicina del hospital para ser atendidos por otra patología aguda, diferente a la enfermedad de Parkinson: celulitis, neumonía, infección de vías respiratorias altas, infección urinaria, dolor abdominal, pancreatitis aguda.
La proporción de casos y controles fue de 1:1.
Variables
Variable resultado: presencia de enfermedad de Parkinson. Enfermedad crónica neurodegenerativa, cuyo diagnóstico es clínico basado en la presencia de acinesia, temblor de reposo y rigidez, debiendo descartarse causas secundarias de parkinsonismo mediante la realización de una tomografía espiral multicorte o resonancia magnética cerebral. Para el estudio se definió esta variable como paciente con diagnóstico clínico de enfermedad de Parkinson realizado por un neurólogo y que este consignado en la historia clínica. Fue manejado como variable cualitativa dicotómica con valores 1 (presencia de enfermedad) y 0 (ausencia de enfermedad).
Variable exposición: malnutrición por exceso. Fue evaluada mediante el IMC, siendo categorizada con un punto de corte de 25 kg/m2 (0: <25 kg/m2 [no malnutrición por exceso] y 1: ≥25 kg/m2 [malnutrición por exceso]).
Covariables: edad, sexo, raza, estado civil, consumo de tabaco, consumo de café, consumo de alcohol, presencia de diabetes mellitus en el último año previo al ingreso del estudio; datos que fueron consignados en las historias clínicas según autorreporte del paciente, empleándose una escala nominal con valores de 0 (ausencia) y 1 (presencia). Asimismo, se consideró sexo y edad registrada en la historia clínica por el personal técnico. La edad se analizó como variable continua.
Análisis estadístico
El análisis estadístico se realizó utilizando el paquete estadístico Stata 15 para Windows. Primero, se realizó un análisis descriptivo para evaluar las características basales de la población de estudio, presentando los datos cualitativos en forma de frecuencias absolutas y porcentajes, y los datos cuantitativos mediante mediana y rango intercuartílico (RIQ) o medias y desviación estándar, de acuerdo a su distribución. Luego se realizó un análisis bivariado entre los dos grupos de pacientes (casos y controles): las variables cualitativas (sexo, diabetes mellitus, consumo de alcohol, tabaco y café, hipertensión arterial, dislipidemia, ECV, IMC, uso de fármacos psicotrópicos) se analizaron mediante el test de Chi cuadrado o el test exacto de Fisher y las cuantitativas (Edad) con la prueba t de Student o con técnicas no paramétricas de acuerdo a la distribución de la variable. Finalmente, se realizó un modelo de regresión logística simple para el cálculo de los odds ratio (OR) y sus respectivos intervalos de confianza (IC95%). Para ajustar las covariables que se asociaron a la aparición de la enfermedad de Parkinson, se desarrolló un modelo de regresión logística múltiple (step up). En dicho modelo se incluyeron las variables que fueron posibles confusoras de acuerdo a nuestro diagrama acíclico dirigido (DAG) (Figura 1). Se consideró como nivel de significancia estadística p<0,05.
Aspectos éticos
Esta investigación se realizó con los datos provistos por el estudio primario, con la autorización del investigador principal, sin posibilidad de identificar a los participantes. El estudio primario [20] fue evaluado y aprobado por el Comité de ética del Hospital Maria Auxiliadora.
RESULTADOS
Se evaluó un total de 230 pacientes (115 casos y 115 controles). Con respecto a las características basales de la población, la mediana de edad fue de 67 años (RIQ: 47-93), con un IMC promedio de 25,6 (DS±3.2), siendo la raza mestiza la predominante (96,1%). En el autorreporte de consumo de tabaco, alcohol y café, los participantes negaron el consumo de estas sustancias (90,4%, 79,6% y 78,5%, respectivamente). Asimismo, la proporción de pacientes con factores de riesgo cardiovascular como hipertensión arterial (25%), diabetes mellitus (16%) y dislipidemia (26%) fue mucho menor.
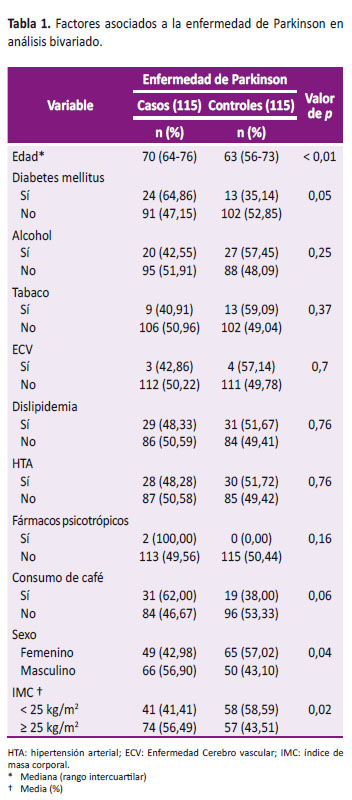
El grupo con enfermedad de Parkinson presentó un porcentaje mayor de pacientes con IMC ≥ 25 kg/m2 en comparación con el grupo control (64,35% frente al 49,57%). Respecto al sexo, la proporción de varones fue mayor en el grupo con Enfermedad de Parkinson, comparada con el control (57,39% frente a 43,48%).
Los pacientes con enfermedad de Parkinson fueron, en su mayoría, varones y de mayor edad comparados con los controles (56,9% frente a 43,1%; 70 años frente a 63 años), siendo esto estadísticamente significativo en ambos casos (p<0,05); asimismo, los casos (56,49%) presentaron un mayor porcentaje de pacientes con IMC ≥ 25 kg/m2 en comparación a los controles (43,51%), manteniéndose la significancia estadística (p=0.02) (Tabla 1).
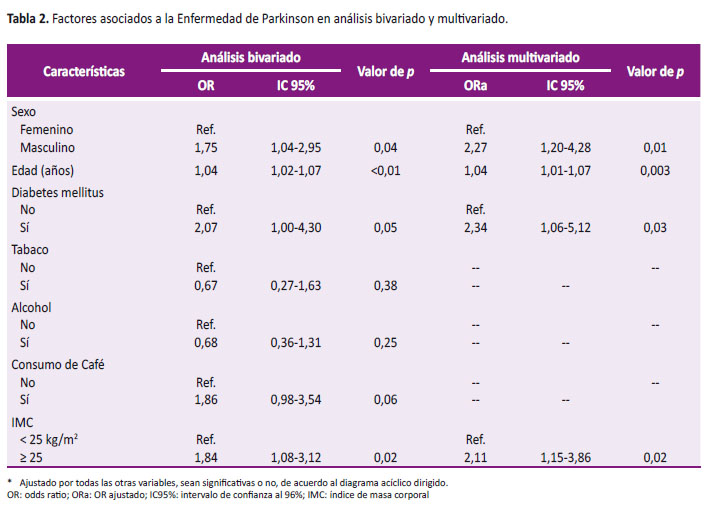
En el análisis bivariado se encontró que la malnutrición por exceso aumenta la probabilidad de tener enfermedad de Parkinson (OR: 1,84; IC95%: 1,08-3,12). Asimismo, la edad (OR: 1,04; IC95%: 1,02-1,07) y el sexo masculino (OR: 1,75, IC95%: 1,04-2,95) (Tabla 2).
La asociación entre malnutrición por exceso y enfermedad de Parkinson se mantuvo luego de ser ajustado por sexo, edad, diabetes mellitus, consumo de tabaco, alcohol y café en un análisis de regresión logística múltiple (ORa: 2,11; IC95%: 1,15-3,86) (Tabla 2).
DISCUSIÓN
El presente estudio encontró que la malnutrición por exceso (sobrepeso y obesidad) estuvo asociada a la enfermedad de Parkinson (OR 2,11; IC 95%: 1,15-3,86). En relación a esta asociación, el estudio realizado por Hu et al. [21] en Finlandia encontró que un IMC ≥ de 23 kg/m2 se asociaba a mayor riesgo de enfermedad, al igual que en el estudio transversal realizado por Briceño et al. donde se evidenció que los pacientes con enfermedad de Parkinson presentaron frecuentemente sobrepeso y obesidad.
La asociación entre malnutrición por exceso y enfermedad de Parkinson podría explicarse porque en ambas enfermedades el sistema dopaminérgico juega un rol importante; en la malnutrición por exceso la dopamina regula la ingesta de alimentos a nivel del hipotálamo [22,23], en tanto que en la enfermedad de Parkinson se presenta una disminución de las neuronas dopaminérgicas en la sustancia nigrans. No obstante, a pesar de nuestro resultado y por los estudios que muestran resultados contradictorios con respecto a esta asociación [3,7,13], se requiere de estudios longitudinales que permitan evaluar mejor esta asociación.
Por otro lado, se evidenció que la edad, el sexo masculino y diabetes mellitus fueron factores asociados a la enfermedad de Parkinson; también el sexo masculino (ORa: 2,27; IC 95%: 1,20-4,28). Estos resultados son consistentes con otros estudios tantos prospectivos y de caso control [3,4,7,11] donde la edad y el sexo masculino son factores de riesgo bien definidos para el desarrollo de la enfermedad de Parkinson. La presencia de diabetes mellitus fue un factor que aumenta la probabilidad de tener enfermedad de Parkinson, resultado que no concuerda con estudios previos [5-7].
En nuestro estudio, el consumo de alcohol no tuvo diferencias significativas en el análisis bivariado, resultado que no respalda lo que suele presentarse en otros estudios (factor protector para la presencia de la enfermedad de Parkinson), requiriendo mayores estudios al respecto o búsqueda de interacciones entre variables. El posible efecto protector del consumo de alcohol estaría relacionado a la presencia de cebada, fibra y minerales presentes en la cerveza y a los polifenoles del vino tinto. Otro argumento que respaldaría este efecto protector se relaciona con los niveles séricos de ácido úrico, que es un antioxidante natural, y que a que niveles bajos se asociaría a una mayor probabilidad de tener Parkinson [24-26]. Este efecto protector inducido por el alcohol se observaría a partir de un consumo de alcohol de 5g/d [25]. Por todo ello se requieren mayores estudios al respecto o búsqueda de interacciones entre variables.
No se encontró asociación entre el consumo de tabaco y café y la enfermedad de Parkinson, a pesar que en otros estudios son considerados factores protectores [10-12].
Con lo expuesto anteriormente, nuestro estudio evidencia una asociación entre malnutrición por exceso y enfermedad de Parkinson; sin embargo, se debe considerar como limitaciones del estudio que los datos son obtenidos a partir de una base de datos secundarios donde no necesariamente se explora las variables de nuestro DAG como son estilos de vida, incluyéndose pacientes con patologías digestivas que podrían afectar el IMC –no obstante, debemos señalar que las patologías de los controles eran cuadros agudos–.
Al ser la enfermedad de Parkinson una enfermedad crónica degenerativa cuyo riesgo incrementa con la edad se decidió controlar su efecto durante el momento del análisis estadístico mediante la regresión logística múltiple. Otra limitación a considerar es que la muestra fue tomada de una población hospitalaria, lo cual no permite generalizar los resultados a la población general; los datos son obtenidos de los registros de las historias clínicas, en las cuales las variables exploradas como: consumo de alcohol, tabaco, y café fueron obtenidas a partir del autorreporte, momento en el cual se pudo introducir sesgos como: el de memoria (frecuente en este tipo de estudio) y sesgo de cortesía el cual se relaciona con la veracidad de las respuestas de los sujetos, pudiendo producir mala clasificación de las covariables.
Asimismo, el consumo de alcohol, tabaco y café no fue cuantificado ni en tiempo ni en cantidad, solo se consideró consumo presente o ausente, además, se debe tener en cuenta que el poder estadístico fue de 0,67, por lo que debemos considerar todos estos aspectos e interpretar con cautela los resultados.
Por otro lado, es preciso señalar que la mayoría de los estudios que evalúan la asociación entre malnutrición y la enfermedad de Parkinson mediante diseños epidemiológicos robustos y grandes tamaños muestrales son principalmente europeos, asiáticos y norteamericanos, encontrando poca evidencia a nivel latinoamericano y nacional por lo que se debe plantear la posibilidad de realizar otros estudios en nuestra población para esclarecer la relación entre malnutrición por exceso y la enfermedad de Parkinson.
Finalmente podemos concluir que la malnutrición por exceso (sobrepeso/obesidad) se encuentra asociado a la presencia de enfermedad de Parkinson en la población estudiada, la cual se mantiene al ser ajustada por otras variables como edad, diabetes mellitus, sexo, alcohol, tabaco y café; aunque se requieren mayores estudios para respaldar este resultado dado el bajo poder estadístico y el diseño del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Martínez-Fernández. R, Gasca-Salas C, Sánchez-Ferro Á, Ángel Obeso J. Actualización en la enfermedad de Parkinson. Rev Med Cllin Las Condes. 2016;27(3):363-79. [ Links ]
2. Velásquez A. La carga de enfermedad y lesiones en el perú y las prioridades del plan esencial de aseguramiento universal. Rev Peru Med Exp Salud Publica. 2009;26(2):222-31. [ Links ]
3. De Lau LML, Giesbergen PCLM, De Rijk MC, Hofman A, Koudstaal PJ, Breteler MMB. Incidence of parkinsonism and Parkinson disease in a general population: The Rotterdam Study. Neurology. 2004;63(7):1240-4. [ Links ]
4. Benito-León J, Bermejo-Pareja F, Morales-González JM, Porta- Etessam J, Trincado R, Vega S, et al. Incidence of Parkinson disease and parkinsonism in three elderly populations of central Spain. Neurology. 2004;62(5):734-41. [ Links ]
5. De Pablo-Fernandez E, Sierra-Hidalgo F, Benito-León J, Bermejo- Pareja F. Association between Parkinson’s disease and diabetes: Data from NEDICES study. Acta Neurol Scand. 2017;136(6):732-6.
6. Yang Y-W, Hsieh T-F, Li C-I, Liu C-S, Lin W-Y, Chiang J-H, et al. Increased risk of Parkinson disease with diabetes mellitus in a populationbased study. Medicine (Baltimore). 2017;96(3):e5921. [ Links ]
7. Palacios N, Gao X, Mccullough ML, Jacobs EJ, Patel A V., Mayo T, et al. Obesity, diabetes, and risk of Parkinson’s disease. Mov Disord. 2011;26(12):2253-9.
8. Priyadarshi A, Khuder SA, Schaub EA, Shrivastava S. A meta-analysis of Parkinson’s disease and exposure to pesticides. Neurotoxicology. 2000;21(4):435-40.
9. Vigna E, Petrungaro A, Perri A, Terzi D, Recchia AG, Mendicino F, et al. Efficacy of eculizumab in severe ADAMTS13-deficient thrombotic thrombocytopenic purpura (TTP) refractory to standard therapies. Transfus Apher Sci. 2018;57(2):247-9. [ Links ]
10. Delamarre A, Meissner WG. Epidemiology, environmental risk factors and genetics of Parkinson’s disease. Presse Med. 2017;46(2):175-81.
11. Kim IY, O’Reilly ÉJ, Hughes KC, Gao X, Schwarzschild MA, Hannan MT, et al. Integration of risk factors for Parkinson disease in 2 large longitudinal cohorts. Neurology. 2018;90(19):e1646-53.
12. Lee P-C, Ahmed I, Loriot M-A, Mulot C, Paul KC, Bronstein JM, et al. Smoking and Parkinson disease: Evidence for gene-by-smoking interactions. Neurology. 2018;90(7):e583-92. [ Links ]
13. Wang Y-L, Wang Y-T, Li J-F, Zhang Y-Z, Yin H-L, Han B. Body Mass Index and Risk of Parkinson’s Disease: A Dose-Response Meta-Analysis of Prospective Studies. PLoS One. 2015;10(6):e0131778.
14. Logroscino G, Sesso HD, Paffenbarger RS, Lee I-M. Body Mass Index and Risk of Parkinson’s Disease: A Prospective Cohort Study. Am J Epidemiol. 2007;166(10):1186-90.
15. Chen H, Zhang SM, Schwarzschild MA, Hernán MA, Willett WC, Ascherio A. Obesity and the Risk of Parkinson’s Disease. Am J Epidemiol. 2004;159(6):547-55.
16. Van der Marck MA, Dicke HC, Uc EY, Kentin ZHA, Borm GF, Bloem BR, et al. Body mass index in Parkinson’s disease: A meta-analysis. Park Relat Disord. 2012;18(3):263-7.
17. Ragonese P, D’Amelio M, Callari G, Di Benedetto N, Palmeri B, Mazzola MA, et al. Body mass index does not change before Parkinson’s disease onset. Eur J Neurol. 2008;15(9):965-8.
18. Roos E, Grotta A, Yang F, Rino B, Ye W. Body mass index , sitting time, and risk of Parkinson disease. Neurology. 2018;90(16):e1413-7. [ Links ]
19. Morales-Briceño H, Cervantes-Arriaga A, Rodríguez-Violante M, Calleja-Castillo J, Corona T. Overweight is more prevalent in patients with Parkinson’s disease. Arq Neuropsiquiatr. 2012;70(July):843-6.
20. Loza Avalos A. Asociacion entre diabetes mellitus y enfermedad de Parkinson, Hospital Maria Auxilidora 2007-2017: Un estudio de casos y controles [Tesis Bachiller]. Lima, Perú: Universidad Cientifica del Sur; 2008. [ Links ]
21. Hu G, Jousilahti P, Nissinen A. Body mass index and the risk of Parkinson disease. Neurology. 2006;67(11):1955-9. [ Links ]
22. Meguid MM, Fetissov SO, Varma M, Sato T, Zhang L, Laviano A, et al. Hypothalamic dopamine and serotonin in the regulation of food intake. Nutrition. 2000;16(10):843-57. [ Links ]
23. Schwartz MW, Woods SC, Porte D, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature. 2000;404(6778):661- 71. [ Links ]
24. Campdelacreu J. Enfermedad de Parkinson y enfermedad de Alzheimer: factores de riesgo ambientales. Neurologia. 2014;29(9):541-9. [ Links ]
25. Hernán MA, Chen H, Schwarzschild MA, Ascherio A. Consumption and the incidence of Parkinson´s disease. Ann Neurol. 2003;54(2):170-5. [ Links ]
26. Noyce AJ, Bestwick JP, Silveira-Moriyama L, Hawkes CH, Giovannoni G, Lees AJ, et al. Meta-analysis of early nonmotor features and risk factors for Parkinson disease. Ann Neurol. 2012;72(6):893-901. [ Links ]
Correspondencia
Ysabel Lozano Rodas
Recibido: 27/02/2019
Aprobado: 12/06/2019