Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. Peru vol.36 no.3 Lima jul./set. 2019
ARTÍCULO ORIGINAL
Crecimiento físico de niños con hiperplasia suprarrenal congénita perdedora de sal durante los dos primeros años de vida en el Instituto Nacional de Salud del Niño
Physical growth in children with salt-wasting adrenal hyperplasia during their first two years of life in the Peruvian National Children’s Health Institute
Ana C. Gariza1,a, Carlos M. Del Águila2,a, Juan M. Falen3,b, María I. Rojas3,c, Oswaldo Núñez2,a, Eliana M. Chávez2,a, Oscar A. Espinoza2,a, Paola M. Pinto2,a, Martha R. Calagua2,a, Miguel A. De Los Santos2,a.
1 Hospital Nacional Hipólito Unanue. Lima, Perú.
2 Instituto Nacional de Salud del Niño. Lima, Perú.
3 Facultad de Medicina, Universidad Nacional Federico Villarreal. Lima, Perú.
a Médico Endocrinólogo Pediatra
b Profesor Emérito
c Docente principal
RESUMEN
Objetivo: Describir el crecimiento físico de niños con hiperplasia suprarrenal congénita (HSC) perdedora de sal durante los dos primeros años de vida, evaluados en el Servicio de Endocrinología del Instituto Nacional de Salud del Niño (INSN), Lima-Perú. Materiales y métodos: Es un estudio observacional, descriptivo y retrospectivo. Se incluyeron 55 niños con HSC que tuvieron seguimiento en el Servicio de Endocrinología del INSN del 2000 al 2016; se recopilaron datos como peso y talla al nacer y cada 6 meses, edad al diagnóstico, dosis de hidrocortisona y fludrocortisona y velocidad de crecimiento. Resultados: Se analizaron 55 niños con HSC perdedora de sal siendo el diagnóstico más precoz en mujeres (mediana: 21 días) que en varones (mediana: 52 días). Al nacimiento, su longitud promedio fue 0,07 + 0,75 DE; a los 6 meses fue -1,67 + 1,33 DE con mayor compromiso en varones (-2,29 + 1,18 DE; p=0,022); a los 12 meses fue -1,84 + 1,27 DE, con recuperación a los 24 meses (-1,51 + 1,10 DE). La velocidad de crecimiento fue -1,03 + 1,62 DE y -0,89 + 1,06 DE en el en el primer y segundo año, respectivamente. Conclusiones: Los niños con HSC perdedora de sal que tuvieron seguimiento en el INSN, tuvieron menor longitud a los 6 y 12 meses de edad y lograron recuperarse a los 24 meses.
Palabras clave: Hiperplasia suprarrenal congénita; Crecimiento y desarrollo; Glucocorticoides; Niño (fuente: DeCS BIREME).
ABSTRACT
Objective: To describe physical growth features in children with salt-wasting congenital adrenal hyperplasia (CAH) during their first two years of life, in the Endocrinology Service of the Peruvian National Children’s Health Institute (CHI) in Lima, Peru. Materials and Methods: This is a retrospective, observational, and descriptive study. Fifty-five children with CAH underwent follow-up in the Endocrinology Service of the CHI from 2000 to 2016; data such as body weight and height were collected at birth time and every six months, as well as age at diagnosis, hydrocortisone and fludrocortisone doses, and growth velocity. Results: Fifty-five children with salt-wasting CAH were assessed, the diagnosis was more promptly made in females (median: 21 days) compared to males (median: 52 days). At birth, their average length was 0.07 ± 0.75 SD; at 6 months it was –1.67 ± 1.33 SD, and male subjects were more affected (–2.29 ± 1.18 SD; p= 0.022); at 12 months, this parameter was –1.84 ± 1.27 SD, and recovery was observed at 24 months (–1.51 ± 1.10 SD). Growth velocity values were –1.03 ± 1.62 SD and –0.89 ± 1.06 SD in the first and second years of life, respectively. Conclusions: Children with salt-wasting CAH who were followed-up at CHI had shorter length at 6- and 12- months of age, and their recovered at 24-monbths.
Keywords: Adrenal hyperplasia, congenital; Child; Growth and development; Glucocorticoids (source: MeSH NLM).
INTRODUCCIÓN
La hiperplasia suprarrenal congénita (HSC) es una enfermedad autosómica recesiva que afecta la biosíntesis del cortisol, siendo la causa más frecuente el déficit de 21 hidroxilasa [1,2]; adicionalmente, el 75% de éstos cursan con déficit mineralcorticoide, lo que es conocido como la forma perdedora de sal [3,4]. Se estima que la HSC tiene una incidencia mundial de uno en 10 000 a 20 000 nacimientos vivos, los que son diagnosticados en forma temprana gracias a la implementación de cientos de programas de tamizaje neonatal [5]. En nuestro país, el reporte temprano de estos casos no fue oficializado hasta el año 2019, cuando se reglamentan los procedimientos necesarios para el tamizaje neonatal en casos de enfermedades congénitas, entre ellas, la HSC [6]. Hasta este momento, la frecuencia de HSC en nuestra población solo se estimaba mediante reportes aislados por establecimientos; por ejemplo, según un reporte del Instituto Nacional Materno Perinatal, la prevalencia de HSC, del 2003 al 2010, fue de 1 por cada 14 946 recién nacidos vivos [7].
Sumado a la falta de datos sobre la frecuencia de esta enfermedad, no se han encontrado referencias que diluciden el impacto de la HSC en el desarrollo y crecimiento de los pacientes afectados, a nivel nacional. Cabe destacar que el tratamiento de la HSC perdedora de sal consiste en corregir el déficit del cortisol y aldosterona [8,9], lo que se logra con el reemplazo de glucocorticoides, mineralocorticoide y suplementos de sal [10]. El reemplazo inadecuado de glucocorticoides no suprime el exceso de andrógenos adrenales causando alteraciones en el patrón de crecimiento lineal; y su exceso resulta en pobre crecimiento lineal por disminución de la velocidad de crecimiento [11,12].
En este contexto, se ha demostrado que dosis de hidrocortisona mayores de 20 mg/m2/d en infantes y de más de 15 - 17 mg/m2/d en adolescentes, causan disminución de la desviación estándar (DE) de la talla, por lo cual se recomienda su reemplazo con dosis de 10 - 15 mg/m2/d [2]. Al respecto, un reporte previo realizado en el Instituto Nacional de Salud del Niño (INSN), hace 23 años, describió una caída de la talla a los 12 meses (-3,22 DE) con recuperación lenta hacia los dos años de edad (-1,81 DE), en pacientes con HSC que recibieron prednisona (5 a 6 mg/m2/d) o hidrocortisona (12 a 25mg/m2/d) en ritmo invertido más fludrocortisona [13].
Desde ese entonces, no se han encontrado nuevas investigaciones que actualicen o reafirmen los datos brindados por el reporte previamente descrito. Por tanto, el objetivo de este estudio fue describir el crecimiento físico de niños con HSC perdedora de sal durante los dos primeros años de vida evaluados en el Servicio de Endocrinología del INSN, en el periodo de tiempo desde el año 2000 hasta el 2016.
MATERIALES Y MÉTODOS
Diseño del estudio
Es un estudio observacional, descriptivo y retrospectivo; realizado en el servicio de Endocrinología del INSN (Lima - Perú) en historias clínicas de pacientes con HSC, diagnosticados desde el 01 de enero del 2000 al 31 de diciembre del 2016.
Población de estudio
Se revisaron 73 historias clínicas de niños con HSC perdedora de sal con seguimiento durante los dos primeros años de vida, excluyéndose 18 casos (Diez historias con datos incompletos, dos casos de síndrome de Klinefelter, un caso de tuberculosis pulmonar, un caso de síndrome de Noonan, una historia de hipotiroidismo congénito, una historia de paciente portador de ileostomía, un paciente que recibió prednisona, y un fallecido).
Con estas exclusiones se obtuvo una muestra final de 55 pacientes que recibieron hidrocortisona y fludrocortisona como terapia de reemplazo hormonal.
Variables de estudio
Se recopilaron datos del nacimiento como lugar (región), peso (g) y longitud (cm); al diagnóstico, se registró, edad (días), 17 hidroxiprogesterona (17OHP) (ng/mL), sodio y potasio (mEq/L), dosis de mantenimiento de hidrocortisona (mg/m2/día) y fludrocortisona (µg/m2/día). Se recolectaron datos de peso (Kg), longitud (cm) y dosis de hidrocortisona y fludrocortisona a los 6, 12, 18 y 24 meses de edad, considerándose como máximo un mes de diferencia en relación a la edad cronológica para los controles indicados.
Se realizó el cálculo de velocidad de crecimiento (cm/año) a los 12 y 24 meses de edad, para el cálculo de desviación estándar se utilizaron las tablas de referencia de Rikken basadas en datos británicos y suecos [14].
Se calculó la desviación estándar del peso y longitud en función del puntaje z, el cual se define como la diferencia entre el valor individual y el valor medio de la población de referencia (curvas de crecimiento de CDC del 2000), para la misma edad y sexo, dividido entre la desviación estándar de la población de referencia.
Análisis estadístico
Los datos recolectados fueron procesados de manera automatizada en Microsoft Office Excel 2010 ® presentándose el análisis de las variables en cuadros estadísticos de doble entrada y figuras, las cuales fueron expresadas como promedio y desviación estándar o mediana y cuartiles (Q1-Q3) según corresponda. El análisis estadístico se realizó según la prueba no paramétrica de U Mann-Whitney, considerándose un valor p <0,05 como estadísticamente significativo.
Aspectos éticos
El estudio fue autorizado por el Comité de Ética de la Oficina Ejecutiva de Apoyo a la Investigación y Docencia Especializada del INSN.
RESULTADOS
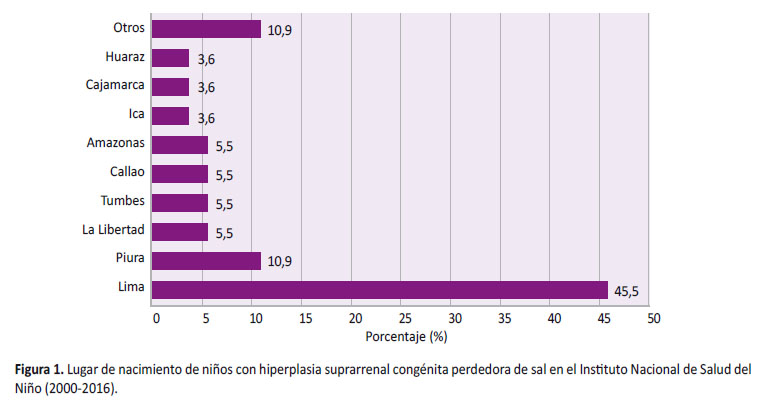
Se analizaron 55 niños (34 mujeres y 21 varones) con diagnóstico de HSC perdedora de sal con seguimiento durante los dos primeros años de vida. De acuerdo al lugar de nacimiento, 25 niños nacieron en la región Lima (45,5%), seis en Piura (10,9%), y tres en La Libertad, Tumbes, Callao y Amazonas (5,5%) (Figura 1).
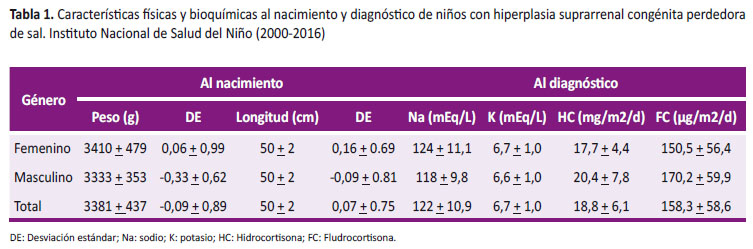
La mediana de la edad al diagnóstico fue 26 días (Q1-Q3: 14 - 59), en mujeres fue 21 días (Q1-Q3: 12 - 39) mientras que en varones fue 52 días (Q1-Q3: 29 - 79). La crisis perdedora de sal, se caracterizó por cursar con deshidratación hiponatremica e hiperpotasemia, teniendo valor promedio de sodio: 122 + 10,9 mEq/L y de potasio: 6,7 + 1,0 mEq/L, corroborándose el diagnóstico con 17 OHP elevado (mediana: 50 ng/mL, Q1-Q3: 19 – 186,7). Recibieron tratamiento con hidrocortisona a dosis de estrés y posteriormente dosis de mantenimiento de 18,8 + 6,1 mg/m2/día, solo 16 casos recibieron dosis 20mg/m2/día y recibieron dosis de fludrocortisona de 158,3 + 58,6 µg/m2/día (Tabla 1).
Al nacimiento, se registró el peso promedio de 3381 + 437 gramos (-0,09 + 0,89 DE) y la longitud promedio fue de 50 + 2 cm siendo mayor en mujeres (0,16 + 0,69 DE) que en varones (-0,09 + 0,81 DE) sin diferencia significativa (p = 0,272) (Tabla 1).
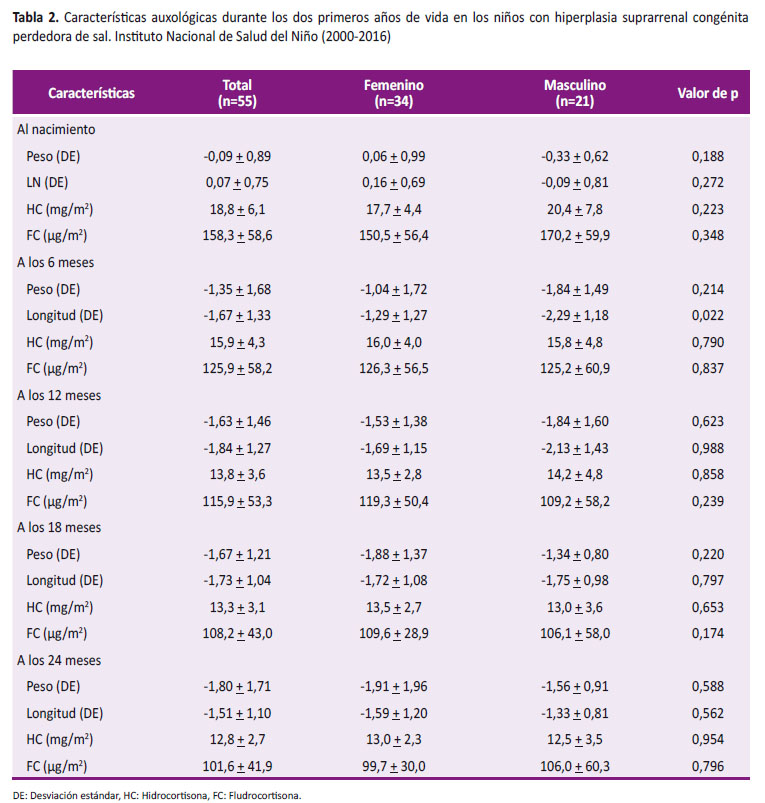
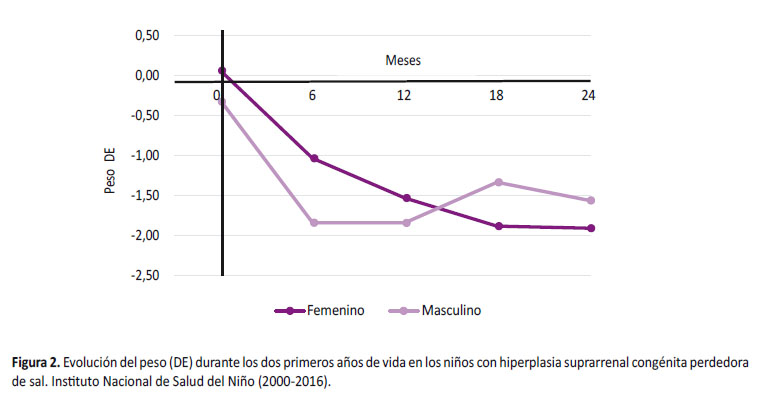
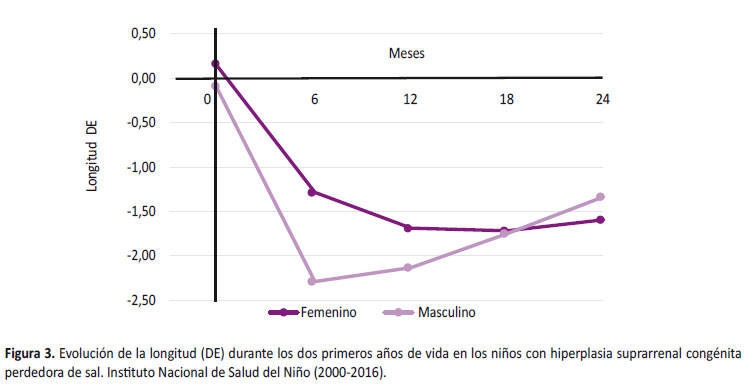
Durante su evolución, a los 6 meses, el peso promedio fue -1,35 + 1,68 DE y en relación a la longitud promedio fue -1.67 + 1.33 DE viéndose más afectada en varones (-2,29 + 1,18 DE) que en mujeres (-1,29 + 1,27 DE) siendo un hallazgo significativo (p = 0,022) (Figura 3). La dosis de hidrocortisona que recibieron fue 15,9 + 4,3 mg/m2/d y de fludrocortisona fue 125,9 + 58,2 µg/m2/d sin diferencia significativa (Tabla 2).
A los 12 meses de edad, el peso promedio fue -1,63 + 1,46 DE y la longitud promedio fue -1,84 + 1,27 DE, siendo menor en varones (-2,13 + 1,43 DE) que en mujeres (-1,69 + 1,15 DE) sin significancia estadística (p= 0,988) (Figura 3). La dosis promedio de hidrocortisona fue 13,8 + 3,6 mg/m2/d y solo un niño recibió dosis 20mg/m2/día, la dosis de fludrocortisona fue 115,9 + 53,3 µg/m2/día (Tabla 2).
A los 18 meses, el peso promedio fue -1,67 + 1,21 DE y se describe recuperación de la longitud, siendo en varones de -1,75 + 0,98 DE y en mujeres de -1,72 + 1,08 DE (Figura 3). No se reportó ningún caso que reciba dosis de hidrocortisona 20mg/m2/día.
A los 24 meses, el peso promedio fue -1,80 + 1,71 DE y presentaron recuperación de la longitud en ambos sexos, siendo en las mujeres de -1,59 + 1,20 DE y en varones de -1,33 + 0,81 DE sin diferencia significativa (Figura 3). Además se requirió menor dosis de hidrocortisona (12,8 + 2,7 mg/m2/d) y fludrocortisona (101,6 + 41,9 µg/m2/d) (Tabla 2).
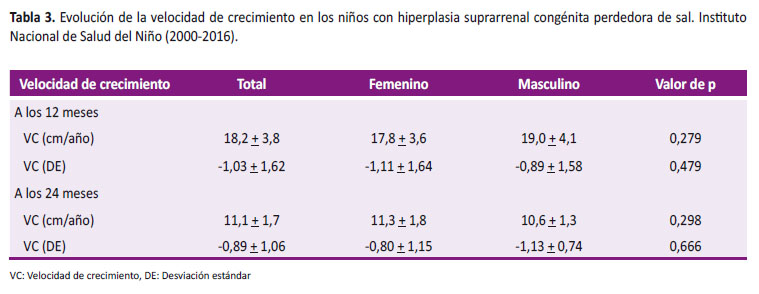
La velocidad de crecimiento fue 18,2 + 3,8 cm/a (-1,03 + 1,62 DE) en el primer año, mientras que a los 24 meses tuvieron una velocidad de crecimiento de 11,1 + 1,7 cm/a (-0,89 + 1,06 DE) (Tabla 3).
DISCUSIÓN
El 51% de casos reportados son de Lima y Callao, probablemente por la mayor densidad poblacional y el 21,9% pertenece al norte del país. Por tratarse de una enfermedad autosómica recesiva, probablemente exista antecedentes de consanguinidad, por ejemplo, un estudio previo encontró que en comunidades de Piura se ha reportado mayor prevalencia de estas enfermedades [15].
Por otro lado, Van der Kamp et al. describieron en niños holandeses que la edad del diagnóstico fue 11 días en mujeres y 44 días en varones [16]; mientras que Gasparini et al. registraron una media de 15 + 14 días en mujeres y 45 + 16 días en varones (p < 0,005) [17]. En nuestro estudio, la mediana fue 21 días en mujeres y 52 días en varones, lo que representa un diagnóstico tardío, explicado por no contar con un Programa Nacional de Tamizaje Neonatal, lo que se agrava en varones debido a que no suelen presentar signos clínicos al nacimiento [10].
Con respecto a la longitud al nacer, se conoce que es menor en niños afectados por HSC, reconociéndose en estudios previos, que existen diferencias por género. Balsamo et al. describieron una longitud de 51,2 ± 1,7 cm y 50,3 ± 1,5 cm en varones y mujeres, respectivamente [18]; probablemente debido al hiperandrogenismo in útero que afecta el crecimiento en los severamente afectados [19]. Estos hallazgos son coherentes con lo descrito en esta investigación, aunque en nuestro caso no se encontraron diferencias significativas (50 + 2 cm en varones y mujeres).
Por otro lado, Takasawa reportó que el valor de 17 OHP promedio al diagnóstico fue 193 ng/mL con inicio del reemplazo hormonal a los 12,5 + 5,4 días de vida [20]; mientras que en nuestro estudio se registró una mediana de 50 ng/ml (Q1-Q3: 19 – 186.7). Esta discordancia podría ser explicada por la forma de selección de los casos y la distribución no paramétrica de la variable en estudio.
Van der Kamp et al. reportaron mayor dosis de hidrocortisona durante los tres primeros meses (39,7 y 44,9 mg/m2/día en varones y mujeres, respectivamente) en comparación con este estudio (18,8 + 6,1 mg/m2/día). Probablemente, esta conducta terapéutica se brindó con el fin de lograr mejor control metabólico, sin embargo, esto se tradujo en una menor talla adulta objetivo [16]. Estudios previos han demostrado que la dosis de hidrocortisona en el primer año se correlaciona negativamente con la velocidad de crecimiento, sugiriendo que en esta etapa, los pacientes son sensibles a los glucocorticoides y a la perdida salina [20–22].
Bonfig et al., evidenciaron que la longitud a los 12 meses fue –1,10 + 1,80 DE y –0,90 + 0,90 DE en mujeres y varones, respectivamente con recuperación a los tres años (–0,40 + 1,8 DE y –0,80 + 1,00 DE en mujeres y varones, respectivamente) [23,24]. Del Águila et al. reportó una caída de la longitud en el tercer mes (-1,95 DE) manteniéndose hasta llegar al año de edad (-3,22 DE), para luego iniciar recuperación hacia los dos años de edad (-1,81 DE) [13]. Similar a lo descrito, donde se observó una caída a los seis meses mayor en varones (-2,29 + 1,18 DE) que en mujeres (-1,29 + 1,27 DE) con recuperación a los 24 meses de edad (varones: -1,33 + 0,81 DE y mujeres: -1,59 + 1,20 DE).
En el primer año de vida, la velocidad de crecimiento esta disminuida en pacientes con HSC, describiéndose una correlación negativa significativa entre la dosis media de glucocorticoides y la velocidad de crecimiento [25]. Gasparini et al. notó que la velocidad de crecimiento en el primer año fue 0,16 + 0,89 DE en varones y 0,00 + 1,10 DE en mujeres con un incremento a los 2 años a 1,20 + 1,26 DE y 0,50 + 1,37 DE en varones y mujeres, respectivamente [17]. Nuestra investigación reportó resultados similares con una velocidad de crecimiento en el primer año de -1,03 + 1,62 DE con una recuperación al segundo año (-0,89 + 1,06 DE).
En la HSC perdedora de sal, la talla adulta se correlaciona positivamente con la talla a los dos años [26,27]. Existen factores que influyen negativamente como el exceso de andrógenos suprarrenales, la presentación de pubertad precoz central y el tratamiento crónico con glucocorticoides. Por tanto la meta es conseguir un buen control metabólico y uso de dosis de hidrocortisona de mantenimiento para alcanzar la talla genética [28]. En aquellos casos de no lograrlo, se podría utilizar la hormona de crecimiento y análogos de hormona liberadora de gonadotrofinas sola o combinada [28], aunque se requieren de estudios que aborden esta problemática y desarrollen seguimiento a largo plazo en estos pacientes.
Dentro de las limitaciones de este estudio, se encuentra la forma de recolección de la información ya que la fuente de los datos analizados son las historias clínicas, por lo que la calidad del registro de factores como el peso, la talla o el tratamiento brindado está influenciada por la metodología de trabajo de los profesionales encargados de brindar las prestaciones de salud correspondientes. Así mismo, se debe recordar que al ser el INSN, un instituto especializado, los datos de estudio no proceden de un tamizaje neonatal, por ende, los resultados obtenidos en esta investigación no pueden ser extrapolados ni pueden actuar como indicadores de la prevalencia de HSC en la población general.
Se concluye que los niños con HSC perdedora de sal que tuvieron seguimiento en el INSN, tuvieron menor longitud a los 6 y 12 meses de edad, periodo en el que requirieron mayor dosis de hidrocortisona y lograron recuperarse a los 24 meses.
Contribuciones de autoría
ACG colaboró con contribuciones significativas al diseño del manuscrito, recolección, análisis e interpretación de los datos; redacción y revisión crítica importante del contenido del manuscrito; la aprobación final de la versión que se publicará; y asumir la responsabilidad frente a todos los aspectos del manuscrito, para garantizar que los asuntos relativos a la exactitud o integridad de cualquier parte del mismo serán adecuadamente investigados y resueltos. CMDA realizó contribuciones significativas a la concepción y al diseño del manuscrito; revisión crítica importante del contenido del manuscrito y la aprobación final de la versión que se publicará. JMF, MIR, ON, EMC, OAE, PMP, MRC y MADLS realizaron la revisión crítica importante del contenido a ser publicado.
Fuente de financiamiento: Autofinanciamiento
Conflictos de interés: Los autores no refieren conflictos de interés a declarar.
Citar como: Gariza AC, Del Águila CM, Falen JM, Rojas MI, Nuñez O, Chávez EM, Espinoza OA, Pinto PM, Calagua MR, De los Santos MA. Crecimiento físico de niños con hiperplasia suprarrenal congénita perdedora de sal durante los dos primeros años de vida en el Instituto Nacional de Salud del Niño. Acta Med Peru. 2019;36(3):209-16
REFERENCIAS BIBLIOGRÁFICAS
1. Jääskeläinen J, Voutilainen R. Growth of patients with 21-hydroxylase deficiency: an analysis of the factors influencing adult height. Pediatr Res. 1997;41(1):30-3.
2. Lin J, Ma H, Su Z, Li Y, Chen H, Chen Q, et al. Near-final height in 82 Chinese patients with congenital adrenal hyperplasia due to classic 21-hydroxylase deficiency: a single-center study from China. J Pediatr Endocrinol Metab JPEM. 2016;29(7):841-8. [ Links ]
3. Speiser PW, Arlt W, Auchus RJ, Baskin LS, Conway GS, Merke DP, et al. Congenital Adrenal Hyperplasia Due to Steroid 21-Hydroxylase Deficiency: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2018;103(11):4043-88. [ Links ]
4. White PC, Speiser PW. Long-term consequences of childhood-onset congenital adrenal hyperplasia. Best Pract Res Clin Endocrinol Metab. 2002;16(2):273-88. [ Links ]
5. Hannah-Shmouni F, Morissette R, Sinaii N, Elman M, Prezant TR, Chen W, et al. Revisiting the prevalence of nonclassic congenital adrenal hyperplasia in US Ashkenazi Jews and Caucasians. Genet Med. 2017;19(11):1276-9. [ Links ]
6. Ministerio de Salud. Aprobar la NRS No 154-MINSA/2019/DGIESP: Norma Técnica de Salud para el Tamizaje Neonatal de Hipotiroidismo Congenito, Hiperplasia Suprarrenal Congénita, Fenilcetonuria, Fibrosis Quistica, Hipoacusia Congénita y Catarata Congénita. [Internet]. 2019 [citado 2019 oct 21]. Available from: https://www.gob.pe/institucion/minsa/normas-legales/280743-558-2019-minsa [ Links ]
7. Dávila Aliaga C. Programa de Tamizaje Neonatal. Actual Materna Perinat. 2011;(9):19-25. [ Links ]
8. Hargitai G, Sólyom J, Battelino T, Lebl J, Pribilincová Z, Hauspie R, et al. Growth patterns and final height in congenital adrenal hyperplasia due to classical 21-hydroxylase deficiency. Results of a multicenter study. Horm Res. 2001;55(4):161-71. [ Links ]
9. Bretones P, Riche B, Pichot E, David M, Roy P, Tardy V, et al. Growth curves for congenital adrenal hyperplasia from a national retrospective cohort. J Pediatr Endocrinol Metab JPEM. 2016;29(12):1379-88. [ Links ]
10. El-Maouche D, Arlt W, Merke DP. Congenital adrenal hyperplasia. Lancet Lond Engl. 2017;390(10108):2194-210. [ Links ]
11. Sellick J, Aldridge S, Thomas M, Cheetham T. Growth of patients with congenital adrenal hyperplasia due to 21-hydroxylase in infancy, glucocorticoid requirement and the role of mineralocorticoid therapy. J Pediatr Endocrinol Metab JPEM. 2018;31(9):1019-22. [ Links ]
12. Fleming L, Van Riper M, Knafl K. Management of Childhood Congenital Adrenal Hyperplasia-An Integrative Review of the Literature. J Pediatr Health Care Off Publ Natl Assoc Pediatr Nurse Assoc Pract. 2017;31(5):560-77. [ Links ]
13. Del Águila C, Falen J, Rojas M, Zaldivar M. Crecimiento físico de pacientes con hiperplasia suprarrenal congénita perdedor de sal durante los dos primeros años de vida. En: X Reunión de la Sociedad Latinoamericana de Endocrinología Pediátrica. Argentina; 1996. [ Links ]
14. Rikken B, Wit JM. Prepubertal height velocity references over a wide age range. Arch Dis Child. 1992;67(10):1277-80. [ Links ]
15. Abarca Barriga HH, Chávez Pastor M, Trubnykova M, La Serna-Infantes JE, Poterico JA. Factores de riesgo en las enfermedades genéticas. Acta Med Peru. 2018;35(1):43-50. [ Links ]
16. Van der Kamp HJ, Otten BJ, Buitenweg N, De Muinck Keizer-Schrama SM, Oostdijk W, Jansen M, et al. Longitudinal analysis of growth and puberty in 21-hydroxylase deficiency patients. Arch Dis Child. 2002;87(2):139-44. [ Links ]
17. Gasparini N, Di Maio S, Salerno M, Argenziano A, Franzese A, Tenore A. Growth pattern during the first 36 months of life in congenital adrenal hyperplasia (21-hydroxylase deficiency). Horm Res. 1997;47(1):17-22. [ Links ]
18. Balsamo A, Wasniewska M, Di Pasquale G, Salzano G, Baronio F, Bombaci S, et al. Birth length and weight in congenital adrenal hyperplasia according to the different phenotypes. Eur J Pediatr. 2006;165(6):380-3. [ Links ]
19. Nebesio TD, Eugster EA. Growth and Reproductive Outcomes in Congenital Adrenal Hyperplasia. Int J Pediatr Endocrinol [Internet] 2010 [citado 2019 oct 21];2010. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2817857/ [ Links ]
20. Takasawa K, Ono M, Miyai K, Matsubara Y, Takizawa F, Onishi T, et al. Initial high dose hydrocortisone (HDC) treatment for 21-hydroxylase deficiency (21-OHD) does not affect linear growth during the first three years of life. Endocr J. 2012;59(11):1001-6. [ Links ]
21. Dörr HG. Growth in patients with classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Horm Res. 2007;68 Suppl 5:93-9. [ Links ]
22. Grigorescu-Sido A, Bettendorf M, Schulze E, Duncea I, Heinrich U. Growth analysis in patients with 21-hydroxylase deficiency influence of glucocorticoid dosage, age at diagnosis, phenotype and genotype on growth and height outcome. Horm Res. 2003;60(2):84-90. [ Links ]
23. Bonfig W, Schmidt H, Schwarz HP. Growth patterns in the first three years of life in children with classical congenital adrenal hyperplasia diagnosed by newborn screening and treated with low doses of hydrocortisone. Horm Res Paediatr. 2011;75(1):32-7. [ Links ]
24. Balbi V, González V, Santucci Z, Apezteguía M. Crecimiento y dosis de hidrocortisona oral en pacientes con hiperplasia suprarrenal congénita forma perdedora de sal. Arch Argent Pediatr. 2002;100(3):197-203. [ Links ]
25. Stikkelbroeck NMML, Van’t Hof-Grootenboer BAE, Hermus ARMM, Otten BJ, Van’t Hof MA. Growth inhibition by glucocorticoid treatment in salt wasting 21-hydroxylase deficiency: in early infancy and (pre)puberty. J Clin Endocrinol Metab. 2003;88(8):3525-30.
26. Kawano A, Kohno H, Miyako K. A Retrospective Analysis of the Growth Pattern in Patients with Salt-wasting 21-Hydroxylase Deficiency. Clin Pediatr Endocrinol. 2014;23(2):27-34. [ Links ]
27. Migeon CJ, Wisniewski AB. Congenital adrenal hyperplasia owing to 21-hydroxylase deficiency. Growth, development, and therapeutic considerations. Endocrinol Metab Clin North Am. 2001;30(1):193-206. [ Links ]
28. Lin-Su K, Harbison MD, Lekarev O, Vogiatzi MG, New MI. Final Adult Height in Children with Congenital Adrenal Hyperplasia Treated with Growth Hormone. J Clin Endocrinol Metab. 2011;96(6):1710-7. [ Links ]
Correspondencia
Ana Cecilia Gariza Solano
Recibido: 29/05/2019
Arbitrado por pares
Aprobado: 04/09/2019