Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. Peru vol.36 no.3 Lima July/Set. 2019
ARTÍCULO ESPECIAL
Guía de práctica clínica para el diagnóstico y manejo de la osteoartritis en el Seguro Social del Perú (EsSalud)
Clinical practice guidelines for the diagnosis and management of osteoarthritis in Peruvian Social Security (EsSalud)
José E. Chavez1, Jessica H. Zafra-Tanaka2, Kevin Pacheco-Barrios2, José Montes-Alvis2, Alvaro Taype-Rondan2, Víctor M. Gallegos4, Juana Arias3, Jorge M. Cucho3, Daniel Roberto Flores1, Mónica Parra-Otárola5, Luz A. Pecho3, María Lazo-Porras6,7, Raúl Timaná 2
1 Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
2 Instituto de Evaluación de Tecnologías en Salud e Investigación, EsSalud, Lima, Perú
3 Hospital Nacional Guillermo Almenara Irigoyen, EsSalud, Lima, Perú
4 Hospital Nacional Alberto Sabogal Sologuren, EsSalud, Lima, Perú
5 Hospital Ramón Castilla, EsSalud, Lima, Perú
6 CRÓNICAS Centro de Excelencia en Enfermedades Crónicas, Universidad Peruana Cayetano Heredia, Lima, Perú
7 CONEVID Unidad de Conocimiento y Evidencia, Universidad Peruana Cayetano Heredia, Lima, Perú
RESUMEN
Este artículo resume la guía de práctica clínica (GPC) para el diagnóstico y manejo de pacientes con osteoartritis (OA) del Seguro Social del Perú (EsSalud). Para su desarrollo se conformó un grupo elaborador de la guía (GEG) que incluyó a especialistas clínicos y metodólogos. Para responder las 13 preguntas clínicas planteadas se realizaron búsquedas sistemáticas en PubMed y repositorios de GPC. Se usó la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE) para evaluar la certeza de la evidencia. Se emitieron 11 recomendaciones: tres fuertes (no solicitar de forma rutinaria radiografías para el diagnóstico de OA, brindar un plan individualizado de medidas de educación y autocuidado, indicar la realización de ejercicio físico) y ocho débiles (intervenciones para reducir el peso en personas con obesidad o sobrepeso, evitar el uso de paracetamol para el manejo de OA, promover el uso de AINE orales para el manejo de OA, evitar el uso de condroitín sulfato para el manejo de OA, evitar el uso de proloterapia para el manejo de OA, en adultos con OA y dolor refractario a manejo farmacológico considerar terapias adyuvantes como ultrasonido o similares, evitar el uso de terapia laser como adyuvante para el manejo de OA, evitar el uso de acupuntura para el manejo de OA); además, 20 puntos de buena práctica clínica y un flujograma de trabajo.
Palabras clave: osteoartritis, guía de práctica clínica, GRADE, medicina basada en evidencias (fuente: DeCS-BIREME).
ABSTRACT
This paper summarizes the clinical practice guideline (CPG) for the diagnosis and management of patients with osteoarthritis (OA) in the Peruvian Social Security health system (EsSalud). A working group was formed for producing this guideline, and this group included both clinical specialists and methodologists. Systematic searches in PubMed and CPG repositories were performed aiming to answer the 13 clinical questions that were asked. The GRADE (Grading of Recommendations Assessment, Development, and Evaluation) method was used aiming to determine the certainty of evidence. Eleven recommendations were issued: three were strong (do not request X-ray films as routine practice, give an individualized plan including educational and self-care measures, and prescribe physical activity; and eight were weak (weight-reducing interventions for persons with obesity or who are overweight, avoid the use of paracetamol for OA management, promote the use of oral non-steroidal anti-inflammatory drugs for OA management, avoid the use of chondroitin sulfate for OA management, avoid the use of prolotherapy for OA management in affected adults, particularly in those with refractory pain not responding to drug therapy, consider the use of adjuvant therapy, such as ultrasound and the like, avoid the use of laser therapies as adjuvant for OA management, and avoid the use of acupuncture for OA management); also, 20 items for good clinical practice and a workflow sheet were issued.
Keywords: osteoarthritis, clinical practice guideline, GRADE, evidence-based medicine (source: MeSH NLM).
INTRODUCCIÓN
La osteoartritis (OA) es una de las principales causas de dolor y discapacidad en el mundo. Se refiere a un síndrome clínico de dolor articular que suele estar acompañado de diversos grados de limitación funcional; además, reduce la calidad de vida por el dolor articular, función reducida y dificultades para realizar actividades cotidianas [1]. Las articulaciones periféricas más afectadas por la OA son las rodillas, las caderas y las pequeñas articulaciones de las manos.
La OA es una condición común; sin embargo, requiere un manejo interdisciplinario y complejo. Por esta razón, el Seguro Social de Salud del Perú (EsSalud) estableció recomendaciones basadas en evidencia científica para guiar su diagnóstico y manejo terapéutico (Tabla 1).
METODOLOGÍA
El procedimiento seguido para elaborar la presente GPC se detalla en su versión extensa que puede descargarse de la página web del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html).
En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía (GEG)
La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del IETSI conformó un GEG que incluyó a expertos en la metodología de elaboración de GPC y especialistas clínicos.
Formulación de preguntas
En concordancia con los objetivos y alcances de esta GPC, se formuló 13 preguntas clínicas (Tabla 1) que incluyeron una o más preguntas PICO (del inglés: population, intervention, comparator, outcome). El GEG definió los desenlaces –outcomes- críticos e importantes para cada pregunta PICO.
Búsqueda y selección de la evidencia
Se realizó una búsqueda sistemática y selección de la evidencia para cada pregunta PICO. Para ello, durante el 2017, se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos en PubMed o realizadas como parte de una GPC en bases de datos y repositorios de GPC.
Con respecto a las GPC, solo una cumplió con el rigor metodológico para ser incluida: la GPC del National Institute for Health and Clinical Excellence (NICE) 2014 [1]. Posteriormente, por cada pregunta se seleccionó una RS (ya sea una RS publicada como artículo científico o una RS realizada como parte de la GPC de NICE 2014), la cual se actualizó cuando fue considerado necesario. Si no se encontró ninguna RS para cierta pregunta, se realizó una búsqueda de novo de estudios primarios, en primera instancia de ensayos clínicos (Anexo 1 - disponible en la versión electrónica de Acta Med Peru).
Evaluación de la certeza de la evidencia
Para evaluar la certeza de la evidencia se siguió la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) [2] y se construyeron las tablas de perfiles de evidencias GRADE de aquellos desenlaces que no tuvieran dicha información en publicaciones previas (ya sea en alguna RS o GPC), cuando las tablas existentes presentaron inconsistencias o cuando no se correspondían a nuestro contexto (La evaluación de la calidad o riesgo de sesgo de los estudios se muestra en el Anexo N° 2, y las tablas GRADE en el Anexo N° 3. (Anexos 2 y 3 - disponibles en la versión electrónica de Acta Med Peru).
Formulación de las recomendaciones
Se realizó reuniones periódicas en las que se presentó la evidencia encontrada a los expertos clínicos del GEG para que puedan emitir las recomendaciones ya sea mediante consenso o votación por mayoría simple siguiendo lo dispuesto por GRADE [2], metodología que valora los beneficios y daños de las opciones, la certeza de la evidencia, los valores y preferencias de los pacientes y el uso de los recursos. Además, se evaluó la aceptabilidad y factibilidad de las recomendaciones con miras a su implementación.
Cada recomendación fue emitida con una dirección (a favor o en contra) y fuerza (fuerte o condicional) especificas (Tabla 2). De considerarse pertinente, se formularon puntos de buena práctica clínica (BPC) por consenso.
Revisión
La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones, pacientes y tomadores de decisiones. Asimismo, su versión extensa fue enviada por vía electrónica a dos revisores clínicos y un revisor metodológico. El GEG valoró los comentarios realizados por los revisores y de ser pertinente modificó el texto de la GPC o las recomendaciones/BPC.
Aprobación de la GPC
La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 54–IETSI–ESSALUD–2018.
Actualización de la GPC
La presente GPC tiene una validez de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si es pertinente ampliar el periodo de validez, actualizar la GPC, o realizar una nueva versión.
Recomendaciones
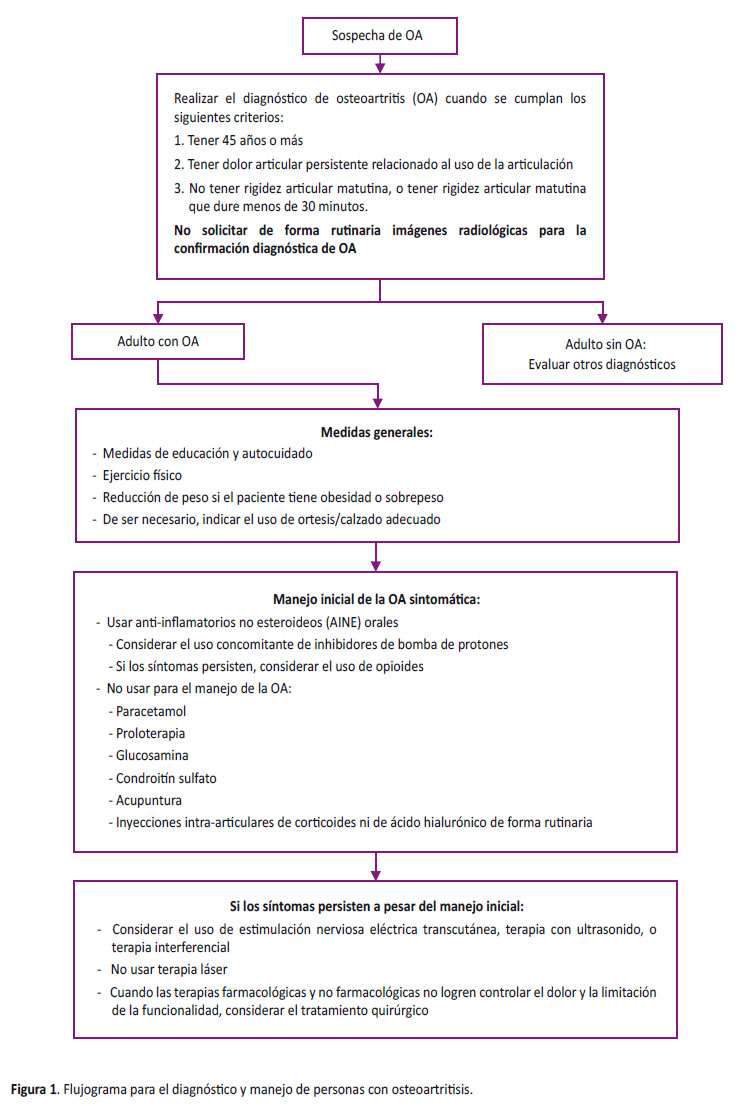
La presente GPC abordó 13 preguntas clínicas, divididas en cinco temas: diagnóstico, medidas generales, manejo farmacológico, manejo no farmacológico, y manejo quirúrgico de OA. Con base a dichas preguntas se formularon 11 recomendaciones (3 recomendaciones fuertes y 8 recomendaciones débiles), 20 puntos de BPC (Tabla 1) y un flujograma (Figura 1).
A continuación, se resume el razonamiento seguido para llegar a cada recomendación y BPC:
Pregunta 1. En adultos con sospecha clínica de OA, ¿está indicada la solicitud de imágenes radiológicas para confirmar OA?
La RS de Shiphof 2008 [3] incluyó 18 estudios observacionales, de los cuales solo 2 (n=2 921) evaluaron la precisión diagnóstica de usar imágenes radiológicas más criterios clínicos, en comparación a solo usar los criterios clínicos, para el diagnóstico de OA. No se halló diferencias en la sensibilidad y especificidad entre ambos grupos. Por ello, se concluyó que no había un beneficio en uso de imágenes radiológicas de forma rutinaria para el diagnóstico de OA, y se emitió una recomendación en contra del uso rutinario de estas pruebas. Debido a que la certeza de la evidencia fue moderada, esta recomendación fue fuerte.
Sobre las BCP, se adoptó la definición estándar de OA propuesta por la GPC NICE 2008 y 2014 [1]. Asimismo, consideró que la toma de imágenes radiológicas debe reservarse para síntomas y/o signos indicadores de otras patologías.
Pregunta 2. En adultos con OA, ¿se debería brindar intervenciones de educación y/o autocuidado sobre su enfermedad?
Una intervención de educación en salud es un conjunto de medidas orientadas a brindar información con el objetivo de facilitar a los pacientes el manejo de su enfermedad. Una intervención de autocuidado es un conjunto de medidas orientadas a empoderar al paciente; que incluye brindar información, capacitación y monitorización de la enfermedad [4].
La RS de Kroon 2014 [5] revisó 14 ECA (n=2 083), los cuales evaluaban la efectividad de los programas de educación y autocuidado en adultos con OA, en comparación con la atención usual; encontraron que el grupo que recibió estas intervenciones presentó menor dolor (diferencia de medias estandarizada [SMD]: -0,19; IC 95%: -0,28 a -0,10). Dicho efecto fue menor a los puntos de corte de diferencia mínima clínicamente importante (DMCI) encontrados para SMD: -0,39 [6] y -0,29 [7], por lo que esta intervención podría no ser clínicamente relevante. Pese a ello, se consideró que brindar estas intervenciones era importante por ser un derecho de los pacientes estar informados y porque no aplicarlas podría producir efectos deletéreos en la salud. En consecuencia, se emitió una recomendación a favor. Debido a que la certeza de la evidencia fue moderada y porque no realizar estas intervenciones atentaría contra los derechos de los pacientes, la recomendación fue fuerte.
Sobre las BPC, se optó por brindar información general sobre la enfermedad y un plan de autocuidado; además de acordar un plan de toma de decisiones compartidas con la persona (y sus familiares o cuidadores cuando sea apropiado) para controlar su OA.
Finalmente, se consideró la realización de seguimientos anuales a todo paciente con OA sintomática. Sin embargo, en ciertos pacientes se requerirían seguimientos más frecuentes (trimestrales) de acuerdo a sus comorbilidades y control de la enfermedad.
Pregunta 3. En adultos con OA, ¿se debería indicar la realización de ejercicio físico?
El ejercicio generaría cambios antiinflamatorios y procondrogénicos que ayudarían a mejorar los síntomas provocados por la OA [8]. La RS de Anwer 2016 [9] evaluó el efecto de los programas de ejercicio en pacientes con artrosis de rodilla; al realizar los metaanálisis encontró que el grupo que participó en el programa de ejercicio tuvo menos dolor (11 ECA, n=1 963, SMD: -0,46; IC 95%: -0,78 a -0,26) y mayor puntaje en las escalas de funcionalidad (9 ECA, n=1 901, SMD: -0,35; IC 95%: -0,55 a -0,15) que el grupo que no participó en estos programas. Con base a esta RS se consideró que el ejercicio físico tendría un beneficio clínicamente relevante en dolor y funcionalidad, por lo que se decidió emitir una recomendación a favor. A pesar de presentar una baja certeza de la evidencia, se consideró emitir una recomendación fuerte por los potenciales beneficios de esta intervención y la escasa posibilidad de que pudiera provocar efectos adversos importantes.
Sobre las BPC, se consideró que el ejercicio físico debía incluir ejercicios aeróbicos y de fortalecimiento muscular local, rutinas que fueron las más usadas en los ECA incluidos en la RS evaluada. Asimismo, se decidió mencionar que los ejercicios pueden realizarse independientemente de la edad, comorbilidad, gravedad del dolor o discapacidad del paciente.
Pregunta 4. En adultos con OA y sobrepeso/obesidad, ¿se debería indicar intervenciones para bajar de peso?
La obesidad es una enfermedad inflamatoria caracterizada por un aumento de citoquinas inflamatorias [10,11], las mismas que podrían modificar la estructura del cartílago articular, incrementar el contenido de proteoglicanos y reducir el espesor del cartílago [12]. Por ello, se propuso la necesidad de indicar la reducción de peso como parte del manejo de pacientes con sobrepeso u obesidad con OA.
La RS de Christensen [13] resumió 4 ECA (n=417), en los cuales se evaluó el efecto de brindar intervenciones para lograr la pérdida de peso en pacientes con OA de rodilla, con un seguimiento de entre 1,5 a 18 meses. Se encontró que el grupo que recibió estas intervenciones presentó menor dolor (SMD: -0,20; IC 95%: -0,39 a -0,00) y mayor funcionalidad (SMD: -0,23; IC 95%: -0,42, -0,04) en comparación con el grupo que no las recibió. Por esto se consideró que la intervención podría tener un beneficio clínicamente relevante en funcionalidad, pero no para reducir el dolor, en pacientes con OA de rodilla. Se decidió emitir una recomendación a favor de brindar intervenciones para lograr la pérdida de peso. Puesto que la certeza de la evidencia fue baja y que los posibles beneficios podrían no ser clínicamente relevantes, se decidió emitir una recomendación débil.
Pregunta 5. En adultos con OA, ¿se debería indicar el uso de ortesis?
Una ortesis es un apoyo o aparato externo aplicado al cuerpo con el fin de modificar los aspectos funcionales o estructurales del sistema neuromusculoesquelético [14]. Habitualmente, es usada como parte del tratamiento con el fin de mejorar en la deambulación y funcionalidad de pacientes con OA.
La RS de NICE 2014 [1] incluyo solo estudios observacionales debido que los ECAS encontrados presentaban limitaciones de diseño y riesgo de sesgo; halló evidencia limitada sobre la efectividad de las plantillas, sin embargo, dado el bajo costo de la intervención, consideró importante ofrecer consejería sobre el calzado adecuado. Así mismo, a pesar de la poca evidencia a favor del uso de dispositivos de asistencia, sugiere su uso en personas con problemas específicos en sus actividades diarias. En relación con las férulas de pulgar, se halló que pueden reducir el dolor y mejorar la funcionalidad de la mano.
En la actualización de la evidencia se halló la RS de Moyer [15], que incluyó 2 ECA (n=213) y estudió el uso de férulas de rodilla. Además, se encontró el ECA de Hinman (n=59) [16] que evaluó el uso de zapatos especiales y el ECA de Mutlu [17] que estudió el uso de vendajes. Al ser presentar estos tres estudios intervenciones muy heterogéneas, no fue posible emitir una recomendación clara a favor o en contra del uso de ortesis. Por ello se planteó puntos de BPC.
Sobre las BPC, se acordó que es necesario que aquellos pacientes que necesiten ortesis sean referidos al Servicio de Medicina Física y Rehabilitación para que los especialistas den indicaciones para su uso. Además, se decidió enfatizar el uso de un adecuado calzado ya que el ECA de Hinman [16] halló eficacia en esta intervención y que, fisiopatológicamente, podría ayudar a reducir el impacto del peso sobre las articulaciones en miembros inferiores. Finalmente, se consideró importante la evaluación individual de cada paciente con OA para determinar la necesidad de usar dispositivos de asistencia en la marcha.
Pregunta 6. En adultos con OA, ¿qué medicamento se debería indicar para el manejo inicial?
Los pacientes con OA sintomática suelen requerir un tratamiento farmacológico para disminuir el dolor o reducir la disfuncionalidad. Existen diversos fármacos con acción analgésica y antiinflamatoria que potencialmente podrían ser utilizados. El paracetamol es un analgésico que actuaría inhibiendo la síntesis de óxido nítrico, aumentando así el umbral de dolor [42]. Por su parte, los antiinflamatorios no esteroideos (AINE) son fármacos que actúan inhibiendo la ciclooxigenasa 1 (COX-1) o la ciclooxigenasa 2 (COX-2). Las COX participan en la síntesis de prostaglandinas, por lo cual su inhibición generaría un efecto analgésico, antiinflamatorio y antipirético. Los AINE pueden ser no selectivos cuando actúan a nivel de COX-1 y COX-2, o selectivos si actúan solo sobre COX-2 [43].
Con respecto al uso de paracetamol, la RS de da Costa 2017 [18] encontró que el paracetamol no tenía efectos clínicamente relevantes en el dolor ni la funcionalidad en comparación con el placebo. Por ello, se decidió emitir una recomendación en contra de su uso. Debido a que la certeza de la evidencia fue muy baja, esta recomendación fue débil.
Con respecto al uso de AINE, la RS de da Costa 2017 [18] encontró un efecto clínicamente relevante en dolor y funcionalidad para el uso diclofenaco a dosis de 150mg/día [18]. Mientras que, ibuprofeno o naproxeno poseerían un efecto clínicamente relevante en dolor y funcionalidad [18].
Con respecto al uso de celecoxib (un COX-2), la RS de da Costa 2017 [18] encontró que habría beneficios clínicamente relevantes para dolor y funcionalidad. Sin embargo, la RS de Bhala 2013 [19] encontró que, en comparación a placebo, el uso de COX-2 tendría un mayor riesgo para desarrollar eventos adversos cardiovasculares, gastrointestinales, y mortalidad por todas las causas.
Al comparar el uso de celecoxib versus AINE, la RS de Puljak 2017 [20] encontró que no existe evidencia de beneficios clínicamente relevantes en dolor y funcionalidad a favor del primero, en tanto que la RS de Bhala 2013 [19] encontró que el uso de COX-2 tendría menor riesgo para desarrollo de eventos adversos gastrointestinales en comparación con ibuprofeno o naproxeno [19].
Ante la evidencia evaluada, se decidió emitir una recomendación a favor del uso de AINE como medicamento para el manejo inicial. Debido a que el diclofenaco oral y el COX-2 no están disponibles en el petitorio y a que el beneficio de estas terapias frente a otros AINE aún no está claro, se decidió no emitir recomendación alguna. Puesto que la certeza de la evidencia fue de muy baja a baja, la recomendación fue débil.
Sobre las BPC, ya que los efectos adversos de los AINE se suelen presentar con su uso crónico, el tratamiento debería ser corto e intermitente. Además, por sus efectos adversos gastrointestinales, se planteó el uso concomitante de inhibidores de bomba de protones. Ante la elección de un medicamento de rescate frente a una pobre mejora sintomatológica con el uso de AINE, se consideró que los opioides podrían ser una alternativa, siempre que se tengan en cuenta sus posibles efectos adversos.
Sobre el uso de AINE tópicos, las RS de Derry 2016 [21] y Makris 2010 [22] no demostraron que tuvieran un mayor efecto frente a los AINE orales; además, refirieron que su perfil de seguridad aún no era claro. Por ello, y porque los AINE tópicos no están incluidos en el petitorio de medicamentos institucional, se decidió no emitir una BPC al respecto.
Pregunta 7. En adultos con OA, ¿se debería indicar el uso de glucosamina y/o condroitín sulfato?
La glucosamina y el condroitín sulfato son parte de la matriz extracelular del tejido cartilaginoso y óseo. Por ello, suele creerse que su ingesta en suplementos nutricionales contribuiría a la reparación tisular. No obstante, el mecanismo de acción que sustentaría ese efecto es aún desconocido [23].
La RS que realizo la GPC NICE 2014 [1] no encontró diferencias entre el grupo que recibió preparaciones de glucosamina/condroitín sulfato y el grupo placebo, en relación al dolor (14 ECA, n=2 218, SMD: -0,28; IC 95%: -0,49 a 0,08) o rigidez (7 ECA, n=1 240, SMD: -0,02; IC 95%: -0,13 a 0,09). Sin embargo, encontró una diferencia estadísticamente significativa, aunque no clínicamente relevante, en funcionalidad medida con el índice de Laquesne (5 ECA, n=951, SMD: -0,47; IC 95%: -0,82 a -0,12).
Debido a que no se halló un beneficio clínicamente importante con el uso de glucosamina/condroitín, se decidió emitir una recomendación en contra. Porque la certeza de la evidencia fue baja, esta recomendación fue débil.
Pregunta 8. En adultos con OA, ¿se debería indicar el uso de inyecciones intraarticulares de corticoides?
El dolor experimentado por los pacientes con OA es producto de del efecto de las citoquinas inflamatorias y la sensibilización de las vías nociceptivas por activación de los nervios aferentes primarios en respuesta a la inflamación y lesión del tejido articular [24,25]. Los corticosteroides tienen efectos antiinflamatorios e inmunosupresores, actúan sobre las células inflamatorias e influyen en la respuesta inmune [26-28]; por lo cual, se postula que las inyecciones intraarticulares de corticoide (IIC) serían útiles para mejorar el dolor y la funcionalidad en adultos con OA.
La RS de Yüni [29] encontró un efecto positivo al usar IIC en dolor y funcionalidad en comparación a control o placebo, en pacientes con OA. Sin embargo, al realizar un subanálisis de los ECA con bajo riesgo de sesgo no se halló un efecto estadísticamente significativo. Por esto, se consideró que no era posible emitir una recomendación a favor o en contra del uso de IIC en pacientes con OA. En su lugar, emitieron BPC.
Sobre las BPC, se consideró que, debido a las discordancias en los efectos hallados en el análisis por subgrupos y que el perfil de seguridad de esta intervención tampoco está claro, no es posible recomendar el uso rutinario de IIC. Sin embargo, el médico especialista podría considerar su uso ante un cuadro de OA complicada con signos inflamatorios articulares refractarios al tratamiento, puesto que en este escenario en particular existe un componente inflamatorio predominante.
Pregunta 9. En adultos con OA, ¿se debería indicar el uso de inyecciones intraarticulares de ácido hialurónico?
La OA ocasiona pérdida de ácido hialurónico por la reducción de su producción y calidad. La inyección intraarticular de ácido hialurónico (IIAH) ayudaría a la restaurar la viscoelasticidad; sin embargo, su permanencia en el espacio intraarticular es relativamente corta (horas o días) por lo que se han generado dudas sobre su mecanismo de acción a largo plazo [30].
La RS de Johansen [31] comparó el uso de IIAH versus control (uso de suero salino) para disminuir dolor y evaluar el perfil de seguridad en pacientes con OA. Esta RS halló un efecto de IIAH en dolor en comparación al control (71 ECA; n=14 393; SMD: -0,39; IC 95%: -0,47 a -0,30). Sin embargo, al realizar un subanálisis de los ocho ECA con bajo riesgo de sesgo no se halló diferencias entre la intervención y el placebo (8 ECA; SMD: -0,00; IC 95%: -0,13 a 0,12). Se consideró que esta evidencia no permitía emitir una recomendación en contra o a favor de esta intervención, por lo cual se optó por emitir BPC.
Sobre las BPC, el GEG consideró que, por la inconsistencia de los resultados en los estudios analizados, no es posible recomendar el uso rutinario de IIAH. Además, se observó que la mayoría de los estudios no reportaban efectos secundarios o no los evaluaban rigurosamente, por lo cual se decidió mencionar que el perfil de seguridad de esta intervención tampoco está claro.
Pregunta 10. En adultos con OA, ¿se debería indicar el uso de proloterapia?
La proloterapia es un procedimiento no quirúrgico que consiste en la inyección intraarticular de ciertas soluciones para estimular la regeneración del tejido dañado por una patología [32]. Al realizar la búsqueda sistemática, se encontró el ECA de Smith 2016 [33] que evaluó el uso de plasma versus placebo; empero, este estudio tuvo una muestra pequeña y alto riesgo de sesgo, por lo que no fue considerado para la toma de decisiones.
Asimismo, se encontró la RS de Hung 2016 [34] que estudió los efectos de proloterapia con dextrosa comparada con placebo y halló efecto estadísticamente significativo, pero no clínicamente relevante respecto al dolor (SMD: 0,36; IC 95%: 0,10 a 0,63). No se halló estudios que evalúen la eficacia de la proloterapia con células madre mesenquimales.
Se consideró que la evidencia hallada no mostraba beneficios en el uso de proloterapia y que los efectos secundarios a las inyecciones intraarticulares, como infecciones intraarticulares o dolor local, podían ser importantes. Por lo tanto, se decidió emitir una recomendación en contra de esta intervención. Debido a que la certeza de la evidencia fue baja la recomendación fue débil.
Pregunta 11. En adultos con OA, ¿se debería indicar el uso de agentes físicos (ultrasonido, láser, TENS, diatermia, o ITF)?
Dentro de las terapias no farmacológicas para el tratamiento de artrosis se incluyen ultrasonido (US), estimulación nerviosa eléctrica transcutánea (TENS), terapia interferencial (ITF), diatermia, y láser. La terapia con US se refiere al uso de ondas de sonido de alta frecuencia que ejercerían un efecto térmico y mecánico sobre el tejido blando, disminuyendo el dolor e inflamación [35]. La estimulación eléctrica (TENS, ITF y diatermia) es un tratamiento no invasivo en el cual se utilizan electrodos colocados en la piel para enviar estímulos eléctricos a los tejidos afectados, los cuales modularían el estímulo nociceptivo mediante la inhibición presináptica de la asta dorsal de la médula espinal [36]. La terapia láser es un tratamiento no invasivo, que tiene como mecanismo de acción propuesto la estimulación y modulación del proceso inflamatorio a nivel de la articulación [37].
Para esta pregunta se tomó como referencia las RS de Chen 2016 [35] para TENS, de Zhang 2016 [36] para US, de Huang 2015 [37] para terapia laser, de Wang 2017 [38] para diatermia y el metaanálisis en red de Zeng 2015 [39] para ITF.
Se encontró que TENS, US e ITF presentaban efectos clínicos aparentemente relevantes en reducción de dolor. Por ello se decidió emitir una recomendación a favor. Debido a que la certeza de la evidencia fue de muy baja a baja, esta recomendación fue débil.
La evidencia respecto a diatermia fue escasa y contradictoria, por lo que se decidió no emitir una recomendación sobre esta terapia.
En relación a terapia laser, la evidencia encontrada mostró que no presentaba efectos beneficiosos en dolor ni funcionalidad, por lo cual se decidió emitir una recomendación en contra de su uso. Debido a que la certeza de la evidencia fue muy baja, esta recomendación fue débil.
Pregunta 12. En adultos con OA, ¿se debería indicar el uso de acupuntura?
En algunos contextos es habitual la prescripción de terapias complementarias como la acupuntura como parte del manejo de pacientes con OA. La acupuntura es una terapia usada en la medicina tradicional china en la que se insertan agujas en distintos puntos del cuerpo teniendo como una de sus utilidades disminuir el dolor [40]. Se hipotetiza que dichas agujas activarían puntos dérmicos que influyen en los centros autonómicos del sistema nervioso, los cuales estimularían la liberación de opioides endógenos que modularían el dolor.
Para esta pregunta se tomó como referencia la RS de Cochrane 2010 [41] (16 ECA) actualizada por la GPC de NICE 2014 [1], la cual encontró diferencias estadísticamente significativas en funcionalidad al comparar acupuntura versus placebo (acupuntura simulada) (SMD: -0.16; IC 95%: -0,30 a -0,02). Debido a que la DMCI para SMD varía entre -0,37 [27] y -0,22 [28], se consideró que esta intervención no tendría un efecto clínicamente importante.
Al considerar la falta de beneficios y a los potenciales riesgos como infecciones dérmicas [42], se optó por emitir una recomendación en contra del uso de acupuntura. Debido a que la certeza de la evidencia fue muy baja, esta recomendación fue débil.
Pregunta 13: En adultos con OA, ¿cuándo se debe indicar el tratamiento quirúrgico?
La cirugía de reemplazo articular o artroplastia es el tratamiento definitivo de la OA y consiste en el retiro del cartílago desgastado de la articulación y el reemplazo por una prótesis de apariencia y función similar al de la articulación normal [43]. Los objetivos del tratamiento quirúrgico son reducir o eliminar el dolor, incrementar la funcionalidad y mejorar la calidad de vida [44].
La RS de NICE 2014 [1] no encontró estudios que hayan contestado directamente esta pregunta. Sin embargo, concluye, con base a la opinión de expertos, que se debe haber ofrecido las principales terapias no quirúrgicas antes de indicar cirugía. Así mismo, aconseja el tratamiento quirúrgico en personas con síntomas que impacten de forma importante su calidad de vida, que no respondan al tratamiento no quirúrgico y en quienes la referencia debe ser oportuna antes de que exista una limitación funcional significativa, establecida y con síntomas severos.
En la actualización de la evidencia se halló 2 RS de estudios observacionales que no realizaron metaanálisis. La RS de Montin 2008 [45] (13 estudios) reportó que el momento o la edad en que se realiza la cirugía no tendría efecto sobre la funcionalidad, dolor o calidad de vida de los pacientes y que el subgrupo de pacientes con menor funcionalidad preoperatoria podría presentar un mayor beneficio. La RS de Lungu 2016 [46] (33 estudios) reportó que la edad al momento de la cirugía no tuvo efecto sobre el dolor postoperatorio y los resultados en funcionalidad y evaluación global fueron inconsistentes entre los estudios. Debido que la evidencia hallada era muy heterogénea, no fue posible emitir una recomendación a favor o en contra del tratamiento quirúrgico. Por ello se planteó BPC.
Sobre las BPC, se acordó considerar el tratamiento quirúrgico cuando las terapias farmacológicas y no farmacológicas no logren controlar ni el dolor ni la limitación de la funcionalidad. Además, se planteó que para la indicación de tratamiento quirúrgico es necesaria una opinión previa del médico reumatólogo y/o del médico de medicina física y rehabilitación. Se sugiere evitar tiempos de espera prolongados para la cirugía. Se deben evaluar y controlar en lo posible factores asociados a peores resultados postquirúrgicos como: ausencia de soporte social, ansiedad, depresión, dolor lumbar, sobrepeso/obesidad, y comorbilidades como osteoporosis. Finalmente, en candidatos a cirugía, brindar información sobre los beneficios y riesgos de la cirugía, las posibles consecuencias de realizarse o no la cirugía y del proceso de recuperación y rehabilitación después de la cirugía.
Contribuciones de autoría: Todos los autores participaron en la realización de la guía. JHZT, KPB, JMA, y MLP se encargaron de las búsquedas sistemáticas y la evaluación de certeza de los estudios para cada pregunta. Todos los autores participaron en la discusión de los estudios encontrados y la formulación de las recomendaciones y puntos de buenas prácticas clínicas.
Fuente de financiamiento: La elaboración de Guía de Práctica Clínica fue financiada por el Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social de Salud (EsSalud).
Conflicto de intereses: Los responsables de la elaboración del presente documento declaran no tener ningún conflicto de interés financiero y no financiero, con relación a los temas descritos en el presente documento.
Citar como: Chavez JE, Zafra-Tanaka JH, Pacheco-Barrios K, Montes-Alvis J, Taype-Rondan A, Gallegos VM, et al. Guía de práctica clínica para el diagnóstico y manejo de la osteoartritis en el Seguro Social del Perú (EsSalud). Acta Med Peru. 2019;36(3):235-46
REFERENCIAS BIBLIOGRÁFICAS
1. National Guideline Centre (UK). Osteoarthritis: care and management in adults. London: National Institute for Health and Care Excellence (UK); 2014. [ Links ]
2. Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. J Clin Epidemiol. 2013;66(7):719-25. [ Links ]
3. Schiphof D, de Klerk BM, Koes BW, Bierma-Zeinstra S. Good reliability, questionable validity of 25 different classification criteria of knee osteoarthritis: a systematic appraisal. J Clin Epidemiol. 2008;61(12):1205-15. [ Links ]
4. Lorig KR, Holman HR. Self-management education: history, definition, outcomes, and mechanisms. Ann Behav Med. 2003;26(1):1-7. [ Links ]
5. Kroon FPB, van der Burg LRA, Buchbinder R, Osborne RH, Johnston RV, Pitt V. Self‐management education programmes for osteoarthritis. Cochrane Database Syst Rev. 2014;(1):CD008963. [ Links ]
6. Angst F, Aeschlimann A, Michel BA, Stucki G. Minimal clinically important rehabilitation effects in patients with osteoarthritis of the lower extremities. J Rheumatol. 2002;29(1):131-8. [ Links ]
7. Angst F, Aeschlimann A, Stucki G. Smallest detectable and minimal clinically important differences of rehabilitation intervention with their implications for required sample sizes using WOMAC and SF‐36 quality of life measurement instruments in patients with osteoarthritis of the lower extremities. Arthritis Rheum. 2001;45(4):384-91. [ Links ]
8. Krishnasamy P, Hall M, Robbins SR. The role of skeletal muscle in the pathophysiology and management of knee osteoarthritis. Rheumatology (Oxford). 2018;57(suppl 4):iv22-iv33. [ Links ]
9. Anwer S, Alghadir A, Brismée J-M. Effect of home exercise program in patients with knee osteoarthritis: a systematic review and meta-analysis. J Geriatr Phys Ther. 2016;39(1):38-48. [ Links ]
10. Cancello R, Clement K. Is obesity an inflammatory illness? Role of low‐grade inflammation and macrophage infiltration in human white adipose tissue. BJOG. 2006;113(10):1141-7. [ Links ]
11. Lago F, Dieguez C, Gómez-Reino J, Gualillo O. Adipokines as emerging mediators of immune response and inflammation. Nat Clin Pract Rheumatol. 2007;3(12):716-24. [ Links ]
12. Richette P, Poitou C, Garnero P, Vicaut E, Bouillot J-L, Lacorte J-M, et al. Benefits of massive weight loss on symptoms, systemic inflammation and cartilage turnover in obese patients with knee osteoarthritis. Ann Rheum Dis. 2011;70(1):139-44. [ Links ]
13. Christensen R, Bartels EM, Astrup A, Bliddal H. Effect of weight reduction in obese patients diagnosed with knee osteoarthritis: a systematic review and meta-analysis. Ann Rheum Dis. 2007;66(4):433-9. [ Links ]
14. Jarl G, Ramstrand N. A model to facilitate implementation of the International Classification of Functioning, Disability and Health into prosthetics and orthotics. Prosthet Orthot Int. 2018;42(5):468-75. [ Links ]
15. Moyer RF, Birmingham TB, Bryant DM, Giffin JR, Marriott KA, Leitch KM. Valgus bracing for knee osteoarthritis: a meta-analysis of randomized trials. Arthritis Care Res (Hoboken). 2015;67(4):493-501. [ Links ]
16. Hinman RS, Wrigley TV, Metcalf BR, Campbell PK, Paterson KL, Hunter DJ, et al. Unloading shoes for self-management of knee osteoarthritisa randomized trialunloading shoes for self-management of knee osteoarthritis. Ann Intern Med. 2016;165(6):381-9. [ Links ]
17. Mutlu EK, Mustafaoglu R, Birinci T, Ozdincler AR. Does kinesio taping of the knee improve pain and functionality in patients with knee osteoarthritis?: a randomized controlled clinical trial Am J Phys Med Rehabil. 2017;96(1):25-33. [ Links ]
18. Da Costa BR, Reichenbach S, Keller N, Nartey L, Wandel S, Jüni P, et al. Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. Lancet. 2017;390(10090):e21-e33. [ Links ]
19. Bhala N, Emberson J, Merhi A, Abramson S, Arber N, Baron J, et al. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 2013;382(9894):769-79. [ Links ]
20. Puljak L, Marin A, Vrdoljak D, Markotic F, Utrobicic A, Tugwell P. Celecoxib for osteoarthritis. Cochrane Database Syst Rev. 2017;2017(5):CD009865. [ Links ]
21. Derry S, Conaghan P, Da Silva JA, Wiffen PJ, Moore RA. Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst Rev. 2016;4:CD007400. [ Links ]
22. Makris UE, Kohler MJ, Fraenkel L. Adverse effects (AEs) of topical NSAIDs in older adults with osteoarthritis (OA): a systematic review of the literature. J Rheumatol. 2010;37(6):1236-43. [ Links ]
23. Martel-Pelletier J, Tat SK, Pelletier J-P. Effects of chondroitin sulfate in the pathophysiology of the osteoarthritic joint: a narrative review. Osteoarthritis Cartilage. 2010;18 Suppl 1:S7-11. [ Links ]
24. Kidd B. Mechanisms of pain in osteoarthritis. HSS J. 2012;8(1):26-8. [ Links ]
25. Hunter DJ, Guermazi A, Roemer F, Zhang Y, Neogi T. Structural correlates of pain in joints with osteoarthritis. Osteoarthritis Cartilage. 2013;21(9):1170-8. [ Links ]
26. Creamer P. Intra-articular corticosteroid injections in osteoarthritis: do they work and if so, how? Ann Rheum Dis. 1997;56(11):634-5. [ Links ]
27. Schäcke H, Schottelius A, Döcke W-D, Strehlke P, Jaroch S, Schmees N, et al. Dissociation of transactivation from transrepression by a selective glucocorticoid receptor agonist leads to separation of therapeutic effects from side effects. Proc Natl Acad Sci U S A. 2004;101(1):227-32. [ Links ]
28. Johnston PC, Lansang MC, Chatterjee S, Kennedy L. Intra-articular glucocorticoid injections and their effect on hypothalamic–pituitary–adrenal (HPA)-axis function. Endocrine. 2015;48(2):410-6. [ Links ]
29. Juni P, Hari R, Rutjes AW, Fischer R, Silletta MG, Reichenbach S, et al. Intra-articular corticosteroid for knee osteoarthritis. Cochrane Database Syst Rev. 2015;(10):CD005328. [ Links ]
30. Hunter DJ. Viscosupplementation for osteoarthritis of the knee. N Engl J Med. 2015;372(11):1040-7. [ Links ]
31. Johansen M, Bahrt H, Altman RD, Bartels EM, Juhl CB, Bliddal H, et al. Exploring reasons for the observed inconsistent trial reports on intra-articular injections with hyaluronic acid in the treatment of osteoarthritis: Meta-regression analyses of randomized trials. Semin Arthritis Rheum. 2016;46(1):34-48. [ Links ]
32. Distel LM, Best TM. Prolotherapy: a clinical review of its role in treating chronic musculoskeletal pain. PM R. 2011;3(6 Suppl 1):S78-81. [ Links ]
33. Smith PA. Intra-articular autologous conditioned plasma injections provide safe and efficacious treatment for knee osteoarthritis: an FDA-sanctioned, randomized, double-blind, placebo-controlled clinical trial. Am J Sports Med. 2016;44(4):884-91. [ Links ]
34. Hung C-Y, Hsiao M-Y, Chang K-V, Han D-S, Wang T-G. Comparative effectiveness of dextrose prolotherapy versus control injections and exercise in the management of osteoarthritis pain: a systematic review and meta-analysis. J Pain Res. 2016;9:847-57. [ Links ]
35. Chen L-X, Zhou Z-R, Li Y-L, Ning G-Z, Li Y, Wang X-B, et al. Transcutaneous electrical nerve stimulation in patients with knee osteoarthritis: evidence from randomized-controlled trials. Clin J Pain. 2016;32(2):146-54. [ Links ]
36. Zhang C, Xie Y, Luo X, Ji Q, Lu C, He C, et al. Effects of therapeutic ultrasound on pain, physical functions and safety outcomes in patients with knee osteoarthritis: a systematic review and meta-analysis. Clin Rehabil. 2016;30(10):960-71. [ Links ]
37. Huang Z, Chen J, Ma J, Shen B, Pei F, Kraus VB. Effectiveness of low-level laser therapy in patients with knee osteoarthritis: a systematic review and meta-analysis. Osteoarthritis Cartilage. 2015;23(9):1437-44. [ Links ]
38. Wang H, Zhang C, Gao C, Zhu S, Yang L, Wei Q, et al. Effects of short-wave therapy in patients with knee osteoarthritis: a systematic review and meta-analysis. Clin Rehabil. 2017;31(5):660-71. [ Links ]
39. Zeng C, Li H, Yang T, Deng ZH, Yang Y, Zhang Y, et al. Electrical stimulation for pain relief in knee osteoarthritis: systematic review and network meta-analysis. Osteoarthritis Cartilage. 2015;23(2):189-202. [ Links ]
40. Zhang R, Lao L, Ren K, Berman BM. Mechanisms of acupuncture–electroacupuncture on persistent pain. Anesthesiology. 2014;120(2):482-503. [ Links ]
41. Manheimer E, Cheng K, Linde K, Lao L, Yoo J, Wieland S, et al. Acupuncture for peripheral joint osteoarthritis. Cochrane Database Syst Rev. 2010;(1):CD001977. [ Links ]
42. Xu S, Wang L, Cooper E, Zhang M, Manheimer E, Berman B, et al. Adverse Events of Acupuncture: A Systematic Review of Case Reports. Evid Based Complement Alternat Med. 2013;2013:581203. [ Links ]
43. Lavery LA, Higgins KR, Lanctot DR, Constantinides GP, Zamorano RG, Armstrong DG, et al. Home monitoring of foot skin temperatures to prevent ulceration. Diabetes Care. 2004;27(11):2642-7. [ Links ]
44. Mandl LA, Martin GM. Overview of surgical therapy of knee and hip osteoarthritis. UpToDate, Waltham, MA Accessed. 2018;4:16. [ Links ]
45. Montin L, Leino-Kilpi H, Suominen T, Lepisto J. A systematic review of empirical studies between 1966 and 2005 of patient outcomes of total hip arthroplasty and related factors. J Clin Nurs. 2008;17(1):40-5. [ Links ]
46. Lungu E, Vendittoli PA, Desmeules F. Preoperative determinants of patient-reported pain and physical function levels following total knee arthroplasty: a systematic review. Open Orthop J. 2016;10:213-31. [ Links ]
Correspondencia
Alvaro Taype-Rondan
Recibido: 08/03/2019
Arbitrado por pares
Aprobado: 19/06/2019