Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Peruana
On-line version ISSN 1728-5917
Acta méd. Peru vol.36 no.4 Lima Oct./Dec 2019
ARTÍCULO ORIGINAL
Parálisis residual posoperatoria tras anestesia general sin monitorización neuromuscular objetiva: un estudio observacional en el Hospital Regional Docente de Cajamarca, Perú
Postoperative residual paralysis after general anesthesia without objective neuromuscular monitoring: An observational study at the Regional Cajamarca Hospital, Perú
Rolando Silas Vela-Vásquez1,a, María Maribel Hurtado-Tello1,a
1 Departamento de Anestesiología, Hospital Regional Docente de Cajamarca. Cajamarca, Perú.
a Médico anestesiólogo.
RESUMEN
Objetivo: Determinar la incidencia y severidad de la parálisis residual en pacientes sin monitorización neuromuscular intraoperatoria. Materiales y métodos: Se realizó un estudio prospectivo y observacional en 236 pacientes adultos ASA I-III intervenidos bajo anestesia general sin monitorización neuromuscular intraoperatoria. A su llegada a la Unidad de Cuidados Post-Anestesia (UCPA) se realizó la monitorización neuromuscular mediante aceleromiografía del músculo aductor del pulgar. La incidencia de parálisis residual con TOF ratio (TOFr) < 0,9 y TOFr < 0,7 fueron valorados. Resultados: La incidencia de parálisis residual en la UCPA con TOFr < 0,9 fue de 81,36% (IC 95%: 76,39-86,33) y con TOFr < 0,7 fue de 33,9% (IC 95%: 27,86-39,94). La neostigmina fue utilizada para revertir el bloqueo neuromuscular solamente en el 48,3% de los casos. La incidencia de parálisis residual con TOFr < 0,7 fue significativamente mayor entre los que no recibieron antagonistas del bloqueo neuromuscular y los que sí lo recibieron (42,62% vs. 24,56%, p=0.003). Conclusiones: La incidencia y severidad de la parálisis residual posoperatoria en pacientes sin monitorización neuromuscular fue elevada en nuestra institución, probablemente favorecida por una dosificación no guiada de los relajantes musculares, la escasa utilidad de los criterios subjetivos para valorar la recuperación de la función neuromuscular y la falta de reversión rutinaria del bloqueo neuromuscular.
Palabras clave: Monitoreo neuromuscular; Bloqueo neuromuscular; Retraso en la recuperación anestésica; Anestesiología; Perú (fuente: DeCS-BIREME).
ABSTRACT
Objective: To determine both the incidence and severity of residual paralysis in patients not undergoing intraoperative neuromuscular monitoring. Material and Methods: A prospective observational study was performed in 236 ASA I-III adult subjects who underwent surgery under general anesthesia without intraoperative neuromuscular monitoring. When patients were brought to the Post-Anesthesia Care Unit (PACU), neuromuscular monitoring was performed using acceleromiography of the adductor muscle of the thumb. The incidence of residual paralysis with TOF ratio (TOFr) values <0.9 and <0.7 was assessed. Results: The incidence of residual paralysis in the PACU with TOFr <0.9 was 81.36% (95% CI: 76.39%–86.33%) and with TOFr <0.7 was 33.9% (95% CI: 27.86%–39.94%). Neostigmine was used to revert neuromuscular blockade only in 48.3% of all cases. The incidence of residual paralysis with TOFr<0.7 was significantly higher in those subjects who did not receive neuromuscular blockade antagonists compared with those who did (42.62% vs. 24.56%, p= 0.03). Conclusions: Both the incidence and severity of residual postoperative paralysis in patients without neuromuscular monitoring was notoriously high in our institution, likely favored by a non-guided dosing of muscle relaxant agents, as well as due to low usefulness of subjective criteria for assessing recovery of neuromuscular function and the lack of routine reversion of neuromuscular blockade.
Keywords: Neuromuscular monitoring; Neuromuscular blockade; Residual neuromuscular blockades; Anesthesiology; Peru (source: MeSH NLM).
INTRODUCCIÓN
La recuperación incompleta de la función neuromuscular tras el uso de relajantes musculares no despolarizantes, conocida también como parálisis residual, continúa siendo un problema frecuente en el posoperatorio temprano [1,2]. Numerosos estudios clínicos evidenciaron que la parálisis residual posoperatoria, documentada mediante la monitorización objetiva de la función neuromuscular, está asociada con una amplia variedad de eventos clínicos adversos [1-4]. Mediante una técnica de monitorización neuromuscular objetiva conocida como «tren de cuatro» o «train of four» (TOF), la parálisis residual posoperatoria está actualmente definida como una relación T4/T1 o «TOF ratio» (TOFr) < 0,9 [1-5].
A pesar del uso de relajantes musculares de acción intermedia, la utilización de fármacos antagonistas y la disponibilidad de monitorización neuromuscular, la incidencia de parálisis residual en las Unidades de Cuidados Post-Anestesia (UCPA) es muy variable y ha sido descrita entre 3,5% y 64% en diversas instituciones de países desarrollados [6-8], reportándose hasta en 56,5% en un extenso estudio canadiense multicéntrico realizado en 2015 [7]. En Latinoamérica, se han publicado reportes de diversas instituciones sanitarias con frecuencias de parálisis residual que oscilan entre 25,3% y 51,2% [9-15]. En nuestro país, existen pocos datos al respecto, una publicación describe una incidencia del 37,5% en un hospital público [14] y una tesis universitaria reporta una incidencia 51,6% en un hospital de la Seguridad Social [15], ambos en la ciudad de Lima.
La parálisis residual posoperatoria es un factor de riesgo bien establecido para el desarrollo de complicaciones pulmonares en el posoperatorio temprano [1-4]. La disfunción de la musculatura respiratoria y de la vía aérea superior predispone a obstrucción de la vía aérea, atelectasias, aspiración pulmonar y neumonía, al mismo tiempo que produce un deterioro de la respuesta ventilatoria a la hipoxia [2,3,16-18]. En el paciente despierto, además, provoca síntomas desagradables de debilidad muscular (disturbios visuales, debilidad facial, dificultad para hablar y deglutir y sensación de fatiga generalizada) [19, 20]. De manera consistente, numerosos estudios han establecido una relación entre la parálisis residual y un incremento en la morbimortalidad posoperatoria, eventos respiratorios críticos y un incremento de la estancia en la UCPA [1-4,16-22].
La monitorización objetiva y cuantitativa de la función neuromuscular permite no solo mantener condiciones adecuadas de relajación muscular en el intraoperatorio, sino también identificar oportunamente la parálisis residual y reducir su incidencia mediante el uso apropiado de fármacos antagonistas [1-3,16-19]. El uso de criterios clínicos o subjetivos para valorar la recuperación de la función neuromuscular se ha mostrado insuficiente para identificar adecuadamente la parálisis residual posoperatoria [1-3,22-24]. Sin embargo, en países en vías de desarrollo e incluso en algunas instituciones de países desarrollados, la disponibilidad de dispositivos de monitorización neuromuscular es todavía limitada [23,25]. En la actualidad, no hay datos publicados sobre la frecuencia de parálisis residual en hospitales del interior del Perú, muchos de los cuales no tienen los recursos logísticos necesarios que les permita contar con dispositivos suficientes para una monitorización intraoperatoria rutinaria de la función neuromuscular.
El presente estudio tuvo como objetivo principal determinar la incidencia y severidad de la parálisis residual posoperatoria en la UCPA del Departamento de Anestesiología del Hospital Regional Docente de Cajamarca, en pacientes en los que no se realizó una monitorización objetiva de la función neuromuscular en el transoperatorio y de manera secundaria el estudio buscó conocer algunas características acerca del uso, la dosificación y la reversión de los relajantes musculares.
MATERIALES Y MÉTODOS
Diseño, población de estudio y muestra
Se realizó un estudio prospectivo observacional en el Hospital Regional de Cajamarca. Este es un hospital provincial ubicado en la sierra norte del Perú (Cajamarca, Perú, 2750 m de altitud), con marcadas limitaciones para una monitorización rutinaria de la función neuromuscular, puesto que al momento del estudio sólo una de las cinco salas quirúrgicas contaba con un monitor TOF.
Para el cálculo del tamaño de la muestra se tomaron en cuenta los datos de pacientes adultos sometidos a anestesia general con intubación endotraqueal durante el periodo comprendido entre 2016 y 2017, estimando una población de estudio de 600 pacientes para el año 2018. Teniendo como base los resultados del RECITE Study [3], que describe una incidencia del 56,5% en un país desarrollado sin limitaciones para una monitorización rutinaria de la función neuromuscular, la frecuencia esperada en nuestra institución fue considerada en al menos el 60%, con un nivel de confianza del 95% y un margen de error del 5%, el tamaño de la muestra fue calculado en 229 pacientes.
Criterios de selección
Pacientes mayores de 18 años, ASA I-III, sometidos a cirugía urgente o electiva bajo anestesia general con uso de relajantes musculares no despolarizantes fueron incluidos. Asimismo, los participantes fueron excluidos del estudio si se utilizó algún tipo de dispositivo para la monitorización intraoperatoria de la función neuromuscular. Otros criterios fueron: antecedentes de enfermedad neuromuscular, secuela de enfermedad cerebrovascular y necesidad de ventilación mecánica en el posoperatorio.
Procedimientos y variables de interés
El protocolo anestésico a utilizar, el uso y la dosificación del relajante muscular, la posibilidad de monitorización de la función neuromuscular, así como el uso y dosificación de fármacos antagonistas se dejaron a criterio del anestesiólogo tratante, el cual fue ciego a la inclusión del paciente para el estudio.
Por cada paciente que llegaba a la UCPA, un anestesiólogo miembro del equipo investigador verificaba el cumplimiento de los criterios de selección. La monitorización de la función neuromuscular se realizó en un tiempo no mayor a cinco minutos desde su llegada a la UCPA. La determinación de la función neuromuscular se realizó con un monitor TOF marca General Electric, el cual pertenece a la institución y es regularmente calibrada por el proveedor.
La monitorización neuromuscular objetiva de los pacientes seleccionados se realizó mediante la técnica de monitorización conocida como TOF, utilizando el principio de aceleromiografía sobre el músculo adductor pollicis (aductor del pulgar), para lo cual se colocaron dos electrodos de superficie separados por 3-4 cm, sobre el territorio del nervio cubital en el tercio distal del antebrazo. Se utilizó un estímulo TOF de intensidad submáxima, consistente en cuatro estímulos sucesivos de 0,2 milisegundos de duración, con una frecuencia de 2 Hertz y una intensidad de 40 miliamperios. En cada paciente, se realizaron dos estímulos TOF con un intervalo de 20 segundos entre ellos. En caso de inconsistencias en las medidas (una diferencia mayor o igual de 0,1), se realizó un tercer estímulo 20 segundos después. El número de respuestas (T1, T2, T3, T4) y el «TOF ratio» (relación T4/T1) fueron recogidos en una ficha estandarizada. En concordancia a las recomendaciones actuales, la parálisis residual fue definida por una TOFr menor de 0,9. Una segunda categoría con una TOFr menor de 0,7 también fue valorada. En los casos con un TOFr menor de 0,7 se recomendó administrar algún antagonista del bloqueo neuromuscular, a criterio del anestesiólogo responsable de la UCPA.
En los casos en los que se utilizó neostigmina como antagonista del bloqueo neuromuscular al final de la intervención, se registraron las dosis utilizadas en relación al peso del paciente. Consistente con la literatura, una dosis subóptima fue considerada cuando se administró menos de 0,04 mg/Kg [1, 22, 26]. A su arribo a la UCPA, se registró la presión arterial no invasiva, la frecuencia cardiaca, la pulsioximetría y el uso de oxigeno suplementario.
Se recolectó información sobre la edad del paciente (años), sexo (masculino/femenino), valoración de la American Society of Anesthesiologists (ASA), tipo de cirugía (electiva/urgente), especialidad quirúrgica (según especialidad de origen), así como el tipo y dosis del relajante muscular empleado.
Análisis de datos
Las variables cuantitativas fueron reportadas mediante medias y su desviación estándar. Las variables cualitativas mediante frecuencias y porcentajes. La comparación estadística, se realizó usando las pruebas de chi-cuadrado para las variables categóricas y las pruebas t para las variables continuas. El software SSPS se utilizó para los cálculos estadísticos. Un valor de p < 0,05 fue considerado como significativo.
Aspectos éticos
El protocolo del estudio fue aprobado por el Comité de Ética institucional. El consentimiento informado fue firmado por todos los participantes antes de su ingreso al estudio, que fue desarrollado en un periodo de ocho meses, entre mayo a diciembre del 2018.
RESULTADOS
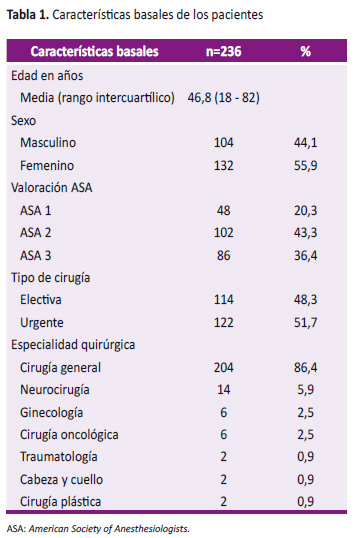
Entre mayo y diciembre del 2018, 242 pacientes fueron seleccionados para el estudio, seis casos fueron excluidos por presentar datos incompletos, quedando 236 casos para el análisis. De ellos, el promedio de edad fue de 46,8 años (rango: 18-82 años) y la mayoría de pacientes fueron de sexo femenino (55,9%), ASA 2 (43,3%), intervenidos de cirugía urgente (51,7%) y de la especialidad de cirugía general (86,4%). El vecuronio fue el relajante muscular no despolarizante más frecuentemente utilizado para la intubación y/o el mantenimiento anestésico (99,2%). El rocuronio fue utilizado en sólo cuatro pacientes. En un 38% de casos se utilizó succinilcolina para la intubación (Tabla 1).
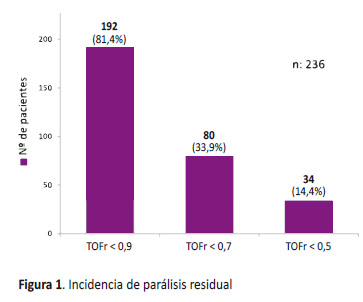
En la UCPA, el TOFr promedio fue de 0,72 (rango: 0,035-1,0), con una incidencia de parálisis residual (TOFr < 0,9) de 81,4% (IC 95%: 76,39-86,33) y TOFr < 0,7 de 33,9% (IC 95%: 27,86 a 39,94) (Figura 1).
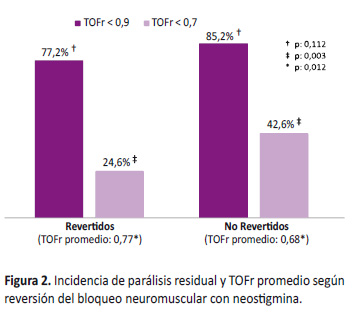
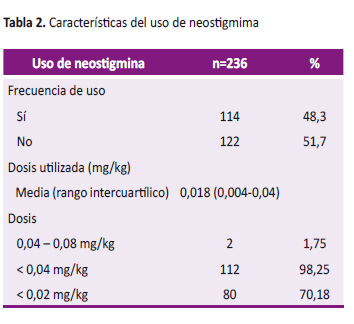
La neostigmina fue el único fármaco disponible en la institución para ser utilizado como antagonista del bloqueo neuromuscular y fue utilizada solamente en el 48,3% de los casos, lo que significa que más de la mitad de los pacientes no recibieron un antagonista del bloqueo neuromuscular al final de la cirugía. La incidencia de parálisis residual fue mayor entre los que no recibieron fármacos antagonistas para revertir el bloqueo neuromuscular en comparación a los que sí lo recibieron, sin diferencias estadísticamente significativas entre ambos (85,2% vs. 77,2%; p=0,112). En cambio, la incidencia de parálisis residual con TOFr < 0,7 fue significativamente mayor entre los que no recibieron fármacos antagonistas para revertir el bloqueo neuromuscular y los que sí lo recibieron (42,6% vs. 24,6%; p=0,003). El TOFr promedio también fue significativamente mayor en el grupo de los que recibieron neostigmina para revertir el bloqueo en comparación con los que no lo recibieron (0,77 vs. 0,68; p=0,012) (Figura 2).
En los casos en los que se utilizó neostigmina, la dosis promedio fue de 0,018 mg/kg (rango: 0,004-0,04 mg/kg). Una dosis subóptima (< 0,04 mg/kg) fue administrada en el 98,2% de casos. Una dosis menor o igual a 0,02 mg/kg fue administrada en el 70,1% de casos (Tabla 2).
Todos los pacientes ingresaron a la URPA con oxígeno suplementario con una SpO2 promedio de 95,9% (rango: 84%-100%). Sólo 10 pacientes (4,2%) presentaron una SpO2 < 90% a su llegada a la URPA.
DISCUSIÓN
A pesar de las recomendaciones actuales acerca del adecuado manejo de la relajación muscular y la disponibilidad cada vez mayor de dispositivos de monitorización neuromuscular, la parálisis residual continúa siendo un problema bastante común en el posoperatorio inmediato, incluso en instituciones sanitarias de los países desarrollados [1-4,6-8]. En nuestro estudio, realizado exclusivamente en pacientes sin monitorización neuromuscular objetiva una situación bastante común en nuestro medio, la incidencia de parálisis residual (TOFr < 0,9) fue notoriamente elevada, alcanzando el 81,35% de los casos en la UCPA. Esta elevada incidencia es notablemente superior a los reportes previos tanto de instituciones de países latinoamericanos como de países desarrollados [6-15], incluyendo los reportes nacionales que la describen entre 37,5% y 51,56% en hospitales de la capital [14, 15]. La tercera parte de nuestros pacientes presentó una parálisis residual con TOFr < 0,7, lo que actualmente se considera un grado inaceptable de bloqueo posoperatorio en el paciente despierto, llegando incluso a objetivar algunos casos con TOFr < 0,5, un grado de bloqueo asociado con un severo deterioro de la función respiratoria y de la musculatura faríngea [27].
Al respecto, consideramos pertinente señalar algunas características del estudio que podrían servir de marco referencial para explicar los resultados. En primer lugar, a diferencia de los estudios señalados previamente [6-15], nuestro estudio se realizó exclusivamente en pacientes sin monitorización intraoperatoria de la función neuromuscular, lo que significa que en todos ellos se utilizó la valoración subjetiva del anestesiólogo como criterio para excluir la presencia de parálisis residual posoperatoria antes de la extubación y su traslado a la UCPA. Sin embargo, está demostrado que los criterios clínicos o subjetivos son inadecuados para valorar la recuperación de la función neuromuscular [22-24]. Tanto la medida de parámetros respiratorios (volumen tidal, ventilación minuto, presión inspiratoria negativa, etc.) así como las pruebas realizadas a la cabecera del paciente (elevación de la cabeza, apretón de manos, elevación de la pierna, etc.) no son confiables y se han mostrado inespecíficos cuando han sido correlacionados con mediciones del TOFr [22]. La elevación sostenida de la cabeza por cinco segundos es uno de los criterios clínicos más utilizados, y se ha visto en algunos pacientes con TOFr entre 0,25 a 0,4 [28].
De hecho, ninguno de los test clínicos tiene una sensibilidad mayor de 0,35 o un valor predictivo positivo mayor de 0,52 para excluir parálisis residual [1]. La monitorización objetiva de la función neuromuscular cuando se utilicen relajantes musculares debería ser adoptada como un estándar básico en anestesia, tal y como ha sido implementado por diversas sociedades científicas nacionales en países europeos [1]. Lamentablemente, en nuestro país, la normativa vigente del Ministerio de Salud del año 2011 (Norma Técnica 089-MINSA/DGSP-V.01), todavía considera la monitorización neuromuscular un recurso opcional «cuando las condiciones del paciente o el tipo de cirugía lo requieran» [29].
En segundo lugar, la mayoría de los pacientes en nuestro estudio no recibieron un fármaco antagonista para revertir el bloqueo neuromuscular residual al final de la cirugía. Al respecto, tanto la ausencia de monitorización como la falta de una reversión rutinaria del bloqueo neuromuscular son factores determinantes independientes de un mayor riesgo de presentar parálisis residual posoperatoria [30]. Una elevada frecuencia de parálisis residual posoperatoria ha sido observada cuando el bloqueo no ha sido revertido farmacológicamente comparado con aquellos casos en los que se utilizó antagonistas del bloqueo neuromuscular [25-27]. Las razones para la práctica extendida de no antagonizar rutinariamente el bloqueo neuromuscular no están claras, pero tal como lo señalan algunos autores, es probable que la mayoría de anestesiólogos consideran que se ha producido una completa recuperación de la función neuromuscular cuando han transcurrido de 1 a 4 horas desde la última dosis del relajante muscular, aunque los datos disponibles no soportan estas creencias [31-33]. Otra probable causa podría ser un exceso de confianza en nuestra capacidad clínica o "experiencia" para valorar la recuperación de la función neuromuscular. Un estudio reciente muestra un exceso de seguridad de los anestesiólogos acerca de su conocimiento y capacidad para el manejo de la relajación muscular y su monitorización [34].
Aunque una mayor incidencia de parálisis residual ha sido observada cuando se omite el uso de agentes antagonistas para revertir el bloqueo neuromuscular, la administración de estos fármacos no elimina la posibilidad de presentar parálisis residual en la UCPA [17, 22]. En nuestro estudio, a pesar de una mayor incidencia de parálisis residual con TOFr < 0,9 en la población no revertida, esta diferencia no fue estadísticamente significativa. Sin embargo, la frecuencia de parálisis residual con TOFr < 0,7, un grado más severo de deterioro de la función neuromuscular, fue significativamente más alta en la población no revertida y los valores promedio de TOFr fueron significativamente más bajos. Aunque nuestro estudio no estuvo diseñado para detectar estas diferencias, los resultados parecen confirmar y reforzar el concepto de que la falta de reversión rutinaria del bloqueo neuromuscular es un factor de riesgo para una mayor incidencia y severidad de la parálisis residual.
Finalmente, en la gran mayoría de casos en los que se administró un antagonista del bloqueo neuromuscular al final de la cirugía, las dosis utilizadas de neostigmina fueron inadecuadas, tomando en consideración las recomendaciones actuales. En el 70% de los casos las dosis de neostigmina fueron menores o iguales a 0,02 mg/kg, muy por debajo de las recomendaciones actuales de la literatura (0,04 a 0,08 mg/kg) [1,22,26]. Aunque las revisiones más recientes sugieren que se pueden usar dosis de anticolinesterasas (neostigmina entre ellas) ajustadas al grado de bloqueo, esto se aplica para aquellos casos en los que disponemos de monitorización neuromuscular como guía de manejo [1]. Cuando la valoración de la recuperación de la función neuromuscular se realice por criterios clínicos o por métodos subjetivos, el uso rutinario y a dosis estándar de los agentes antagonistas debería ser la regla [33]. En un estudio observacional realizado en Polonia, con características de diseño similares al nuestro, 415 pacientes sin monitorización neuromuscular intraoperatoria fueron evaluados para determinar la frecuencia de parálisis residual en la UCPA. En todos los pacientes se permitió una recuperación espontánea de la función neuromuscular sin el uso de neostigmina y fueron evaluados mediante criterios clínicos de recuperación antes de su traslado a la UCPA. La incidencia de parálisis residual (TOFr < 0,9) encontrada fue de 89% en mayores de 65 años y 77% en menores de 65 años, con valores de TOFr < 0,7 en 44% y 20% respectivamente [35]. En otro estudio más reciente realizado en Nigeria, 41 pacientes adultos sometidos a anestesia general sin monitorización objetiva de la función muscular fueron evaluados para determinar la presencia de parálisis en la UCPA. La incidencia de parálisis residual con TOFr < 0,9 fue 75,5% y con TOFr < 0,7 fue de 41,7% [36]. Estos resultados, como los nuestros, ratifican la escasa utilidad de los criterios clínicos o subjetivos como herramienta de valoración de la función neuromuscular y de manera indirecta subraya la importancia de una rutinaria reversión del bloqueo neuromuscular, particularmente en escenarios con importantes limitaciones en la disponibilidad de dispositivos de monitorización neuromuscular y fármacos alternativos a las anticolinesterasas para revertir el bloqueo neuromuscular.
Todos los pacientes en nuestro estudio estaban recibiendo oxígeno suplementario a su llegada a la UCPA, lo que podría haber enmascarado situaciones de hipoxia. A pesar de esto, el 4,2% de los pacientes presentó una saturación de oxígeno menor al 90%. Tal como lo señalamos previamente, nuestro estudio no estuvo diseñado para recoger de manera sistemática todas las posibles complicaciones posoperatorias relacionadas a la parálisis residual.
Dentro de las limitaciones del estudio podemos señalar que la muestra fue seleccionada por conveniencia según la disponibilidad de tiempo de los autores y/o colaboradores, el tiempo desde la última dosis del relajante muscular no fue medido, no se registraron los criterios clínicos o subjetivos utilizados por los anestesiólogos para valorar la recuperación de la función neuromuscular, no se recopilaron datos de los criterios del anestesiólogo para decidir el uso de antagonistas de la relajación muscular y la selección de la dosis, y no se realizó una búsqueda sistemática de complicaciones posoperatorias relacionadas con la parálisis residual. Asimismo, debido a las limitaciones para el enmascaramiento, pudo haber un cambio en la práctica anestésica habitual al percatarse del estudio. Finalmente, debido a limitaciones logísticas del equipo investigador el estudio no fue diseñado para evaluar de manera sistemática la presencia de complicaciones relacionadas a la parálisis residual en la UCPA, ni al alta de la misma.
En conclusión, la incidencia de parálisis residual posoperatoria en pacientes sin monitorización rutinaria de la función neuromuscular es elevada, probablemente favorecida por el uso no estandarizado de los relajantes musculares, la escasa utilidad de los criterios clínicos como herramienta de valoración de la recuperación de la función neuromuscular y la no utilización rutinaria y a dosis estándar de antagonistas para revertir el bloqueo neuromuscular. El uso racional de los relajantes musculares, junto con el uso rutinario de antagonistas del bloqueo neuromuscular debería ser la regla en escenarios con escasa o nula disponibilidad de monitorización neuromuscular, incluso en aquellos casos en los que se considere que ha habido una recuperación clínica de la función neuromuscular o que haya transcurrido un tiempo considerado suficiente para el metabolismo de los relajantes musculares. De igual modo, los resultados de nuestro estudio sugieren que debemos revisar los protocolos institucionales y modificar nuestra práctica anestésica actual para hacerla más segura, al mismo tiempo que subraya le necesidad de implementar la monitorización neuromuscular a la práctica anestésica estándar para reducir o evitar la elevada incidencia de parálisis residual posoperatoria.
Contribuciones de autoría: Los autores declaran haber participado en la concepción y diseño del trabajo, análisis e interpretación de los resultados, redacción del manuscrito y aprobación final. Asimismo, asumen responsabilidad frente a los contenidos del manuscrito.
Fuente de financiamiento. Autofinanciado.
Conflictos de Interés. Los autores declaran que no han recibido financiamiento alguno para la elaboración del presente artículo, ni mantienen vínculo laboral o comercial con alguna empresa o institución que tenga conflicto de intereses con la realización del presente estudio.
Agradecimientos: A los residentes de Anestesiología, personal de enfermería y personal técnico del Departamento de Anestesiología del Hospital Regional Docente de Cajamarca, por su desinteresada y paciente colaboración en la realización del presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Brull SJ, Kopman AF. Current Status of Neuromuscular Reversal and Monitoring. Anesthesiology. 2017;126(1):173-90. doi: 10.1097/ALN.0000000000001409 [ Links ]
2. Fuchs-Buder T, Nemes R, Schmartz D. Residual neuromuscular blockade: management and impact on postoperative pulmonary outcome. Curr Opin Anesthesiol. 2016;29(6):662-7. doi: 10.1097/ACO.0000000000000395 [ Links ]
3. Kopman AF, Brull SJ. Is Postoperative Residual Neuromuscular Block Associated with Adverse Clinical Outcomes? What Is the Evidence?. Curr Anesthesiol Rep. 2013;3:114-21. doi: 10.1007/s40140-013-0009-6 [ Links ]
4. Murphy GS, Brull SJ. Residual neuromuscular block: lessons unlearned. Part I: definitions, incidence, and adverse physiologic effects of residual neuromuscular block. Anesth Analg. 2010;111(1):120-8. doi: 10.1213/ANE.0b013e3181da832d [ Links ]
5. Fabregat López J, Candia Arana CA, Castillo Monzón CG. La monitorización neuromuscular y su importancia en el uso de los bloqueantes neuromusculares. Rev Colomb Anestesiol. 2012;40(4):293-303. doi: 10.1016/j.rca.2012.05.001 [ Links ]
6. Esteves S, Martins M, Barros F, Barros F, Canas M, Vitor P, et al. Incidence of postoperative residual neuromuscular blockade in the postanesthesia care unit: an observational multicentre study in Portugal. Eur J Anaesthesiol. 2013;30(5):243-9. doi: 10.1097/EJA.0b013e32835dccd7 [ Links ]
7. Fortier LP, McKeen D, Turner K, de Médicis É, Warriner B, Jones PM, et al. The RECITE study: A Canadian Prospective, Multicenter Study of the Incidence and Severity of Residual Neuromuscular Blockade. Anesth Analg. 2015;121(2):366-72. doi: 10.1213/ANE.0000000000000757 [ Links ]
8. Errando CL, Garruti I, Mazzinari G, Díaz-Cambronero O, Bebawy JF, Grupo Español de Estudio Del Bloqueo Neuromuscular. Residual neuromuscular blockade in the postanesthesia care unit: observational cross-sectional study of a multicenter cohort. Minerva Anestesiol. 2016;82(12):1267-77. [ Links ]
9. Mari-Zapata D, Ángeles-de la Torre R, Aguirre-Ibarra C, Álvarez-Reséndiz G, Ocampo A, Gutiérrez-Porras C. Bloqueo residual neuromuscular en pacientes hospitalizados versus ambulatorios en la Unidad de Cuidados Postanestésicos. Rev Mex Anest. 2016;39(2):97-105. [ Links ]
10. Ariza F, Dorado F, Enríquez LE, González V, Gómez JM, Chaparro-Mendoza K, et al. Posoperative residual curarization at the post-anesthetic care unit of a university hospital: a cross-sectional study. Rev Colomb Anestesiol. 2017; 45(1):15-21. doi: 10.1016/j.rcae.2016.11.002 [ Links ]
11. Aytac I, Postaci A, Aytac B, Sacan O, Alay GH, Celik B, et al. Survey of postoperative residual curarization, acute respiratory events and approach of anesthesiologists. Braz J Anesthesiol. 2016;66(1):55-62. doi: 10.1016/j.bjane.2012.06.011 [ Links ]
12. García MP, Sergi N, Finkel DM. Incidencia del bloqueo neuromuscular residual al ingreso en la unidad de recuperación postanestésica. Rev Arg Anest. 2006;64(3):121-9. [ Links ]
13. Silva MG, Rojas CE. Incidencia de parálisis muscular residual con el uso de relajantes musculares no despolarizantes de duración intermedia. Rev Chil Anest. 2011;40(4):305-10. [ Links ]
14. Chiguala Mixan E. Parálisis neuromuscular residual postoperatoria en la unidad de recuperación postanestésica del Hospital Nacional Arzobispo Loayza, enero a marzo 2010. Actas Peru Anestesiol. 2012;20(1):8-12. [ Links ]
15. Soriano Soriano NP. Frecuencia de parálisis residual de los bloqueadores neuromusculares en la Unidad de Recuperación Post-Anestésica del Hospital Nacional Edgardo Rebagliati Martins febrero-junio 2012 [Tesis para optar el título de Médico Cirujano]. Lima: Universidad de San Martín de Porres; 2012. Disponible en: http://www. [ Links ]repositorioacademico.usmp.edu.pe/bitstream/handle/usmp/2219/soriano_np.pdf?sequence=3&isAllowed=y
16. Murphy GS, Szokol JW, Marymont JH, Greenberg SB, Avram MJ, Vender JS, et al. Intraoperative acceleromyographic monitoring reduces the risk of residual neuromuscular blockade and adverse respiratory events in the postanesthesia care unit. Anesthesiology 2008;115:946-54. doi: 10.1097/ALN.0b013e3182342840 [ Links ]
17. Hunter JM. Reversal of residual neuromuscular block: complications associated with perioperative management of muscle relaxation. Br J Anaesth. 2017;119(S1):i53-i62. doi: 10.1093/bja/aex318 [ Links ]
18. Bulka CM, Terekhov MA, Martin BJ, Dmochowski RR, Hayes RM, Ehrenfeld JM. Nondepolarizing neuromuscular blocking agents, reversal, and risk of postoperative pneumonia. Anesthesiology. 2016;125:647-55. doi: 10.1097/ALN.0000000000001279 [ Links ]
19. Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Marymont JH, Vender JS, et al. Intraoperative acceleromyography monitoring reduces symptoms of muscle weakness and improves quality of recovery in the early postoperative period. Anesthesiology 2011;115(5):946-54. doi: 10.1097/ALN.0b013e3182342840 [ Links ]
20. Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Shear T, Vender JS, et al. Postoperative residual neuromuscular blockade is associated with impaired clinical recovery. Anesth Analg. 2013;117(1):133-41. doi: 10.1213/ANE.0b013e3182742e75 [ Links ]
21. Murphy GS, Szokol JW, Marymont JH, Greenberg SB, Avram MJ, Vender JS. Residual neuromuscular blockade and critical respiratory events in the postanesthesia care unit. Anesth Analg 2008;107(1):130-7. doi: 10.1213/ane.0b013e31816d1268 [ Links ]
22. Brull SJ, Murphy GS. Residual neuromuscular block: lessons unlearned. Part II: Methods to reduce the risk of residual weakness. Anesth Analg. 2010;111(1):129–40. doi: 10.1213/ANE.0b013e3181da8312 [ Links ]
23. Videira RL, Vieira JE. What rules of thumb do clinicians use to decide whether to antagonize nondepolarizing neuromuscular blocking drugs? Anesth Analg. 2011;113(5):1192-6. doi: 10.1213/ANE.0b013e31822c986e [ Links ]
24. Murphy GS, Szokol JW, Marymont JH, Franklin M, Avram MJ, Vender JS. Residual paralysis at the time of tracheal extubation. Anesth Analg. 2005;100(6):1840-5. doi: 10.1213/01.ANE.0000151159.55655.CB [ Links ]
25. Naguib M, Kopman AF, Lien CA, Hunter JM, Lopez A, Brull SJ. A survey of current management of neuromuscular block in the United States and Europe. Anesth Analg. 2010;111(1):110-9. doi: 10.1213/ANE.0b013e3181c07428 [ Links ]
26. Butterworth JF, Mackey DC, Wasnick JD. Chapter 12: Cholinesterase Inhibitors & Other Pharmacologic Antagonists to Neuromuscular Blocking Agents. En: Morgan & Mikhail’s Clinical Anesthesiology. 5th edition [Internet]. Madrid: Mc Graw Hill; 2013. p. 223-32. Disponible en: https://accessmedicine.mhmedical.com/content.aspx?bookid=2444§ionid=189636512
27. Eikermann M, Groeben H, Hüsing J, Peters J. Accelerometry of Adductor Pollicis Muscle Predicts Recovery of Respiratory Function from Neuromuscular Blockade. Anesthesiology. 2003; 98(6):1333-7. doi: 10.1097/00000542-200306000-00006 [ Links ]
28. Fruergaard K, Viby-Mogensen J, Berg H, El-Mahdy AM. Tactile evaluation of the response to double burst stimulation decreases, but does not eliminate, the problem of postoperative residual paralysis. Acta Anaesthesiol Scand. 1998;42(10):1168-74. doi: 10.1111/j.1399-6576.1998.tb05271.x [ Links ]
29. Ministerio de Salud. Norma Técnica 089-MINSA/DGSP-V.01. Norma Técnica de Salud para la Atención Anestesiológica [Internet]. Lima, Perú: MINSA; 2011. Disponible en: ftp://ftp2.minsa.gob.pe/normaslegales/2011/RM022-2011-MINSA(A).PDF [ Links ]
30. Baillard C, Clec’h C, Catineau J, Salhi F, Gehan G, Cupa M, et al. Postoperative residual neuromuscular block: a survey of management. Br J Anaesth. 2005;95(5):622-63. doi: 10.1093/bja/aei240
31. Baillard C, Gehan G, Reboul-Marty J, Larmignat P, Samama CM, Cupa M. Residual curarization in the recovery room after vecuronium. Br J Anaesth. 2000; 84(3):394-5. doi: 10.1093/oxfordjournals.bja.a013445 [ Links ]
32. Maybauer DM, Geldner G, Blobner M, Pühringer F, Hofmockel R, Rex C, et al. Incidence and duration of residual paralysis at the end of surgery after multiple administrations of cisatracurium and rocuronium. Anaesthesia. 2007;62(1):12-7. doi: 10.1111/j.1365-2044.2006.04862.x [ Links ]
33. Murphy GS, Kopman AF. "To reverse or not to reverse"? The answer is clear!. Anesthesiology. 2016;125:611-4. doi: 10.1097/ALN.0000000000001280 [ Links ]
34. Naguib M, Brull SJ, Hunter JM, Kopman AF, Fülesdi B, Johnson KB, et al. Anesthesiologists’ overconfidence in their perceived knowledge of neuromuscular monitoring and its relevance to all aspects of medical practice: an international survey. Anesth Analg. 2019;128(6):1118-26. doi: 10.1213/ANE.0000000000003714
35. Pietraszewski P, Gaszyński T. Residual neuromuscular block in elderly patients after surgical procedures under general anaesthesia with rocuronium. Anaesthesiol Intensive Ther. 2013;45(2):77-81. doi: 10.5603/AIT.2013.0017
36. Majekodunmi AA, Ikotun OA, Oladokun OD. Incidence of postoperative residual paralysis in a Nigerian teaching hospital. Niger J Clin Pract. 2017;20(12):1561-5. doi: 10.4103/njcp.njcp_99_17 [ Links ]
Correspondencia
Rolando Silas Vela Vásquez
Recibido: 21/10/2019
Arbitrado por pares
Aprobado: 11/12/2019