INTRODUCCIÓN
El dengue es una enfermedad producida por el virus del dengue; este patógeno presenta cuatro serotipos, siendo el serotipo 2 (DENV-2) el más asociado con los casos graves [1]. Algunas estimaciones indican que se producen 390 millones de infecciones anualmente, de las cuales 96 millones presentan manifestaciones clínicas. Un estimado de 128 países están en riesgo de infección por dengue, sin contar con un tratamiento antiviral [2].
Se ha descrito que las algas rojas presentan actividad inhibitoria de la replicación de los virus de inmunodeficiencia humana y dengue (DENV) [3,4]. Esta propiedad estaría asociada a sus polisacáridos complejos (carragenanos). Particularmente, sus efectos dependerían de los cationes asociados a su estructura, ya sea en formando geles firmes con el potasio (k-carragenanos) o fracciones no gelificantes (λ-carragenanos) debido a su sulfatación; además, se identifica que la variabilidad en la estructura depende de factores ambientales, de la etapa de desarrollo del alga y de la técnica de extracción utilizada [3,4].
Chondracanthus chamissoi es una de las algas rojas más abundantes de la costa peruana y es endémica en las costas del Pacífico sur [5]. La actividad antiviral de los carragenanos presentes en esta alga puede variar según el serotipo del virus dengue en estudio y el tipo de célula utilizada en su evaluación [6-8]. Por otro lado, sustancias encontradas en el extracto de Chlorella sp. un alga unicelular de color verde, presentan actividad antiviral contra el virus de la septicemia hemorrágica viral y de la fiebre porcina africana [9].
En vista de la presencia de estas algas en nuestro país y los pocos estudios realizados sobre su potencial antiviral contra el DENV-2, consideramos necesaria su evaluación para determinar su posible uso en la producción de antivirales. Por lo cual el objetivo del presente estudio fue extraer y evaluar la actividad antiviral de los compuestos de Chondracanthus chamissoi y Chlorella peruviana contra el DENV-2 en células Vero-76.
MATERIAL Y MÉTODOS
Obtención de muestras para el estudio
Chondracanthus chamissoi fue obtenida del balneario de San Bartolo (12°25′00″S 76°47′00″O), al sur de Lima y se identificó en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (UNMSM). Chondracanthus chamissoi gametofítico fue registrado con código 302774 y Chondracanthus chamissoi esporofítico con el código 302775.
Chlorella peruviana fue obtenida de las lagunas mineromedicinales del Balneario de Chilca, provincia de Cañete-Lima (12° 32´35’’ S, 76° 43’ 31’’ W). Su identificación fue realizada en el Laboratorio Dulce Acuícola y Cordados de la misma universidad con el número de registro 303650.
El virus de dengue serotipo 2 utilizado en el estudio corresponde a un aislamiento peruano y la línea celular Vero-76 fue donada por el Laboratorio de Virología Clínica Molecular de la Universidad de Sao Paulo. Ambos fueron propagados y mantenidos en el Laboratorio de Virología Clínica Molecular de la Facultad de Ciencias Biológicas de la (UNMSM), lugar donde se desarrolló el estudio.
Extracción e identificación del carragenano de Chondracanthus chamissoi
Se realizó la extracción de carragenano de algas en fase gametofítica y esporofítica, siguiendo el método propuesto por Riofrio con modificaciones [10]. Cada alga fue lavada con agua destilada, etanol de 96° y agua destilada estéril; se secó a 60°C por 8 horas, fue triturada, cernida y guardada a -20 °C. Un gramo de muestra se disolvió en 100 ml de agua destilada estéril, se llevó a ebullición por una hora y se filtró. El material vegetal recuperado se guardó a -20 °C. A la solución de la filtración se agregó 50 ml de isopropanol frio. El polisacárido recuperado fue lavado con etanol y secado en una estufa a 38°C por 12 horas luego guardado a -20 °C. Para la lectura de infrarrojo (IR), las muestras fueron tratadas con 20 μl de cloruro de cetilpiridinio al 8%, se lavó el precipitado con agua destilada, se trató con cloruro de sodio al 25% y se adicionó tres volúmenes de etanol. El producto precipitado fue desecado con silica gel al vacío por 24 horas.
Extracción de carbohidratos solubles de Chondracanthus chamissoi y Chlorella peruviana
Un gramo del material vegetal previamente lavado en fase esporofítica y gametofítica fue resuspendido en 10 ml de agua destilada estéril, se colocó en baño de agua a 100°C/4 horas, seguidamente se centrifugó a 2 750 rpm/10 min/21°C. La fase soluble fue filtrada con un filtro de 0,45 μm, denominándosele extracto crudo de carbohidratos solubles de Chondracanthus chamissoi. Un gramo de Chlorella peruviana liofilizada fue triturado con nitrógeno líquido, resuspendido en 20 ml de agua destilada estéril y llevado a baño de agua (100°C aprox.) por 90 min. La mezcla fue centrifugada a 4 000 rpm/10 min/24°C. La fase soluble se filtró con un filtro de 0,45 μm, a esta muestra se le denominó extracto crudo de carbohidratos solubles de Chlorella peruviana. A una alícuota de los extractos crudos se le agregó isopropanol en proporción de 3:1 y se colocó a 4°C toda la noche. Posteriormente, se centrifugó a 3 000 rpm/10 min/10°C, el precipitado fue secado a 50°C por tres horas. Los carbohidratos secos fueron resuspendidos en agua destilada estéril y filtrada. Las muestras fueron almacenadas a -20 °C.
Cuantificación de carbohidratos y análisis por cromatografía líquida de alta resolución (HPLC) de extractos de carbohidratos solubles de Chondracanthus chamissoi fase gametofito y Chlorella peruviana
La determinación de la presencia de carbohidratos en las muestras fue realizada por el método de Antrona [11]. El análisis cromatográfico de las muestras de carbohidratos solubles de Chondracanthus chamissoi fase gametofito y Chlorella peruviana, se realizó en un equipo de HPLC SHIMADZU, NEXERA bajo las siguientes condiciones cromatografícas: temperatura de horno de columna 35°C, fase móvil: A: acetonitrilo, B: agua, volumen de inyección: 25 μl, flujo: 0,8 ml/min. El análisis fue realizado en un sistema isocrático (solvente acetonitrilo/agua: 80/20). Se usaron los siguientes estándares de carbohidratos (Sigma-Aldrich): ribosa 99%, xilosa 100%, arabinosa 99%, fructosa 100%, manosa 100%, glucosa 99,8%, galactosa 99%, sucrosa 100%, maltosa monohidratada 99%, lactosa monohidratada 100%.
Fracciones del extracto crudo de carbohidratos solubles obtenidas a partir de Chondracanthus chamissoi fase gametofitica y esporofitica
Se evaluaron cuatro fracciones mezclando 5g de Chondracanthus chamissoi y 100 ml de diferentes solventes para cada fracción: fracción 1 preparada con agua destilada y calentada a 22 oC/ 1 hora, fracción 2 se mezcló el alga (fracción 1) con agua destilada y se calentó a 60 oC/ 1 hora, fracción 3 se mezcló el alga (fracción 2) con HCl 0,1 M a 37 oC/ 16 horas y fracción 4 se mezcló el alga (fracción 3) más KOH 2M a 37oC / 16 horas.
Prueba de toxicidad en células VERO-76
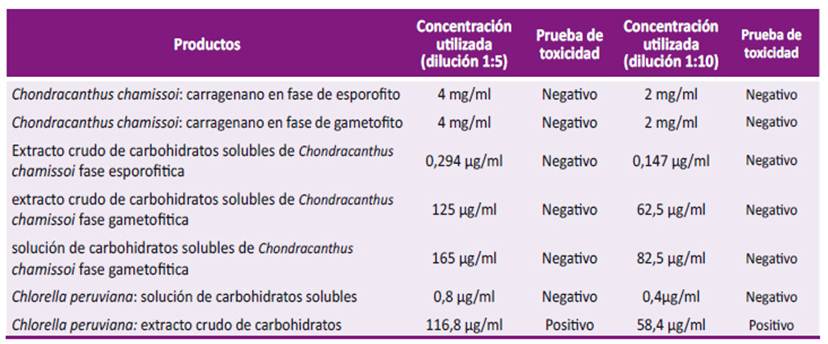
Se utilizó la metodología descrita por Montanha et al. con modificaciones [12]. Se realizaron diluciones 1:5 y 1:10 de los extractos con medio de mantenimiento con 2% de suero bovino fetal en placas de 24 pozos con monocapa confluente de células Vero-76, inoculando 500 µl/pozo de cada dilución por duplicado e incubando los cultivos por nueve días. La evaluación de la toxicidad se realizó diariamente identificando cambios en la morfología celular y/o el desprendimiento de la monocapa.
Producción de la semilla viral y evaluación de la pureza
Se inoculó 200 µl del DENV-2 aislamiento peruano diluido 1:10 en un frasco de 25 cm2 con monocapa confluente de células Vero-76, se incubó por 60 min/37°C y se adicionó 8 ml de medio de mantenimiento con 2% de suero bovino fetal, se incubó hasta observar efecto citopático (las células se redondean y se desprenden de la monocapa). Finalmente se centrifugó la suspensión viral a 2 000 rpm/10 minutos, el sobrenadante se almacenó a -80°C.
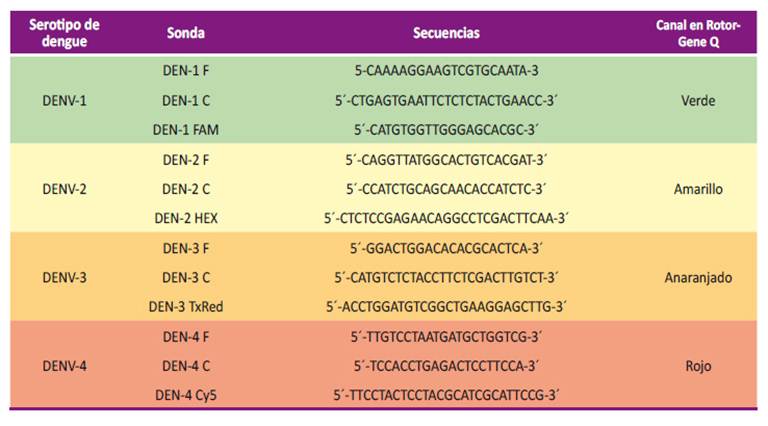
Se realizaron cuatro pasajes para realizar la adaptación e incrementar el título del virus en la línea celular Vero-76. Para evaluar la pureza de la semilla viral se realizó la extracción del RNA con el kit de extracción QIAmp viral RNA (Qiagen), siguiendo las indicaciones del manual del proveedor 13. Para el PCR en tiempo real se empleó el termociclador Rotor-Gene Q de la marca QIAGEN, realizando un ensayo basado en sondas de hidrólisis; para esto se emplearon los primers descritos en la Tabla 1. En un microtubo de 0,2 ml se mezcló: 12,5 µl de buffer 2x RG, 2,3 µl de agua libre de RNAasas, 0,5 µl de cada primer (0,4 µM), 0,25 µl de cada sonda (0,1 mM) y 0,20 µl de enzima (RG RT MIX). Se dispensó 5 µl del eluido de extracción de la muestra. Las condiciones de la RT-PCR en tiempo real fueron: retrotranscripción: 50 °C/15min/1 ciclo; activación de la enzima: 95 °C/5 min/1 ciclo; desnaturalización: 95 °C/15 s/45 ciclos; extensión: 60 °C/15 s/45 ciclos.
Prueba de plaqueo en células Vero-76
Se realizó la prueba de plaqueo para determinar el título del virus producido. Se utilizó la técnica descrita en el manual de técnicas de laboratorio para el diagnóstico y la caracterización de los virus del dengue con algunas modificaciones [14]. Se prepararon tres placas de 24 pozos adicionando una suspensión celular de 2,5x105 cel/ml en medio de crecimiento con 10% SBF y dispensándola a razón de 500 µl/ pozo. Las placas se incubaron a 37 °C durante una hora y se inoculó 50 µl/pozo/triplicado de las diluciones del virus DENV-2 de 10-1 a 10-7 diluidos en medio de mantenimiento y se incubó por 4 horas, seguidamente se adicionó 500 µl/pozo de medio overlayer. La coloración se realizó en días sucesivos (día 7, 8 y 9) adicionando 500 µl de azul negro de naftol.
Evaluación de la actividad antiviral mediante la prueba de reducción de placas (PRP(50)) en células Vero-76
Una vez determinado el título del virus, se realizó una mezcla en partes iguales utilizando una concentración conocida del DENV-2 con el extracto vegetal diluido 1:5 y 1:10 se incubó una hora a 37oC, se inoculó 50 µL/pozo/duplicado en placas de 24 pozos preparadas una hora antes con una suspensión celular de 2,5x105 cel/ml, se incubó por cuatro horas y se adicionó 500 µl/pozo de medio overlayer. Después de 9 días se coloreó la placa con azul negro de naftol. Todo extracto que inhibió el crecimiento del 50% o más del número de virus inoculado se consideró como positivo a la prueba. Se utilizaron controles de carragenanos iota, kappa y lambda (Sigma Aldrich) y controles de carbohidratos de manosa, maltosa monohidratada, galactosa, xilosa, lactosa monohidratada, fructuosa, ribosa, arabinosa, sucrosa y glucosa (Sigma Aldrich).
RESULTADOS
Extracción e identificación del carragenano de Chondracanthus chamissoi
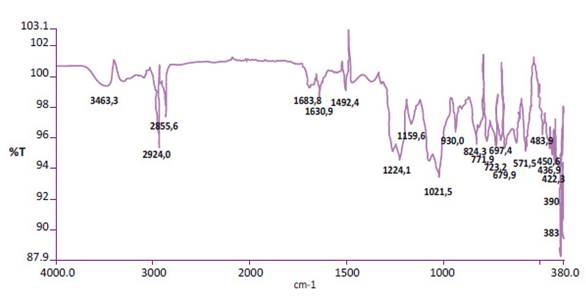
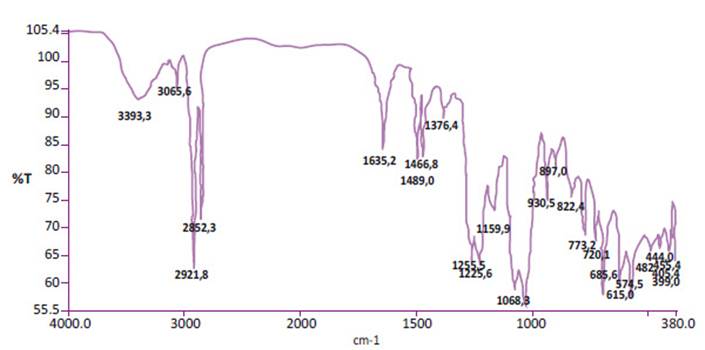
Según los resultados del análisis del espectro infrarrojo se observó en ambas muestras fase gametofito y esporofito absorción a los 930 cm-1, esta absorción es característica de los polisacáridos k-carragenanos y del puente 3,6-anhidro-D-galactosa 6. Además, se vieron picos característicos de absorción de Chondracanthus chamissoi en fase gametofítica: 1021,5, 1224,1, 697,4, 1492,4 cm-1 y de Chondracanthus chamissoi en fase esporofítica: 897, 1068,3, 1255,5, 1225,6, 685,6 cm-1 (Figura 1 y 2).
En la gráfica de espectro IR podemos ver en el eje Y la transmitancia y en el eje de las X el número de onda. Nótese la absorción a los 930 cm-1 la cual es característica de los polisacáridos k-carragenanos.
Extracción y análisis por (HPLC) de extractos de carbohidratos solubles de Chondracanthus chamissoi fase gametofito y Chlorella peruviana
Con respecto a los carbohidratos solubles se obtuvieron las siguientes concentraciones: extracto crudo de carbohidratos solubles de Chondracanthus chamissoi fase esporofítica 1,47 μg/ml, extracto crudo de carbohidratos solubles de Chondracanthus chamissoi fase gametofítica 625 μg/ml y solución de carbohidratos solubles de Chondracanthus chamissoi fase gametofítica 825 μg/ml. En el caso de Chlorella peruviana se obtuvo una concentración de carbohidratos de 1,42 µg/ml para el extracto crudo y de 4 μg/ml para la solución de carbohidratos solubles. La alta presencia de carragenano en la muestra de Chondracanthus chamissoi fase esporofítica no permitió obtener carbohidratos solubles por precipitación. A través del análisis de los cromatogramas se identificó la presencia de nueve azúcares (ribosa, xilosa, arabinosa, fructuosa, manosa, galactosa, sucrosa, maltosa y lactosa) en la muestra de carbohidratos solubles de Chondracanthus chamissoi fase gametofito y cuatro azucares (glucosa, sucrosa, maltosa y lactosa) en la muestra de carbohidratos solubles de Chlorella peruviana.
Prueba de toxicidad en células VERO-76
Los compuestos de Chondracanthus chamissoi y la solución de carbohidratos solubles de Chlorella peruviana no presentaron citotoxicidad a las concentraciones trabajadas (Tabla 2). Los carbohidratos del extracto crudo de Chlorella peruviana presentaron citotoxicidad (Tabla 2). De las fracciones del extracto crudo obtenidas a partir de Chondracanthus chamissoi fase gametofítica se observó que las muestras analizadas no presenta citotoxicidad. En el extracto crudo de carbohidratos de Chlorella peruviana se presentó citotoxicidad en las diluciones 1:5 y 1:10.
Evaluación de la actividad antiviral (PRP(50)) en células Vero-76
Con respecto a la capacidad de inhibir el crecimiento de DENV-2, se encontró que el k-carragenano de Chondracanthus chamissoi en fase gametofito y esporofito y los extractos crudos de carbohidratos solubles de Chondracanthus chamissoi y Chlorella peruviana inhiben el crecimiento del DENV-2 al igual que la solución de carbohidratos solubles de Chlorella peruviana, no así los carbohidratos del extracto crudo de Chlorella peruviana (Tabla 3).
Tabla 3 Resultados de los extractos evaluados mediante la prueba de reducción de placas en células Vero-76 para DENV-2.
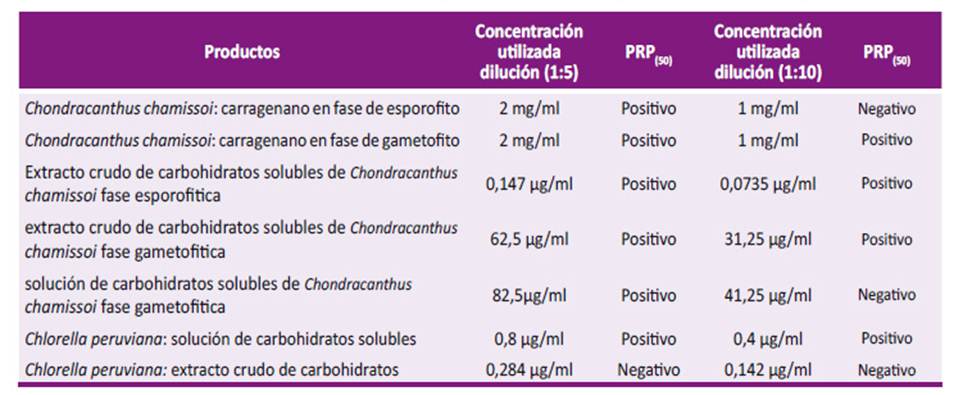
Se consideró como muestra negativa a la prueba de reducción de placas a toda muestra que inhibía la formación de menos del 50% del número de placas líticas inoculadas en el cultivo celular. Cada placa lítica equivale a una partícula viral infecciosa.
En las fracciones del extracto crudo obtenidas a partir de Chondracanthus chamissoi fase gametofítica y esporofítica se encontró que ellas fueron positivas por la prueba de PRP(50) para inhibir el crecimiento de DENV-2 a las diluciones 1:5 y 1:10 (Tabla 3). Los controles de carragenanos iota, kappa y lambda (Sigma Aldrich) fueron positivos en ambas diluciones. Los controles de carbohidratos manosa, maltosa monohidratada, galactosa, xilosa, lactosa monohidratada, fructuosa, ribosa, Arabinosa, sucrosa y glucosa (Sigma Aldrich) no inhibieron el crecimiento de DENV-2.
DISCUSIÓN
En este estudio se extrajo y evaluó la actividad antiviral de los compuestos de Chondracanthus chamissoi y Chlorella peruviana contra el DENV-2 en células Vero-76. La metodología usada permitió la obtención de carragenano y/o carbohidratos solubles de Chondracanthus chamissoi fase gametofito y esporofito y Chlorella peruviana. Además, se confirmó por HPLC la presencia de carbohidratos, en los extractos obtenidos de Chondracanthus chamissoi fase gametofito y Chlorella peruviana.
Los k-carragenanos de la fase esporofítica y gametofítica, los extractos crudos de carbohidratos solubles de Chondracanthus chamissoi de ambas fases, la solución de carbohidratos solubles de Chondracanthus chamissoi fase gametofítica y la solución de carbohidratos solubles de Chlorella peruviana presentaron actividad antiviral contra DENV-2, lo que coincidió con lo reportado en estudios anteriores [7,15].
La presencia de cuatro tipos distintos de carragenano en Chondracanthus chamissoi, κ-carragenano, λ-carragenano, ι-carragenano y μ-carragenano, los cuales se diferencian en el grado de sulfatación, las posiciones de los grupos sulfato y la presencia de grupos de anhidrogalactosa [15], hizo necesaria la identificación de los carragenanos extraídos por espectro infrarrojo y permitió reportar con precisión los ficocoloides extraídos como polisacáridos k-carragenanos.
Se ha indicado anteriormente que la actividad inhibitoria viral de los k-carragenanos podría ser menor para algunos virus [15]; sin embargo, en nuestro estudio se encontró que los k-carragenanos de Chondracanthus chamissoi de la fase gametofítica y esporofítica presentaron actividad antiviral contra DENV-2, el extracto de k-carragenano de fase gametofito presentó un efecto inhibidor del virus a una concentración más baja (1 mg/ml). Resultados que coinciden con Talarico quien reportó que los carragenanos kappa, lambda y iota inhiben la infección de DENV-2 en células Vero, la inhibición de DENV-2 en la línea celular Vero podría ser por interferencia en la interacción de la glicoproteína E con la molécula heparán sulfato presente en células de vertebrados [7].
Los extractos crudos de carbohidratos solubles de Chondracanthus chamissoi fase esporofítica y gametofítica presentaron actividad antiviral siendo la concentración inhibitoria más baja 0,0735 µg/ml. En la solución de carbohidratos solubles de Chondracanthus chamissoi fase gametofítica la muestra con concentración de 41,25 µg/ml fue negativa para la PRP(50) contra DENV-2, siendo positiva a una concentración mayor.
La cantidad y el tipo de carragenano extraído de Chondracanthus chamissoi de las fases gametofito y esporofito puede variar con relación al patrón estacional (fase de vida en la que se hace la extracción) impactando en el rendimiento y en la calidad de los ficocoloides presentes [10]. En nuestras muestras, analizadas mediante IR, solo se pudo identificar la presencia de k-carragenanos, resultado similar al que encontró Wang et al. al utilizar agua caliente en su método de extracción - usar agua caliente favorecería la recuperación de k-carragenanos y usar agua fría lo haría para la recuperación de un hibrido k/µ/ι-carragenano- [6].
Medimos la actividad antiviral de los carragenanos en células Vero al ser las recomendadas por la Organización Mundial de la Salud para la prueba de neutralización por reducción de placas para dengue y nuestros resultados coincidieron con lo ya reportado [16]; no obstante, se indica que su actividad antiviral varía según el serotipo del virus y la línea celular utilizada para la prueba de evaluación antiviral, por ejemplo, para la prueba de reducción de placas realizada en células Vero, BHK-21, HepG2 y LLC-MK2 se encontró que el serotipo más susceptible fue el DENV-2 seguido del DENV-1 [7]. Esta variación en la susceptibilidad se debería a las diferentes formas de infección que tienen ambos serotipos: el DENV-1 utiliza la vía de endocitosis dependiente de clatrina mientras que el DENV-2 la vía endocítica no clásica independiente de clatrina y caveolas, pero dependiente de dynamin [7].
La cepa nativa de DENV-2 utilizada para el estudio se aisló en un inicio en la línea celular C6/36 y se propagó en células Vero-76 (cuatro pasajes) incrementando el título viral hasta tener placas definidas en la prueba de neutralización para una correcta cuantificación del virus. Un estudio realizado por Acosta et al. encontró que una serie de pasajes en células Vero puede incrementar la resistencia de los virus a los carragenanos; sin embargo, esta susceptibilidad no se altera realizando la misma acción en la línea celular C6/36 [3], situación que sería debido a que los residuos de heparán sulfato están ausentes en la absorción viral en estas células [3].
El análisis de los azúcares presentes en los extractos de carbohidratos solubles de Chondracanthus chamissoi y Chlorella peruviana por HPLC identificó carbohidratos con posible actividad antivírica. Este estudio logró identificar los azucares presentes en Chlorella peruviana obtenida de las lagunas de Chilca, provincia de Cañete-Lima y Chondracanthus chamissoi obtenida del Balneario de San Bartolo. Estudios en distintas especies de Chlorella como Chlorella pyrenoidosa, Chlorella ellipsoidea, Chlorella vulgaris, reportan la presencia de diferentes azucares entre ellos los identificados en este estudio [15,17-19]. Salas et al. reportó la presencia de glucosa en un 11,95% y 2,89% por cada 100 g de tejido de Chondracanthus chamissoi femenino y masculino, respectivamente [19].
En el análisis de HPLC no pudimos identificar la presencia de glucosa en Chondracanthus chamissoi fase gametofito, posiblemente debido a las bajas concentraciones de este monosacárido libre en la muestra; esto se debería a que las algas rojas almacenan polímeros de reserva como el almidón de florideas, compuesto por una larga cadena de glucosas conectadas por uniones α (1,4), muy similares a la estructura de la amilopectina [20]. Algunas especies del género Chlorella presentan compuestos como polisacáridos sulfatados y azucares como galactosa, arabinosa entre otros que podrían tener actividad antiviral [9].
En el presente estudio se encontró que la solución de carbohidratos solubles de Chlorella peruviana presentó actividad antiviral mas no así los carbohidratos del extracto crudo. Quizá esto se deba a la alta concentración de carbohidratos obtenida en la muestra.
Solo pudimos evaluar la concentración de los carragenanos y soluciones de carbohidratos obtenidos en la muestra en dos diferentes diluciones, por lo que no pudimos determinar la concentración mínima exacta de carragenanos y carbohidratos que inhibe la infección de DENV-2. Por otro lado, según el análisis del espectro IR para la identificación del carragenano de Chondracanthus chamissoi se observó picos característicos de absorción de Chondracanthus chamissoi en fase gametofítica: 1021,5, 1224,1, 697,4, 1492,4 cm-1 y de Chondracanthus chamissoi en fase esporofítica: 897, 1068,3, 1255,5, 1225,6, 685,6 cm-1, pero los grupos funcionales presentes en estas longitudes están pendientes de ser elucidados; por ello, se requeriría de métodos adicionales como resonancia magnética nuclear o espectrometría de masas y realizar más estudios para conocer las concentraciones y los compuestos exactos capaces de inhibir la replicación de este virus, identificar su mecanismo de acción y evaluar su potencial como antiviral.