INTRODUCCIÓN
Durante las últimas décadas, se ha evidenciado un desarrollo sexual más temprano, indicado por una edad de menarquia más temprano, lo cual se ha demostrado en un estudio realizado en Korea en 37890 niñas y 1220 niños entre el 2008 y el 2014. La incidencia de pubertad precoz central en niñas incrementó 4,7 veces durante el periodo de estudio de 89,4 a 415,3 por 100 000 en niñas menores de nueve años de edad 1. En Dinamarca se realizó un estudio epidemiológico entre 1993 y 2001 donde se reporta entre 50 y 70 nuevos casos de pubertad precoz por año. La incidencia subdividida por edad y género al diagnóstico fue de 0,5 por 10 000 en niños menores de dos años, disminuyendo a 0,05 por 10 000 en niñas entre dos y cuatro años e incrementando progresivamente a 8 por 10 000 para niñas entre cinco y nueve años. Mientras que, en la población de varones, la incidencia fue muy baja, menor a 5 por 10 000 2.
La pubertad precoz puede ser de origen central dependiente de la activación del eje o periférica, o independiente del eje hipotálamo - hipófisis gonadal. Rohani en el año 2012, presentó un estudio para evaluar la etiología encontrando 42,6% de niños con pubertad precoz central (idiopática o neurogenica), 23,3% con pubertad precoz periférica (hiperplasia suprarrenal congénita, quistes ováricos, síndrome de Mc Cune Albright o carcinoma adrenal) 3.
Aunque el punto de corte para definir pubertad precoz es controversial, actualmente se siguen empleando los criterios reportados por Marshall y Tanner en 1969, basados en un estudio longitudinal que incluyó 192 niñas británicas, evaluadas con registros fotográficos trimestralmente durante la etapa de la adolescencia, las cuales fueron clasificados en cinco estadios por dos personas para definir el estadio puberal 4. En esta escala se incluye por primera vez la relación entre la edad y el desarrollo puberal, siendo aun de gran utilidad en el medio de la endocrinología pediátrica. Sin embargo, algunos estudios han demostrado que puede existir variación entre los estadios Tanner y la edad, de acuerdo a la etnia 5 e incluso a la altitud en donde las niñas residen 6.
Con relación al tratamiento, desde los años 80, los análogos de la hormona liberadora de gonadotropina (GnRH) constituyen el tratamiento de elección de la pubertad precoz central cuyos objetivos son mejorar la talla final adulta y disminuir el impacto emocional a causa del desarrollo puberal precoz 7. A tres décadas de la introducción del uso de análogos de GnRH para el tratamiento de pubertad precoz central, el tratamiento en niñas diagnosticadas después de los siete años de edad sigue siendo controversial para mejorar el impacto sobre la talla final y los trastornos emocionales como consecuencia del inicio temprano de la pubertad 8,9.
En este contexto, nuestro objetivo fue evaluar el efecto de los análogos de GnRH sobre la predicción de talla final adulta en niñas con pubertad precoz central de diagnóstico tardío, en el Hospital Cayetano Heredia, durante los años 2012 a 2018.
MATERIALES Y MÉTODOS
Población y muestra
Se incluyeron en el estudio niñas que fueron atendidas entre 2012 a 2018 en la Unidad de Endocrinología Pediátrica del Hospital Cayetano Heredia (HCH), mediante un muestreo por conveniencia con el diagnóstico de pubertad precoz central idiopática según criterios de la Guía de Práctica Clínica (GPC) de pubertad precoz aprobada oficialmente para su uso en el Hospital Cayetano Heredia 10.
Se excluyeron las niñas con pubertad precoz periférica, telarquia precoz idiopática, adrenarquia prematura, trastornos neuropsiquiátrico, enfermedades crónicas de compromiso sistémico, otras endocrinopatías, pacientes con cortico terapia prolongada y síndromes dismorfogenéticos claramente identificables.
Variables de estudio
Se definió pubertad precoz central cuando el inicio de la telarquia (estadio M2 de Tanner) ocurrió antes de los 8 años de edad cronológica asociado a progresión de otras características sexuales secundarias similar a la de pubertad normal 4,11, con una edad ósea mayor de un año respecto a la edad cronológica asociado a un criterio bioquímico (gonadotropinas plasmáticas basales con LH > 0,3 UI/L por inmunoquimioluminiscencia ultrasensible) 23,13 y/o ecográfico: longitud uterina mayor de 3,4 cm 14 y/o volumen ovárico mayor de 1,2 mL 15.
Se definió pubertad precoz central idiopática cuando la resonancia magnética de silla turca y región supraselar con contraste no evidenció lesión estructural relacionada al desarrollo de pubertad precoz. En caso de hallazgos compatibles con microadenoma hipofisiario se amplió la evaluación del eje hipotálamo hipofisiario.
Se definió como pubertad precoz central idiopática de inicio tardío a las niñas cuyo inicio de telarquia ocurrió después de los siete años de edad cronológica según anamnesis, lo cual es considerado según algunos autores como un subtipo de pubertad temprana, aunque sin consenso en su definición hasta la actualidad 16.
La evaluación antropométrica se realizó siguiendo estándares recomendados por la Organización Mundial de la Salud y se determinó el estado nutricional según curvas de índice masa corporal (IMC) del Center of Disease Control (CDC). Se evaluó el estadío Tanner con consentimiento de los padres y asentimiento de la niña por un endocrinólogo pediatra con experiencia.
La edad ósea fue determinada en una radiografía de la mano izquierda utilizando el atlas de Greulich y Pyle por dos endocrinólogos pediatras expertos en lectura de edad ósea. Se estimó la predicción de talla final adulta inicial (PTAI) mediante el método de Bayley Pinneau 17 antes del inicio de tratamiento y la predicción de talla adulta final (PTAF) con la última edad ósea tomada a la paciente con al menos 12 años de edad. Finalmente, se estimó la talla genética según el método de Tanner.
En las pacientes incluidas se estimó una edad ósea previa al tratamiento que permitió el cálculo de la predicción de talla final adulta al ingreso. Al confirmar el diagnóstico, se inició el tratamiento con análogos de GnRH (leuprorelina 7,5 mg o triptorelina 3,75 mg cada 28 días) y se realizó un control clínico mensual con evaluación de caracteres sexuales secundarios y monitoreo de efectos adversos, además de control con medición de gonadotrofinas y edad ósea cada seis meses.
Se decidió la culminación del tratamiento con una edad ósea estimada de al menos 12 años y se calculó la predicción de talla final adulta post tratamiento. Todos los pacientes incluidos fueron beneficiarios del Seguro Integral de Salud quien suministró la medicación y exámenes auxiliares según las recomendaciones de la Guía de Práctica Clínica 10.
Análisis estadístico
Se empleó estadística descriptiva con reporte de medidas tendencia central y dispersión según la normalidad de los datos, el cual se evaluó con la prueba de Shapiro Wilk. Se realizó t de student para muestras pareadas con el objetivo de comparar la predicción de talla inicial y talla final post tratamiento. Se consideró significativo p<0,05. Se empleó Microsoft Excel 2013® y Stata: Release 14 (College Station, TX: StataCorp LP. StataCorp. 2015®) para el análisis de los datos.
RESULTADOS
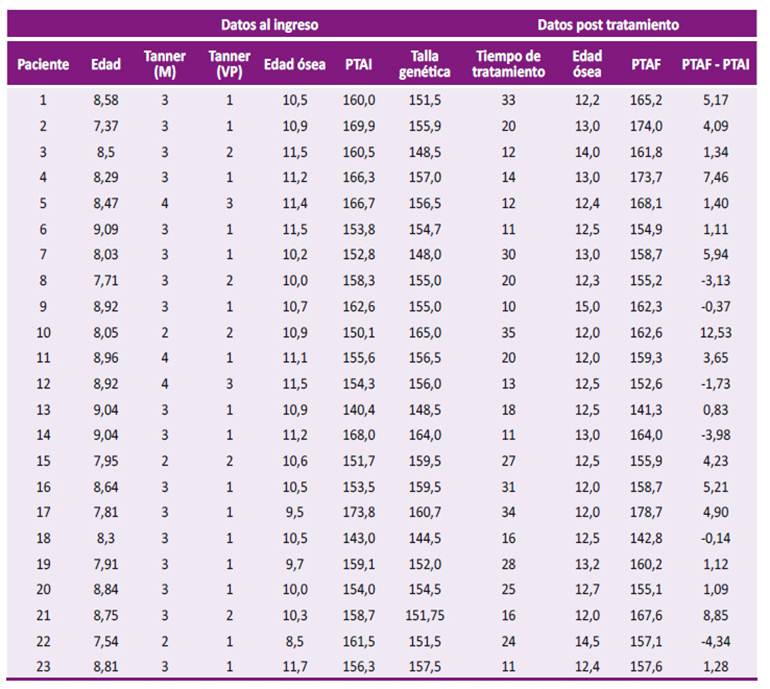
Se identificaron 38 niñas con pubertad precoz central idiopática durante el periodo de estudio; de las cuales, 15 fueron excluidas por no cumplir con el criterio de 12 años de edad ósea al momento de la recolección de la información. Por ende, se incluyeron 23 pacientes que recibieron tratamiento con análogos de GnRH por un promedio de tiempo de 20,5 ± 8,4 meses, con una edad ósea promedio alcanzada luego de finalizar el tratamiento de 12,8 ± 0,8 años (Tabla 1). Veintidós pacientes cumplieron el diagnóstico de pubertad precoz de inicio tardío. En un caso, la edad cronológica fue de 7,4 años y desarrollo puberal estadio Tanner 3 en su admisión.
Tabla 1 Características de la población de estudio previo al inicio de tratamiento con análogos de GnRH.
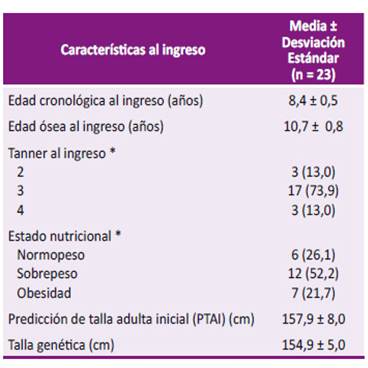
*Resultados expresados en categorías y porcentajes.
El estudio de resonancia magnética de hipófisis y región supraselar no reportó alteración estructural en 19 participantes. En cuatro niñas se evidenció incidentalomas: dos casos de quiste de Rathke y dos de microadenomas hipofisiarios. En ambos casos, no se encontró compromiso de otros ejes hipotálamo-hipofisiarios.
Se evidenció diferencias significativas entre la predicción de talla adulta final (PTAF) y la predicción de talla adulta final (PTAI), con una diferencia promedio de 2,5 ± 4,1 (p<0,01). Así mismo, se encontró significancia estadística en la diferencia entre PTAF y la talla genética en cm, con un promedio de 5,4 ± 7,9 (p<0,01).
En dos pacientes se reportó cefalea esporádica que no requirió tratamiento farmacológico y un paciente reportó sangrado vaginal luego de la primera dosis del análogo, sin descontinuación de tratamiento posterior.
La ganancia de talla fue de 2,5 ± 1,3 cm en niñas con edad ósea al ingreso menor a 10,5 años en comparación a 2,4 ± 1,2 cm en niñas con edad ósea de inicio mayor a 10,5 años. (p=0,99). La ganancia individual de talla, así como las características de las pacientes al ingreso del estudio, se detallan en la Tabla 2.
DISCUSIÓN
En nuestro estudio, que incluyó niñas entre 7 a 9 años de edad cronológica, encontramos un beneficio discreto de 2,7 cm en la predicción de la talla final adulta, lo cual ha sido reportado en otros estudios. Lazar et al. (2007) 18 publicaron un estudio realizado en 115 niñas con pubertad precoz central idiopática, de las cuales 60 tuvieron inicio de desarrollo puberal antes de los 8 años y 55 una pubertad temprana entre 8 y 9 años con progresión rápida definida como el cambio de estadio Tanner entre 2 a 3 en menos de un año y con una edad de suspensión del tratamiento similar a la nuestra de 12 a 12,5 años de edad ósea. Este investigador encontró una ganancia de talla de 7,2 ± 4,3 cm en niñas con edad entre 6 y 8 años, y menor en pacientes con pubertad temprana rápidamente progresiva de 5,5 ±2,3 cm, con reducción de talla final respecto a su talla genética, probablemente relacionado al cierre más rápido de las epífisis en diagnóstico tardío de pubertad precoz, a diferencia de la ganancia reportada en niñas con inicio de la pubertad antes de los 6 años en quienes se reporta una ganancia de talla mayor de 10,8 ± 2,5 cm.
Un estudio más reciente, realizado por Lee et al. (2018) 9, que incluyó pacientes con características de edad cronológica y ósea similar a la nuestra (8,2 ± 0,6 años y edad ósea de 10,3 ± 0,8 años), reporta el efecto del tratamiento con análogos de GnRH en 84 niñas con diagnóstico de pubertad precoz distribuidas en dos grupos: con inicio de tratamiento entre 6 y 8 años (n=23) y aquellas tratadas después de los 8 años (n=61). La ganancia de talla encontrada fue 3,9 ± 4,6 cm, sin diferencia significativa entre grupos, lo cual fue discretamente mayor a nuestros hallazgos; que podría ser atribuido a la diferencia en el estadio Tanner al diagnóstico y tiempo de tratamiento más prolongado. En el estudio de Lee, 56% tuvieron Tanner 2 al diagnóstico con un tiempo de tratamiento de 3,0 ± 0,7 años; a diferencia de nuestro estudio donde solo 13% tuvieron estadio Tanner 2 y el mayor porcentaje entre Tanner 3 y 4 con un tiempo de tratamiento menor (20,5 ± 8,4 meses), lo que podría estar relacionado a un diagnóstico tardío e inadecuada identificación de estas pacientes por pediatras o médicos generales en el primer nivel de atención.
Aunque existen resultados controversiales respecto al manejo de la pubertad precoz diagnosticada tardíamente, el consenso realizado en el 2009 para el uso de análogos de GnRH en pubertad precoz, sugiere que este tipo de tratamiento debe emplearse en niñas menores de 6 años, pero en caso de ser mayor de 6 años este tratamiento debería ser individualizado, dado que no existe suficiente evidencia científica que apoye el efecto del tratamiento 19. En el presente estudio, se observó que aquellas pacientes con mayor duración de tratamiento (mayor a 30 meses) presentaron una ganancia de talla superior de 6,7 cm en comparación al grupo de menor duración de tratamiento; lo que podría estar en relación al grupo de pacientes con menor avance de edad ósea durante el tratamiento.
Por otro lado, es importante resaltar que el 73,9% de nuestra población presentó exceso de peso en su admisión (52,2% sobrepeso y 21,7% obesidad), lo que podría influenciar en el cierre anticipado de las epífisis. Esto ha sido reportado previamente, observando en niños obesos un incremento de edad ósea probablemente como consecuencia de una hiperinsulinemia marcada, lo que podría contribuir a una maduración esquelética precoz 20. Así mismo, Chen et al. (2017), realizaron un estudio transversal de una población representativa que incluyó 17 620 niños entre 6 y 12 años, los cuales tuvieron una evaluación antropométrica, definiendo obesidad según criterios de OMS y evaluación de desarrollo sexual por un médico entrenado. Se encontró un desarrollo puberal antes de los 8 años y menarquia antes de los 10 años en 23,1% de las niñas, de las cuales 13,9% tuvieron obesidad. Aunque este hallazgo fue mucho menor que lo encontrado en nuestro estudio, se describió una edad media de inicio de desarrollo puberal de 8,8 años en niñas con IMC normal, 7,7 años en el grupo de sobrepeso y 7,1 años en el grupo de obesidad, sugiriendo un inicio de pubertad más temprano asociado al incremento del IMC 21.
Considerando estos hallazgos, este grupo de pacientes representa una población donde podría existir una duda diagnóstica, por lo cual requiere un seguimiento cercano de la progresión del desarrollo puberal para evaluar la necesidad de tratamiento, dado que incluso con edad ósea avanzada, estos pacientes podrían alcanzar una talla final adulta normal 19. Por lo cual, el desarrollo puberal antes de los 8 años de edad en niñas obesas, debería tener una evaluación especializada por un endocrinólogo pediatra quien determine la necesidad de tratamiento por la gran variabilidad en el avance de la edad ósea y la dificultad para la determinación del estadio Tanner en estas pacientes.
Otro hallazgo importante en nuestro estudio, es la marcada diferencia entre la edad ósea y la edad cronológica asociado a un estadio de desarrollo sexual avanzado encontrado en el 87% de nuestras pacientes con estadio Tanner 3 y 4 al diagnóstico, lo cual fue probablemente el parámetro principal para la indicación del inicio de tratamiento tardío, acorde a las recomendaciones de la actualización del consenso internacional reportado en el 2019, a pesar de que el beneficio a esta edad sigue siendo controversial 22. Aunque no existe un solo criterio para tomar la decisión de la suspensión de tratamiento, se recomienda no prolongar el tratamiento luego de 12,5 años, similar a los criterios empleados en nuestro estudio donde la suspensión de tratamiento se realizó al alcanzar 12 años de edad ósea 22.
Dentro de las limitaciones del estadio, cabe resaltar que es un estudio retrospectivo, donde se valoró el efecto de tratamiento con análogos de GnRH siguiendo las recomendaciones de la Guía de Práctica clínica aprobada en nuestra institución, pero no se calculó un tamaño muestral y podría existir una variabilidad entre los médicos tratantes que podría afectar el resultado final. Por otro lado, no se contó con un grupo control para evaluar el efecto del tratamiento, sin embargo, dado que los análogos de GnRH son de aplicación intramuscular, esto podría limitar la participación de niñas para el grupo placebo en estudios posteriores.
En conclusión, el uso de análogos de GnRH mostró un discreto beneficio sobre la predicción de talla final adulta en niñas con diagnóstico de pubertad precoz central de diagnóstico tardío. Por tal motivo, recomendamos que la decisión terapéutica en este grupo etario debe ser cuidadosamente definida en base a la edad de inicio de la telarquia, el avance de edad ósea, el efecto psicoemocional y el costo beneficio del tratamiento. Adicionalmente es necesario fortalecer el diagnóstico temprano por parte de los profesionales de la salud del primer nivel de atención para la identificación del desarrollo sexual normal según los criterios de Tanner, lo cual permitirá la referencia oportuna al especialista.