INTRODUCCIÓN
El Ministerio de Salud peruano (MINSA) ha publicado resoluciones ministeriales (RM) con el objetivo de normar el tratamiento de personas afectadas por COVID-19. Las RM emitidas hasta el 29 de abril de 2020 se resumen en la Tabla 1. Dichas RM brindan documentos técnicos «de aplicación obligatoria en las instituciones prestadoras de servicios de salud (IPRESS) públicas del Ministerio de Salud (…); del Seguro Social de Salud - EsSalud; de las Sanidades de las Fuerzas Amadas y de la Policía Nacional del Perú; así como de las IPRESS privadas» 1.
Tabla 1 Resoluciones Ministeriales sobre el tratamiento de personas afectadas por COVID-19 emitidas por el Ministerio de Salud del Perú hasta el 29 de abril de 2020.
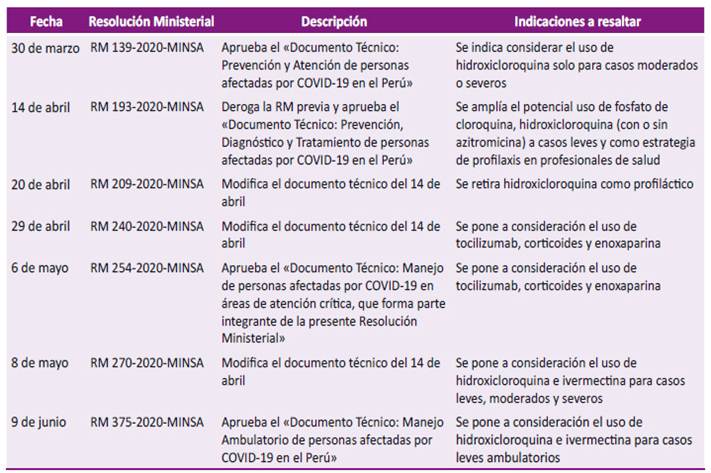
RM: Resolución Ministerial
Si bien puede resultar beneficioso estandarizar el manejo de la COVID-19 a nivel nacional, el beneficio que estos lineamientos brinden a nuestros pacientes dependerá del proceso que se siguió para la toma de estas decisiones. Sin embargo, la toma de decisiones en salud pocas veces es sencilla, pues se necesita una evaluación adecuada de beneficios, daños, costos, factibilidad, aceptabilidad e inequidad 2. Pero resulta aún más retadora en el contexto de la pandemia por la COVID-19, pues se dispone de poca evidencia científica, y la disponible mayormente es de mala calidad. De igual forma, se tiene alto riesgo de desabastecimiento de fármacos, existen intereses económicos (por ejemplo, la industria farmacéutica que posee el monopolio de ciertos medicamentos) 3, e incluso intereses políticos (por ejemplo, la hidroxicloroquina como arma política en Estados Unidos) 4.
Lamentablemente, los documentos técnicos del MINSA no son transparentes en aspectos como quiénes son sus autores, sus potenciales conflictos de interés, qué metodología han usado para llegar a sus decisiones, ni cuál fue la lógica para cada una de estas. Esta falta de transparencia resulta preocupante, pues impide entender y aplicar adecuadamente las recomendaciones brindadas.
Para ejemplificar las controversias que se pueden dar en cada recomendación, se discute brevemente algunas controversias referentes a la inclusión de fármacos específicos para pacientes con COVID-19 (modificadores de la enfermedad o antivirales) en las RM del MINSA para tratamiento de personas con COVID-19. Finalmente, se plantean recomendaciones sobre el proceso de toma de decisiones y su transparencia.
SOBRE LA INCLUSIÓN DE CIERTOS FÁRMACOS ESPECÍFICOS PARA PACIENTES CON COVID-19
Para este análisis, se obtuvo los costos de los fármacos del Observatorio de Productos Farmacéuticos del MINSA 5 y mostramos también lo que mencionan las guías de COVID-19 de la National Institutes of Health (NIH) 6 y de la Infectious Diseases Society of America (IDSA) 7. En la Tabla 2 se resumen la recomendación del MINSA, el costo, beneficio, daño, y se hace la comparación con otras GPC.
Tabla 2 Resumen de las recomendaciones del Ministerio de Salud del Perú sobre tocilizumab, corticoides, enoxaparina (según Resolución Ministerial 240-2020-MINSA), hidroxicloroquina e ivermectina (según Resolución Ministerial 270-2020-MINSA y 375-2020-MINSA).
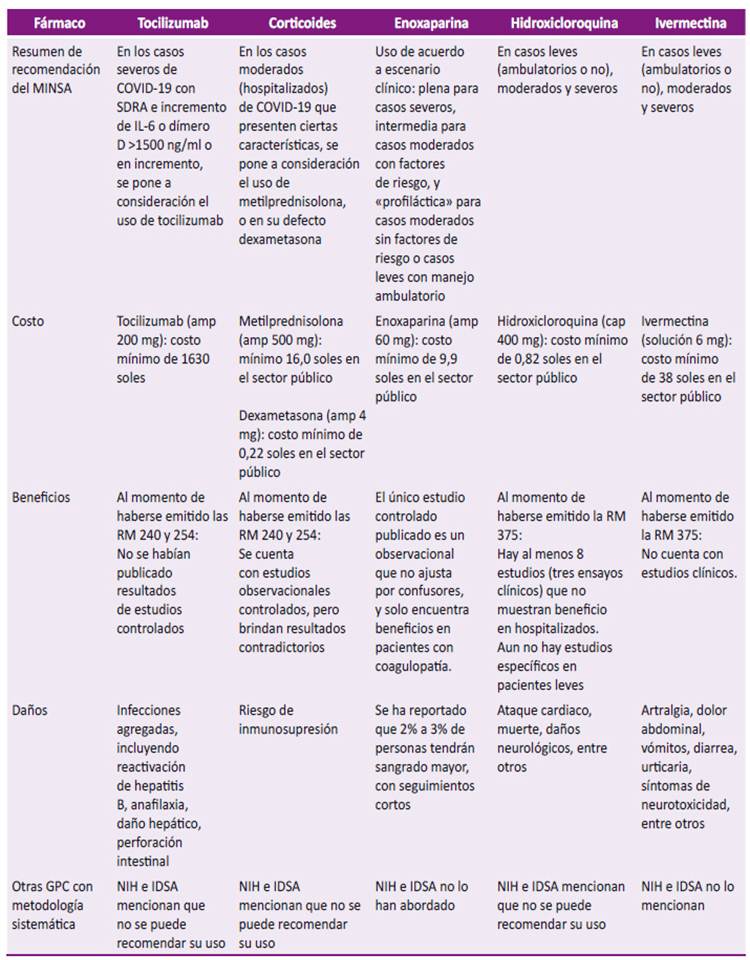
MINSA: Ministerio de Salud; SDRA: síndrome de distress respiratorio agudo; GPC: guías de práctica clínica; NIH: National Institutes of Health; IDSA: Infectious Diseases Society of America; RM: Resolución Ministerial; amp: ampolla.
Transparencia en documentos técnicos del MINSA A continuación, se exponen los beneficios y daños de los fármacos específicos para pacientes con COVID-19 (modificadores de la enfermedad o antivirales) que son recomendados en las RM del MINSA. Para motivos del presente artículo no se analizan artículos científicos en condición de pre print.
Tocilizumab
El tocilizumab es un anticuerpo monoclonal humanizado dirigido contra el receptor de la interleucina-6 (IL-6), usado para la artritis reumatoide 8. Roche tiene la patente de exclusividad de este fármaco hasta el año 2028 9.
Beneficios: A la fecha de emisión del documento del MINSA, no se habían publicado resultados de estudios controlados para pacientes con COVID-19.
Daños: se sabe que tiene efectos adversos, como aumentar el riesgo de infecciones agregadas 10. incluyendo reactivación de hepatitis B. Además, daño hepático y perforación intestinal 11.
Controversias: Se trata de un medicamento de alto precio, para el cual el Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud) realizó una revisión publicada el 18 de marzo, concluyendo que no se cuenta con evidencia robusta que permita sustentar una recomendación, y sugiere esperar para ello a los ensayos clínicos que culminan en mayo. Posteriormente, publica una actualización de esta revisión el 29 de abril manteniendo esta postura 12.
Corticoides
Los corticosteroides tienen efecto antiinflamatorio al inhibir una gran cantidad de genes proinflamatorios que codifican citocinas, quimiocinas, moléculas de adhesión celular y enzimas inflamatorias, y a menudo se usan como tratamiento auxiliar en casos de neumonía viral 13. Sin embargo, estos potenciales efectos fisiológicos también pueden inhibir la respuesta inmune y la eliminación de patógenos 14.
Beneficios: si bien al momento de la publicación de las RM del MINSA se contaba con estudios controlados publicados en pacientes con COVID-19, estos no ajustan por confusores tales como la severidad de la enfermedad y presentaron resultados contradictorios: algunos a favor de su uso 15,16, otros en contra 17, y otros no encontraron efecto a favor ni en contra 18,19. Asimismo, se tienen dos revisiones sistemáticas: una en SARS-CoV en general que encuentra tres ensayos clínicos aleatorizados de los cuales dos no encuentran efecto y uno no es concluyente 20, y otra en coronavirus en general (que incluye dos estudios en COVID-19) que tampoco encuentra beneficios 13.
Daños: la revisión realizada en coronavirus encuentra en sus meta-análisis mayor mortalidad, estancia hospitalaria, riesgo de infecciones bacterianas e hipokalemia en el grupo que recibió corticosteroides. Sin embargo, debido a que incluye estudios observacionales no ajustados, este resultado es muy propenso a presentar confusión 13. Asimismo, el uso de corticoides se ha asociado a mayor mortalidad en neumonías contra la influenza 21.
Controversias: a la fecha de publicación del lineamiento del MINSA en cuestión, la evidencia para beneficios es contradictoria, y los daños potenciales pueden ser peligrosos (disminución de la inmunidad que puede aumentar el riesgo de complicaciones o muerte). Asimismo, puesto que las dosis y duración del tratamiento fueron heterogéneos en los estudios analizados 22, no queda claro por qué en las RM del MINSA se eligió brindar pulsos de metilprednisolona.
Enoxaparina
La fisiopatología de la COVID-19 implica varios mecanismos directos e indirectos que promueven alteraciones en la coagulación 23, de manera que entre 25 y 69% de pacientes tienen eventos tromboembólicos 24 y entre el 20 y 30% hacen cuadros de embolia pulmonar aguda 25. Asimismo, los pacientes pueden presentar coagulación intravascular diseminada (CID), con lo cual su riesgo de mortalidad llega a 71% 23.
Beneficios: el único estudio controlado publicado es uno observacional cuyo análisis no fue ajustado por confusores, y encuentra menor mortalidad en quienes recibieron anticoagulantes 26 solo en el subgrupo de pacientes con coagulopatía o con dímero D >3 ug/mL, y no encuentra beneficios en los demás pacientes.
Daños: el principal evento adverso es el sangrado mayor, cuya frecuencia se estima en alrededor de 2 a 3% por anticoagulación con enoxaparina, aun usando este fármaco en periodos cortos 23,27,28. Este efecto podría ser especialmente importante a la luz de los reportes de hemorragia gastrointestinal en pacientes con COVID-19 29,30
Controversias: en pacientes con coagulopatía existe un estudio de evidencia limitada que sugiere un beneficio. Sin embargo, existe heterogeneidad respecto a los fármacos, dosis y esquemas especificados por los consensos 31-33, por lo cual es necesario justificar las dosis usadas y cuándo se pueden usar dosis alternativas. Por otro lado, no existe evidencia alguna de beneficios en pacientes ambulatorios, en quienes el sangrado mayor podría producir iatrogenias innecesarias 34.
Hidroxicloroquina
Hidroxicloroquina fue uno de los fármacos que se propusieron para el manejo de la COVID-19, debido a su efecto antiviral 35 e inmunomodulador 36.
Beneficios: al momento de emitirse las RM 270 y 375, ya se contaba con estudios que evaluaron el beneficio de la hidroxicloroquina en pacientes con COVID-19, incluyendo tres ensayos clínicos 19,37,38, que no encontraban beneficios clínicos.
Daños: reportes de vigilancia farmacológica han encontrado que, dar hidroxicloroquina a pacientes con COVID-19 se ha asociado a eventos adversos como alargamiento del segmento QT, arritmias ventriculares y muertes cardiovasculares 39.
Controversias: resulta controversial recetar un medicamento para COVID-19 cuando varios estudios muestran que no tiene beneficios, y se ha asociado con daños mortales. Además, el IETSI viene publicando revisiones rápidas periódicas (ocho a la fecha) en las que repetidamente ha informado sobre la falta de estudios que prueben su eficacia 40.
Ivermectina
Se ha hipotetizado que en humanos, la ivermectina puede inhibir la replicación de SARS-CoV-2, como se ha encontrado in vitro41.
Beneficios: no se cuentan con estudios clínicos publicados sobre este fármaco.
Daños: aunque los eventos adversos son relativamente raros, su uso se ha asociado a artralgia, dolor abdominal, vómitos, diarrea, urticaria, síntomas de neurotoxicidad, entre otros 42.
Controversias: resulta controversial recetar un medicamento sin estudios clínicos que evalúen sus beneficios, ni siquiera por evidencia indirecta; y que tiene potencial de causar ciertos daños. Además, el IETSI viene publicando revisiones rápidas periódicas (tres a la fecha) en las que repetidamente ha informado sobre la falta de estudios que prueben su eficacia 43.
PROCESO DE TOMA DE DECISIONES
Resulta importante realizar una toma de decisiones sistemática, reproducible, clara, transparente y que minimice el efecto de los potenciales conflictos de interés. Para ello, se necesitan: un esquema sistematizado para la toma de decisiones, una presentación amigable pero informativa del informe final, y una declaración de los conflictos de interés de los autores.
Esquema sistematizado
Existen diversas metodologías para la toma de decisiones, aunque suelen coincidir en los siguientes pasos:
1) Organizar un equipo multidisciplinario.
2) Plantear la pregunta que se quiere responder.
3) Realizar una búsqueda sistemática.
4) Evaluar la evidencia para balancear beneficios/daños.
5) Agregar otros factores (costos, factibilidad, aceptabilidad, equidad, etc.).
6) Tomar la decisión.
7) Definir el proceso de actualización total o parcial del documento (posiblemente involucrando una búsqueda activa de estudios).
Cada una de estas fases debe estar sistematizada, para lo cual se pueden usar herramientas multicriterio. Este proceso puede ser más o menos complejo de acuerdo a la factibilidad en recursos y tiempo que tenga el equipo. Asimismo, el resumen técnico de cómo se ha realizado cada paso debe ser publicado para que distintos actores sociales puedan evaluar el proceso y los posibles conflictos de interés involucrados.
Cabe resaltar que tomar decisiones en base a plausibilidad fisiopatológica (por razonamiento fisiopatológico; o por estudios in silico, in vitro o en modelos animales) por lo general no es razonable, pues la mayoría de fármacos con plausibilidad fisiopatológica finalmente causan más daños que beneficios. Un ejemplo de ello es que, de 100 fármacos con plausibilidad fisiopatológica que se comienzan a estudiar (ensayos clínicos fase 1), solo siete pasan a fase 4 44, de los cuales, varios se retiran luego de su comercialización por concluirse, en estudios posteriores, que causaban más daños que beneficios 45.
Asimismo, la experiencia clínica resulta muy limitada y suele ser engañosa para la toma de decisiones. Esto debido a que existen muchas variables que pueden alterar las observaciones (sesgo de memoria, falta de un grupo control adecuado, dificultad para recolectar sistemáticamente las variables necesarias, tendencia a reforzar ideas preconcebidas, etc.) 46.
Presentación del informe final
La directiva actual del MINSA solo menciona las recomendaciones finales sin mencionar mayor información sobre las intervenciones. Sin embargo, pone a consideración del juicio del médico tratante el uso de diversos medicamentos.
Para poder aplicar un juicio adecuado, los médicos necesitan entender los beneficios y daños potenciales de cada intervención. Sin embargo, es de esperar que, por la carga asistencial actual, tengan poco tiempo para revisar adecuadamente la evidencia y sacar sus propias conclusiones al respecto. Por ello, es necesario brindarles un resumen de los beneficios y daños y el razonamiento usado para incluir en los lineamientos cierto medicamento, de manera que los médicos puedan tomar la mejor decisión e individualizar el manejo cuando sea necesario.
Es importante presentar esta información de una manera sencilla, corta y amigable. Para lo cual, se pueden usar plataformas web, como lo usado por la guía del grupo de trabajo nacional para COVID-19 de Australia, que se actualiza periódicamente 47.
Al respecto, a manera de ejemplo, presentamos una comparación entre lo mencionado por el documento técnico del MINSA y por la guía de IDSA 7 (que tiene un formato informativo, pero a la vez amigable) sobre el uso de tocilizumab (Tabla 3).
Conflictos de interés
Es importante tener en cuenta los conflictos de interés y las presiones (tanto monetarias y no monetarias) que suelen actuar durante la elaboración de documentos normativos 48, por lo cual, es esperable que se presenten durante la elaboración de lineamientos para el tratamiento de pacientes con COVID-19, donde además, se están discutiendo medicamentos de alto costo. Esto resulta importante especialmente en sistemas de salud con recursos limitados que necesitan asignarlos juiciosamente.
Para ello, resulta útil recordar casos emblemáticos como el caso del oseltamivir durante la pandemia del H1N1 49. Este fármaco fue ofertado como una gran ayuda para todos los pacientes con influenza H1N1 y fue incluido por varias guías de práctica clínica. Pero cuando se obligó al laboratorio Roche, empresa encargada de su fabricación, a revelar los resultados de los estudios que avalaron su uso, se vio que no tenía eficacia en desenlaces críticos, por lo cual fue retirado de las guías 49, no sin antes significar un gasto millonario para muchos países incluido Perú 50.
Para limitar los conflictos de interés, es necesario ser transparente durante el proceso de toma de decisiones, así como revelar los potenciales conflictos de interés de los autores del documento y otras personas involucradas.
CONCLUSIÓN
El MINSA viene normando el manejo de pacientes con COVID-19 en Perú. Sin embargo, las directivas emitidas no son transparentes en el proceso de toma de decisiones. Esto resulta importante, especialmente en un tema en el cual aún no se cuenta con mucha evidencia de calidad como es el caso de la COVID-19. Invocamos a que se adopte un enfoque basado en evidencias que busque evitar causar daños innecesarios a la población e incurrir en asignaciones indebidas de los fondos públicos.
















