INTRODUCCIÓN
La enfermedad por COVID-19, causada por el SARS-CoV-2, ha generado una pandemia que causa importante morbilidad y mortalidad. El mayor impacto sintomático se da en los sistemas respiratorio y endotelial 1,2; sin embargo, las estructuras cardíacas también pueden ser afectadas por diferentes mecanismos como la hipoxemia, la lesión directa al miocardio y la cascada inflamatoria generalizada; incluso los daños cardíacos se han relacionado con elevados niveles de IL-6 3-5.
La endocarditis infecciosa (EI) en válvula nativa en paciente hospitalizado (EIAH) tiene una incidencia que va del 26 al 40 % 5-7, la válvula más comúnmente afectada es la aórtica seguida de la tricúspidea y los gérmenes causales más frecuentes son Staphylococcus y Enterococcus7. La edad avanzada, la colocación de catéteres vasculares, estar en hemodiálisis, la implantación de dispositivos y la cirugía cardiacos son factores de riesgo 8-11. La asociación de esta entidad con COVID-19 no se ha probado de forma contundente, sólo hay reportes de series de casos que sugieren causalidad.
Al permanecer estos pacientes en condiciones graves con daño endotelial y procesos de estasis sanguínea 12, la formación de trombos y procesos infecciosos secundarios 5 o el no uso de corticoides pueden generar lesiones infecciosas como trombosis y procesos de endocarditis 13.
A continuación, presentamos el caso de un paciente adulto diagnosticado de enfermedad por COVID-19 mediante RT- PCR, quién desarrolló una endocarditis infecciosa en válvula nativa sana adquirida en el hospital; una condición clínica poco frecuente relacionada al SARS-CoV-2.
REPORTE DE CASO
Varón de 53 años de edad, hipertenso sin tratamiento e hipotiroideo tratado con levotiroxina. Acudió a hospital por presentar tos no productiva y disnea progresiva de siete días de evolución, condición que requirió de ingreso hospitalario. Se solicitó radiografía de tórax que mostró un infiltrado alveolo intersticial bilateral difuso (Figura 1) y se tomó una muestra para RT-PCR de SARS-CoV-2 de hisopado nasofaríngeo que fue positivo.
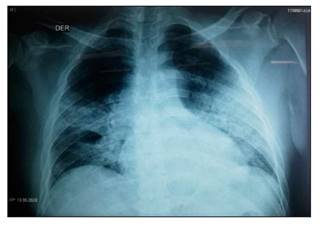
Figura 1 Radiografía anteroposterior de tórax tomada al ingreso del paciente en la que se observa infiltrado alveolo intersticial bibasal difuso, periférico y paracadíaco, que sugiere COVID-19.
En el servicio de urgencias se intensificaron sus síntomas y 72 horas posteriores a su ingreso presentó taquipnea de hasta 45 respiraciones por minuto, uso de musculatura respiratoria accesoria e hipoxemia severa (saturación de oxígeno de 65 % con fracción inspirada de O2 de 100 %); requirió soporte ventilatorio mecánico invasivo con altos requerimientos de oxígeno y presentó choque distributivo de componente séptico y farmacológico con requerimiento de soporte vasoactivo a base de norepinefrina. Fue admitido en la unidad de terapia intensiva luego de seis días de su hospitalización.
Ingresó a terapia intensiva, sedado profundamente, acoplado a la ventilación mecánica invasiva, con altos requerimientos ventilatorios: tuvo una saturación de oxígeno de 86% con presión positiva al final de la espiración (PEEP) de 12 cm H2O y fracción inspiratoria de oxígeno de 80 %. Superó el choque, se retiraron los fármacos vasoactivos y no tuvo otros fallos orgánicos asociados.
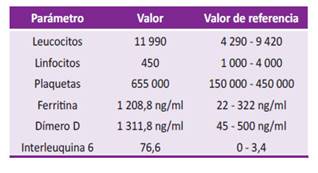
En la analítica, como hallazgos relevantes se encontró leucocitosis, linfopenia, trombocitosis y elevación de ferritina, dímero D e IL-6 (ver Tabla 1). Debido a estos valores alterados, se sumó a la terapéutica anticoagulación con heparina de bajo peso molecular (enoxaparina) a dosis de 1 /mg /kg cada 12 horas y corticoide a base de metilprednisolona a dosis de 1 mg /kg /peso por cinco días (peso del paciente 75 kg).
Tabla 1 Valores analíticos de paciente de 53 años con COVID-19 y sospecha de endocarditis bacteriana en válvula nativa en paciente hospitalizado
Su evolución fue tórpida. A los cinco días de hospitalización presentó fiebre intermitente e hipoxemia severa pese concentraciones altas de O2; aparecieron secreciones purulentas moderadas en cantidad y aumentaron los leucocitos de forma persistente (se mantuvieron sobre 20 000 x mm3 durante 48 horas). Ante la negatividad de posible foco urinario, se consideró infección pulmonar bacteriana por gérmenes multidrogorresistentes, se tomaron cultivos y se amplió cobertura antibiótica a polimixina E más aminoglucósido, enfocados a la epidemiología de la Unidad que en ese momento reportaba bacilos gramnegativos productores de KPC con concentración mínima inhibitoria (CIM) para carbapenémicos mayor a 16. Se realizó ecocardiografía sin evidencia de anomalías cardiacas.
Cuatro días después se recibieron los resultados de los hemocultivos, en los que se reportó crecimiento de Staphylococcus hominis resistente a la meticilina, por lo que se indicó vancomicina y se suspendieron los antibióticos previos.
La evolución fue mala. Persistió la fiebre en picos y, tras 10 días de hospitalización, se solicitó nuevo ecocardiograma, en donde se observó vegetación en la válvula aórtica sin signos de insuficiencia valvular u otra anomalía cardiaca (Figura 2). Se catalogó como una endocarditis infecciosa adquirida en el hospital y se añadió gentamicina al esquema antibiótico.
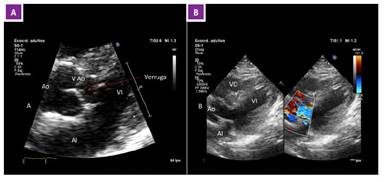
Figura 2 Ecocardiograma transtorácico. A. Vista de eje largo con registro de válvula aórtica e imagen de verruga endocárdica en cara ventricular de velo no coronario (flecha roja). Video 1: Eje paraesternal largo, acercamiento a nivel de válvula aórtica, tracto de salida del ventrículo izquierdo. Luego de círculo transiluminado se puede verificar la presencia de una verruga en la válvula no coronariana de la válvula aórtica, la misma que se atribuye a la presencia de infección por estafilococo en paciente infectado por COVID-19. B. Eje largo con doppler color en tracto de salida del VI, no hay insuficiencia valvular significativa. Video 2: Ventana paraesternal eje largo, invertida, tomada desde el lado derecho. Muestra doppler con la presencia de aliasing sin evidencia de una disfunción severa; se muestra ligera regurgitación tranaórtica, posiblemente funcional, que no llega a generar insuficiencia valvular.
Luego de 15 días de hospitalización, la condición del paciente empeoró, persistió hipoxemia severa refractaria y falleció.
DISCUSIÓN
Se presenta la evolución de un paciente positivo para SARS- CoV-2, quien desarrolló una bacteriemia por Staphylococcus hominis y ante episodios febriles persistentes se diagnosticó con ecocardiografía una EIAH.
Nuestro paciente tuvo factores de riesgo para endocarditis infecciosa potenciados por la presencia de infección por COVID-19, hemocultivos positivos y fiebre persistente que nos enfocaron en esa patología, y el uso de la imagen ecocardiográfica permitió realizar el diagnóstico oportuno y preciso. Como demuestra Castillo et al.14, aplicando los criterios de Duke, el 38% de 154 casos con EI en válvula nativa no tenían conocimiento de enfermedad cardiaca predisponente. Otro estudio que valoró los datos ecocardiográficos en pacientes con EI encontró que, de 328 pacientes estudiados, el 26% desarrolló vegetaciones en estructuras aparentemente sanas 7.
La epidemiología de la EIAH ha cambiado en los últimos 20 años 14, la injuria al endocardio puede ocurrir más frecuentemente en el corazón izquierdo relacionado a su exposición y a la relativa alta presión (6), la válvula nativa sin enfermedad previa más afectada suele ser la válvula aórtica y los gérmenes más relacionados son los Staphylococcus7. Nuestro paciente tuvo hemocultivo positivo para Staphylococcus hominis y afectación valvular aórtica.
El mecanismo fisiopatológico para el desarrollo de EI en válvula nativa sana no es claro; no obstante, una válvula sana no está libre de regurgitación o flujos turbulentos que pueden caracterizar a pacientes hipertensos con pobre control (dato encontrado en nuestro paciente), pacientes con enfermedad renal crónica o apnea del sueño 7.
La EIAH es una complicación grave de aplicar procedimientos médicos invasivos 8,9 en pacientes hospitalizados por más de 48 horas y que cumplen los criterios de Duke modificados 15,16. El diagnóstico microbiológico se basa en la positividad de los hemocultivos. Las ecocardiografías transtorácica y transesofágica son pilares diagnósticos y su indicación depende de que haya una sospecha clínica o microbiológica 17. Nuestro paciente tenía una hospitalización prolongada, cuadro clínico sugestivo, hemocultivos positivos y ecocardiografía transtorácica realizada en dos momentos por un cardiólogo experto, con negatividad en el primer examen y positividad en el segundo, lo que enmarcó el caso como una EIAH. La relación de EIAH y COVID-19 no fue establecida.
La endotelitis asociada al COVID-19 es una situación clínica cada vez más frecuente, presente tanto en necropsias 18,19 como en pacientes hospitalizados 20-22. Puede afectar a la microcirculación mediante la generación de microtrombos (microclots) por inmunotrombosis o enfermedad tromboembólica venosa y arterial con prevalencia moderada a baja. El dímero D es un monitor de baja certeza en estas alteraciones 2.
No existen estudios grandes que demuestren una asociación entre EIAH y COVID 19. No obstante, la serie de casos reportada por Ramos et al.23 encontró una incidencia que iba de 0,25 a dos pacientes por mes; dos de los cuatro casos recibieron metilprednisolona y tocilizumab y todos ellos tenían el antecedente de uso de catéter venoso central y catéteres urinarios. Los gérmenes hallados fueron Enterococcus faecalis (dos casos), Staphylococcus aureus y Candida albicans (un caso cada uno). La fuente de infección fue identificada en tres casos y se correspondió con catéteres vasculares. Nuestro paciente tuvo factores de riesgo propios de un paciente en estado crítico para desarrollar bacteriemia; tuvo catéter venoso central y catéter urinario, recibió metilprednisolona y presentó una ecocardiografía previa negativa para EI y luego positiva. Creemos que a nivel de la válvula aórtica se habría producido un trombo que se contaminó posteriormente por una bacteriemia asociada a uso de catéter. Este argumento se fortalece en el hecho que en los pacientes contiguos se identificó el mismo germen en hemocultivos y trombosis vascular adyacente al catéter venoso central.
El germen que se aisló en este paciente y en otros hospitalizados en la misma unidad fue un miembro del género bacteriano Staphylococcus, tipo coagulasa negativo, que comúnmente es un comensal inofensivo en la piel humana y puede causar infección en pacientes con sistemas inmunitarios debilitados, como en el caso de nuestro paciente; aunque no es reportado como causante típico de endocarditis 24,25.
En resumen, la relación entre EIAH y COVID-19 podría existir, situación que generaría un incremento en la morbilidad y la mortalidad. Por ello, para reducir el riesgo de esta infección grave, es necesario protocolizar el cuidado de catéteres vasculares y urinarios e individualizar mediante un análisis riesgo beneficio el uso apropiado de corticosteroides y otros inmunomoduladores.















