INTRODUCCIÓN
La diarrea asociada a Clostridioides (también conocido como Clostridium) difficile (DACD) es una infección frecuente asociada a la atención de salud en países desarrollados 1,2, por lo menos 30% de los casos de diarrea nosocomial están asociados a C. difficile y de 50% a 70% cuando se consideran los casos de colitis asociada a antibióticos 3,4). C. difficile es una bacteria anaerobia productora de toxinas A y B con efecto enterotóxico y citotóxico a nivel del colon; y que ha ocasionado los brotes epidémicos en Canadá, Estados Unidos y Europa por la aparición de la cepa hipervirulenta ribotipo 027 productora de toxina binaria 4,5. El espectro clínico de la infección por C. difficile (ICD) puede incluir desde portadores y formas leves de diarrea, hasta las manifestaciones clínicas más graves como la colitis pseudomembranosa con complicaciones que ponen en riesgo la vida del paciente 5,6.
Varios métodos de laboratorio pueden ser usados para el diagnóstico de la bacteria, sus toxinas o el daño celular que ocasiona 3-6. El ensayo de citotoxicidad celular inicialmente fue considerada el «estándar de oro» por su alta especificidad, pero estudios recientes han demostrado que el cultivo toxigénico tiene mayor sensibilidad convirtiéndose en el método de referencia; sin embargo, es una técnica de alto costo, baja disponibilidad y tiempo dependiente 3,5,6. Actualmente no existe ninguna técnica que por sí misma pueda ser lo suficientemente costo-eficaz como para ser usada como método único en el diagnóstico de ICD, esto ha dado lugar al diseño de varios algoritmos diagnósticos que aprovechan lo mejor de cada una de las pruebas 2,7,8.
En un hospital de referencia que atiende patologías de alta complejidad como el nuestro, los pacientes reciben tratamiento antibiótico de amplio espectro que es reconocido como el principal factor de riesgo de DACD 6,9. Hay poca información en nuestro medio del comportamiento de esta bacteria 10, por lo que este estudio aportará datos orientados a fines preventivos.
El objetivo fue determinar la frecuencia, incidencia y describir las características clínico-epidemiológicas de los pacientes que desarrollan diarrea nosocomial por C. difficile en el Hospital Nacional Edgardo Rebagliati Martins (HNERM) en el período abril a julio de 2019.
MATERIALES Y MÉTODOS
Diseño y lugar de estudio
El presente es un estudio observacional y transversal, realizado en el HNERM que es un establecimiento de tercer nivel de la Seguridad Social del Perú y cuenta con 1505 camas de hospitalización. Para fines del estudio se incluyeron los servicios de medicina interna, hematología, gastroenterología, unidades de cuidados intensivos e intermedios, y en la emergencia se incluyeron las salas de observación y cuidados críticos.
Población de estudio y muestra
Fueron los pacientes mayores de 18 años que desarrollaron diarrea nosocomial definida como tres o más deposiciones no formadas en 24 horas luego de 48 horas de admisión hospitalaria 11 entre abril a julio del 2019. Considerando una frecuencia de ICD del 10% y un error muestral de ± 7,5%, el tamaño mínimo requerido para el estudio fue de 77 pacientes 12. Se excluyeron aquéllos con diagnóstico de colitis fulminante (íleo paralítico, megacolon tóxico y perforación intestinal) o con sangrado digestivo manifiesto, sin acceso a una muestra de heces. También se excluyeron pacientes con antecedente de colectomía total o uso de laxantes en las últimas 48 horas. Otros criterios de exclusión fueron los datos incompletos de las principales variables del estudio y que no acepte participar en la investigación.
Procedimientos
Enrolamiento de pacientes
Los pacientes se enrolaron a través de una vigilancia epidemiológica activa de diarrea nosocomial. Se revisaba las historias clínicas para determinar si eran sujetos elegibles y previa firma del consentimiento informado se obtenían las muestras de heces.
Envío de las muestras al laboratorio
Las muestras de heces se recolectaron en frascos estériles indicando la fecha y hora, procediendo a refrigerarlo entre 2 y 8 °C antes de las dos horas en el servicio de Microbiología del HNERM para su posterior envío a un laboratorio privado según las normas de bioseguridad, siendo procesadas de acuerdo a las instrucciones del fabricante.
Algoritmo diagnóstico
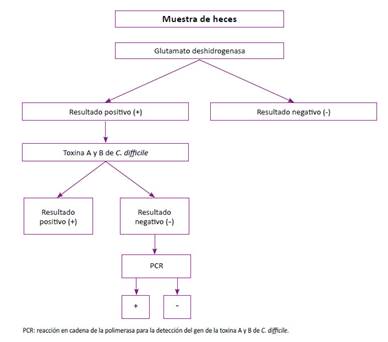
El diagnóstico de DACD se realizó con un algoritmo secuencial de tres pasos (Figura 1) 7. La primera prueba en heces fue la detección de la enzima glutamato deshidrogenasa (GDH) con el RIDA® QUICK Clostridium difficile GDH que es un ensayo inmunocromatográfico lateral flow para la determinación cualitativa de la GDH específica del C. difficile. Tiene sensibilidad y especificidad relativa de 100% y 98% respectivamente. La segunda fue la prueba de toxina fecal empleando el RIDA® SCREEN C. difficile A y B que es un ensayo inmunoenzimático para la determinación cualitativa de las toxinas A y B del C. difficile sin diferenciarlas. Según el fabricante en comparación con el análisis de citotoxicidad con neutralización, la sensibilidad es de 89,7% y la especificidad de 96,8%. Por último, la tercera prueba fueron los ensayos moleculares de amplificación de ácidos nucleicos (NAAT, siglas en inglés) utilizando el ensayo Xpert® C. difficile, que se realiza en los Gene Xpert® Instrument systems, que es una prueba diagnóstica cualitativa in vitro que emplea la técnica de reacción en cadena de la polimerasa (PCR, siglas en inglés) automática y en tiempo real para la detección de la toxina producida por C. difficile. Detecta secuencias de los genes de la toxina B (tcdB) y la toxina binaria (cdt), y del gen tcdC con la deleción nt 117 (tcdCΔ117), que presumiblemente corresponda a cepas 027/ NAP1/BI. En caso que la prueba de GDH y toxina fecal tuvieran resultados discordantes (primera positiva y segunda negativa) se realizaba la técnica de PCR. Los pacientes con resultado negativo de GDH fueron considerados negativos para la infección y no se les realizó pruebas adicionales. Se analizó solo una muestra de heces por paciente con sospecha de ICD.
Ficha de datos
Los datos de las variables se obtuvieron a partir de la historia clínica. Se clasificó a los pacientes como positivos o negativos a ICD según los resultados del algoritmo diagnóstico. La clasificación del episodio inicial de diarrea fue: a) no grave: leucocitos <15 000 µ/L y creatinina sérica <1,5 mg/dL; b) grave: leucocitos >15 000 µ/L o creatinina sérica <1,5 mg/dL; y c) fulminante: presencia de hipotensión, choque o megacolon tóxico 7,9. Los días de terapia antibiótica se calcularon como la suma del registro de días de uso de cada antibiótico por paciente 13.
Estadística hospitalaria
Los días de estancia hospitalaria, número de egresos, número de pacientes-día por servicio y fechas de altas se obtuvieron del intranet de la institución. En el caso de defunción se consideró la fecha del deceso como alta del paciente.
Análisis estadístico
Los datos se ingresaron en una base de datos en Excel 2010 (Microsoft Office para Windows XP) y posteriormente se procesaron con el paquete estadístico Stata v.14.6 (STATA Corp. LP, College Station, TX, EUA). Las pruebas comprendieron estadística descriptiva (medias, desviación estándar, medianas y rango intercuartílico, según corresponda). La frecuencia de diarrea nosocomial por C. difficile se expresó en porcentaje con intervalos de confianza al 95% y se estimó la densidad de incidencia de DACD como el número de casos positivos por 10 000 pacientes-día en el mismo período de tiempo por servicio hospitalario 14. La mortalidad general en la población de estudio fue el porcentaje de fallecidos durante la hospitalización. Debido al pequeño tamaño de muestra no fue posible establecer diferencias estadísticas entre grupos con ICD y sin infección.
Aspectos éticos
Se respetó la confidencialidad de la información y los principios éticos de la Declaración de Helsinki. El proyecto fue aprobado por el Comité de Ética del hospital (Carta N° 249-CE-GHNERM-GRPR- ESSALUD-2018), y recibió financiamiento por EsSalud por lo que las pruebas del algoritmo diagnóstico fueron gratuitas para los participantes. Los resultados fueron enviados a la investigadora principal y comunicados inmediatamente al médico así como al paciente, para que reciban tratamiento durante la hospitalización en caso de ser positivo.
RESULTADOS
En el período de abril a julio de 2019 se registraron un total de 4518 egresos de los servicios de medicina interna, cuidados intensivos, hematología y gastroenterología del HNERM. Hubo 110 pacientes elegibles con diarrea nosocomial, pero se excluyeron dos pacientes por datos incompletos en los registros del uso de antibióticos y uno porque rechazó participar en el estudio, por lo que la población de estudio fueron 107.
Del total de 107 muestras de heces, 21 (21/107, 19,6%) fueron positivas con GDH, de ellas 17 (17/21, 81%) fueron negativas para toxina fecal, siendo analizadas con PCR y las cuatro restantes (4/21, 19%) fueron positivas para toxina confirmando la infección. De las 17 muestras con resultados discordantes, es decir GDH positivo y toxina negativo, 8 (8/17, 47,1%) fueron positivos con PCR, confirmándose el diagnóstico de ICD. Solo una prueba de PCR fue NAP1-BI-027 positivo. Finalmente, 12 fueron consideradas positivas basadas en el algoritmo diagnóstico, por lo que la frecuencia de diarrea nosocomial por C. difficile en nuestro estudio fue 11,2% (IC 95%: 6,44-18,82).
En la Tabla 1 se muestra la distribución de la población de estudio y el número de casos de DACD por servicio hospitalario. En cuidados intensivos ningún paciente tuvo DACD y en gastroenterología hubo un paciente con diagnóstico de pancreatitis aguda grave procedente de cuidados intensivos que desarrolló DACD. La mayor densidad de incidencia fue en hematología (5,54 x 10 000 pacientes-día).
Tabla 1 Distribución de pacientes con diarrea asociada a C. difficile (DACD) en un hospital de referencia entre abril a julio 2019.
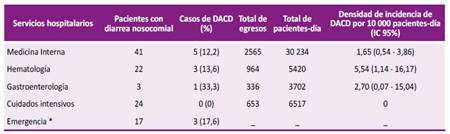
* Emergencia: no tiene indicador de número de egresos ni pacientes-día en la estadística hospitalaria.
Las características clínicas y el uso de medicamentos de la población de estudio se describen en la Tabla 2. El diagnóstico de ingreso en el 52,4% fue por insuficiencia respiratoria aguda y septicemia. La mayoría (72,9%) tuvo al menos una comorbilidad, siendo la asociación más frecuente hipertensión arterial con diabetes mellitus o enfermedad renal crónica. De los antibióticos indicados previo a la diarrea, las lincosaminas (clindamicina) estuvieron en el 16,8% y las fluoroquinolonas en el 7,5% de los pacientes. Los días de terapia antibiótica fueron 16 (RIC 9-36). La mediana del tiempo de la estancia hospitalaria hasta el alta o defunción fueron 35 días (RIC 23-57) y de la estancia antes del episodio de diarrea fueron 19 días (RIC 11-29).
Tabla 2 Características clínicas y uso de medicamentos en la población de estudio (n = 107).
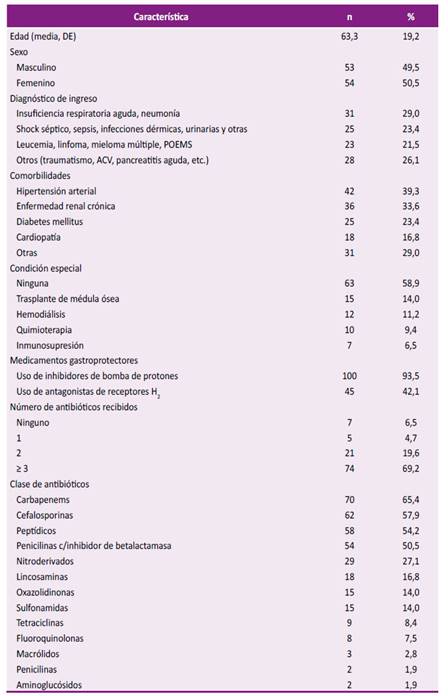
DE: desviación estándar; ACV: accidente cerebro vascular; POEMS: síndrome de POEMS.
En la Tabla 3 se presentan las características clínicas y epidemiológicas de los pacientes con DACD. Siete (58,3%) fueron varones y la edad fue 64,58 ± 21,34 años. Tres pacientes tuvieron diagnóstico de leucemia aguda y uno recibió trasplante de médula ósea. La mayoría (8/12, 66,7%) tuvo un episodio inicial no grave de enfermedad, y el 33,3% tuvo un episodio grave. De los cuatro pacientes con toxina fecal positiva, dos tuvieron episodios iniciales graves de diarrea; mientras que de los ocho pacientes con diagnósticos confirmados con PCR positivos, seis tuvieron episodios no graves de enfermedad incluyendo el paciente con ribotipo 027. Solo una paciente refirió tener el antecedente de ICD en el 2016, con resultado actual negativo; por lo que ninguno de los pacientes con resultado positivo fue considerado una recurrencia de enfermedad. El principal antibiótico indicado previo a la diarrea fue el meropenem (9/12, 75%). Solo dos pacientes recibieron clindamicina y ninguno fluoroquinolonas. Los días de terapia antibiótica fueron 17,5 (RIC 11-53,75). La mediana de la estancia hospitalaria hasta el alta o defunción fueron 37 días (RIC 22,5-59) y de la estancia antes del episodio de diarrea fueron 24,5 días (RIC 15,5-43).
Tabla 3 Características clínicas y epidemiológicas de los pacientes con diarrea nosocomial por C. difficile.
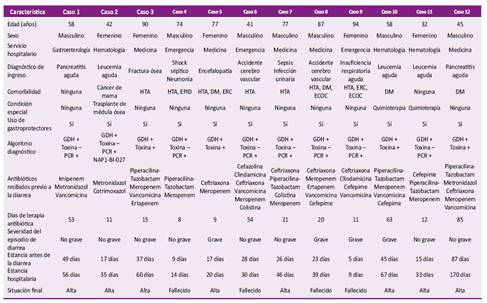
HTA: hipertensión arterial; DM: diabetes mellitus; ERC: enfermedad renal crónica; ECOC: enfermedad coronaria crónica; EPID: enfermedad pulmonar intersticial difusa; GDH: glutamato deshidrogenasa; Toxina: toxina A y B del C. difficile; PCR: reacción en cadena de la polimerasa.
La mortalidad general fue 28% (30/107) (IC 95%: 20,27-37,38) y cuatro fallecidos tuvieron DACD. Se observó que 37,5% (9/24) de pacientes con diarrea nosocomial en cuidados intensivos fallecieron, pero ninguno tuvo ICD.
DISCUSIÓN
La frecuencia de DACD varía entre países de altos y medianos ingresos económicos, lo que refleja distintos contextos epidemiológicos 15. En Latinoamérica se ha reportado con una metodología diversa una prevalencia de DACD de 26% a 40% entre el 2000 al 2010 4,16. En el Perú, García et al.10 en el 2007 hallaron una frecuencia de 35,2% de diarrea nosocomial por
C. difficile en un hospital público de tercer nivel en Lima con el método de ELISA para identificar toxinas A y B, mientras que Panduro-Meza et al.17 recientemente en el 2017 reportaron una frecuencia de 11,8% utilizando PCR multiplex en pacientes adultos con diarrea intrahospitalaria, en un estudio que incluyó servicios de medicina interna y emergencia del mismo hospital.
En el presente estudio se encontró una frecuencia de 11,2% que es menor comparada al estudio previo del 2007 en otro hospital de Lima 10. Estos hallazgos pueden explicarse por la población de estudio, el método diagnóstico empleado, y principalmente por el uso racional de antibióticos que es el principal factor de riesgo de DACD 17.
En nuestro hospital no hay criterios institucionales pre- establecidos para el envío de muestras de heces para el estudio de ICD, y en estos casos se recomienda utilizar un algoritmo de varios pasos que combinen dos o tres pruebas que puedan aumentar la precisión diagnóstica 2,7,18. Existen diferentes algoritmos, la Sociedad Europea de Microbiología y Enfermedades Infecciosas (ESCMID) 8 recomienda dos pasos (inicial con GDH o NAAT y luego toxina fecal), y una prueba adicional con NAAT solo en el caso de GDH positivo en el cribado y la toxina fecal negativa; mientras que la Sociedad de Salud Epidemiológica de Norteamérica y la Sociedad de Enfermedades Infecciosas de América en los Estados Unidos de América (SHEA/ IDSA) 7 consideran que se puede utilizar solo NAAT si la selección del paciente ha sido adecuada. Consideramos que el algoritmo de tres pasos permite la detección oportuna de ICD, y reduce en casi 50% el uso de pruebas moleculares 19, con la consiguiente disminución de costos y sobrediagnóstico que representa realizar solo PCR 18,20.
La interpretación de los resultados depende de la prevalencia de ICD y del cuadro clínico 2. Si un paciente tiene un resultado inicial de GDH negativo con una evolución favorable de la diarrea sin tratamiento específico, es poco probable que sea un falso negativo dada la baja frecuencia de ICD en nuestro medio 16. Por otro lado, para algunos autores no es suficiente para el diagnóstico de DACD un resultado de PCR positivo si es que la toxina fue negativa 21, ya que solo habría enfermedad por el daño intestinal producido por las toxinas 22,23. Sin embargo, las pruebas comerciales de inmunoensayo enzimático para la detección de toxina fecal tienen sensibilidad subóptima 20, en cambio un PCR positivo en un paciente sintomático indicaría ICD o en menor probabilidad una colonización 2,20,24.
La presencia de toxinas de C. difficile en muestra de heces se correlaciona con mayor severidad y duración de la diarrea 20,23, pero cuando el diagnóstico se realiza solo con pruebas moleculares generalmente los casos no son graves, esto se explicaría por un rol de colonización del C. difficile, por lo que el muestreo en pacientes con diarrea clínicamente significativa es importante para evitar un sobrediagnóstico de ICD 24. Un paciente con la cepa NAP1/BI/027 tuvo un episodio no grave de enfermedad. Oñate-Gutiérrez et al. 25 no hallaron relación de la cepa NAP1- 027 con cuadros graves de diarrea. Es probable que esta cepa no sea el factor más importante en la mayoría de casos no epidémicos 6.
La edad mayor de 65 años se ha descrito como factor de riesgo de DACD 26. El deterioro de la inmunidad por el envejecimiento, junto a las comorbilidades confiere mayor susceptibilidad a la ICD 6,27. Si existe alguna condición especial el riesgo es mayor, como el observado en tres pacientes con DACD que tuvieron diagnóstico de leucemia aguda, por lo que la inmunosupresión asociada al trasplante de médula ósea y los regímenes de acondicionamiento que ocasionan mucositis pueden favorecer el desarrollo de DACD 28. En el servicio de hematología, la aparición de diarrea probablemente se relaciona con el efecto de altas dosis de quimioterapia en la mucosa gastrointestinal y el efecto de antibióticos de amplio espectro para la profilaxis y tratamiento de neutropenia 29. En cambio, la diarrea nosocomial en pacientes críticos de cuidados intensivos no asociada a C. difficile podría señalar al intestino como posible blanco de disfunción orgánica múltiple en sepsis 30.
La ICD puede ocasionar una variedad de cuadros clínicos con distintos grados de severidad desde diarrea leve hasta una colitis fulminante que es una forma severa que se presenta en el 3-10% de los pacientes 5,6. En nuestro estudio el 66,7% de los pacientes tuvieron un episodio inicial no grave de DACD, lo que es similar a otros trabajos que encontraron que la diarrea fue leve en el 44,7% y 56,7% 27,31. Si bien se excluyeron pacientes con megacolon tóxico o íleo paralítico, hay un reporte de baja incidencia de colitis pseudomembranosa por C. difficile en población adulta peruana, por lo que es posible que la microbiota intestinal de nuestra población juegue un rol contra esta bacteria 32.
La DACD se asocia al consumo previo de antibióticos hasta en el 96% de casos, siendo el principal factor de riesgo 6,26,27. La mayoría de pacientes tuvieron diagnóstico de septicemia y neumonía que aumenta el riesgo de ICD por la mayor necesidad de antibióticos 33. Los antibióticos asociados con la infección son aquéllos con menor absorción oral o que tienen excreción hepatobiliar, ya que producen mayor alteración de la flora intestinal y de la composición biliar fecal que favorece la germinación del C. difficile, como la ampicilina, amoxicilina y ácido clavulánico, clindamicina y cefalosporinas 2,13,26,27. Martínez-Rodríguez et al. (34) encontraron en pacientes con DACD que el antibiótico más frecuente como monoterapia fue ceftriaxona (50%), seguido de meropenem (20,6%); mientras que nosotros observamos que meropenem fue el principal antibiótico indicado previo al desarrollo de DACD.
En el HNERM existe una política de vigilancia de antibióticos (stewarshid) y las experiencias internacionales han señalado el impacto del uso racional de antibióticos en la disminución de las tasas de incidencia de C. difficile9,13. En Norteamérica la disminución del uso de fluoroquinolonas en 30% en los hospitales, ha contribuido a reducir la ICD nosocomial en 19%, especialmente por la cepa NAP1/BI/027 35. En el Perú, García et al. 22 hallaron en 50 pacientes con DACD que los antibióticos más usados fueron la clindamicina (76%) y ciprofloxacino (52%); mientras que en nuestro estudio solo dos pacientes recibieron clindamicina y ninguno fluoroquinolonas, lo que puede explicar la menor frecuencia de DACD en nuestra institución.
Las esporas del C. difficile se transmiten desde objetos y superficies contaminadas a través de las manos del personal sanitario 21,27. García et al. 10 sugieren una mayor transmisión de C. difficile en salas hospitalarias con dos a seis camas. Nuestro hospital tiene habitaciones con uno a dos camas y solo tuvimos una paciente que desarrolló DACD en habitación compartida con otra paciente con diagnóstico confirmado de ICD. Es por ello que una medida preventiva eficaz es la higiene de manos, que junto con la detección precoz de casos, aislamiento y descontaminación, forman parte de los programas más exitosos en el control de la ICD 6,13.
La mortalidad se asocia con sepsis y falla multiorgánica en la mayoría de pacientes con DACD, por lo cual esta infección confiere un riesgo de mortalidad adicional en sujetos que ya tienen un mayor riesgo para una evolución desfavorable 36. El fallecimiento de los pacientes con DACD se debería a las complicaciones de las comorbilidades y al estado crítico subyacente 31.
Una de las ventajas del presente estudio fue la aplicación de un algoritmo diagnóstico de laboratorio como señalan las guías de práctica clínica 7,20, permitiendo la detección oportuna de pacientes con DACD. Nuestro hospital dispone solamente de una prueba que es un ensayo inmunocromatográfico para la identificación cualitativa de las toxinas A y B, y las muestras no se procesan siempre en las dos horas luego de su recolección, con lo que disminuye aún más la rentabilidad diagnóstica debido a la proteólisis de las toxinas, pudiéndose interpretar los resultados como falsos negativos 2. En nuestro estudio, las muestras fecales tuvieron una adecuada conservación (2 a 8 °C) en las primeras 48-72 horas, y rápido procesamiento en un laboratorio privado. Otra ventaja fue la vigilancia epidemiológica activa de diarrea nosocomial, ya que el diagnóstico microbiológico generalmente se realiza a demanda del médico, con la posibilidad de infradiagnóstico por una falta de sospecha clínica hasta en el 30% de los pacientes 2,6,19.
La principal limitación del estudio fue el tamaño de muestra que no permitió realizar un análisis de los factores asociados a la DACD y el corto tiempo de ejecución reduce el impacto de la investigación con respecto a las densidades de incidencia. Hubo pocos casos de ICD pero creemos que esto puede ser atribuido a la baja frecuencia de la enfermedad en nuestro medio. Una desventaja del algoritmo diagnóstico fue que las muestras con resultados de GDH y toxina positivas, ya no fueron analizadas con pruebas moleculares, por lo que se carece de información sobre la prevalencia del ribotipo 027 en el hospital 35.
En conclusión la frecuencia de diarrea nosocomial por C. difficile en la población de estudio de nuestra institución fue menor a lo reportado en años anteriores en otro hospital público de Lima. El uso racional de antibióticos y las medidas preventivas explicarían la menor frecuencia de DACD. En nuestro país no se conoce la diversidad de ribotipos de C. difficile que circulan en el ámbito hospitalario, por lo que sugerimos incluir el uso de pruebas moleculares en pacientes con diarrea nosocomial.