INTRODUCCIÓN
La enfermedad renal crónica (ERC) consiste en una pérdida progresiva de la función renal a través de cinco estadios 1,2. Se estima que la ERC afecta del 8% a 16% de la población y tanto la incidencia como mortalidad van en aumento a nivel mundial 3. En el Perú, un estudio realizado en Lima y Tumbes reportó que la prevalencia de ERC fue de 20,7% y 12,9%, respectivamente, en el año 2011 4.
La tendencia creciente tanto en la incidencia como en la mortalidad de la ERC, dan cuenta que a pesar de contar con estrategias terapéuticas para su manejo, los pacientes son captados en estadios avanzados 5. Ante ello, se ha propuesto que la evaluación y el manejo oportuno y adecuado de los casos de ERC, principalmente en estadios tempranos (1 al 3), reducirían la morbimortalidad y las complicaciones de esta condición, evitando que esta enfermedad impacte en la calidad de vida de las personas que la padecen 1,5,6. En consecuencia, el Seguro Social de Salud (EsSalud) priorizó la elaboración de la presente guía de práctica clínica (GPC) para establecer lineamientos basados en evidencia y gestionar de la mejor manera los procesos y procedimientos asistenciales de la presente condición.
Por ello, la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud) elaboró la guía de práctica clínica (GPC) basada en evidencias para el tamizaje, diagnóstico y manejo de la ERC en estadios 1 al 3, cuyas recomendaciones (Tabla 1) serán aplicadas por profesionales de la salud en EsSalud. El presente artículo es un resumen de dicha GPC.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión completa, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud. gob.pe/ietsi/guias_pract_clini.html). En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía (GEG): Se conformó un GEG, que incluyó expertos en la metodología de la elaboración de GPC y médicos especialistas clínicos.
Formulación de preguntas: En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 8 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome).
Búsqueda y selección de la evidencia: Entre 2018 y 2019, para cada pregunta PICO se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC sobre el tema) (Material suplementario 1). Cuando se encontraron RS de calidad aceptable, se escogió una RS para la toma de decisiones en base al puntaje obtenido con el instrumento A MeaSurement Tool to Assess systematic Reviews (AMSTAR-2), la fecha en la que realizó la búsqueda sistemática, y el número de estudios incluidos. Dicha RS fue actualizada cuando el GEG lo consideró necesario (mediante búsquedas sistemáticas en PubMed). Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios (mediante búsquedas sistemáticas en PubMed, Scopus, y/o Biblioteca Regional de Medicina (BIREME)).
Evaluación de la certeza de la evidencia: La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja, o muy baja (Tabla 2). Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) 7 y se usaron tablas de perfiles de evidencias de GRADE (Material suplementario 2). Finalmente, se le asignó a la pregunta PICO el nivel de certeza más bajo alcanzado por alguno de los desenlaces críticos.
Formulación de las recomendaciones: El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 2) usando la metodología GRADE (8). Para ello, se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud, 4) Factibilidad de las opciones en los establecimientos de salud de EsSalud, y 5) Uso de recursos. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple. Asimismo, el GEG formuló puntos de buenas prácticas clínicas (BPC), usualmente en base a su experiencia clínica.
Revisión por expertos externos: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión in-extenso fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos).
El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC: La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 58-IETSI-ESSALUD-2020.
Actualización de la GPC: La presente GPC tiene una vigencia de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
RECOMENDACIONES
La presente GPC abordó 8 preguntas clínicas, con relación a cinco temas: tamizaje, diagnóstico y estadiaje; manejo farmacológico y no farmacológico; monitoreo; y criterios de referencia. En base a dichas preguntas se formularon 8 recomendaciones (4 recomendaciones fuertes y 4 recomendaciones condicionales), 29 puntos de buena práctica clínica, y 3 flujogramas (ver Tabla 1 y Figuras 1, 2 y 3).
La presente GPC se enfoca en los pacientes con ERC en estadios 1 al 3. En esta etapa de la enfermedad, el médico debe decidir cuándo realizar el tamizaje de ERC durante la atención primaria (pregunta 1), además de elegir la forma de estimar la función renal (mediante ecuaciones para calcular la tasa de filtración glomerular estimada (TFGe)) y daño renal (mediante métodos para la detección de albuminuria) (pregunta 2 y 3), definir el manejo no farmacológico y farmacológico adecuado (preguntas 4 al 7), y finalmente determinar los criterios de referencia al especialista en nefrología (pregunta 8).
A continuación, se expondrán las recomendaciones para cada pregunta clínica, así como un resumen del razonamiento seguido para llegar a cada recomendación. No se incluyó la justificación de los puntos de BPC, la cual se puede leer en el documento in-extenso.
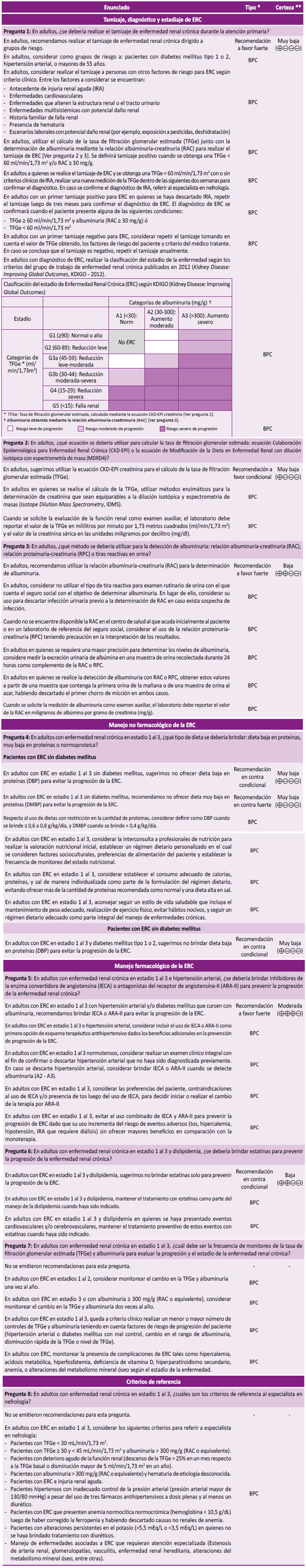
Pregunta 1: En adultos, ¿se debería realizar el tamizaje de enfermedad renal crónica durante la atención primaria?
Evidencia: Se consideró el tamizaje dirigido a grupos de riesgo 1. En la búsqueda sistemática no se encontró ninguna RS ni ensayo clínico aleatorizado (ECA) que hayan evaluado el efecto de realizar el tamizaje de ERC. Adicionalmente, se contó con una revisión narrativa y una GPC que proporcionaron información para la evaluación de los daños del tamizaje 1,9.
Beneficios: Si bien no se encontró estudios que hayan evaluado los beneficios de realizar tamizajes de ERC versus no realizarlos, se consideró que un tamizaje podría captar tempranamente a un importante número de pacientes con ERC en quienes se podría intervenir para evitar la progresión de la enfermedad. Para ello, se tomó en cuenta que la prevalencia de ERC en Perú se ha descrito en 20,7% para una localidad urbana de Lima y 12,9% para una localidad semiurbana de Tumbes en el año 2011 4.
Daños: Podría presentarse estigmatización o ansiedad del paciente producto del diagnóstico, aparición de eventos adversos por el uso de procedimientos diagnósticos o tratamientos innecesarios, y el uso inadecuado de recursos en caso de falsos positivos de ERC 1,9.
Costos: Si bien el tamizaje de ERC es una intervención costosa a nivel poblacional, el GEG consideró que los costos de la hemodiálisis (calculados en 44 414 soles por año), que es una de las terapias de reemplazo renal para el último estadio de la enfermedad, podrían ser mayores al costo de tamizaje y tratamiento temprano, en especial en población de riesgo. Esto está respaldado por un estudio de costo-efectividad realizado en EsSalud que aún no ha sido publicado.
Balance y fuerza: El tamizaje tiene un potencial importante para detectar pacientes con ERC y a través de un manejo adecuado, evitar su progresión a la necesidad de terapia de reemplazo renal; lo cual en opinión del GEG podría superar los daños y costos potenciales. Por ello, se emitió una recomendación a favor de realizar el tamizaje dirigido a esta población. A pesar de que la certeza de evidencia fue muy baja y no se evaluaron desenlaces importantes para los pacientes como incidencia de terapia de reemplazo renal o complicaciones de ERC, el GEG consideró que el potencial beneficio de disminuir el riesgo de requerimiento de hemodiálisis sería muy importantes en nuestro contexto. Por ello, la fuerza de la recomendación fue fuerte.
Pregunta 2: En adultos, ¿qué ecuación se debería utilizar para calcular la tasa de filtración glomerular estimada: ecuación Colaboración Epidemiológica para Enfermedad Renal Crónica (CKD-EPI) o la ecuación de Modificación de la Dieta en Enfermedad Renal con dilución isotópica con espectrometría de masa (MDRD4)?
Evidencia: Se decidió evaluar las ecuaciones MDRD4-IDMS (10) y CKD-EPI 11 específicamente en población latinoamericana ya que el rendimiento de las ecuaciones podría variar según etnia 12,13. En la búsqueda sistemática no se encontró ninguna RS para dicha población. Por ello, se realizó una RS de novo para población latinoamericana y se metaanalizaron los seis estudios encontrados.
Hallazgos: Para el punto de corte < 60 ml/min/1,73 m2, las ecuaciones CKD-EPI creatinina y MDRD4-IDMS obtuvieron similar sensibilidad y especificidad. Sin embargo, CKD-EPI tuvo menor sesgo y mayor exactitud (P30), por lo que clasificaría mejor la severidad de la ERC.
Recomendación: Debido a las ventajas observadas con el uso de la ecuación CKD-EPI y por no involucrar mayor costo se emitió una recomendación a favor del uso de la ecuación CKD-EPI creatinina.
Fuerza: La certeza de la evidencia fue de baja a muy baja y no se contaba con información directa acerca del impacto de la capacidad diagnóstica de ambas ecuaciones en desenlaces clínicos. Por ello, la fuerza de la recomendación fue condicional.
Pregunta 3: En adultos, ¿qué método se debería utilizar para la detección de albuminuria: relación albuminuria-creatinuria (RAC), relación proteinuria-creatinuria (RPC) o tiras reactivas en orina?
Evidencia: Se consideró definir y clasificar la magnitud de la albuminuria en base a los criterios propuestos por KDIGO en 2012 2; establecer como gold standard a la albuminuria en 24 horas o a la RAC; y se tomó en cuenta que el seguro social solo cuenta con tiras reactivas para examen rutinario de orina 14.
En la búsqueda sistemática sólo se encontró una RS que realizó metaanálisis (MA) para evaluar la capacidad diagnóstica de la RAC 15. Se actualizó la búsqueda y MA de dicha RS con tres estudios encontrados 16-18. En contraste, no se encontraron RS que hayan abordado la pregunta de interés para RPC ni para el tipo de tira reactiva con el que cuenta EsSalud, por lo cual solo se formularon puntos de BPC.
Hallazgos: La sensibilidad y especificidad de la RAC fue 0,87 (IC 95%: 0,82 - 0,91) y 0,88 (IC 95%: 0,85 - 0,91), respectivamente.
Recomendación: La RAC tendría una adecuada capacidad de identificar y, por consiguiente, tratar oportunamente a personas con ERC en estadios iniciales. En base a ello, se emitió una recomendación a favor del uso de RAC.
Fuerza: Si bien la certeza de evidencia fue baja para el uso de RAC, el GEG consideró que su uso podría devenir en beneficios y ahorros a futuro ya que permitiría detectar pacientes en estadios tempranos y que su implementación es factible. Por ello, la fuerza de la recomendación fue fuerte.
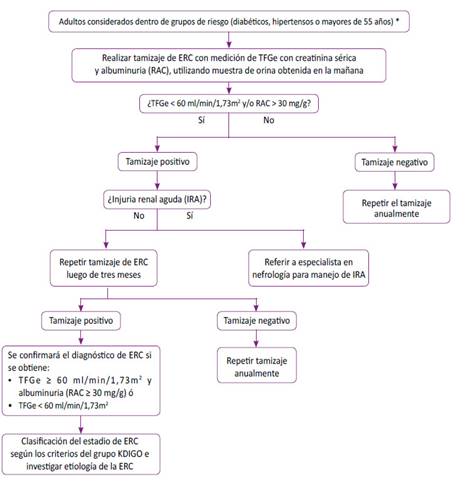
Pregunta 4: En adultos con enfermedad renal crónica en estadio 1 al 3, ¿qué tipo de dieta se debería brindar: dieta baja en proteínas (DBP), muy baja en proteínas (DMBP) o normoproteica?
Pregunta 4.1: Pacientes con ERC sin diabetes mellitus
Evidencia: En la búsqueda sistemática se encontraron tres RS, de las cuales se eligió las de mejor calidad (19, 20). La población incluida en las RS fue heterogénea e incluyó participantes con ERC en estadio 3 y 4.
Beneficios: La mortalidad, incidencia de ERC estadio 5, y el cambio en la TFGe fueron similares entre aquellos que recibieron DBP y aquellos con dieta normoproteica 19. La incidencia de ERC estadio 5 fue menor en aquellos que recibieron DMBP en comparación con aquellos que recibieron DBP o dieta normoproteica 19, y la proteinuria fue menor con el uso de DBP o DMBP en comparación con la dieta normoproteica 20.
Daños: El peso al final de la intervención fue menor en los pacientes que recibieron DBP 19. El GEG consideró que esta disminución de peso sería a expensas de la disminución de masa muscular. No se han reportado la comparación de DMBP y dieta normoproteica.
Balance y fuerza para el uso de DBP: Se consideró que el beneficio en términos de disminución de proteinuria no fue clínicamente significativo, en tanto que existe un potencial daño por disminución de peso a expensas de masa muscular, y mayores costos debido a que un porcentaje de pacientes requerirán suplementos de cetoácidos y aminoácidos. Por ello, se emitió una recomendación en contra. Debido a que la certeza de evidencia fue muy baja, la fuerza de la recomendación fue condicional.
Balance y fuerza para el uso de DMBP: A pesar de que la DMBP podría reducir la incidencia de ERC estadio 5, este beneficio fue observado en pacientes con estadio 4 de la ERC y el GEG consideró que este beneficio podría no estar presente en estadios tempranos. Además, podría esperarse una disminución de peso como se reportó para el uso de DBP, y devendría en costos adicionales por requerir suplementación. Por ello, se emitió una recomendación en contra. Si bien la certeza de evidencia fue baja, los posibles beneficios no superarían los potenciales daños y costos. Por ello, la fuerza de la recomendación fue fuerte.
Pregunta 4.2: Pacientes con ERC y diabetes mellitus
Evidencia: En la búsqueda sistemática se encontraron dos RS, de las cuales se eligió la de mejor calidad 21. En la RS elegida, la población estuvo compuesta por adultos con un promedio de TFGe de 62 ml/min/1,73 m2.
Beneficios: El cambio de la TFGe fue similar entre aquellos con DBP y con dieta normoproteica, tanto en pacientes con ERC y DM tipo 1 ó 2 (21).
Daños: Se consideraron los resultados encontrados en pacientes con ERC sin DM como evidencia indirecta 19.
Balance y fuerza: No hubo beneficio de la DBP para disminuir la progresión de ERC, por el contrario, podría causar disminución de peso a expensas de la masa muscular, e incrementaría los costos en caso de añadir suplementos nutricionales. Por ello, se emitió una recomendación en contra. Debido a que la certeza de evidencia fue muy baja, la fuerza de la recomendación fue condicional.
Pregunta 5: En adultos con enfermedad renal crónica en estadio 1 al 3 e hipertensión arterial, ¿se debería brindar inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas del receptor de angiotensina-II (ARA-II) para prevenir la progresión de la enfermedad renal crónica?
Evidencia: En la búsqueda sistemática se encontraron cinco RS, de las cuales se eligieron las dos de mejor calidad. Una incluyó a adultos con ERC, hipertensión arterial (HTA) y DM, la mayoría de los cuales cursaba con albuminuria 22; mientras que la otra evaluó adultos hipertensos con ERC sin DM (23).
Beneficios: Aquellos que utilizaron IECA o ARA-II tuvieron menor riesgo de progresión a ERC estadio 5 22,23 y albuminuria 23 en comparación con los que recibieron placebo o no tratamiento. Además, en pacientes con ERC, HTA y DM que cursaron con albuminuria, aquellos que utilizaron estos antihipertensivos tuvieron menor mortalidad 22.
Daños: Aquellos que utilizaron IECA o ARA-II tuvieron mayor riesgo de hipercalemia pero similar riesgo de hipotensión, en comparación con aquellos que utilizaron placebo o no tratamiento 23.
Balance y fuerza: Los beneficios encontrados fueron considerados estrategias críticas para disminuir el riesgo de progresión de la ERC y se consideró que los daños eran manejables. Por ello, se emitió una recomendación a favor del uso de IECA o ARA-II para evitar la progresión de la ERC. Debido a que la certeza de evidencia fue moderada, la fuerza de la recomendación fue fuerte.
Pregunta 6: En adultos con enfermedad renal crónica en estadio 1 al 3 y dislipidemia, ¿se debería brindar estatinas para prevenir la progresión de la enfermedad renal crónica?
Evidencia: En la búsqueda sistemática se encontraron seis RS, de las cuales se eligió la de mejor calidad y que proporcionara evidencia en pacientes con estadios iniciales de ERC 24.
Adicionalmente, se tomó en cuenta una RS que proporcionó evidencia indirecta para la evaluación de los daños del uso de estatinas en diferentes tipos de patologías 25.
Beneficios: En aquellos que usaron estatinas la albuminuria y la disminución de la TFGe anual fueron menores en comparación con quienes recibieron placebo. Sin embargo, la progresión a ERC estadio 5 fue similar 24.
Daños: El uso de estatinas incrementó el riesgo de miositis y desarrollo de DM. Si bien la mayoría de los estudios no encontraron diferencia en la frecuencia de miopatías y rabdomiólisis, se describe que de 10% a 25% de pacientes que usa estatinas reporta problemas musculares 25.
Balance y fuerza: Los beneficios fueron considerados pequeños ya que las estatinas no tuvieron efecto en la progresión a ERC estadio 5; y los hallazgos en albuminuria y disminución de la TFGe no serían clínicamente importantes. Los daños fueron considerados pequeños, pero podrían tener mayor impacto en grupos vulnerables. Por ello, se emitió una recomendación en contra de brindar estatinas para prevenir la progresión de ERC. Puesto que la certeza de evidencia fue baja, la fuerza de la recomendación fue condicional.
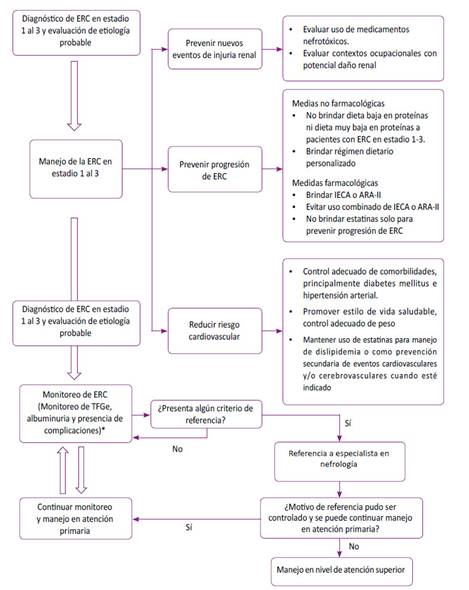
Pregunta 7: En adultos con enfermedad renal crónica en estadio 1 al 3, ¿cuál debe ser la frecuencia de monitoreo de la tasa de filtración glomerular estimada (TFGe) y albuminuria para evaluar la progresión y el estadio de la enfermedad renal crónica?
Evidencia: Se consideró que la albuminuria y TFGe son los parámetros más utilizados para realizar el monitoreo de la ERC 6,26. En la búsqueda sistemática no se encontraron RS que aborden la pregunta. Sin embargo, se encontraron cinco RS que proporcionaban información respecto a las frecuencias en los que evaluaba la albuminuria y TFGe en estudios previos 27-31. Por tal motivo, se optó por emitir puntos de BPC considerando las frecuencias más usadas y la factibilidad en nuestro contexto (Tabla 1).
Pregunta 8: En adultos con enfermedad renal crónica en estadio 1 al 3, ¿cuáles son los criterios de referencia al especialista en nefrología?
Evidencia: No se encontraron RS que aborden la pregunta. Se consideró que diversas GPC basan los criterios de referencia en consensos de expertos y se decidió evaluar dicha información. Para tal fin, se tenía conocimiento de dos revisiones narrativas (6, 26) que resumían las recomendaciones de GPC para el monitoreo de ERC. Se tomaron en cuenta dichas revisiones narrativas para formular puntos de BPC (Tabla 1).