INTRODUCCIÓN
La leucemia linfoblástica aguda (LLA) es una neoplasia hematológica maligna caracterizada por el aumento de linfoblastos en la sangre y médula ósea 1, que afecta principalmente a la población pediátrica y a adultos mayores de 60 años 2.
A nivel mundial, se estima que la incidencia de LLA oscila entre 1 a 5 casos por 100 000 habitantes 3, siendo mayor en la región de las Américas, sobre todo en Costa Rica y Colombia 4. En Perú, se han reportado 1679 casos de neoplasias hematológicas en la población pediátrica, entre los años 2006 y 2011, con una incidencia esperada en niños menores de 14 años de 270 a 360 nuevos casos por año 5,6.
El acceso a intervenciones eficaces y el uso óptimo de los protocolos de tratamiento ha permitido elevar la supervivencia de pacientes con LLA hasta alrededor del 70 al 100% 7,8, principalmente debido a una disminución de la mortalidad asociada a infecciones y recaídas 9,10. Sin embargo, en Perú se han reportado supervivencias menores 11,12.
Debido a la importancia de este tema en términos de mortalidad y morbilidad, la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud) elaboró la guía de práctica clínica (GPC) basada en evidencias para el diagnóstico y manejo de LLA, cuyas recomendaciones (Tabla 1) serán aplicadas por profesionales de la salud en EsSalud. El presente artículo es un resumen de dicha GPC.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión “in extenso”, la cual puede descargarse de la página web del IETSI de EsSalud ( http://www. essalud.gob.pe/ietsi/guias_pract_clini.html). En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía local (GEG)
Se conformó un GEG, que incluyó metodólogos y médicos especialistas en hematología.
Formulación de preguntas
En concordancia con los objetivos y alcances de esta GPC, el GEG formuló ocho preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
Búsqueda y selección de la evidencia
Para cada pregunta PICO, se realizó la búsqueda y selección de la evidencia. Para ello, durante el 2019 se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y CENTRAL) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC sobre el tema) (Material Suplementario 1). Cuando se encontraron RS de calidad aceptable, se escogió una RS para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia
La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja, o muy baja (Tabla 2). Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) 13 y se usaron tablas de perfiles de evidencias de GRADE (Material Suplementario 2). Finalmente, se le asignó a cada recomendación el nivel de certeza más bajo alcanzado por sus desenlaces críticos.
Formulación de las recomendaciones
El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 2) usando la metodología GRADE 14. Para ello, se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, Aceptabilidad por parte de los profesionales de salud, 4) Factibilidad de las opciones en los establecimientos de salud de EsSalud, y 5) Uso de recursos. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple. Asimismo, el GEG formuló puntos de buenas prácticas clínicas (BPC), usualmente en base a su experiencia clínica.
Revisión por expertos externos
La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión in-extenso fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para mejorar las recomendaciones finales.
Aprobación de la GPC
La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 23-DGPCFyT-IETSI-ESSALUD-2019
Actualización de la GPC
La presente GPC tiene una validez de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
RECOMENDACIONES
La presente GPC abordó ocho preguntas clínicas, en relación con cuatro temas: diagnóstico, medidas generales, manejo quimioterápico de LLA, y trasplante. En base a dichas preguntas se formuló cinco recomendaciones (tres recomendaciones fuertes y dos recomendaciones condicionales), 20 puntos de buena práctica clínica, y tres flujogramas (Tabla 1 y Figuras 1-3).
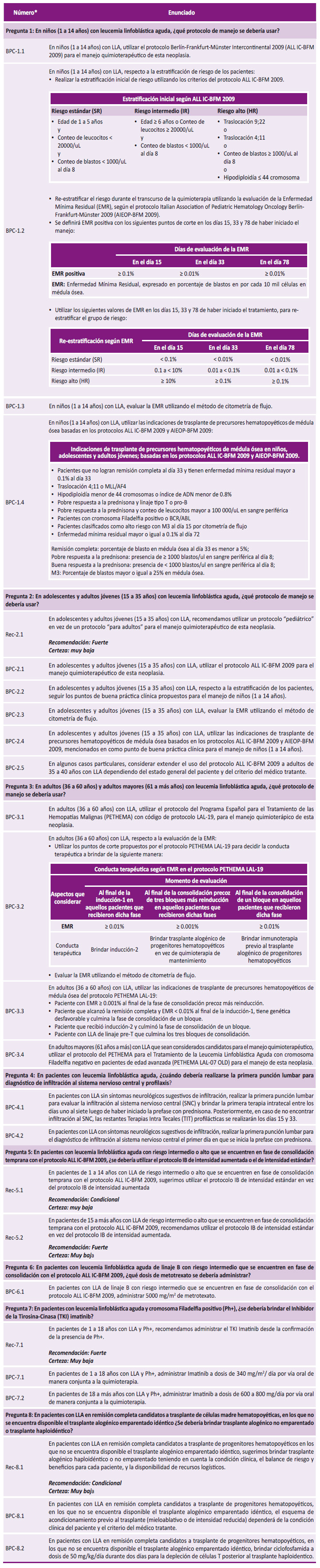
AYA: adolescentes y adultos jóvenes; ALL IC-BFM 2009: Protocolo Berlín-Frankfurt-Münster Intercontinental 2009; PETHEMA: Programa Español para el Tratamiento de las Hemopatías Malignas; MO: médula ósea; EMR: Enfermedad mínima residual. *En algunos casos se puede considerar extender el uso del protocolo ALL IC-BFM 2009 a adultos mayores de 35 años, dependiendo del estado general del paciente y del criterio del médico tratante.
Figura 1 Flujograma de elección del protocolo para el manejo quimioterapéutico según grupo etario
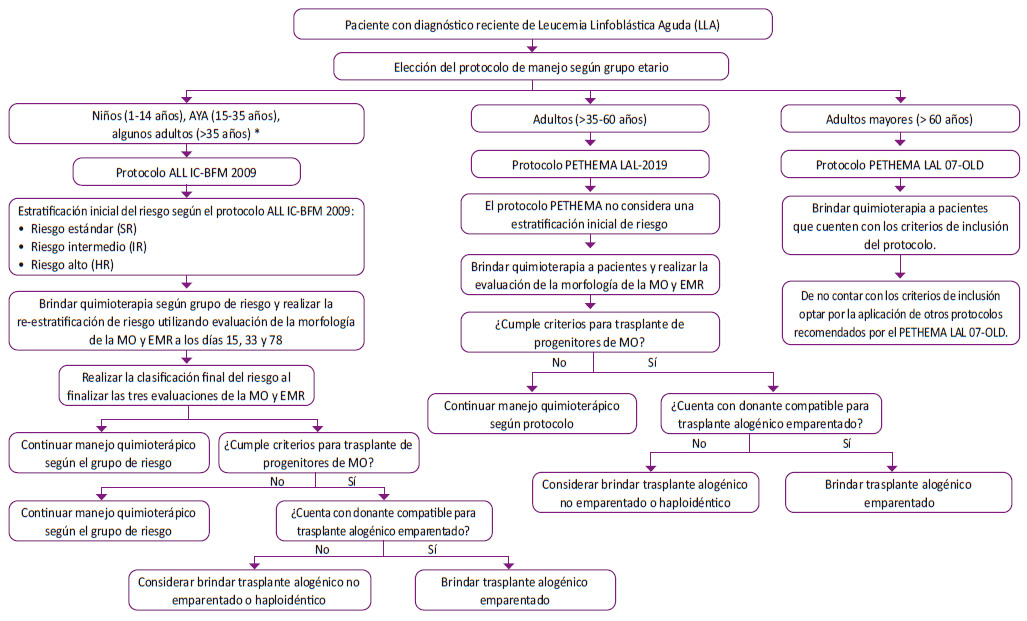
Morfología: Evaluación morfológica de la médula ósea (MO); EMR-CF: Evaluación de la enfermedad mínima residual (EMR) mediante citometría de flujo; M1: presencia de < de 5% de blastos en MO; M2: presencia de > 5% de blastos a < 25% de blastos en MO; M3: presencia de ≥ 25% de blastos en MO.
Figura 2 Flujograma de proceso de re-estratificación del riesgo con EMR y morfología de médula ósea en niños, adolescentes y adultos jóvenes
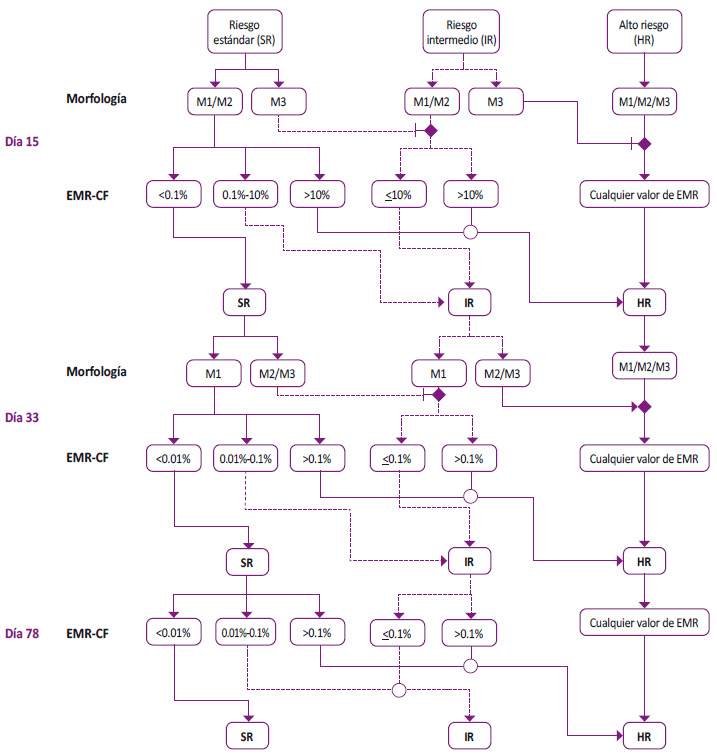
PETHEMA: Programa Español para el Tratamiento de las Hemopatías Malignas; Ph+: Cromosoma Filadelfia positivo. *El grupo PETHEMA define a un paciente frágil en base al índice de comorbilidades de Charlson.
Figura 3 Flujograma de estratificación y manejo inicial de leucemia linfoblástica aguda en adultos y adultos mayores
La presente GPC se enfoca en los pacientes con diagnóstico de LLA de uno a más años. Para el manejo de esta neoplasia, el médico deberá decidir qué protocolo de manejo usar (Preguntas 1, 2 y 3); el día que se evaluará la presencia de infiltración al sistema nervioso central (Pregunta 4); qué tipo de protocolo IB usar durante la fase consolidación (Pregunta 5); la dosis de metotrexato que se va a administrar (Pregunta 6); si usar inhibidores de la Tirosina-Cinasa en pacientes con cromosoma Filadelfia positivo (Pregunta 7); y el tipo de trasplante (Pregunta 8).
A continuación, se expondrán las recomendaciones y los puntos de BPC para cada pregunta, así como un resumen del razonamiento seguido para llegar a cada uno de estos. Para ello, se usarán los códigos de cada recomendación y punto de BPC definidos en la Tabla 1.
Pregunta 1: En niños (1 a 14 años) con leucemia linfoblástica aguda, ¿qué protocolo de manejo se debería usar?
La búsqueda realizada no encontró evidencia de calidad para responder a esta pregunta. Por ello, se formuló puntos de BPC.
BPC-1.1: Los protocolos de manejo para pacientes con LLA son un conjunto de lineamientos usados para definir la clasificación de riesgo y el tratamiento de los pacientes 15. Estos protocolos varían entre sí, en sus criterios de clasificación de riesgo, el uso de quimioterápicos, la intensidad y frecuencia de los regímenes, y en las indicaciones de trasplante. En la actualidad, existen varios protocolos pediátricos disponibles, entre los más conocidos se encuentran los del grupo Berlin-Frankfut- Münster (BFM) 16. El GEG consideró elegir usar el protocolo ALL IC-BFM 2009 del grupo BFM 17, tomando en cuenta que es una actualización del protocolo ALL IC-BFM 2002 18, que fue validado en la población latinoamericana y reportó un alto porcentaje de supervivencia (82%) y baja toxicidad (5%); y que es un protocolo en el que se tiene experiencia de uso a nivel nacional.
BPC-1.2: Se ha encontrado que los pacientes con enfermedad mínima residual (EMR) negativa tienen mejor supervivencia global y supervivencia libre de eventos a los 10 años en comparación con los pacientes con EMR positivo 17. Si bien el protocolo elegido ALL IC-BFM 2009 sugiere evaluar la EMR para realizar la estratificación de riesgo del paciente, sólo incluye la estratificación de riesgo por EMR el día 15. Debido a la necesidad de una reevaluación continua en nuestro contexto, se consideró utilizar los criterios del protocolo AIEOP-BFM 2009 que incluye la evaluación de la EMR en el día 15, 33 y 78.
BPC-1.3: La medición de la EMR mediante citometría de flujo (CMF) tiene una sensibilidad que hace posible detectar los puntos de corte sobre la EMR propuestos por el protocolo AIEOP-BFM 2009, siempre y cuando el operador tenga la experticia necesaria 19. Por ello, se estableció que la medición de la EMR sea realizada con el método de citometría de flujo, siendo necesaria la capacitación del personal que realice el método.
BPC-1.4: Debido a que el protocolo AIEOP-BFM 2009 incluía dentro de sus criterios de trasplante los puntajes de la EMR, el GEG consideró unificar las indicaciones de trasplante de precursores hematopoyéticos de médula ósea propuestas por los protocolos ALL IC-BFM 2009 y AIEOP-BFM 2009.
Pregunta 2: En adolescentes y adultos jóvenes (15 a 35 años) con leucemia linfoblástica aguda, ¿qué protocolo de manejo se debería usar?
Rec-2.1:
Los adolescentes y adultos jóvenes son un grupo de transición etaria, por lo que resulta difícil incluirlos dentro de los protocolos de manejo “pediátricos” y “para adultos” 20).
Para contestar esta pregunta, se contó con la RS de Ram et al., (2012) 21, el cual incluyó 11 estudios observacionales (n=2489), con una población de pacientes con LLA adolescentes y adultos jóvenes (16 a 35 años), y en donde se comparó la efectividad del uso de los regímenes de quimioterapia inspirados en protocolos pediátricos comparados con los protocolos para adultos. Se encontró que aquellos pacientes tratados con protocolos “pediátricos” lograron una mayor reducción de la mortalidad (RR: 0.58, IC95%: 0.51-0.67), mayor remisión completa post inducción (RR 1.05, IC95% 1.01-1.10), mayor supervivencia libre de eventos (RR: 1.66, IC95%: 1.39-1.99), y menor recaída (RR 0.51, IC95%: 0.39-0.66), en comparación con los pacientes tratados con protocolos “para adultos”. Sin embargo, no se observó diferencia entre las tasas de mortalidad no relacionadas a recaída entre ambos grupos (RR: 0.53, IC95%: 0.19-1.48) 21. Por ello, se decidió formular una recomendación a favor del uso de protocolos pediátricos.
Aunque la certeza de la evidencia para todos los desenlaces fue muy baja, los beneficios potenciales fueron considerados muy importantes. Por este motivo, se decidió asignarle una fuerza fuerte a esta recomendación.
BPC-2.1, 2.2, 2.3 y 2.4: El GEG tomó en cuenta lo discutido en la pregunta 1 para emitir estos puntos de BPC.
BPC-2.5: El GEG consideró que el uso del protocolo ALL IC-BFM 2009 podría extender a los pacientes de 35 a 40 años, tomando en cuenta su estado general y el criterio del médico tratante. Esto en base a que la RS de Ram et al., (2012) incluía a tres estudios con poblaciones en este rango de edades (15-55 años), en los que se encontró beneficio del uso de protocolos “pediátricos” 21.
Pregunta 3: En pacientes adultos (36 a 60 años) y adultos mayores (61 años a más) con leucemia linfoblástica aguda, ¿qué protocolo de manejo se debería usar?
La búsqueda realizada no encontró evidencia de calidad para responder a esta pregunta. Por ello, se formuló puntos de BPC.
BPC-3.1: Entre los protocolos más conocidos para el manejo de adultos con LLA se encuentran: el “Hyperfractionated cyclophosphamide, vincristine, doxorubicin and dexamethasone protocol” (Hyper-CVAD), “Medical Research Council United Kingdom Acute Lymphoblastic Leukaemia XII/Eastern Cooperative Oncology Group” (MRC UKALL XII/ECOG E2993), “German Multicenter Study Group for Adult ALL” (GMALL) y el protocolo del “Programa Español para el Tratamiento de las Hemopatías Malignas” (PETHEMA) 22.
Los estudios derivados de cada uno de estos protocolos muestran similares frecuencias de remisión completa (92%, 91%, 89%, y 82%, respectivamente) y supervivencia global (38%, 38%, 54%, y 34%, respectivamente) 23. Por este motivo el GEG consideró que podría utilizarse cualquiera de estos protocolos; sin embargo, se priorizo el protocolo del grupo PETHEMA, en su última versión (LAL-19), debido a que se cuenta con experiencia en su uso, se cuenta con los quimioterápicos propuestos para el manejo, y es una de las opciones propuestas para el manejo de adultos con LLA en Latinoamérica 24.
BPC-3.2: El protocolo PETHEMA LAL-19 incorpora la evaluación de la enfermedad mínima residual (EMR) para decidir la conducta terapéutica a brindar. Debido a los resultados beneficiosos observados en el uso de la EMR en la población pediátrica 17, y que la EMR es incorporada dentro del protocolo elegido para la población adulta, se decidió realizar la evaluación de la EMR utilizando los puntos de corte propuestos por el protocolo PETHEMA LAL-19 mediante el método de citometría de flujo.
BPC-3.3: Se consideró que las indicaciones de trasplante de precursores hematopoyéticos tenían que ir acorde a lo propuesto por el protocolo PETHEMA LAL-19.
BPC-3.4: Los protocolos más conocidos para el manejo de adultos mayores con LLA son: “Vincristine and doxorubicin plus intermittent high-dose dexamethasone régimen” (VAD), “Cancer and Leukemia Group B” (CALGB), GMALL y el protocolo “PETHEMA para el Tratamiento de la Leucemia Linfoblástica Aguda con cromosoma Filadelfia negativo en pacientes de edad avanzada” (PETHEMA LAL-07 OLD) 22. Debido a que no se encontraron estudios que comparen la eficacia de los protocolos para el manejo del paciente adulto mayor con LLA, y que se consideró que la supervivencia global fue similar entre los protocolos mencionados: 10% a tres años 25, 17% a tres años 26, 3,4% a cinco años 27, 39% a dos años 24, respectivamente; se concluyó que podría utilizarse cualquiera de estos. Sin embargo, se optó por elegir el protocolo del grupo PETHEMA LAL-07 OLD 28 debido a que se cuenta con experiencia en su uso y se cuenta con los quimioterápicos propuestos para el manejo (con la consideración del uso de idarubicina, la cual fue sustituida por daunorubicina).
Pregunta 4: En pacientes con leucemia linfoblástica aguda, ¿cuándo debería realizarse la primera punción lumbar para para profilaxis y/o diagnóstico de infiltración al sistema nervioso central?
La búsqueda realizada no encontró evidencia de calidad para responder a esta pregunta. Por ello, se formuló puntos de BPC.
BPC-4.1: La incidencia de infiltración positiva al SNC parece ser menor en los pacientes que reciben la primera punción lumbar siete días luego de iniciar el manejo con corticoides (1,1% y 2,9%) 29,30, en comparación aquellos que la reciben el primer día de quimioterapia (14,7%, 38,8%, y 27,9%) 30. Sin embargo, la supervivencia libre de eventos parece ser similar en los pacientes que reciben la punción después de una semana del inicio de los corticoides (84,2% y 78,2%), en comparación quienes la reciben el primer día de tratamiento (79%, 80,2%, y 85,6%) 30,31. Por estos motivos, se decidió realizar la primera punción lumbar en los primeros siete días luego de haber iniciado la prefase con prednisona en aquellos pacientes sin síntomas neurológicos sugestivos de infiltración al SNC, preferentemente en el día siete de haber iniciado prednisona (día ocho de tratamiento). Así mismo, se consideró importante incorporar lo mencionado en el protocolo ALL IC-BFM 2009 con respecto a la realización de tres terapias intratecales profilácticas en caso no se encuentre infiltración al SNC.
BPC-4.2: El GEG consideró que, debido a la factibilidad, en aquellos pacientes con síntomas neurológicos sugestivos de infiltración se deba realizar la primera punción lumbar para el diagnóstico de infiltración al SNC el primer día en que se inicie la prefase con prednisona.
Pregunta 5: En pacientes con leucemia linfoblástica aguda con riesgo intermedio o alto que se encuentren en fase de consolidación temprana con el protocolo ALL IC-BFM 2009, ¿se debería utilizar el protocolo IB de intensidad aumentada o el de intensidad estándar?
Rec-5.1 y Rec-5.2:
El protocolo de investigación ALL IC-BFM 2009 tiene entre sus objetivos comparar el protocolo IB estándar versus un protocolo IB de intensidad aumentada 17.
Para definir cuál de estos protocolos IB usar en nuestra población, se seleccionaron tres ECA que respondieron a esta pregunta. El ECA de Nachman et al., (1988) realizado en niños con LLA de alto riesgo con respuesta inicial lenta (n=311), encontró que el protocolo IB de régimen aumentado a comparación con el régimen estándar tuvo una mejor supervivencia global a los cinco años y una mayor toxicidad, como reacción alérgica a la asparaginasa nativa, mucositis y osteonecrosis 32. El ECA de Hasting et al., (2015) realizado en niños con LLA de alto riesgo con respuesta inicial rápida (n=1302), halló que los pacientes tratados con el protocolo IB de régimen aumentado tuvieron mejor supervivencia global a los cinco años en comparación con aquellos tratados con el protocolo IB de régimen estándar 33. El ECA de Chang et al., (2008), realizado en adultos (19 a 70 años) con LLA (n=29), encontró que el uso del protocolo IB de régimen aumentado versus el estándar no presentaron diferencias significativas en la supervivencia global, supervivencia libre de eventos, pero se observó una menor cantidad de pacientes que lograron completar el régimen quimioterápico con el régimen aumentado, principalmente por recaída y toxicidad 34.
En la población pediátrica se concluyó que el protocolo IB de intensidad aumentada parece mejorar la sobrevida en pacientes pediátricos con LLA de alto riesgo, pero con una mayor toxicidad, siendo el evento más frecuente la reacción alérgica a la asparaginasa nativa. Considerando que, en nuestro contexto, se reporta gran porcentaje de pacientes que presentan reacciones alérgicas a la asparaginasa nativa, produciendo una interrupción de la quimioterapia; que los pacientes peruanos tienen un estado nutricional diferente a los que participaron en los estudios presentados 35, conllevando a un mayor riesgo y frecuencia de toxicidad a la terapia; y existen estudios observacionales en poblaciones latinoamericanas con características similares a la peruana que reportan menos supervivencia en pacientes que utilizaron IB de intensidad aumentada 36; el GEG concluyó en brindar una recomendación a favor del uso del protocolo IB estándar. Debido a que la certeza de la evidencia para todos los desenlaces muy baja, se decidió asignarle una fuerza condicional a esta recomendación.
Por otro lado, en población adulta, se consideró que el protocolo IB de régimen aumentado no ha mostrado tener beneficios y además presenta mayor riesgo de toxicidad, lo cual podrían presentarse aún con mayor severidad y frecuencia en los pacientes peruanos. Tomando en cuenta que la intervención tendría más riesgos y ningún beneficio en la sobrevida, se decidió formular una recomendación a favor del uso de un protocolo IB de régimen estándar para el tratamiento de adultos con LLA. Puesto que no se cuenta con beneficios claros de implementar un régimen intensivo, se decidió asignarle una fuerza fuerte a esta recomendación.
Pregunta 6: En pacientes con leucemia linfoblástica aguda de linaje B con riesgo intermedio que se encuentren en fase de consolidación con el protocolo ALL IC-BFM 2009, ¿qué dosis de metotrexato se debería administrar?
La búsqueda realizada no encontró evidencia de calidad para responder a esta pregunta. Por ello, se formuló puntos de BPC.
BPC-6.1: El protocolo de investigación ALL IC-BFM 2009 tiene entre sus objetivos determinar la mejor dosis de metotrexato (2000 mg/m2/día vs 5000 mg/m2/día como dosis total administradas por día de metotrexato) para pacientes con riesgo intermedio de linaje B 17. Una cohorte de pacientes colombianos con LLA de linaje B y T de riesgo estándar e intermedio (N=119) que recibían el protocolo ALL IC-BFM 2009, usó dosis de metotrexato de 2000 mg/m2/día y 5000 mg/m2/día, sin realizar comparaciones, encontrándose una supervivencia global y libre de eventos de 79,9% y 73,3%, respectivamente (36).
El GEG consideró que, la supervivencia fue similar, y que en nuestro contexto, no se alcanzaría la dosis terapéutica al utilizar dosis de 2000 mg/m2, tomando en cuenta que se ha reportado variantes genéticas que podrían afectar el transporte de metotrexato en una población similar a la peruana 37. Por lo que se decidió proponer el uso de una dosis de 5000 mg/m2 de metotrexato en nuestra población.
Pregunta 7: En pacientes con leucemia linfoblástica aguda y cromosoma Filadelfia positivo (Ph+), ¿se debería brindar el Inhibidor de la Tirosina-Cinasa (TKI) imatinib?
Rec 7.1:
El protocolo ALL IC-BFM 2009 no incluye indicaciones específicas sobre el uso de TKI, por lo que se decidió formular una pregunta al respecto.
Para responder esta pregunta se encontró el ECA de Biondi et al., (2012), el cual incluyó pacientes de 1 a 18 años de edad con LLA Ph+, y comparó los grupos que recibieron y no recibieron imatinib en las fases post-inducción. Se encontró que la supervivencia libre de enfermedad a los cuatro años, en el análisis “as treated” fue mayor en el grupo con imatinib en comparación con el grupo que no lo recibió (75,2% vs 55,9%; p = 0,060); sin embargo, no se encontró diferencias significativas en el análisis “intention to treat” para este desenlace (72,9% vs 61,7%; p= 0,240) 38.
El GEG consideró que, si bien en el análisis “intention to treat” no encontró diferencia significativa entre la sobrevida libre de eventos, la diferencia de 11,2% entre ambos grupos, fue considerado clínicamente importante, por lo que se decidió formular una recomendación a favor del uso de imatinib. Aunque sólo se contó con un ECA para esta recomendación, las cohortes de los distintos protocolos de manejo quimioterapéutico en pacientes Ph+ respaldan las conclusiones del ECA evaluado 39,40, por ello, se decidió asignarle una fuerza fuerte a esta recomendación.
BPC-7.1: Sobre la dosis de imatinib a administrar en pacientes de 1 a 18 años, el ECA evaluado usaba un rango de dosis de 260-570 mg/m²/día 38. Por lo que el GEG consideró utilizar la dosis de 340 mg/m2/día por vía oral, debido a que está en el rango establecido y por ser la dosis que usualmente se administra en nuestro contexto.
BPC-7.2: Asimismo, en pacientes adultos se consideró tomar en cuenta los estudios encontrados por la revisión sistemática realizada por la GPC de Colombia (2017) 22: seis ensayos clínicos de fase I y fase II, los cuales sugieren que los TKI serían útiles en el manejo de adultos con LLA. En base a ello, se decidió establecer en adultos el uso de imatinib de 600 a 800 mg/día vía oral de manera conjunta a la quimioterapia, como lo indica la GPC de Colombia 2017.
Pregunta 8: En pacientes con LLA en remisión completa candidatos a trasplante de células madre hematopoyéticas, en los que no se encuentra disponible el trasplante alogénico emparentado idéntico ¿Se debería brindar trasplante alogénico no emparentado o trasplante haploidéntico?
Rec-8.1:
Aproximadamente, dos tercios de los pacientes con indicación de trasplante no cuentan con un donador emparentado idéntico disponible, por lo que el trasplante de un donador no emparentado (MUD) sería la siguiente elección 41; sin embargo, en Perú, la búsqueda de donantes idénticos no emparentado es realizada en banco internacionales, con una probabilidad de encontrar un donante de 25% en un periodo entre tres a seis meses. Lo que conllevaba a la demora en la realización del procedimiento y por consiguiente un mayor riesgo de recaídas 42. Frente a esto, se ha sugerido el uso de trasplante haploidéntico, que no necesita un donante que sea HLA-idéntico al del paciente sino basta con que tenga un solo haplotipo idéntico lo que brinda una posibilidad de encontrar un donante potencial dentro de los miembros de la familia 43.
Para responder esta pregunta se seleccionó la RS de Yang et al., (2019) 44 que comparó el trasplante haploidentico con el trasplante MUD en la población de pacientes con algún cáncer hematológico, incluyendo las leucemias agudas; e incluyó cinco cohortes. Al actualizar la búsqueda de esta RS se encontró tres cohortes adicionales 45-47 y se decidió realizar un meta-análisis con ocho cohortes 45-52.
El metaanálisis reportó que el grupo que recibió trasplante haploidéntico (en comparación con aquellos que recibieron el trasplante MUD) tuvo una menor mortalidad sin recidiva (HR: 0,77; IC95% 0,65 - 0,92), menor riesgo de enfermedad injerto huésped aguda tanto para el estadio II-IV (HR: 0,65; IC95% 0,53 - 0,81) como para el estadio III-IV (HR: 0,67; IC95% 0,46 - 0,96), menor riesgo de enfermedad injerto huésped crónica (HR: 0,49; IC95% 0,39-0,63), menor supervivencia global (HR: 0,89; IC95% 0,80 - 0,99) y supervivencia libre de enfermedad (HR: 0,85; IC95% 0,75-0,96). Asimismo, no se encontró diferencias estadísticamente significativas en el número de recaídas (HR: 0,97; IC95% 0,85-1,10).
Considerando que el trasplante haploidéntico parece ser inferior en algunos desenlaces críticos (supervivencia global y supervivencia libre de enfermedad) en comparación con el trasplante no emparentado, pero que el trasplante haploidéntico puede ser realizado dentro de la institución (lo que acelera el proceso, evitando recaídas y generando menores gastos). Se decidió formular una recomendación a favor de cualquiera de ambos tipos de trasplantes, de no contarse con un donador emparentado idéntico. Debido a que la certeza fue muy baja, se decidió asignarle una fuerza condicional a esta recomendación.
BPC-8.1: Si bien estudios previos no han encontrado diferencias en la supervivencia libre de progresión entre el acondicionamiento mieloablativo y el de intensidad reducida 53, el GEG consideró que podría existir mayor toxicidad terapéutica con el uso del acondicionamiento mieloablativo, por lo cual la indicación de un tipo de acondicionamiento sobre otro dependerá de la valoración médica del estado del paciente.
BPC-8.2: Dentro de los estudios incluidos en el metaanálisis, la ciclofosfamida es la profilaxis más usada para la enfermedad injerto contra huésped en el trasplante haploidentico, y es una medida disponible dentro de la realidad de EsSalud. En ese sentido, se indica utilizar un ciclo de ciclofosfamida 50mg/ kg por día en el periodo de dos días, según indicaciones internacionales 54.