INTRODUCCIÓN
El coronavirus tipo 2 del síndrome respiratorio agudo grave (SARS- CoV-2) puede causar un espectro clínico que va desde la infección asintomática hasta la insuficiencia respiratoria, síndrome de distrés respiratorio agudo (SDRA), falla multiorgánica y muerte 1. Estas manifestaciones graves de COVID-19 se podrían deber al síndrome de liberación de citocinas (SRC) 2, que consiste en una respuesta inmune hiperinflamatoria con liberaciones de interferones, interleucinas, factor de necrosis tumoral y otros mediadores inflamatorios 2. Se ha observado que los valores de Interleucina-6 (IL-6) en pacientes con COVID-19 se encuentran por encima del rango normal, no obstante, incluso en pacientes con COVID-19 crítico, estos valores son entre 10 a 200 veces más bajos que en pacientes con SDRA hiperinflamatorio debido a otras causas 3. A pesar de ello, experiencias clínicas más recientes sugieren que la IL-6 podría ser una citocina importante en el desarrollo del SRC inducido por COVID-19 4. Por esta razón, Tocilizumab, al ser un anticuerpo monoclonal humanizado contra el receptor de IL-6 podría resultar de utilidad para tratar el SRC en pacientes con COVID-19 crítico 5. Aún no se tiene claro el efecto que tendría el uso de Tocilizumab en pacientes críticamente enfermos sobre todo en población de América Latina. El objetivo de este estudio fue describir los resultados en la evolución de todos los pacientes que ingresaron a un centro hospitalario por COVID-19 crítico y que fueron tratados con Tocilizumab.
MATERIALES Y MÉTODOS
Diseño y población
Se realizó un estudio descriptivo, desarrollado en el Hospital III Daniel Alcides Carrión; ubicado en la ciudad de Tacna, Perú. Este es un hospital nivel tres, de referencia en el sur de Perú y pertenece al seguro social de salud (EsSalud). Se evaluaron 480 historias clínicas de todos los pacientes hospitalizados por neumonía secundaria a SARS-CoV 2 entre el 1 de mayo y el 2 de septiembre del 2020. Se incluyeron adultos (≥18 años) con diagnóstico de COVID-19, confirmado por cuadro clínico, radiológico, con prueba rápida de detección de anticuerpos IgM reactivo y/o prueba de reacción en cadena de polimerasa (PCR) para SARS-CoV 2 de hisopado nasofaríngeo positivo y que además recibieron durante la hospitalización Tocilizumab.
Los criterios de elegibilidad para la administración de Tocilizumab fueron: Ser adulto con diagnóstico de COVID-19 y tener afección respiratoria grave definida por el compromiso del parénquima pulmonar ≥ 50 % en la tomografía y una relación de la presión parcial de oxígeno (PaO2) a la fracción de oxígeno inspirado (FiO2) PaO2/FiO2 ≤200 mmHg. Los criterios de exclusión fueron: evidencia de infección bacteriana concomitante activa, neutropenia ≤1500 células/ml, trombocitopenia ≤100000 células/ml, elevación de alanino aminotransferasa (TGP), aspartato aminotransferasa (TGO) >5 veces su límite normal, tasa de filtración glomerular ≤30 ml/kg/1.72m2. Se solicitó la consulta de un especialista en enfermedades infecciosas para garantizar que los pacientes fueran elegibles de recibir Tocilizumab según estos criterios y el consentimiento por el propio paciente.
La dosis de Tocilizumab fue de 400 mg a 600 mg como dosis única en infusión intravenosa de 60 minutos. Los pacientes fueron examinados para detectar virus de la hepatitis B, C y VIH antes de la infusión de Tocilizumab. La terapia con Tocilizumab se asoció con la administración de Metilprednisolona dosis de 40 mg en infusión intravenosa cada 12 horas por 7 a 10 días.
Variables de estudio
Se utilizó una ficha de recolección de datos que se dividió en 4 secciones: a) datos demográficos; b) características clínicas; c) comorbilidades; y d) datos de laboratorio. Los datos clínicos y laboratoriales se tomaron al momento de la prescripción del Tocilizumab, al tercer y al décimo día de su administración. La toxicidad se calificó de acuerdo con las pautas establecidas por la FDA, con un rango de 0 (sin toxicidad) a 4 (potencialmente mortal) 6.
La evolución clínica fue evaluada según la “Escala ordinal de mejoría clínica” (SOC) propuesta por la OMS para pacientes con diagnóstico de COVID-19. La escala presenta puntuación de 0 a 8, de la siguiente manera: Sin evidencia clínica o virológica de infección (puntuación 0); sin limitaciones de actividad (puntuación 1); con limitación de actividad (puntuación 2); no requiere oxigenoterapia (puntuación 3); con oxígeno por mascarilla o cánula binasal (puntuación 4); sin ventilación no invasiva u oxígeno a alto flujo (puntuación 5); intubación y ventilación mecánica (puntuación 6); ventilación mecánica y soporte adición para órganos: vasopresores o ECMO (puntuación 7); Muerte (puntuación 8) 7.
Recolección de datos y Aspectos éticos
Se utilizó el registro general de pacientes hospitalizados entre el 1 de mayo y el 2 de septiembre del 2020, una vez identificados los pacientes dos investigadores distintos hicieron la revisión de las historias clínicas físicas y electrónicas. Un tercer investigador comparó los datos recolectados, cuando hubo alguna diferencia, se procedió a revisar nuevamente la historia clínica y a corregir el error. El protocolo fue aprobado por el comité de ética en investigación de la Universidad Privada de Tacna (número de registro: 49-FACSA-UI), así como por el comité de investigación del Hospital III Daniel Alcides Carrión - Tacna. No se solicitó consentimiento informado, debido a la naturaleza observacional retrospectiva del estudio.
Análisis estadístico
Todos los datos fueron analizados en el programa estadístico Stata v16. Se realizó estadística descriptiva (frecuencia y porcentaje) para variables categóricas y para variables numéricas (mediana y rango intercuartílico) ya que su distribución era no simétrica. Luego, se realizó la comparación de las mediciones de rangos (medianas) en la evolución de los valores laboratoriales al 0, tercer y décimo día de haber recibido Tocilizumab, mediante la prueba estadística de Friedman. Finalmente, se realizó un gráfico de barras para describir el puntaje SOC de la evolución clínica en los pacientes.
RESULTADOS
Evaluamos un total de 24 pacientes tratados con Tocilizumab durante el periodo de estudio. La gran mayoría de pacientes fueron hombres (95,8 %), con una mediana de edad de 56,5 años (RIC: 48,3 - 66,3). Las comorbilidades más frecuentemente observadas fueron obesidad (33,3 %), hipertensión arterial (25 %) y diabetes mellitus tipo 2 (25 %). La mediana de tiempo entre presentación de síntomas y hospitalización fue de 7 días (RIC: 5,3 - 8). Un total de 21 (87,5 %) pacientes presentaron mejoría clínica y 3 (12,5 %) fallecieron. El 66,6 % de pacientes ingresaron a la unidad de cuidados intensivos (UCI), todos ellos requirieron ventilación mecánica (VM) con una mediana de estancia en VM de 8,5 (RIC: 3,5 - 11,8) días. Tocilizumab fue administrado con una mediana de 12,5 días (RIC: 9 - 14,8) desde el inicio de síntomas y 4,5 días (RIC: 3 - 6) después de la hospitalización (Tabla 1).
Tabla 1: Descripción de las características clínicas y efectos adversos de los pacientes evaluados (n=24)

UCI: Unidad de cuidados intensivos, VM: Ventilación mecánica, RAM: Reacción adversa de medicamento
a Mediana y rango intercuartílico
Once pacientes (37,5 %) presentaron sobreinfecciones bacterianas, siendo la neumonía intrahospitalaria la más frecuente (29,2 %) y Acinetobacter baumannii el germen más frecuentemente aislado (16,6 %). Así mismo, se observó que 15 pacientes (62,5 %) desarrollaron hepatotoxicidad, la mayoría de grado 3 (33,3 %) y 3 pacientes presentaron injuria hepática de grado 4 (12,5 %). Otras reacciones adversas descritas fueron, trombocitosis (4,2 %), trombocitopenia leve (4,2 %), injuria renal grado 2 (4,2 %) y herpes genital (4,2 %). La mayoría de los pacientes presentaron un score de 6 (42 %) y 5 (33 %) en la SOC al momento de la administración de Tocilizumab. Luego de 10 días posteriores al inicio de terapia con Tocilizumab la mayoría de los pacientes presentó un score de 4 (46 %) y 3 (29 %) en la SOC (Figura 1).
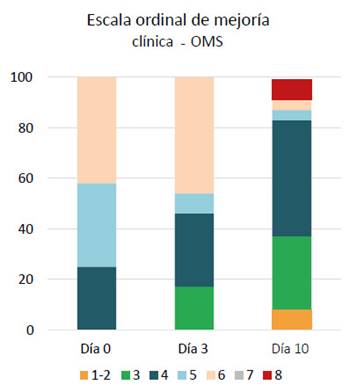
Figura 1 Progresión de parámetros clínicos en la escala ordinal de mejoría clínica de la OMS comparando los valores basales previos a la administración de Tocilizumab (Día 0) frente al frente al tercer y al décimo día tras su administración.
El 100 % de los pacientes presentaban SDRA y la mediana de PaO2/FiO2 fue de 159,5 (RIC: 114,5 - 255,3) al momento de la administración de Tocilizumab. La progresión de los parámetros de laboratorio y respiratorios tras el uso de Tocilizumab al día 3 y 10, mostraron disminución del número de leucocitos, incremento del porcentaje de linfocitos y disminución de la proteína C reactiva a los 10 días de recibir Tocilizumab. No se observó mejoría en otros parámetros de laboratorio como CPK y ferritina (Tabla 2).
Tabla 2: Evolución clínica y laboratorial de los pacientes tratados con Tocilizumab
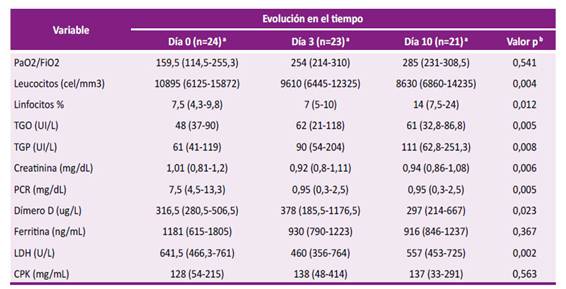
PaO2/FiO2: Cociente entre la presión arterial de oxígeno (PaO2) y la fracción inspirada de oxígeno (FiO2), TGO: transaminasa glutámico-oxalacéticam, TGP: transaminasa glutámico-pirúvica, PCR: Proteína C Reactiva, LDH: Lactato deshidrogenasa, CPK: Creatina fosfocinasa
a. Mediana y rango intercuartílico
b. Prueba estadística de Friedman
DISCUSIÓN
En este estudio se describen los efectos del tratamiento con Tocilizumab en pacientes críticamente enfermos por COVID-19. Se observó una mortalidad de 12,5 % y mejoría clínica en la escala SOC en la mayoría de los pacientes luego de 10 días tras la administración de Tocilizumab. Asimismo, se reporta que más de la mitad de los pacientes presentaron reacciones adversas, luego de la administración de Tocilizumab.
La mortalidad reportada en aquellos pacientes que recibieron Tocilizumab fue relativamente baja, incluso en aquellos que ingresaron a ventilación mecánica invasiva, esto coincide con otros estudios observacionales 8-10, y con lo reportado en el ensayo clínico RECOVERY 11, que incluyó a 4116 participantes, donde el uso de Tocilizumab se asoció a una reducción de mortalidad (rate ratio 0,85; IC 95 % 0,76-0,94), no obstante, el ensayo clínico COVACTA 12 en pacientes hospitalizados con neumonía severa por COVID-19, no logró demostrar una reducción estadísticamente significativa de la mortalidad al día 28 en el grupo que recibió Tocilizumab, comparado con el placebo. Similares resultados fueron anunciados en el estudio EMPACTA 13, con una mortalidad al día 28 de 10,4 % en el grupo Tocilizumab vs 8,6 % en el grupo placebo. Estas diferencias se podrían deber a que estos ensayos clínicos fueron pequeños y que reclutaron pacientes críticamente enfermos con COVID-19 que requerían asistencia ventilatoria no invasiva o ventilación mecánica 11. A diferencia del ensayo clínico RECOVERY que tuvo cuatro veces más información que todos los ensayos clínicos combinados y publicados hasta la fecha 11.
En este estudio se reporta que, de 14 pacientes con SDRA con altos requerimientos de oxígeno suplementario y con indicación de ventilación mecánica que recibieron Tocilizumab, solo 4 de ellos (28,5 %) finalmente recibieron ventilación mecánica invasiva. Estos hallazgos coinciden con lo anunciado en el estudio RECOVERY (11), donde el riesgo de ingresar a VM en aquellos que recibieron Tocilizumab fue inferior al grupo control (15 % vs 19%; RR: 0,79; IC 95 % 0,69-0,92) y al estudio EMPACTA 13, que demostró que aquellos que recibieron Tocilizumab, presentaron 44 % menor riesgo de progresar a ventilación mecánica, comparado a aquellos pacientes que recibieron placebo (12,2 % vs 19,3 %; HR= 0,56 (95 % IC; 0,32 - 0,97)). La disminución en el ingreso a VM se podría deber a que Tocilizumab, al reducir el SRC inhibiendo el receptor de IL-6, disminuiría la progresión de la enfermedad 5.
Otro hallazgo relevante en este estudio fue el poco tiempo de estancia hospitalaria y en la UCI, hallazgos similares fueron reportados en el estudio COVACTA 12, donde aquellos que recibieron Tocilizumab, presentaron una menor estancia hospitalaria (20 días vs 28 días; p=0,037; HR: 1,35) y menor estancia en cuidados intensivos (9,8 días vs 15,5 días) al ser comparados con el grupo control. Estos resultados no fueron observados en el estudio EMPACTA 13, donde no se observó beneficios en la estancia hospitalaria.
En este estudio, tras la administración de Tocilizumab, se observó una mejoría significativa al día 10, de los leucocitos, porcentaje de linfocitos, PCR y LDH. Esta disminución de la PCR ha sido observada también por el estudio de Noa Biran, MD 9, donde además reportan una reducción de la mortalidad en aquellos pacientes que recibieron Tocilizumab con un valor de PCR superior a 15mg/ dL. Se ha descrito también que la PCR, porcentaje de linfocitos y la IL-6 son factores sensibles y fiables en predecir mortalidad, pero no se ha demostrado si su disminución podría mejorar el pronóstico 14-15.
Finalmente, en este estudio se observó que el 37,5 % de pacientes desarrollaron sobreinfecciones bacterianas en forma de neumonía asociada a ventilador y bacteriemia. En otros estudios la incidencia de sobreinfección bacteriana en los grupos que recibieron Tocilizumab varía entre 8,1 - 38,3 % 10,13-14, la alta incidencia de sobreinfección en nuestro estudio probablemente sea secundario a una mayor proporción de pacientes que ingresaron a UCI y a ventilación mecánica, esto también debido a que, en nuestra institución, durante el periodo de estudio, no se contaba con sistemas de ventilación mecánica no invasiva (incluyendo cánulas de alto flujo).
Este estudio tiene algunas limitaciones. Primero, la naturaleza descriptiva de este estudio no permite el control de sesgos inherentes a estudios observacionales, asimismo, al no poseer grupo control, no se pueden determinar factores asociados a buenos o malos resultados con el uso de Tocilizumab. Segundo, el reducido tamaño de la muestra haría que estos resultados no sean extrapolables a toda la población. Tercero, las dosis usadas fueron de 400 y 600 mg, estas son inferiores a las usadas en los ensayos clínicos y en la mayoría de los estudios observacionales (8 mg/kg, máximo 800 mg). Cuarto, si bien todos los pacientes presentaron SDRA al momento de recibir Tocilizumab, la gran mayoría de pacientes se encontraban en ventilación mecánica invasiva, donde probablemente los beneficios son inferiores que en pacientes no ventilados, ya que podría ayudar a prevenir la ventilación mecánica. Finalmente, debido a los recursos limitados en nuestro hospital durante la primera ola de COVID-19, el acceso a UCI y a VM fue restringido según disponibilidad, y es posible que esto haya influenciado en los resultados.
En conclusión, en este estudio se reportan las características principales de todos los pacientes atendidos en un solo centro hospitalario por COVID-19 crítico, que durante la hospitalización recibieron Tocilizumab. Luego de la administración de Tocilizumab, más de la mitad de los pacientes presentó una reacción adversa, a pesar de ello la mortalidad reportada fue baja y la mayoría de los pacientes mejoró.















