INTRODUCCIÓN
El cáncer pulmonar (CP) lidera los primeros lugares a nivel mundial tanto en morbilidad como en mortalidad entre todos los tipos de cáncer. En el año 2018 se reportaron 2.1 millones de nuevos casos y causó una mortalidad aproximada de 1.8 millones de muertes, lo cual lo convierte en el cáncer con mayor mortalidad 1. En el Perú ocupa el sexto lugar en morbilidad y segundo en mortalidad 2-4. El Instituto Nacional de Enfermedades Neoplásicas (INEN) del Perú ha reportado en el año 2018, 447 nuevos casos de CP en ambos sexos, de los cuales se registraron 257 casos nuevos por año en el sexo femenino y 190 en el sexo masculino, siendo alrededor del 60 % estadíos avanzados 4. El CP generalmente se presenta en etapas avanzadas de la enfermedad y la supervivencia a los 5 años sigue siendo menos del 10 % 5.
Existen dos grandes categorías que difieren en estadiaje, manejo y pronóstico; el cáncer de pulmón de células pequeñas (CPCP) derivadas de células con características neuroendocrinas y el cáncer pulmonar de células no pequeñas (CPCNP), que a su vez se divide en tres histologías principales: Adenocarcinoma, carcinoma de células escamosas y de células grandes 3. El descubrimiento de alteraciones moleculares que comandan la carcinogénesis en el CPCNP, que involucran a mutaciones en el gen del receptor del factor de crecimiento epidérmico (EGFR), re-arreglo del gen de la kinasa del linfoma anaplásico (ALK), entre otros, ha sentado la base del tratamiento personalizado en CPCNP a través del uso de diferentes inhibidores de tirosin kinasa (ITK) 6,7.
Cáncer pulmonar EGFR mutado
El EGFR juega un rol muy importante en la oncogénesis del CPCNP. La frecuencia de mutaciones del gen EGFR en la población de pacientes con CPCNP es variable en el mundo, siendo aproximadamente 10 % en la población caucásica y hasta 60 % en la población asiática. En el Perú, la incidencia de mutaciones del EGFR ha sido reportada en aproximadamente 40 % (5). La mutación del EGFR se observa con frecuencia en aquellas personas que nunca fumaron con respecto a quienes alguna vez fumaron (51 % vs 10 %), en adenocarcinomas frente neoplasias de otras histologías (40 % vs 3 %) y más en mujeres que en varones (42 % vs 14 %) 8,9
En el tratamiento de primera línea de cáncer pulmonar EGFR mutado, es superior los ITK de primera y segunda generación sobre la quimioterapia; sin embargo, los pacientes en tratamiento con ITK en un promedio de 12 a 14 meses desarrollan progresión de la enfermedad 10-12. Se han documentado muchos mecanismos de resistencia a los ITK, como aparición de nuevas mutaciones o activación de rutas accesorias. El mecanismo más frecuente es la aparición de una mutación secundaria en el exón 20 del gen EGFR, denominada T790M, que es un cambio de aminoácido en la posición 790 del exón 20 (sustitución de treonina por metionina), la cual es detectada en aproximadamente el 50 % de los casos 13. Actualmente osimertinib, un ITK de tercera generación, está indicada en este contexto clínico.
Tecnología Sanitaria de Interés
Para la detección de mutaciones del gen EGFR se usa convencionalmente muestras de tejido, sin embargo, la biopsia líquida detecta mutaciones del EGFR usando ADN circulante (ADNc) libre, y es una prueba de complemento diagnóstico que facilita la selección de pacientes con CPCNP para el tratamiento con ITK del gen EGFR. El análisis para la detección de las mutaciones del EGFR (incluyendo la detección de las mutaciones activantes hotpost y mutaciones de resistencia a los ITK como el T790M), incluyen PCR a tiempo real, PCR digital y secuenciación de nueva generación (NGS) 3.
Objetivo
A la fecha, no se dispone de estudios o revisiones que evalúen la precisión diagnóstica del uso de biopsia líquida frente al uso de la parafina para la detección de mutaciones del gen EGFR en ADN circulante de pacientes adultos con CPCNP. Por ello, el Instituto Nacional de Enfermedades Neoplásicas (INEN) a través de la Unidad Funcional de Evaluación de Tecnologías Sanitarias, ha elaborado una revisión rápida de evidencias científicas disponibles sobre la comparación del uso de biopsia líquida y biopsia en parafina para la detección de mutaciones del gen EGFR. Así, el objetivo de la presente revisión es discutir la información actual y relevante para toda la comunidad académica y científica del Perú, que pueda servir para toma de decisión en salud sobre la mejor técnica de complemento diagnóstico en pacientes con CPCNP.
METODOLOGÍA
La pregunta PICO se detalla en la Tabla 1. En base a ella, se realizó una búsqueda manual de guías clínicas de instituciones internacionales como National Comprehensive Cancer Network (NCCN), European Society for Medical Oncology (ESMO), National Institute For Health And Care Excellence (NICE), y guías locales del Instituto Nacional de Enfermedades Neoplásica (INEN). Adicionalmente, se realizó una búsqueda de la literatura en artículos disponibles hasta el 29 de Julio del 2020, utilizando las bases de datos Medline, y Cochrane Library. Se aplicó filtros para buscar artículos publicados en los últimos 10 años. Las estrategias de búsqueda se detallan en la Tabla 1.
Tabla 1: Desarrollo de estrategia de búsqueda para búsqueda de artículos de detección de mutaciones EGFR por biopsia líquida en pacientes con carcinoma pulmonar de células no pequeñas

Se incluyeron artículos de metaanálisis, revisiones sistemáticas (RS) y ensayos controlados aleatorizados (ECA), sin restricciones de idioma o ámbito geográfico; o que sean parte de una Guía de Práctica Clínica (GPC) previa (mediante una búsqueda sistemática de GPC sobre el tema). Después de realizar la búsqueda y selección, se realizó una discusión de la evidencia científica. Dos médicos (MJEG y VEFR) realizaron la búsqueda y selección de artículos, y el equipo de médicos, oncólogos, gestores y tomadores de decisiones realizaron la discusión de la evidencia.
RESULTADOS
Revisiones Sistemáticas (RS)
En la búsqueda sistemática se encontraron 5 estudios, del cual dos responden a los objetivos de esta revisión rápida. Los dos estudios correspondieron a Revisiones Sistemáticas y se detallan en la Tabla 2. A continuación cada estudio de describe en forma narrativa:
Tabla 2: Descripción de las revisiones sistemáticas incluidas para la evaluación de tecnología en la detección de mutaciones gen EFGR con biopsia "líquida"
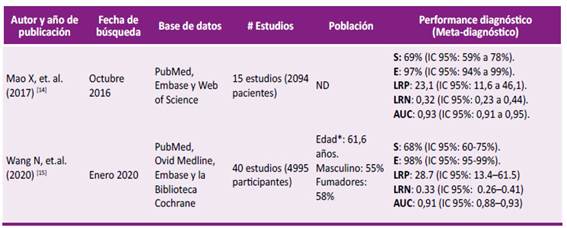
* Mediana. S: Sensibilidad. E: Especificidad. LRP: Likelihood ratio positivo. LRN: Likelihood ratio negativo. AUC: Área bajo la curva (en español). IC 95 %: Intervalo de confianza al 95 %. ND: No data
RS de Mao X, et al (2017) 14: Analizaron si la biopsia líquida podría ser similar a la biopsia de tejido como método diagnóstico de detección de mutaciones de EGFR. Todos los estudios incluidos evaluaron la capacidad diagnóstica de detección de mutaciones EGFR en biopsia líquida versus biopsia en tejido (parafina), además la población fueron pacientes diagnosticados con CPCNP avanzado (desde estadio clínico IIIA a IV de acuerdo al TNM del año 2009 para cáncer pulmonar) quedando 15 estudios seleccionados. El rendimiento general de la prueba evaluado por el AUC fue excelente (0,93). En este estudio se obtuvieron un likelihood ratio (LR) positivo (LR +) de 23,1, siendo este valor considerablemente alto, sin embargo el LR negativo (LR -), es decir, la probabilidad de que sí existan mutaciones de EGFR a pesar de que el resultado es negativo, fue de 0,32. Los resultados del rendimiento diagnóstico se describen en la Tabla 1. Una limitación de este estudio fue que en algunos artículos aplicaron plasma para biopsia líquida, en otros usaron el suero y en un estudio, la muestra fue mixta. No hubo sesgo de publicación. En este estudio, no se encontraron diferencias significativas en el análisis de subgrupos por muestras recolectadas. En conclusión, esta revisión encontró que la detección de mutaciones EGFR en sangre periférica de pacientes con CPCNP es un método no invasivo y confiable debido a su alta especificidad, además puede ser un sustituto de las biopsias en tejidos tradicionales. Sin embargo, debido a su sensibilidad moderada, se deberían realizar estudios de calidad tratando de incrementar la sensibilidad de la prueba.
RS de Wang et al (2020) 15: Evaluaron la precisión diagnóstica del ADNc en la biopsia líquida de sangre periférica para la detección de la mutación EGFR en CPCNP. Todos los estudios incluidos evaluaron en un mismo paciente la detección de mutaciones EGFR por medio de biopsia líquida vs biopsia en tejido, la población fueron pacientes diagnosticados con CPCNP (estadio clínico I a IV) quedando 40 estudios seleccionados. La evaluación de los estudios a través de QUADAS 2 fue buena y de mediana calidad. El rendimiento general de la prueba fue excelente (AUC: 0,91), el LR+ fue de 28,7 y el LR- fue de 0,33. En conclusión, este estudio encontró que la biopsia líquida de sangre periférica tuvo una mejor especificidad para detectar la mutación EGFR en pacientes con CPCNP, por lo que los pacientes con biopsia líquida negativa deberán tener una biopsia de tejido.
Guías de Práctica Clínica (GPC)
En las búsquedas manuales para GPC, encontramos que cada institución tenía una GPC que responden a la pregunta de interés, las cuales se detallan a continuación:
Guía de Práctica Clínica en Oncología -Cáncer de Pulmón de Células no pequeñas - National Comprehensive Cancer Network (NCCN): Realizado en Diciembre del 2017, Esta GPC se basó para sus conclusiones en recomendaciones de categoría 2A, es decir, con un bajo nivel de evidencia pero que el panel de forma conjunta llegó al consenso que la intervención es la adecuada.
Así, esta guía recomienda que la biopsia líquida no debería reemplazar a la biopsia de tejido debido al porcentaje de falsos negativos (aproximadamente 30 %), sin embargo, podría ser usado cuando el paciente se encuentre en un estado de salud deteriorado que no permita realizar la biopsia de tejido, o si una vez realizada la biopsia de tejido al diagnóstico, no se cuenta con suficiente material para poder realizar un análisis molecular sólo si en la biopsia inicial no se determinó alguna mutación driver. En el contexto de pacientes con sospecha de mutación del EGFR y progresión de enfermedad estando en ITK de primera línea, la biopsia líquida podría ser usada para detectar mutaciones. Si el resultado es negativo, una biopsia de tejido es fuertemente recomendado 16.
Guía de Cáncer de Pulmón de Células no pequeñas metastásico- de la Sociedad Europea de Oncología Médica (ESMO, por sus siglas en inglés): Realizado en septiembre del 2019, en sus apartados "Patología/Biología molecular" y "Tratamiento de segunda línea del CPCNP con mutación de EGFR", recomienda que todos los tumores con evidencia clínica de resistencia a ITK EGFR, no tratados previamente con osimertinib, deben analizarse para detectar la presencia de la mutación en el exón 20 de EGFR, T790M. La biopsia líquida se puede usar como prueba inicial para la detección de la mutación T790M, y si la prueba es negativa, se debe intentar una nueva biopsia de tejido si es posible (Grado de recomendación: II, A). No hacen referencia de su uso al momento del diagnóstico inicial 17.
Guía del Instituto Nacional de Excelencia en Salud y Atención - Diagnóstico y tratamiento del Cáncer de Pulmón (NICE, por sus siglas en inglés): Menciona en el apartado sobre la progresión a un tratamiento con ITK de primera o segunda generación, la necesidad de repetir una biopsia para confirmar si se ha desarrollado una mutación de resistencia EGFR T790M, pero no especifican el tipo de biopsia 18. En una nota informativa de NICE:
"Test de mutación en plasma EGFR", mencionan que el posible uso de este test se daría como una alternativa a las pruebas de EGFR tisular o antes de las pruebas tumorales para informar las decisiones sobre la prescripción de ITK-EGFR. Las pruebas de plasma pueden ser particularmente útiles para las personas cuya enfermedad ha desarrollado resistencia a un ITK-EGFR y a quienes se les podría ofrecer ITK-EGFR de segunda línea, si corresponde, sin tener que realizar más biopsias de tejido. No hacen una recomendación explícita 19.
Documento Técnico de Cáncer de Pulmón del INEN: Mencionan que el diagnóstico molecular será realizado antes de iniciar tratamiento. Recomiendan el uso de pruebas de detección de mutación T790M en pacientes con diagnóstico de cáncer de pulmón de células no pequeñas y resistencia clínica a los ITK, no especificando cuál sería la prueba 20.
DISCUSIÓN
Análisis a partir de la evidencia
La biopsia líquida sirve para hallar la mutación EGFR en sangre usando el ADNc libre, esto sirve como complemento diagnóstico para facilitar la selección de pacientes con CPCNP para el tratamiento con ITK del gen EGFR. La biopsia líquida es menos invasiva que la biopsia de tejido al detectar la mutación EGFR ya que solo necesita la extracción de sangre periférica15. Las RS encontraron resultados similares, obteniendo la prueba de detección de mutaciones del gen EGFR en biopsia líquida con una alta especificidad (97 %-98 %), pero una regular sensibilidad (68 %-69 %). Esto significa que la prueba puede tener aproximadamente un 30 % de falsos negativos, por lo cual se recomienda realizar en lo posible, una biopsia de tejido siempre que haya un resultado negativo de la prueba.
En las guías de práctica clínica como las guías NICE, ESMO y NCCN, recomiendan el análisis molecular de EGFR en el CPCNP 16,17. Siendo el uso de biopsia líquida una alternativa en la búsqueda de mutaciones del gen EGFR al inicio del diagnóstico y con una mayor aceptación de uso en el escenario clínico de pacientes con CPCNP con mutaciones sensibles de EGFR y cuya enfermedad ha progresado a requerir un ITK de primera o segunda generación.
Análisis De Costo
El costo de la detección de mutaciones del gen EGFR en biopsia líquida, obtenida de manera indirecta es de S/1 693.00 (aproximado para el mes de octubre del 2020) por paciente. Para hacer el cálculo del costo de realizar esta prueba en nuestra institución se consultó con el área solicitante, manifestando que los costos en comparación a la detección de la mutación EGFR en biopsia de tejido, son básicamente los mismos debido a que lo único que variaría sería el kit de extracción, por lo cual los costos estarían oscilando entre S/1 665.00 a S/864.00 (según tarifario INEN 2020). Se consultó también a la Unidad Funcional de Costos y Tarifas del INEN, para que nos indiquen el costo de procedimientos que serían necesarios para la obtención de biopsia de tejido, dando un aproximado de S/ 966.00 por procedimientos en un paciente. El costo de hospitalización por día, según tarifario INEN 21, oscila entre 40 a 350 soles. Por lo tanto, se puede evidenciar los costos adicionales que el realizar una biopsia de tejido acarrea en comparación a la biopsia líquida.
Por otro lado también se debe evaluar los año de vida ajustado por calidad que se podrían obtener al hacer uso de un adecuado empleo del resultado de la prueba de detección, ya que la supervivencia libre de enfermedad con el empleo de ITKs en pacientes con mutaciones EGFR han demostrado ser mayores respecto a quimioterapia, por lo cual los posibles efectos adversos a consecuencia del empleo de estos medicamentos permitirían un ahorro para nuestro instituto así como la facilidad de su uso (vía oral) permitiría también una mayor adherencia al tratamiento y ahorro para el "bolsillo" del paciente, ya que realizaría menos visitas al instituto, ahorrando tiempo y dinero.
Limitaciones
Este trabajo se realizó a través de una búsqueda sistemática en repositorios donde los autores tenían acceso, esta búsqueda incluyó metaanálisis, revisiones sistemáticas y guías de práctica clínica. No se realizó búsqueda de literatura gris. A pesar de estas limitaciones, los artículos encontrados brindan evidencia científica sobre el rendimiento diagnóstico de mutaciones del gen EGFR en ADNc.
Conclusiones
Los kits para la realización de la detección de mutaciones del gen EGFR en ADNc cuenta con al menos un registro de importación vigente en nuestro país. Esta detección actualmente se realiza en laboratorios y clínicas particulares en el Perú. Implementar esta nueva tecnología no repercute sustancialmente en un costo adicional a la institución debido a la similitud de lo utilizando actualmente para la detección de las mutaciones del gen EGFR en biopsia de tejido. El principal ahorro de parte de la institución es el hecho de no realizar nueva biopsia de tejido.
Se recomienda el empleo de detección de mutaciones EGFR en biopsia líquida en pacientes con diagnóstico de CPCNP. Los escenarios clínicos recomendados son: 1) Paciente con CPCNP avanzado, en el cual la detección molecular en una biopsia de tejido al diagnóstico no es posible, debido a material insuficiente, y/o el paciente es frágil para un procedimiento invasivo. 2) Pacientes con CPCNP avanzado EGFR mutado que han progresado a enfermedad que requiere una primera línea de tratamiento con ITKs de primera y segunda generación, en busca de la mutación de resistencia T790M.















