INTRODUCCIÓN
La adenomiosis o adenomiomatosis vesicular (AV) es una lesión benigna adquirida 1 poco frecuente 2 caracterizada por invaginación de la mucosa que se extiende a través del tejido fibromuscular subepitelial 1 , hasta la subserosa, y forma divertículos intramurales, los senos de Rokitansky-Aschoff (SRA) (3.4) acompañado de hiperplasia de la muscular propia 1,3,5.
Y la colecistitis xantogranulomatosa (CXG) es una rara enfermedad inflamatoria de la vesícula biliar 6-8, variante benigna y poco común de colecistitis crónica 9,10, caracterizada por una inflamación activa y destructiva focal o difusa 6,8,11 , una proliferación severa de tejido fibroso acompañada de la acumulación de macrófagos cargados de lípidos (“células espumosas”), y células inflamatorias agudas y crónicas 6,7,12 .La reacción inflamatoria y la fibrosis provocan un engrosamiento asimétrico de la pared de la vesícula y múltiples nódulos intramurales de color marrón amarillento 7,13.
La prevalencia de la AV es baja, varía de 1-8.5 % 3,5,14) de las colecistectomías. Más frecuente en mujeres 1,3, después de los 50-60 años 5. Así también, la prevalencia de la CXG depende de la ubicación geográfica, oscilando entre 1.3-1.9 % (Europa, EE.UU. y Japón 15,17 ), 2.5-3.2 % (Latinoamérica) 12,18,19 y hasta 9 % (India) 7,11,16, de todas las colecistectomías; con solo un reporte en nuestro medio 12. Y se observa principalmente entre los 60- 70 años 20,21 con reportes de predominio en hombres 7,12, en mujeres10,17,14,21 y otros sin diferencia 11,20 .
En ambas su etiología se desconoce, pero se asocian a colelitiasis 1,3,5,7 , y la CXG además con colestasis 13,18) . Siendo los SRA factor de riesgo para formación de cálculos de pigmento negro 1. Además, la CXG puede desarrollarse como secuela de los SRA, encontrándose asociados en el 5.3 % 1.
La mayoría de los pacientes con AV son asintomáticos 1,2,5.. Algunos refieren dolor abdominal en cuadrante superior derecho (CSD), indistinguible de la colelitiasis (2,3,5,14,), epigastralgia, náuseas, vómitos y dispepsia a grasas 5,14. Asimismo, la CXG pueden presentarse como una colecistitis aguda o crónica6,7,11,13).. Siendo lo más común, una complicación aguda de colelitiasis, con dolor en CSD, dolor epigástrico 11, fiebre, ictericia, náuseas y vómitos 6. Así como, una masa en CSD 7,12, hiporexia y pérdida de peso 12, que imita al cáncer de vesícula biliar (CVB). Y hasta en el 30-32 % puede complicarse con perforación, abscesos y fístulas a órganos vecinos 6,21,22. También, ambas pueden presentarse como ictericia obstructiva o pancreatitis aguda 2,7.
El estudio por imágenes de la AV presenta quistes intramurales (divertículos anecoicos) con artefactos de reverberación con completo o parcial engrosamiento de la pared vesicular 3,5. La ecografía en CXG, revela un engrosamiento de la pared de la vesícula biliar, que puede ser focal o difusa, acompañado de cálculos vesiculares y nódulos o bandas hipoecoicos intramurales (6.7.16.20) , lo que asemeja mucho a CVB 6,7. Además, la tomografía presenta signos útiles; pero la Resonancia (RM), es quien ayuda a diferenciarlas del CVB; muchas veces confirmando el diagnóstico en la AV 3, y en combinación con tomografía podrían acercarse al diagnóstico de CXG 8; como se describe en la Tabla 1.
Tabla 1 Signos imagenológicos para diagnosticar Ademiomatosis vesicular (Tabla 1A), y diferenciar Colecistitis Xantogranulomatosa y Cáncer de Vesícula Biliar (Tabla 1B)
1: Quistes intramurales (divertículos anecoicos)3), anecoicos (llenos de bilis) y ecogénicos (llenos de cálculos o barro biliar)3,14
2: El artefacto de reverberación en cola de cometa o en forma de V que surge de pequeños focos ecogénicos de la pared (creado por el material dentro del divertículo),
es el sello de la hiperplasia adenomiomatosa3
3: Limitada por no poder demostrar los quistes intramurales. Un diagnóstico confiable de GA en la pared GB engrosada es posible solo si hay presencia de SRA grande (al menos 3 mm)5).
4: 92-93% de Especificidad para AV3,14), muchas veces confirma el diagnóstico3, porque las cavidades intraluminares hiperintensas en T2 son sugestivas de ser SRA y excluyen el diagnóstico de CVB4.
%: Siendo lo más característico, correspondiente a las bandas de colágeno y grietas de colesterol21.
#: Presente hasta en el 90% de los casos de CXG7,13,21 y AV1,3
*: Reportado por algunos autores como signo patognomónico de CXG13
+: Informada por algunos autores como más frecuente en CXG13
$: Esto debido a que la pared de la vesícula biliar engrosada en CXG contiene grasa intramural mientras que CVB carece de ella13
No son consideradas lesiones premalignas 1,3,10, pudiendo estar presentes cambios inflamatorios, fibróticos y metaplásicos en la AV 1,3. Siendo el desarrollo del cáncer relacionado a los cálculos e inflamación crónica, en ambas 1,3,5,11.
En ambas el diagnóstico diferencial es difícil 2,6,13,18, e incluyen el CVB 1,2,8. Ya que, la forma localizada o fúndica (la más frecuente) de la AV se presenta como un nódulo umbilicado vesicular 1. Y la apariencia macroscópica de la CXG 7,13 y el hallazgo intraoperatorio de infiltración perivascular, hepática y colónica 6,13, asociada a linfadenopatías 13, las asemeja a CVB. Por consiguiente, en ambos, el diagnóstico definitivo es histopatológico (1,2,9.13,14,18).
En la CXG generalmente hay leucocitosis 8 y en formas precoces de AV, elevación de fosfatasa alcalina y amilasa, sin hiperbilirrubinemia 2. También, los marcadores tumorales CA19-9 y CEA pueden no tener utilidad para diferenciar la CXG del CVB 6,23, ya que tienden aumentar en CVB y pueden elevarse en CXG 6,12,16.
La cirugía es el único tratamiento definitivo para ambos 2,6,7,11,12 y la colecistectomía laparoscópica (CL) es el estándar de oro actual (6.7). Sin embargo, se asocia con una alta tasa de conversión a colecistectomía abierta (10- 80%) 6,11,16,20 , ya que la cirugía suele ser difícil debido a la intensa fibrosis y las adherencias a los órganos vecinos 7,20.
REPORTE DE CASO
Presentamos el caso de una mujer de 34 años, con antecedente de colelitiasis hace 2 años. Que acude por presentar 3 días antes, dolor en hemiabdomen superior, a predomino de epigastrio e hipocondrio derecho, con irradiación a la espalda; además de náuseas, vómitos y deposiciones líquidas; sin sentir mejoría a pesar del tratamiento médico. Al examen se encontró una paciente en mal estado general, pálida, taquicárdica, con apoyo de oxígeno por cánula binasal; con dolor a la palpación en hipocondrio derecho y epigastrio, signo de Murphy positivo, dolor leve a la descompresión, y ruidos hidroaéreos alejados. La analítica mostró IgG para COVID-19, anemia, leucocitosis de 25600 con desviación izquierda, trombocitosis 815000, hipoglicemia, fosfatasa alcalina y GGTP elevadas, en acidosis metabólica, con hipocalemia e hiponatremia. La ecografía solo mostró signos de colecistopatía crónica litiásica. La paciente es hospitalizada con los diagnósticos de abdomen agudo quirúrgico e insuficiencia respiratoria aguda. Al repetirse la ecografía, se apreció, además, una colección subcapsular hepática y líquido libre en cavidad. Por consiguiente, se solicitó una tomografía en la que se evidenció un absceso subcapsular hepático (Figura 1B,1C), y colecistitis crónica calculosa (Figura 1A,1B). La paciente ingresa a sala de operaciones donde se evidencia 200ml de líquido de aspecto bilioso, purulento, a nivel subhepático, zona bloqueada por epiplón y asas intestinales, así como, la presencia de múltiples bridas y adherencias en toda la cavidad abdominal. Además, una vesícula escleroatrófica de 5x3cm, de paredes fibrosadas y edematosas, con presencia de perforación de 1cm en cara inferior de bacinete, donde se aprecia salida de bilis y cálculos. Motivo por el cual, se realiza drenaje de absceso y colecistectomía parcial (subtotal), debido a no poder identificar conducto cístico, ni colédoco. Paciente recibe antibioticoterapia de amplio espectro, y cursa con buena evolución, salvo por presentar una infección de sitio operatorio, la cual se resuelve con curaciones diarias. Posteriormente el informe histopatológico concluye una colecistitis crónica reagudizada xantogranulomatosa (Figura 2) y adenomiosis (Figura 3). Y la paciente finalmente es dada de alta a los diez días.
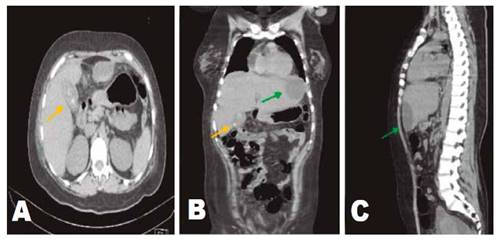
Figura 1 Tomografía abdominal sin contraste. A, Corte transversal. B, Corte coronal. C, Corte sagital. Fecha amarilla: vesícula biliar de ubicación, forma y tamaño normal, con paredes engrosadas de forma difusa, conteniendo múltiples litiasis, la mayor de hasta 7mm. Flecha verde: colección subcapsular hepática que mide 102x36mm, a nivel del segmento III sugerente de absceso subcapsular hepático.
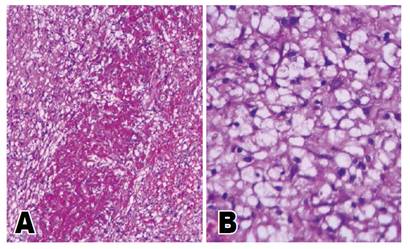
Figura 2 Anatomía patológica: Vesícula Biliar. A, Pared de vesícula biliar (capa perimuscular) con zona necrótica central con histiocitos de citoplasma espumoso en el tejido necrótico y alrededor del mismo (xantogranuloma) - 200x. B, Xantogranuloma en pared de vesícula biliar (acúmulo de histiocitos de citoplasma espumoso por fagocitosis de lípidos - 400x H-E
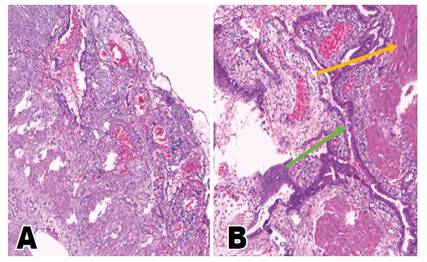
Figura 3 Anatomía patológica: Vesícula Biliar. A, Mucosa de vesícula biliar con inflamación crónica y aguda - 100x H-E. B, Mucosa de vesícula biliar con inflamación crónica, aguda y adenomiosis - 200100x H-E. Flecha verde: invaginación de la mucosa (Senos de Rokitansky-Aschoff) y Flecha naranja: hiperplasia de la muscular propia.
DISCUSIÓN
Los cálculos de la vesícula biliar3,6,12,18 y la inflamación crónica3,12,18,21 están asociados a ambas. Además, la CXG corresponde a una variante poco frecuente de la colecistitis crónica 12, aunque, se diferencian por su carácter destructivo e invasivo12,17, extendiéndose a través de la pared de la vesícula hacia estructuras adyacentes16,17, con fistulización o perforación vesicular10,12; por lo que es considerada una entidad clínica distinta o una variante invasiva6,17. Al mismo tiempo, puede desarrollarse como secuela de los SRA, existiendo solo un reporte, de estar asociada a la AV en el 5.3 % 1.
Nuestro caso, se trató de una mujer con antecedente de colelitiasis 1,3,6,7,10,17, con una edad menor a la reportada, en ambas patologías1,6. Con dolor abdominal, náuseas y vómitos, y un signo de Murphy positivo 11,16,21, asociada a una insuficiencia respiratoria por COVID-19, diferente a otros reportes con clínica obstructiva biliar o duodenal 9 Posteriormente, la tomografía evidenció un absceso subcapsular hepático y colecistitis crónica litiásica. No se planteó la sospecha de CVB 17 por la edad, clínica aguda, y hallazgos tomográficos, a pesar del engrosamiento difuso de pared vesicular (Figura 1); distinto al reporte nacional donde encontró signos radiológicos de neoplasia maligna 12.
La CXG se considera una “enfermedad simuladora” y un reto diagnóstico. Porque, a pesar de ser una patología benigna que cursa con clínica de colecistitis aguda, como en nuestro caso; macroscópica y radiológicamente puede confundirse con CVB 13,12. Por eso, la revisión integrada de las características clínicas, radiológicas y la PAAF preoperatoria puede ayudar a evitar la cirugía radical en pacientes seleccionados 13. Además, el estudio de RM puede llegar a confirmar el diagnóstico 3,8) (Tabla 1), el cual no fue realizado por la urgencia del cuadro agudo quirúrgico. Por ende, frente a la sospecha de CVB, se puede completar el estudio con una RM para poder descartar estas dos patologías. Aunque en ambas, el diagnóstico definitivo dependa del examen histopatológico 1,2,9,13,14,18.
Asimismo, se debe enfatizar que la CXG, al simular una neoplasia avanzada hepatobiliar, puede considerarse como inoperable y condicionar tratamientos conservadores que restarían al paciente, el beneficio de extirpar la enfermedad 12. Más aún, cuando la CXG presenta alta tasa de complicaciones, o puede coexistir con estadios potencialmente curables; y además, ambas presenten un riesgo potencial de desarrollo de cáncer 1,3.
La AV puede ser una condición degenerativa secundaria a presiones intraluminales elevadas en la vesícula1,5, a causa de obstrucción periódica intermitente del conducto cístico por impactación de cálculos 1 o por disfunción neurogénica5. Así como, la CXG podría desarrollarse como secuela de los SRA1) y/o úlceras de la superficie mucosa 6,10,12,13,21, con extravasación intramural subsecuente de bilis espesa y mucina dentro de la pared vesicular; causando una reacción inflamatoria con formación de nódulos xantogranulomatosos intramurales por fagocitosis de lípidos biliares 1,13,22. En nuestro caso, las invaginaciones provocadas por la AV, y el proceso inflamatorio crónico de la CXG, probablemente favorecieron que se produzca la perforación vesicular, y su posterior complicación con absceso hepático.
Asimismo, la rotura del revestimiento seroso de la vesícula y la diseminación de la respuesta inflamatoria dan lugar a adherencias con el hígado, el duodeno y el colon transverso 13. Estas últimas presentes en nuestro caso, ya que, se evidenció adherencias de epiplón e intestino, que al ser liberadas mostraron una perforación vesicular contenida, acorde a una complicación 21,22 propia de la CXG.
Además, la CXG puede confundirse con CVB intraoperatoriamente debido al endurecimiento de la pared de la vesícula, infiltración en el parénquima hepático y adherencias densas con el colon, el duodeno y el estómago 13; perforaciones 22 y fístulas con estructuras adyacentes (6). Por eso, nuestro caso mostró, una vesícula escleroatrófica, de paredes fibrosadas, edematosas, con perforación a nivel de bacinete.
Nosotros optamos por la colecistectomía abierta, por la urgencia y disposición de equipo, en un hospital dedicado a la atención de pacientes con COVID-19. Aunque, debido a las múltiples adherencias y la dificultad para identificar la anatomía normal, algunos recomiendan un abordaje quirúrgico abierto 6,11,17.
Se debe preferir la colecistectomía completa por su coincidencia 11,20 con CVB y el riesgo de malignidad residual. Ya que, el 3.2 % 4 de las AV se asocian con cáncer precoz de vesícula y su tipo segmentario es considerada una condición preneoplásica 4,5; además, la coexistencia de CXG y CVB es del 3 % 23,24, oscilando entre 0.2-15 % de los casos 7,16).Así también, la tasa de realización de una cirugía inadecuada (cirugía abierta o resección del lecho), con falso prediagnóstico de CVB durante la CL, es del 3 % 7. Con este fin, si la inflamación y la fibrosis se extienden al tejido hepático adyacente y las estructuras del hilio hepático; el lecho de la vesícula biliar y las estructuras adyacentes pueden incluirse en la muestra de resección 11.
Además, durante la intervención, se presentó dificultad para la disección del triángulo de Calot 9, por lo que, además del drenaje del absceso, se realizó una colecistectomía parcial, igual que otros reportes 25. Ya que, la misma, puede ser la única opción cuando la resección completa es imposible, el paciente no puede tolerar una resección prolongada; y existe un alto riesgo de causar lesiones en las estructuras hiliares debido a la dificultad significativa en la identificación anatómica 11,20,24 .
Finalmente, el análisis de cortes congelados intraoperatorios es útil para distinguir entre CXG y CVB 6,11,25; e importante para evitar una cirugía innecesariamente prolongada 6,7,11 y excesiva (resección con márgenes libres y disección ganglionar regional)(8,13. Pero, debido a su mal pronóstico, si persiste la sospecha, se debe plantear cirugías amplias 16), como la resección adicional del segmento IVB y V, en los casos de infiltración hepática, a pesar del riesgo de morbilidad adicional 13.
En conclusión, la CXG y la AV son enfermedades raras, asociadas a colelitiasis. Además, la CXG es confundida con el CVB y no existen hallazgos clínicos, laboratoriales, ni imagenológicos que por sí solos puedan diferenciarlos de forma confiable. En nuestro caso, la asociación de ambas y su complicación con absceso hepático, hacen que sea particularmente excepcional. Requiriendo ambas, cirugía e histopatología para confirmarlas. Por lo tanto, deben ser incluidas en el diferencial de colecistitis crónicas y sospechas de CVB; además de considerar el uso de la RM para completar su estudio, ya que puede ser confirmatorio, y así poder evitar cirugías prolongadas y complejas.















