INTRODUCCIÓN
En la actualidad, la incertidumbre se vuelve parte de nuestras actividades asistenciales y cotidianas con relación a la pandemia por el SARS-CoV-2. Por ejemplo, los pacientes se preguntan ¿Estoy infectado? ¿Me reinfectaré? ¿Debo hacerme una prueba para evaluar la eficacia de la vacuna? De la misma forma los médicos tratantes tienes otras ¿Qué prueba solicito para descartar una infección? ¿Cuál prueba de laboratorio evaluará la eficacia de las vacunas? ¿Las variantes afectan las pruebas de laboratorio? ¿Qué son los anticuerpos neutralizantes? Y por último los profesionales de la medicina de laboratorio nos preguntamos ¿Estamos implementando correctamente las pruebas? ¿La verificación analítica resultará conforme? ¿Qué diseño debe tener una prueba para valorar los anticuerpos neutralizantes?
En este escenario de la pandemia, las pruebas de laboratorio (PL) toman un protagonismo sin precedentes. Sin embargo, es importante destacar que el uso de las PL son parte del proceso diagnóstico, es decir son complementarias. La suma de los antecedentes clínicos y epidemiológicos, el examen físico, la historia clínica, las interconsultas a otras especialidades y otras intervenciones de ayuda al diagnóstico; definen el proceso del diagnóstico, donde nos enfrentamos a la enfermedad para que los pacientes recuperen su salud 1.
En estos momentos las pruebas diagnósticas vigentes contra el
SARS-CoV-2, pueden definirse como:
Pruebas directas (asociadas a la infección aguda), que determinan la presencia del virus, como las pruebas de detección de ácidos nucleicos y las pruebas antigénicas.
Pruebas indirectas (Asociadas a infección pasada) que determinan respuestas relacionadas al virus, como los anticuerpos de unión (AU) y los anticuerpos neutralizantes (AN, neutralizing antibodies -nAb). Los AU son validados en su diseño, en su fabricación frente a las pruebas de detección de ácidos nucleicos, mientras que los AN son validados en su diseño contra métodos gold estándar para neutralización directa de los virus, como la reducción de placa (PRNT) o pruebas de reducción por microneutralización. En resumen, podemos observar que los anticuerpos de unión se unen a diferentes partes del virus (anticuerpos no funcionales), mientras que los nuevos ensayos que determinan AN, solo se unen a la proteína S del SARS-CoV-2 (anticuerpos funcionales) (Figura 1).
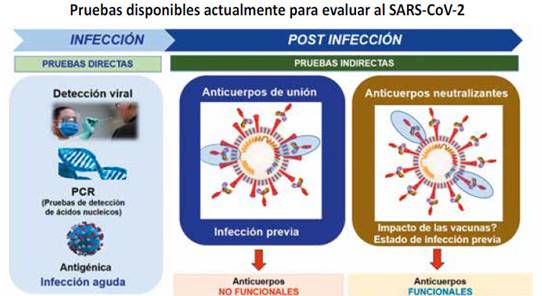
Fuente: Propia
Figura 1 Pruebas de laboratorio disponibles para evaluar las respuestas contra el SARS-CoV-2
El abordaje de esta revisión requiere tener claros los conceptos acerca de la respuesta inmune, la proteína S del coronavirus, las pruebas de neutralización viral donde están los anticuerpos neutralizantes y por último los temas relacionados a la inmunoprotección en el escenario de la vacunación.
PRESENTACIÓN DEL ESTADO DEL ARTE
Respuesta inmunitaria
Un solo virión del SARS-CoV-2 puede generar un promedio de 100.000 copias en 24 horas. Sin embargo, nuestro sistema inmune demora entre 15 y 21 días en generar una respuesta adecuada contra el virus. Está formado por decenas de miles de millones de células muy especializadas en localizar y destruir a los patógenos. Por eso, en la mayoría de los casos, nuestras defensas acaban ganando la batalla al coronavirus.
La primera línea de respuesta, después de que la primera partícula viral haya ingresado en una célula, acuden los macrófagos, células que fagocitan a los patógenos. En estos primeros momentos de la infección también participan otras células llamadas asesinas naturales. Los lisosomas, orgánulos encargados de degradar material intracelular de origen externo, destruyen el virus. Los fragmentos de proteínas y ARN del virus servirán como antígenos, para que otros componentes del sistema inmune (SI) sepan reconocerlo y neutralizarlo. Si la infección no es grave, los macrófagos bastarán para eliminarla. Esto sucede en la mayoría de las personas, por eso el coronavirus no produce síntomas o solo síntomas leves en el 80 % de los casos. Si los macrófagos no consiguen vencer al virus, se producen citoquinas, proteínas que controlan la inflamación, para activar al SI y aumentar la respuesta antiviral. La interleuquina-6 o IL6, en especial genera inflamación local. Esto genera el incremento de diferentes biomarcadores como la proteína C reactiva, la ferritina, el dimero D, entre otros, que permiten predecir la gravedad de la enfermedad. Muchas de las muertes por COVID-19 se deben a la «tormenta de citoquinas» que acaban colapsando al sistema inmune.
La célula natural Killer (NK) o asesinas naturales, tienen como misión la localización y destrucción de las células infectadas. Todas las células sanas están recubiertas por proteínas que les sirven para que no sean atacadas por las células NK, y si la célula está infectada pierde esas proteínas, por lo tanto, las células NK no la reconocen como propia y destruyen la célula infectada 2
En la segunda línea de respuesta, las células dendríticas son el engranaje, entre la primera y la segunda línea de respuesta. Estas células atrapan antígenos del virus y los transportan por el sistema linfático hasta los ganglios, para ser presentados al resto de miembros del SI. Estas células les presentan el virus a los linfocitos T colaboradores, que ayudarán a otras células a ejercer su acción y a los linfocitos B que se encuentran directamente con el virus o el antígeno. Hay 10 000 millones de variantes de linfocitos B. Cada una tiene un tipo concreto de anticuerpo, contra el virus. Cuando un linfocito B puede unirse con el virus, mediante una proteína de su envoltura exterior, es donde produce anticuerpos a todas las partículas virales que encuentre, iniciando el proceso para producir miles de copias de sí mismo. Estos linfocitos se transforman después en células plasmáticas que viajan por la sangre a todos los tejidos y al final producen los anticuerpos que en su inicio son inmunoglobulinas M (Ig M) y luego inmunoglobulina G (Ig G). Los estudios sobre los anticuerpos y células inmunes son fundamentales para el desarrollo de una vacuna efectiva 2.
Ahora estos anticuerpos en su inicio tienen uniones monovalentes y son anticuerpos de baja afinidad y avidez (Ig M), conforme pasan los días, semanas y meses estos anticuerpos van madurando, generando uniones multivalentes produciendo madurez, mayor afinidad y avidez (Ig G). Por lo tanto, los anticuerpos producidos inicialmente son IgM de alto peso molecular con baja afinidad, mientras que los anticuerpos producidos después son de peso molecular más bajos, IgG con mayor afinidad 3.
Proteína de la espíga (Spike - S)
El virus del SARS-CoV-2 es un virus de envoltura, donde destacan en su conformación proteínas estructurales y no estructurales. Una de las proteínas estructurales y que está relacionada en su transmisión es la proteína de la espiga (spike) o proteína S 4. Esta proteína tiene 1273 aminoácidos y permite al virus unirse a las células del huésped a través de su conformación trimérica; convirtiéndola en el objetivo clave para posibles terapias y ensayos diagnósticos, como por ejemplo los diseños de las vacunas para la lucha contra la COVID-19 4,5.
Cuando observamos la proteína S, mediante microscopía crioelectrónica, tienes una reconstrucción tridimensional del trímero, destacando los dominios NTD (N terminal domain) y RBD (receptor binding domain) de la subunidad S1 (favorece la adhesión) y la subunidad S2 (responsable de la fusión a la membrana) 6. El dominio RBD se une a la enzima convertidora de angiotensina 2 (ACE2) de la célula hospedadora. El SARS-CoV-2 emplea esta enzima y la serina-proteasa TMPRSS2 (proteasa 2 de la serina de la transmembrana para su penetración) 7.
Diversos estudios demuestran la potencia y diversidad de los anticuerpos monoclonales neutralizantes contra el SARS-CoV-2. Liu y colaboradores, efectuaron un estudio de mapeo de epítopos de diecinueve anticuerpos se dividió en partes iguales a los dominios RBD y NTD, lo que indica que ambas regiones son inmunogénicas, es decir, los anticuerpos neutralizantes se unen en estas porciones de la subunidad S1 8. Los anticuerpos de alta afinidad pueden provocar la neutralización reconociendo epítopos virales específicos. Los anticuerpos neutralizantes se definen in vitro por su capacidad para bloquear la entrada, fusión o salida del coronavirus 9.
Anticuerpos neutralizantes
Los AN tienen la capacidad de bloquear la capacidad del virus, para unirse al receptor ACE2 en las células humanas. Los AN permiten eliminar el efecto de microorganismos invasores, y su actividad se genera por las proteínas situadas en la superficie de los virus, a las que se unen para «bloquear» la infección. Diferentes estudios enfocados en los AN contra el SARS-CoV-2, señalan que estos anticuerpos aparecen unas dos semanas tras comenzar la infección, y que su pico máximo de actividad se produciría entre las 4 y 6 semanas. Pero no se ha confirmado si todos los pacientes generan anticuerpos neutralizantes, qué factores determinan su aparición y actividad, y si sus niveles de neutralización son siempre suficientes para conferir protección, ya que los niveles son muy variables y no se detectan entre el 10 a 30 % de pacientes, un 50 a 70 % tienen actividad neutralizante media o media/baja y sólo una minoría de pacientes, entre 1 a 5 %, generan altos títulos de neutralización. En resumen, son anticuerpos funcionales 10.
Sin embargo, hay que tener presente que no es sólo su actividad neutralizante, también contribuyen a la citotoxicidad celular favoreciendo el control y curación de la COVID-19; las metodologías que son el Patrón de Oro (PO) - gold standard en inglés - tienen una sensibilidad que desconocemos y deben optimizarse para aumentar su sensibilidad y el hecho de que no se detecte su actividad neutralizante, no excluye que el paciente tenga esos anticuerpos capaces de bloquear el virus 10.
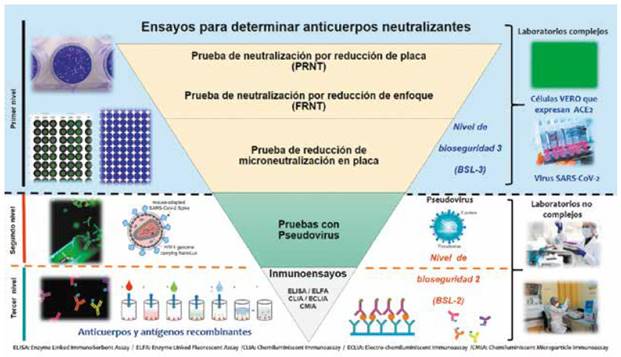
Tipos de pruebas de laboratorio para determinar anticuerpos neutralizantes
Para poder cuantificar la presencia de AN, propongo una clasificación de tres niveles, donde el primer nivel son las pruebas PO, en el segundo nivel los pseudovirus y en el tercer nivel los inmunoensayos de alto rendimiento. Estos ensayos de laboratorio pueden obtener una detección cuantitativa o cualitativa de los AN.
En el primer nivel, son consideradas el patrón de oro (gold standard), ya que imitan el comportamiento natural de la infección, donde células humanas o similares expresan receptores ACE2, interactúan con una mezcla de virus vivo del SARS-CoV-2 y el suero humano con o sin la presencia de AN. Estos métodos consumen mucho tiempo y el profesional debe tener
altas habilidades técnicas para su desarrollo e interpretación 11,12. En este tipo de pruebas destacan la Prueba de Neutralización por Reducción de Placa (plaque reduction neutralization tests - PRNT), la Prueba de Neutralización por Reducción de Enfoque (focus reduction neutralization test - FRNT) y la Prueba de Microneutralización (microneutralization assay). Todas estas pruebas necesitan un laboratorio de bioseguridad de nivel 3 (Biosafety level 3 - BSL3) 11,12.
Estas pruebas analizan la actividad neutralizante en suero o plasma mediante la incubación de una preparación viral con el suero del paciente en varias diluciones. Se compara el grado de infección en ausencia de suero y en presencia de las distintas diluciones del suero. La dilución con la que se inhibe el 50 % de la infección se denomina concentración inhibitoria 50 y la dilución del plasma que la consigue es el título de neutralización 10.
Esta dilución se conoce como Median Tissue Culture Infectious Dose (TCID 50), que representa la dosis infecciosa de cultivo de tejidos del 50 %. El TCID 50 se utiliza para cuantificar los títulos virales determinando la concentración a la que el 50 % de las células infectadas presentan efecto citopático y la dilución única a la que el 50 % de las células presentan el EC, se usa para cuantificar en promedio la cantidad de virus presente en la siembra original 13.
En el segundo nivel, encontramos a dos tipos de pruebas que imitan esta unión entre el receptor ACE2 y la proteína S. Son pruebas basadas en virus pseudotipados y las pruebas de neutralización con virus sustituto. En el caso de las pruebas con pseudovirus, se genera un virus quimera, que consiste en el núcleo de un virus defectivo que se recubre con una membrana que lleva la proteína S del SARS-CoV-2, y mediante una bioluminiscencia (fluorescencia o luciferasa) que actúan como emisores de luz, podemos cuantificar una reacción. Estos pseudovirus, pueden ser el virus de la estomatitis vesicular, lentivirus, u otros, donde se integra la glicoproteína de la envoltura de otro virus de forma exógena, y el genoma conserva las características del virus original. Se diseñan, genéticamente y albergan un gen informador que se determinan por un sistema de detección 11.
Estas pruebas incluyen neutralización de células vivas basados en pseudovirus procesados en métodos con niveles de bioseguridad más bajos (nivel de bioseguridad 2 - BSL2). Al usar un virus quimérico, avirulento no patógeno que expresa la proteína de unión a la superficie del virus de interés (proteína S trimérica del SARSCoV-2). Se basan en vectores retrovirales, lentivirales o rabdovirus recombinantes (virus de la estomatitis vesicular). Las lecturas de estas pruebas se basan en un sistema indicador incorporado dentro del virus quimérico, cuyos ejemplos incluyen la expresión de diferentes enzimas luciferasas, proteína verde fluorescente y operón lacZ de beta-galactosidasa. Estos sistemas informadores permiten un tiempo de respuesta de los resultados más corto. La señal informadora resultante se puede detectar mediante luminometría, microscopía de fluorescencia o clasificación de células activadas por fluorescencia 14. Estas pruebas de neutralización basados en pseudovirus siguen siendo métodos complejos asociados con una variabilidad analítica significativa y son difíciles de respaldar en la mayoría de los laboratorios clínicos dada la necesidad de mantener cultivos celulares y virales 11-15.
Estos ensayos de neutralización del primer y segundo nivel son métodos complejos, con una variabilidad analítica importante y difíciles de implementar en la mayoría de los laboratorios clínicos dada la necesidad de mantener cultivos celulares y virales, aunque los del segundo nivel no son tan exigentes en la bioseguridad 15.
En el tercer nivel, tenemos a las pruebas de inmunoensayos de alto rendimiento (quimioluminiscencia, electroquimioluminiscencia, ensayos por inmunoabsorción ligado a enzimas - ELISA y por inmunofluorescencia) que pueden detectar anticuerpos específicos de alto rendimiento por unión, frente a dominios de la proteína expresados en su forma conformacional nativa. En la actualidad, se están comercializando un tipo de inmunoensayos de bloqueo de unión (assays or blockade of binding - BoB) para la detección de AN mediante ELISA, y este diseño incorpora moléculas receptoras de ACE2 humanas adheridas en una fase sólida y con antígenos RBD del SARS-CoV-2 marcados con enzima. A esta prueba se conoce con el nombre de prueba de neutralización de virus sustituto (Surrogate Virus Neutralization Test (sVNT) 14-16. Otros inmunoensayos detectan anticuerpos frente al dominios diferentes, por ejemplo, anti RBD, anti S1, anti S2, anti S, otros. Hay que destacar que en una clasificación de los anticuerpos contra el SARS-CoV-2 realizado por el Centers for Disease Control and Prevention de los EE. UU., incluye a la única prueba aprobada por la Food and Drug Administration (FDA) como una prueba que permite detectar anticuerpos neutralizantes funcionales 17 (Figura 2).
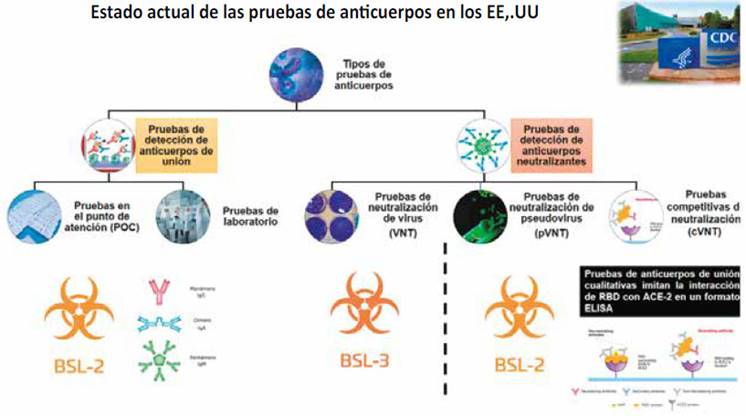
Fuente: Interim Guidelines for COVID-19 Antibody Testing. Centers for Disease Control and Prevention (18)
Figura 2 Tipos de pruebas de laboratorio para la determinación de anticuerpos según el CDC
Es crucial que las pruebas de inmunoensayo de alto rendimiento sean validadas en su fabricación comparándolas frente al PO para la detección de las inmunoglobulinas G, que se correlacionan con la detección de anticuerpos neutralizantes anti SARS-CoV-2, realizados por ejemplo con PRNT, microneutralización o como el uso de pseudovirus. Por lo tanto, estas pruebas deben ser validadas con un número representativo de muestras para ver sus acuerdos positivos o negativos y especificidad para que sean robustos y tengan un desempeño analítico aceptable en uso, con una sensibilidad y especificidad aceptables 14 (Figura 3).
DISCUSIÓN
En estos momentos el antecedente de una infección previa, las variantes que emergen y las campañas de vacunación contra el SARS-CoV-2, están aumentado la complejidad para el uso e interpretación de las pruebas contra el SARS-CoV-2. Muchos se preguntan si las pruebas diagnosticarán con precisión una infección contra una cepa variante y si la vacunación dará lugar a resultados inexactos con una prueba de diagnóstico o serológica. Por fortuna la mayoría de las pruebas de diagnóstico que se utilizan siguen siendo precisas ante las variantes y la vacunación, y no deberían interferir su desempeño analítico con las pruebas de diagnóstico o de anticuerpos. Es crucial entender el diseño de la vacuna y la prueba de laboratorio para esta valoración 17.
El Centro para el Control y la Prevención de Enfermedades (CDC) de los Estados Unidos de América (EUA), desaconseja las pruebas de anticuerpos para evaluar la inmunidad después de recibir la vacuna. Menciona que todos los que reciben la vacuna, no darán positivo en la prueba de anticuerpos y es posible que las pruebas de anticuerpos comerciales no busquen los mismos anticuerpos que activan las vacuna. Algunos individuos que hayan recibido la vacuna y sean inmunes al virus, aún pueden dar negativo en la prueba de ciertos anticuerpos. Por eso es crucial entender que muchas personas darán negativo en la prueba de anticuerpos, y eso no significa que la vacuna no haya funcionado 18.
En la actualidad, incluso los ensayos semicuantitativos o cuantitativos contra la proteína S que pueden cuantificar la magnitud de la respuesta de anticuerpos a las vacunas no deben usarse para determinar la eficacia de la vacuna y la inmunidad protectora 15. Esta recomendación aplica para los anticuerpos de unión y ensayos de neutralización. En la actualidad no existen recomendaciones de ninguna sociedad profesional en los EUA para monitorear o evaluar la respuesta a la vacuna en ninguna población 14,17,18.
Un tema crítico está relacionado a la armonización de las pruebas de laboratorio. Las pruebas de laboratorio necesitan tener resultados que puedan ser comparados y permitan la toma de decisiones, independiente del laboratorio clínico que lo procese y del lugar donde se haga (local, regional, continental o mundial). Para que esto suceda, debemos armonizar analíticamente los resultados y se necesita que todos los resultados tengan las mismas unidades de medida, lo que está relacionado a que independiente que el fabricante de la prueba de laboratorio (dispositivo de diagnóstico in vitro) utilice al mismo material de referencia o patrón (calibrador) de forma estandarizada. Por esta razón la Organización Mundial de la Salud (OMS) durante el 2020, estableció un panel internacional de patrones y materiales de referencia para los anticuerpos anti-SARS-CoV-2 19.
La OMS ofertó el primer estándar internacional para la inmunoglobulina anti-SARS-CoV-2. El uso previsto de este estándar internacional es para la calibración y armonización de ensayos serológicos que detectan anticuerpos neutralizantes anti-SARS-CoV-2. La preparación también se puede utilizar como reactivo de referencia interno para la armonización de los ensayos de anticuerpos de unión. La unidad de medida propuesta en este patrón es de BAU/mL (unidades de anticuerpos de unión por mililitro - binding antibody units per mL). Para los ensayos de anticuerpos de unión, se puede utilizar una unidad arbitraria de 1000 unidades de anticuerpos de unión BAU/ml para ayudar a la comparación de ensayos que detectan la misma clase de inmunoglobulinas con la misma especificidad (por ejemplo, IgG anti-RBD, IgM anti-N, etc.) 20.
En este momento existen diferentes fabricantes de ensayos que miden los AN, y todos tienen diferentes unidades validadas en su fabricación. Este escenario no permite definir un valor que nos permita determinar con claridad cuál sería un nivel de protección de la seropositividad ante una infección natural o artificial (vacunación) que garantice la inmunoprotección tan esperada. Hasta el momento estos fabricantes están definiendo factores de corrección para llevar sus unidades a las BAU/ml, recomendados por la OMS. Por lo tanto, se espera que las nuevas versiones de estas pruebas para medir los AN uniformicen los resultados con las BAU/ml planteados por la OMS 20.
Diferentes estudios evalúan el impacto serológico de una infección natural por el coronavirus o inducida por las vacunas. Krammer y colaboradores, en su estudio evalúa las respuestas de anticuerpos en personas seropositivas después de una dosis única de la vacuna de ARN mensajero contra el SARS-CoV-2, en 110 participantes con o sin SARS-CoV-2 preexistente que recibieron su primera dosis de vacuna (88 con Pfizer y 22 con Moderna), midió el incremento de IgG antiproteína S contra el SARS-CoV-2, con el uso de un ensayo de ELISA. Al evaluar la producción de anticuerpos, los títulos en los vacunados con inmunidad preexistente fueron de 10 a 45 veces más altos que los títulos de anticuerpos de los vacunados sin inmunidad preexistente, de la primera dosis de vacuna 21. Inclusive al evaluar el refuerzo heterólogo con una vacuna de ARNm después de la vacunación principal con ChAdOx1-S en lugar de un refuerzo homólogo, por ejemplo, la fuerte inhibición de variantes, incluida la delta, respalda la vacunación heteróloga ChAdOx1-S / BNT162b2 22.
Lucas y colaboradores, evaluaron la producción retardada de anticuerpos neutralizantes y su correlación con la presencia de COVID-19 grave. Demostraron que la mortalidad se correlaciona, con la cinética retardada de la producción de AN. Aunque los sueros del 85 % de los pacientes mostraron cierta capacidad de neutralización, la generación de AN antes de los 14 días del inicio de la enfermedad surgió como un factor clave para la recuperación y la gravedad de COVID-19 se correlaciona con los anticuerpos anti-S. La producción temprana de AN se correlacionó con la mejoría de los signos clínicos y una menor mortalidad que la producción de AN tardíos y tuvieron una mala progresión de la enfermedad y una mayor mortalidad 23.
Además, Vanshylla y colaboradores, brindan las características que dan forma a la respuesta de los AN contra el SARS-CoV-2 en individuos recuperados por COVID-19. Evaluaron la dinámica de anticuerpos contra el SARS-CoV-2 durante 10 meses en 963 personas que experimentaron COVID-19 leve. En promedio las concentraciones de los AN en los participantes fueron: 3 % muy altas (AN de élite); 21 % altas; 45 % medias; 10 % bajas y 21 % no presentaron AN en la evaluación. Hay que destacar que la concentración baja se observó más en participantes jóvenes, con síntomas leves o asintomáticos y del sexo femenino. La edad avanzada, los síntomas y la enfermedad grave predicen una mayor neutralización del SARS-CoV-2 y la respuesta de anticuerpos revela una respuesta de anticuerpos IgG de vida relativamente larga que dura en promedio 10 meses después de la infección por SARS-CoV-2 en la mayoría de los individuos 24.
Por ejemplo, la vacuna BNT162b2 (vacuna de ARNm), en este estudio, al evaluar una inducción de AN y producción de células T poli-específicas en humanos; demuestra que produce fuertes respuestas de AN, con títulos de hasta 3,3 veces superiores a los observados en muestras convalecientes por infecciones naturales, una semana después del refuerzo 24.
Un tema que preocupa es la presencia de las variantes contra el SARS-CoV-2. Dado el aumento de estas variantes virales. Moore y Offitun proponen 5 recomendaciones: el virus SARS-CoV-2 de personas vacunadas (de preferencia con 2 dosis) independiente del diseño y que son hospitalizadas por COVID-19 deben aislarse y caracterizarse; se debe crear y mantener un sistema activo de secuenciación y vigilancia genómica para identificar estas variantes una vez que surjan; crear un banco de muestras de suero de personas que hayan sido inmunizadas con vacunas contra el SARS-CoV-2; reducir la propagación global de nuevas variantes y fabricar nuevas versiones de vacunas que incluyan estas variantes 25.
Conocer más de la proteína S, es crucial para comprender la producción de los AN y cómo las nuevas variantes afectan la eficacia de las vacunas. Una reciente publicación detalla sobre las mutaciones de la proteína S del SARS-CoV-2 como antígeno primario; enfocándose en el impacto de su antigenicidad, además de evaluar las frecuencias de mutaciones observadas en el mundo 26. Estudios que incluyen modelos predictivos para evaluar eficacia y longevidad del correlato inmunológico serán investigaciones futuras que aclaren este panorama, hoy complejo 27,28.
Los fabricantes de vacunas están preparando plataformas para una posible actualización de las secuencias y es fundamental que la vigilancia de los cambios genéticos y antigénicos en la población mundial de virus se realice junto con experimentos para dilucidar los impactos fenotípicos de las mutaciones 26.
Para concluir el presente artículo de revisión, se esbozan algunas respuestas a ciertas preguntas iniciales:
Pacientes: ¿Debo hacerme una prueba para evaluar la eficacia de la vacuna? Hasta el momento no existe ninguna institución de la academia que recomiende el uso de pruebas serológicas para ver este tema. Las vacunas sirven para evitar presentaciones graves, hospitalizaciones o muerte por el virus.
Médicos tratantes: ¿Qué prueba solicito para descartar una infección? Se deben solicitar las pruebas moleculares o antigénicas. ¿Cuál prueba de laboratorio evaluará la eficacia de las vacunas? Con el transcurrir de los años, podremos tener alguna prueba de inmunoensayo de alto rendimiento que permita responder el nivel de protección, tal como se hace hoy para evaluar la inmunización contra el virus de la hepatitis B.
Profesionales de la Medicina de Laboratorio: ¿Estamos implementando correctamente las pruebas? Hasta la fecha existen innumerables desafíos para realizar la verificación analítica de las pruebas contra el SARS-CoV-2, como las pruebas antigénicas y para los inmunoensayos de alto rendimiento de anticuerpos neutralizantes. ¿Qué diseño debe tener una prueba para valorar los anticuerpos neutralizantes? En el futuro las pruebas inmunológicas de alto rendimiento en base a la evidencia científica se irán posicionando en términos de performance y estandarización-armonización analítica.
CONCLUSIONES
Debemos comprender que los actuales ensayos para determinar AN por inmunoensayos como ELISA, CLIA, ECLIA o inmunofluorescencia; y que determinan Ig G contra la proteína S del SARS-CoV-2 o algunas subunidades S1 - S2; o sus dominios RBD o NTD específicos de esta proteína; deben ser validados en su fabricación contra los métodos gold estándar.
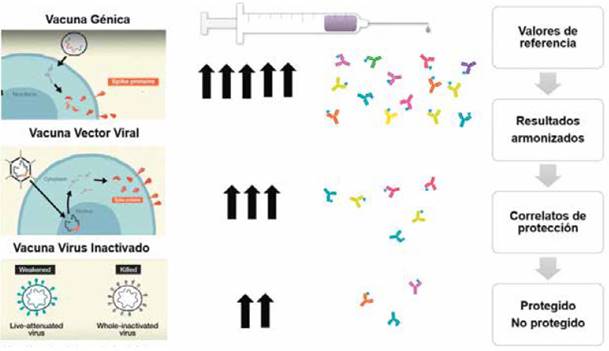
Es indispensable que los fabricantes de dispositivos in vitro (ensayos de laboratorio) comiencen a utilizar materiales de referencia armonizados, conforme lo recomienda la OMS, para que todos los laboratorios del mundo y en todos los países reporten sus resultados con unidades armonizadas. Debemos entender que en un futuro los estudios y la medicina basada en evidencia generen más información científica; conoceremos un valor de referencia en unidades armonizadas por la OMS, que represente una protección inmunológica: correlato de protección contra el SARS-CoV2, y que este valor de referencia dependerá del diseño de la vacuna. Es decir que los títulos de AN en los pacientes dependerán de 2 variables: diseño de las vacunas y el antecedente de COVID-19. Esto significa que un futuro los valores de referencia estarán relacionados a si el paciente no se vacuno (un valor), si tuvo vacunación homóloga (otro valor) y si tuvo vacunación heteróloga (con otro valor de referencia) (Figura 4 y 5).
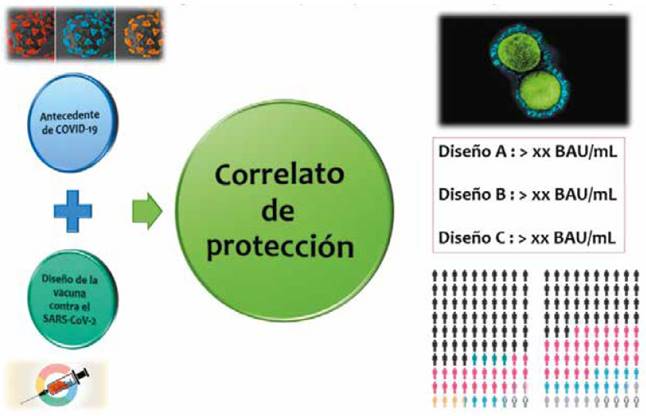
Fuente: Propia
Figura 5 Variables que influyen en los niveles de protección serológica contra el SARS-CoV-2
Por todo lo anterior, debemos tener claro que instituciones como el CDC (Centers for Disease Control and Prevention) o el FDA (Food and Drug Administration) de los EUA, no recomiendan las pruebas de anticuerpos para evaluar la inmunidad después de la vacunación contra la COVID-19, por el hecho que se refieren a las pruebas que fueron aprobadas desde el inicio de la pandemia para su uso de emergencia en los EUA. Hasta la redacción de este artículo de revisión existían 76 pruebas de laboratorio aprobadas para este fin 18,29.
Para finalizar, debemos comprender que la mayoría de los pacientes después de la infección, desarrollan anticuerpos neutralizantes y que la intensidad y duración de las respuestas inmunes varía según la edad y la gravedad de los síntomas y que las respuestas inmunitarias son protectoras contra la reinfección durante 6 a 8 meses después de la infección. Algunas variantes con cambios en la proteína S, tienen una susceptibilidad reducida a la neutralización, por eso debemos entender que la inmunidad celular se dirige además de la proteína S y a otras proteínas virales, que son constantes en las variantes hasta hoy detectadas 30.