INTRODUCCIÓN
El cáncer de próstata (CaP) es el segundo cáncer más comúnmente diagnosticado en hombres, con una incidencia en aumento que atañe en promedio a uno de cada seis hombres durante su vida, afectando principalmente a hombres mayores de 60 años 1,2. En hombres se sospecha que puedan tener CaP, cuando el antígeno prostático específico (PSA) está elevado, el examen digital rectal de la próstata (EDRP) es anormal o en ambas situaciones. La biopsia sistemática transrectal de 12 núcleos guiada por ultrasonido ha sido tradicionalmente un método principal de diagnóstico de CaP, sin embargo, se sobreestima el diagnóstico de cáncer próstata clínicamente insignificante (CaP-ci) y subestima el cáncer próstata clínicamente significativo (CaP-cs) hasta en el 35 % de los pacientes evaluados. Las razones de esta discordancia es que las imágenes con el ultrasonido, no discriminan adecuadamente las lesiones sospechosas 3,4. La sepsis después de la biopsia de próstata transrectal (BPTR) ocurre en 2 % - 5 % de los casos, convirtiéndose en un riesgo clínicamente significativo. La biopsia transperineal de próstata (BTPP), ya sea dirigido por resonancia magnética o no, da lugar a una reducción importante o tasas nulas de sepsis 5-10. En los últimos años, la resonancia magnética multiparamétrica de próstata (RMNmP) se ha mostrado prometedora como herramienta de diagnóstico para el cáncer de próstata. La combinación de imágenes anatómicas en T1, T2, funcionales, ponderadas por difusión proporciona una buena sensibilidad para la detección y localización de tumores con una puntuación de Gleason ≥7 11,12. Permitiéndonos diagnosticar pacientes con CaP-cs y reducir el número de diagnósticos de CaP-ci; reduciendo el número de tratamientos innecesarios 13-18. La Biopsia Transperineal de Próstata por Fusión Cognitiva por Resonancia Magnética y Ultrasonido (BTPPFC-RM/US) permite obtener muestras en áreas de la próstata que son difíciles y frecuentemente imposibles de obtener por el abordaje transrectal, principalmente de la región anterior de la próstata 14,19. La BTPPFC-RM/US es segura, viable y permite obviar la necesidad de una plataforma de fusión formal 20. Un metaanálisis informa que no encontraron diferencias significativas en la tasa de detección de CaP entre las técnicas de biopsia de próstata transperineal (TP) y transrectal (TR). Sin embargo, en una reciente revisión sistemática y metaanálisis reportan que la ruta TP detectó más CaP-cs, con una tasa de detección del 62,2 % (204/328) en comparación con el 41,3 % (130/315) de la ruta TR; siendo más eficiente en la detección de CaP-cs ubicados en la próstata anterior 21 En este estudio describimos los primeros resultados de la realización de BTPPFC-RM/US en Clínica Delgado.
MATERIALES Y MÉTODOS
Es un estudio retrospectivo de serie de casos, con revisión de datos de historia clínica, realizado entre julio del 2019 y octubre del 2021 en el Departamento de Radioterapia de la Clínica Delgado. Se obtuvo el consentimiento informado de los pacientes a quienes se les explicó los beneficios y riesgos de la técnica de la BTPPFC-RM/US. Los criterios de inclusión fueron: pacientes con EDRP y/o PSA anormal y con resultados en la RMNmP, categorías PI-RADS (Sistema de datos e informes de imágenes de próstata) 4 o 5 sospechosos de cáncer. Excluyendo a pacientes con trastorno de la coagulación, hemorroides internas y externas graves o lesiones perianales o rectales. Así como, imposibilidad para abducción o prótesis de cadera, comorbilidades específicas para anestesia y pacientes que se nieguen a firmar el consentimiento informado. Todos los pacientes recibieron anestesia general con sedación y antibiótico profiláctico. Se registraron sus características clínicas, demográficas, valores del PSA, volumen de la próstata, categoría de PI-RADS, tasas de detección de cáncer, complicaciones.
Técnica de la BTPPFC-RM/US
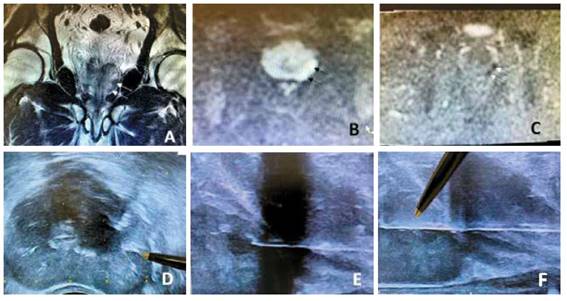
Preparación del paciente: un día antes de la biopsia, el paciente recibe una dieta líquida y entre las 4 y 6 pm. tomará dos frascos de Fosfato sódico (laxante osmótico) de 45 cc disueltos en un litro de jugo de naranja. A las 6 pm. y a las 9 pm. debe colocarse un enema de Fosfato de sodio (130 cc). A partir de las 10 pm no debe recibir alimentos. Para evitar deshidratarse, tomara un vaso de suero oral o liquido cada vez que entre al baño a hacer deposición. La obtención de las imágenes de RMNmP se realizaron en dos resonadores de 1.5T (Aera, Siemens e Ingenia, Philips) con antena de superficie y protocolos dedicados (incluyendo secuencias T2 de alta resolución en eje axial, coronal y sagital, T1 vibe dixon dinámico y difusión B0, 800 y 1400 calculado y mapa de ADC) (American College of Radiology. Prostate Imaging - Reporting and Data System. 2019. Version 2.1. PI-RADS). Con Ecógrafo BK 500 y Transductor Biplanar Transrectal y Software de Fusión HDR Plus. El proceso de la BTPPFC-RM/US se inicia con un planeamiento previo que hace el radioterapeuta al leer las imágenes de la RMNmP e identifica la zona donde se encuentra la lesión, determinará su extensión y puntualizará su profundidad para realizar la biopsia, proceso que realiza delante del urólogo quien será el que realice la biopsia, con la seguridad de que el radioterapeuta durante el procedimiento le indicará el punto exacto en la rejilla de Braquiterapia donde debe de colocar la aguja, correlacionando mentalmente las imágenes de la RMNmP y coincidiendo con las coordenadas del monitor del ecógrafo para que finalmente se realice la biopsia.
Como profilaxis antibiótica, 30 minutos antes del procedimiento, se le administra una dosis única de Cefazolina 2 gr/EV. Previa anestesia general, se le coloca en posición de litotomía y se procede a realizar la asepsia y antisepsia de los genitales y región perineal con Yodopovidona espuma. Se le coloca una sonda de Foley, se hace tracción escrotal con un lazo de gasa para lograr la exposición de la región perineal. Seguidamente se coloca el brazo robot seguido del transductor rectal y la rejilla de Braquiterapia. El radioterapeuta escanea la glándula prostática desde el nivel de las vesículas seminales proximales, base de la glándula prostática hasta el ápice y la región de interés (lesiones sospechosas) proyectando cognitivamente de acuerdo con el estudio de resonancia magnética, verificando la zona en donde se tomarán los núcleos. Bajo guía ecográfica se realiza la biopsia transperineal con la aguja de biopsia Bard Max Core de 18G x 25cm., verificando vía ecográfica la profundidad en plano sagital y axial. Las muestras obtenidas fueron rotuladas de la siguiente manera:
Frasco 1: Zona Periférica Ápex Derecho # núcleos = 2
Frasco 2: Zona Periférica Ápex Izquierdo # núcleos = 2
Frasco 3: Zona Periférica 1/3 medio Derecho # núcleos = 2
Frasco 4: Zona Periférica 1/3 medio Izquierdo # núcleos = 2
Frasco 5: Zona Periférica Base Derecha # núcleos = 2
Frasco 6: Zona Periférica Base Izquierda # núcleos = 2
Frasco 7: Zona Central Derecha # núcleos = 2
Frasco 8: Zona Central Izquierda # núcleos = 2 Cuando se realiza saturación se adiciona 2 núcleos o más.
Una vez terminado el procedimiento, se hace compresión perineal por 10 minutos dejando un apósito compresivo. Seguidamente, se traslada al paciente a la sala de recuperación con monitoreo por un lapso de 2 horas. Los procedimientos duraron 45 minutos en promedio y culminaron sin complicaciones. Finalmente, se les da de alta con indicaciones de tomar fenazopiridina 100 mg cada 12 horas por tres días y colocación de hielo en región perineal (Figura 1).
Análisis de los datos
Se describen las características clínicas, demográficas, valores del PSA, volumen de la próstata, categoría de PI-RADS, tasas de detección de cáncer y las complicaciones en los pacientes evaluados. Las variables continuas y/o discretas se expresan como medias. Las desviaciones estándar, las variables categóricas y ordinales se expresan en proporciones.
Al ser un estudio de revisión de datos de las historias clínicas, no se solicitó revisión ni aprobación por el Comité de Ética de la Clínica Delgado. Se respetó y se mantuvo la confidencialidad de los datos.
RESULTADOS
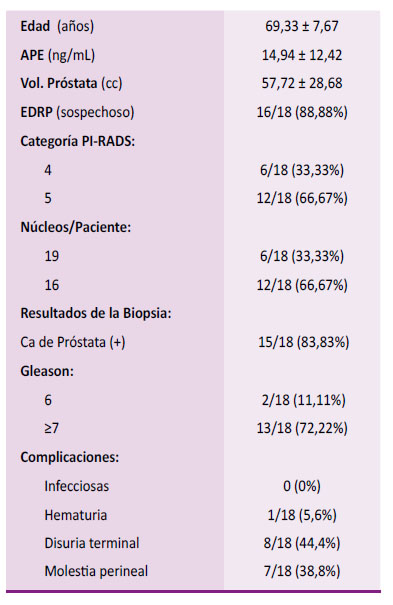
Se revisaron 21 casos; de los cuales 18 pacientes tenían los datos completos a quienes se le realizó BTPPFC-RM/US. La edad media de nuestros pacientes fue de 69,33 ± 7,67 años. La media del PSA fue de 14,94 ± 12,42 ng/mL. La media del volumen de la próstata fue de 57,72 ± 28,68cc. Al EDRP 16/18 (88,88 %) de los pacientes tenían evidencia clínica o zonas sospechosas de cáncer de próstata. Tres de los 18 pacientes estudiados tuvieron biopsias negativas a cáncer. Se hicieron biopsias con 19 núcleos en pacientes cuya RMNmP tenían lesiones con categoría de PI- RADS 4 en 6/18 (33,33 %) de los cuales 3 resultaron positivas a Adenocarcinoma y otras 3 negativas a cáncer. Biopsia con 16 núcleos en PIRADS 5 en 12/18 (66,67 %) pacientes, resultando todas positivas a cáncer. En todos los casos realizamos una combinación de biopsias cognitivas y sistemáticas, con saturación a 6/18 (33,33 %) realizando 19 núcleos y sistemática a 12/18 (66,67 %) pacientes con 16 núcleos. En el estudio anatomo- patológico se encontró lesiones con cáncer de próstata en 15/18 (83,33 %) pacientes y todos eran Adenocarcinoma Acinar, con Gleason 6 en 2/18 (11,11 %) pacientes y Gleason ≥ 7 en 13/18 (72,22 %) pacientes. Ningún paciente presentó complicaciones infecciosas. Si presentaron complicaciones leves como: hematuria 1/18 (5,6 %), disuria terminal 8/18 (44,4%) y molestia perineal 7/18 (38,8 %). Dos pacientes ya tenían Sonda de Foley antes de la Biopsia (Tabla 1).
DISCUSIÓN
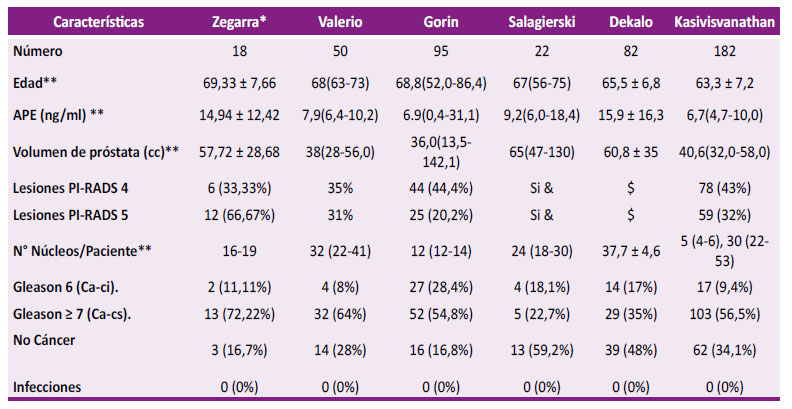
Se ha demostrado que la principal ventaja de la biopsia TP en comparación con el abordaje TR estándar está relacionada con la mejora del muestreo de las regiones anterior y apical de la próstata, siendo también una opción útil para pacientes en los que el acceso rectal es difícil o imposible 18,22,23. El enfoque cognitivo es el más simple, pero más dependiente del operador y su precisión es probablemente ligeramente inferior a la de la fusión por software. Sin embargo, existe una posibilidad de error debido a las dificultades para extrapolar el plano de imagen 2,24. La biopsia dirigida basada en software encontró más enfermedades clínicamente significativas que la biopsia dirigida visualmente, aunque no fue estadísticamente significativo 25. Se presenta los resultados de una muestra de 18 casos de pacientes a quienes le realizamos BTPPFC-RM/US. Radiólogos con experiencia en informes PIRADS evaluaron las lesiones sospechosas mediante imágenes ponderadas en T2, imágenes ponderadas por difusión con mapas de coeficiente de difusión aparente y secuencias dinámicas con contraste mejorado. La edad media de los pacientes estudiados fue de 69,33 ± 7,66 años, similar a los reportados por otros autores. La media del PSA fue de 14,94 ± 12,42 ng/mL, diferentes a lo reportado por Valerio 7,9 (6,4 - 10,2) ng /ml (25), Gorin 6,9 (0.4 - 31,1) ng/mL., 19, Salagierski 9,2 (6,0 - 18,4) ng/mL., (2), Kasivisvanathan 6,7 ng /mL (4,7-10,0) 27, pero similar a Dekalo con; 15,9 ± 16,3 ng/mL 26, siendo en la mayoría de los casos biopsiados por elevación del PSA. La media del volumen de la próstata fue de 57,72 ± 28,68 cc, observando que otros autores intervenieron a pacientes con próstatas entre 13.5 cc y 65 cc, incluyéndose también próstatas hasta 142 cc. Se hicieron biopsias en pacientes con imágenes de RMNmP con categorías PIRADS 4 a 6/18 (33,33 %) y categoría 5 a 12/18 (66,67 %) pacientes. Autores como Valerio, Gorin, Dekalo, y Kasivisvanathan, incluyen en su serie pacientes con categoría PIRADS 4 en un rango de 33 a 44 % y PIRADS 5 en un rango de 20 a 32 % 2,19,25,26,27. Se hicieron 19 núcleos de biopsia a 6/18 (33,33 %) y 16 núcleos a 12/18 (66,67 %) pacientes. Con relación a otros autores hay gran variabilidad en el número de núcleos, con un rango que va de 12 a 53 núcleos, demostrando que la biopsia de próstata dirigida a lesiones sospechosas en la RMNmP, tiene tasas alentadoras de detección de Ca-cs y al mismo tiempo disminuye la tasa de detección de Ca-ci, pudiéndose lograr con menos núcleos que con la biopsia sistemática, guiada por plantilla. Se espera más ensayos prospectivos, multicéntricos y comparativos del rendimiento de las estrategias de focalización para considerar que la biopsia próstata dirigida evitaría la necesidad de una biopsia sistemática 2,18,19,25,26,27.
Nuestra tasa de detección de cáncer de próstata fue 83,33 %, resaltando que 15/18 pacientes al EDRP tenía zonas sospechosas de NM y 17 pacientes tenían PSA elevado y todos sospecha de NM en la RMNmP. Tuvimos un caso con PSA de 2.56 ng/mL, EDRP sospechoso y el resultado histologico fue Adenocarcinoma acinar, Gleason: 7/10 (4+3), GP (ISUP) 3 con infiltración perineural positiva. Nuetras tasas de detección de cáncer fueron similares a las de Valerio 72 %, Gorin (83.2 %) y Kasivisvanathan (62 %), mientras que Salagierski de (41 %) y Dekalo de (45,6 %) tenían tasas menores, que eran de esperar dado que todos sus pacientes estudiados tenían varias biopsias previas negativas. No encontramos cáncer en 16,7 %, también similares a Valerio 14 (28 %) y Gorin 16 (16,8 %) 2,19,25-27. En este trabajo, la tasa de diagnóstico de Ca-cs (Gleason ≥ 7) fue de 72,22 %, coincidiendo con la de Valerio 64 % 25 y Gorin 54,8 % 2,19. Las complicaciones de nuestros pacientes fueron: hematuria leve, disuria terminal y molestia perineal, de 1 a 3 días de duración. Salagierski informó complicaciones como: dolor escrotal y hematoma que se resolvió espontáneamente en 2 semanas; Gorin describió hematuria autolimitada, hematospermia y hematoquecia. Hay que resaltar que ningún paciente presentó infecciones al igual que otros autores 2,19,25,26,27 (Tabla 2). Es un artículo inicial de nuestro grupo de trabajo, con esta serie de casos no podemos dar conclusiones definitivas, pero si nos permite demostrar su factibilidad y seguridad asociada a las bajas complicaciones de nuestros pacientes estudiados. Estamos seguros que con una mayor muestra de pacientes seleccionados, nos permitirá informar de sensibilidad y especificidad de la prueba, medir correlación entre la RMNmP y la positividad de la biopsia, tamaño de lesiones entre 7 a 10 mm en pacientes con PSA ≤ 10, finalmente evidenciar la utilidad del uso de este examen en pacientes con PSA ≥ 10.
CONCLUSIÓN
Demostramos que la biopsia transperineal de próstata mediante fusión de resonancia magnética cognitiva/ultrasonido, es factible, segura, con tasas importantes de positividad y sin registro de complicaciónes infecciosas. El aumento del muestreo en especial en aquellos en los que el PSA y el EDRP; estén en los rangos de duda diagnóstica demostrarán aun más el valor de esta nueva técnica.