INTRODUCCIÓN
El síndrome de Cushing (SC) se describe como la elevación persistente, inapropiada y mantenida de glucocorticoides que llevan a una sintomatología característica. La principal causa del Cushing endógeno son los adenomas hipofisiarios que producen un exceso de ACTH y sobre estimulan el eje hipotálamo-hipófisis- suprarrenal, menos frecuente es la producción no controlada de cortisol por causas suprarrenales y aún más raras son las lesiones ectópicas con capacidad secretoria hormonal autónoma de ACTH por tumores neuroendocrinos. (1, 2)
PRESENTACIÓN DEL CASO
Ingresa al servicio de urgencias una mujer de 62 años reportando 20 días de astenia, adinamia, edema de miembros inferiores, parestesias en extremidades y sensación de inestabilidad. Adicionalmente hiperpigmentación cutánea en pliegues y episodios de diarrea autolimitada en los últimos años secundario a colectomía por su antecedente oncológico.
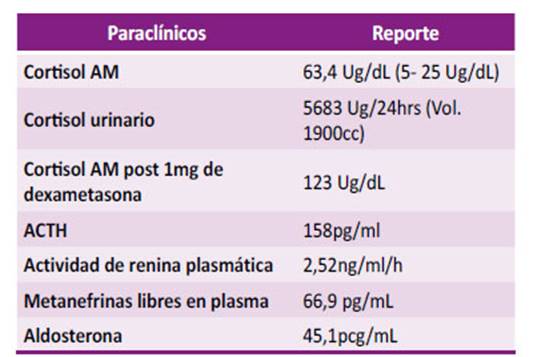
Reportó como antecedentes hipertensión arterial, diabetes mellitus tipo 2, cáncer de colon y melanoma (ambos con tratamiento completo y en remisión por los últimos 10 años según concepto de oncología). Metformina y linagliptina eran administrados de forma ambulatoria. Los paraclínicos se reportan en la tabla 1 y 2.
Tabla 1 Resumen de paraclínicos.
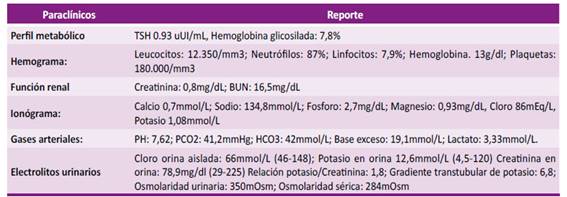
TSH: hormona estimulante de la tiroides, BUN: nitrógeno ureico, PCO2: presión parcial de dióxido de carbono, HCO3: bicarbonato de sodio
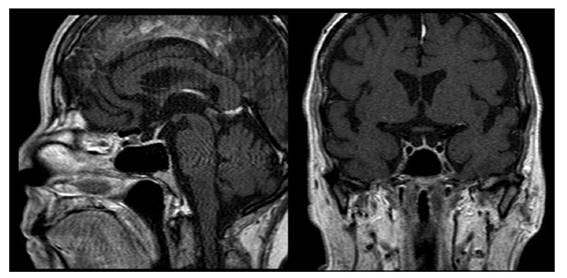
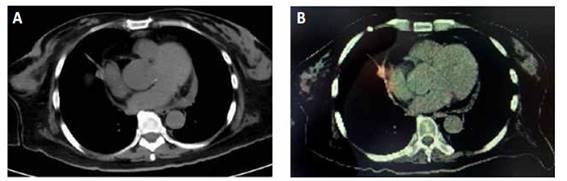
Se inicia corrección calculada de hipocalemia por vía intravenosa y se descartan perdidas renales o gastrointestinales como causantes del trastorno electrolítico. A pesar del tratamiento establecido los episodios de hipocalemia fueron recurrentes al retirar el aporte de potasio, dentro de los estudios para establecer la etiología se documentó un cortisol urinario en 24 horas marcadamente elevado y una respuesta paradójica posterior al freno con 1 mg de dexametasona oral a medianoche. Los valores elevados de ACTH evidenciaron la dependencia de esta hormona y para su estudio se realizó resonancia magnética (RM) de silla turca que descartó su origen hipofisiario (Figura 1). Al realizar imágenes de tomografías en cuello, abdomen y pelvis se encontraron normales, sin embargo; en aquellas torácicas se halló un nódulo para cardiaco derecho que posteriormente se confirmó hipercaptante en el estudio de emisión de positrones con Galio 68 (Figura 2B). La sospecha de Cushing de origen ectópico indico programar resección de lesión pulmonar. Se inició inhibición de esteroidogenesis con ketoconazol y se realizó lobectomía pulmonar segmentaria derecha cuyo reporte patológico reveló la presencia de un tumor carcinoide productor de ACTH, asociado a foco de inflamación crónica granulomatosa y presencia de citomegalovirus, confirmado por inmunohistoquímica.
DISCUSIÓN
El síndrome de Cushing (SC) endógeno es una patología endocrina poco frecuente con incidencia aproximada de 0,2 a 5 casos por millón de habitantes año. Hasta el 25% es independiente de adenocorticotropina (ACTH), el restante 75% es dependiente de la misma, siendo el 70% de origen hipofisiario, conocido como enfermedad de Cushing (EC). Solo el 5% suele estar asociado a una fuente ectópica de producción de ACTH, usualmente en el escenario de un tumor neuroendocrino.(2-4 El síndrome de Cushing ectópico (SCE) supone un reto diagnóstico y tiene una tasa de morbimortalidad alta por su usual asociación a comorbilidades, retrasos en el diagnóstico y tratamiento que derivan en un aumento en el riesgo de tromboembolismo pulmonar, sepsis, infección parasitaria oportunista o diseminada, insuficiencia cardíaca, hemorragia gastrointestinal, psicosis aguda, miopatía debilitante progresiva, hipopotasemia incontrolada, hipertensión y/o hiperglucemia.(3,12,16 No existe una clara definición de hipercortisolismo severo, sin embargo; hallazgos bioquímicos como cortisol sérico aleatorio superior 40 Ug/dL, elevación del cortisol libre en orina de 24 horas por encima de cinco veces el límite superior de normalidad y / o hipopotasemia grave, están frecuentemente relacionados con presentaciones clínicas de SC severo.(12,16
La cronicidad y los niveles de cortisol, marcarán la severidad de las manifestaciones clínicas. Típicamente se describen cambios fenotípicos como plétora, cara de luna llena, estrías abdominales violáceas, joroba de búfalo, obesidad central, debilidad muscular proximal; clínica que no es específica de un tipo en particular de SC y que no está presente en todos los pacientes. La hipertensión arterial y la diabetes mellitus generalmente difíciles de controlar, suelen estar asociadas a esta entidad.(5 En el caso presentado la paciente no tenía cambios fenotípicos usuales, tenía diagnóstico reciente de diabetes e hipertensión; asociado a hipocalemia severa persistente y de difícil manejo. Se ha documentado una frecuente asociación entre alteraciones electrolíticas y del equilibrio acido base con hipocalemia y alcalosis metabólica con SCE, por lo que en aquellos casos que no se documente una causa aparente o en aquellas que no respondan adecuadamente al manejo estándar está indicado evaluar los niveles de cortisol como parte del diagnóstico diferencial; que puede estar presente hasta en un 70% de los casos de Síndrome de Cushing(4,6,8) y al menos en el 10% de Enfermedad de Cushing.1
Son fundamentales para poner de manifiesto el hipercortisolismo realizar mediciones de cortisol en salival durante la noche, excreción de cortisol libre en orina por 24 horas, o prueba de supresión de 1 mg de dexametasona durante la noche. 5
En nuestro caso se halló un nivel de cortisol urinario en 24 horas elevado, supresión paradójica de cortisol sérico post dexametasona oral y ACTH elevada, por lo que se estableció la presencia de hipercortisolismo severo dependiente de ACTH. Generalmente en EC encontramos una respuesta del cortisol no adecuada al freno post dexametasona que confirma el exceso en su producción, pero en causas ectópicas dicha respuesta puede llegar a ser paradójica con valores más elevados del cortisol posterior al freno debido a que la producción de ACTH es más alta al compararla con las derivadas de los tumores hipofisiarios corticotropos. Se puede realizar una prueba con dosis altas de dexametasona, teniendo como sustento el hecho de que la secreción de ACTH por adenomas hipofisiarios es solo relativamente resistente a la regulación por retroalimentación negativa ejercida por los glucocorticoides. En contraste, la mayoría de los tumores no pituitarios asociados con secreción ectópica de ACTH son completamente resistentes a esta inhibición por retroalimentación. Debe mencionarse además que está prueba es poco específica, debido a que hasta un 20% de los pacientes con EC no presentan respuesta; por lo anterior es necesario documentar con imágenes la causa hipofisiaria o extra hipofisiaria de producción de ACTH. 2,3
Con el diagnóstico de SC dependiente de ACTH, la primera causa a descartar es la presencia de un adenoma hipofisiario, la imagen de elección es la resonancia magnética de silla turca y en ciertos casos se puede realizar medición de niveles de ACTH en los senos venosos petrosos inferiores. 4,9 Si se descarta la presencia de adenoma hipofisiario, debe evaluarse la localización de un tumor productor de ACTH o tumor neuroendocrino (TNE); los más frecuentes son pulmonares; carcinoma microcítico de pulmón, tumor carcinoide pulmonar; o tumores carcinoides tímicos (5-42%).1,8,10 La localización del tumor que secreta ACTH no siempre es fácil, por lo que se han estudiado diferentes técnicas de imágenes para facilitar el diagnóstico,(2 se pueden ampliar estudios con tomografía abdominal, dado que también se presentan en tumores pancreáticos (7,5 -25%), feocromocitomas (2,5-25%) y mucho menos frecuentes del tracto gastrointestinal, próstata y cáncer medular de tiroides (2-8%)8). En nuestro caso se documentó hiperplasia adrenal bilateral y un nódulo pulmonar a nivel paracardíaco derecho. No hay estudios imagenológicos que sean estándar de oro para identificar todos los tumores neuroendocrinos, hasta un 10 a 20% de los pacientes pueden permanecer sin identificar su origen 4). La mayoría de los tumores relacionados con la secreción ectópica de ACTH, son neuroendocrinos y tienen una sobreexpresión del receptor de somatostatina (70-90% de los casos). Para la tomografía con emisión de positrones (PET Scan) que usan Galio 68 o 18 fluorodesoxiglucosa la sensibilidad mejora para el diagnóstico de carcinoides bronquiales. Aproximadamente 20% de los SC dependientes de ACTH evidenciadas por PET Scan (Escanografía por emisión de positrones), son de origen pulmonar.(7
En el caso de nuestra paciente se realizó un PET Scan con Galio 68, documentando hipercaptación a nivel pancreático y en suprarrenales, además del área para cardíaca derecha relacionada a la lesión nodular documentada en la tomografía del tórax. Al realizar la resección de la lesión pulmonar los hallazgos de patología reportaron un tumor carcinoide neuroendocrino positivo en inmunohistoquímica para ACTH.
El SC aumenta la morbimortalidad sin importar su etiología durante los primeros 90 días del diagnóstico y el SCE tiene una tasa de mortalidad aún más alta (20%), generalmente asociada a la evolución tórpida por la progresión tumoral 3); los factores que más influyen en el pronóstico de estos pacientes son el tipo de tumor neuroendocrino, su clasificación, la presencia de metástasis a distancia y el grado de diferenciación tumoral. La localización bronquial tiene mejor supervivencia que los tumores ocultos en los cuales el hipercortisolismo deteriora la calidad de vida del individuo afectado. 8 Estos pacientes presentan además trastornos osteomusculares, neuropsiquiátricos, hepáticos, enfermedad vascular con aumento de fenómenos tromboembólicos y riesgo cardiovascular aumentado. (3,11,14
El aumento en la susceptibilidad a infecciones, especialmente oportunistas, puede presentarse en cualquiera de los tejidos, pero predominan a nivel pulmonar. 12 El deterioro de la función inmune de tipo celular se basa en la disminución en adherencia de los neutrófilos al endotelio obstaculizando la extravasación y la quimiotaxis, así como la desgranulación y la capacidad fagocítica. También afectan el componente humoral del sistema inmune innato 15 asociado al enmascaramiento del cuadro, por el efecto antiinflamatorio del corticoide. 11,12 La concentración de cortisol puede ser un buen predictor de infecciones graves 11,15 oportunistas y/o diseminadas; especialmente para el SC ectópico, en donde se ha reportado asociación con Citomegalovirus, Epstein Barr, Herpes simple 1, 2 y herpes Zoster. 11,15
Se concluye que el síndrome de Cushing ectópico representa dentro de los subtipos del SC, mayor morbimortalidad y un reto diagnóstico para los tratantes, dado que generalmente no se presenta con las características fenotípicas típicamente descritas que lo hagan sospechar, sin embargo hallazgos paraclínicos como la hipocalemia de difícil manejo sin otra causa atribuible nos debe hacer sospecharlo y establecer el algoritmo diagnóstico, dado que al estar en contexto de un síndrome para neoplásico, las complicaciones no están únicamente relacionadas al hipercortisolismo, también están supeditadas a la neoplasia en sí.