INTRODUCCIÓN
La diabetes mellitus (DM) es una patología multifactorial caracterizada por hiperglicemias crónicas y es una de las principales causas de morbilidad y mortalidad en el mundo. 1 La diabetes tipo 2 (DM2) es su forma más común, y puede ser causada por una deficiencia y/o resistencia a la insulina pudiendo afectar personas de cualquier edad y estatus socioeconómico habiendo más de 500 millones de casos en el mundo actualmente.2 En nuestro país, el estudio PERUDIAB encontró una prevalencia de 7 % de DM y se espera que aumente en los próximos años.3
La desregulación metabólica causada por la disminución de la función y la masa de las células beta del páncreas ocasionada por la diabetes puede generar cambios macro y microvasculares en diferentes órganos. 4 Estas se pueden prevenir con un adecuado control glucémico. 5 Dentro de los marcadores de laboratorio para valorar la función de las células beta tenemos a la glucosa basal, la hemoglobina glicada (HbA1c) y el péptido C, los dos primeros valoran la secreción de insulina 4,6 y el último reserva de insulina.7 Sin embargo, son métodos invasivos y dolorosos motivando el disconfort del paciente por lo que es deseable técnicas más sencillas y menos invasivas. 8
La saliva es un fluido orgánico que cataliza la glucosa en la boca 9 y puede representar la situación nutricional, hormonal y el estado metabólico del paciente por lo que está emergiendo como una herramienta diagnóstica para la detección de diferentes enfermedades sistémicas, ya que es de fácil recolección y conservación. 10 Estudios han demostrado que la glucosa salival está elevada en pacientes diabéticos en comparación con los no diabéticos 11,12). A pesar de esto aún existen inconsistencias en la bibliografía disponible entre la correlación de la glucosa salival y marcadores como glucosa basal y HbA1c. Algunos reportes encuentran una correlación alta a media entre glucosa salival con la glucosa basal (13, 14), mientras que otros estudios no encuentran asociación significativa 15). Existen pocos reportes que han estudiado la correlación entre glucosa salival y HbA1c encontrando una correlación moderada. 14,16 No existen estudios que indiquen que la glucosa salival está relacionada con la reserva de insulina medida por el péptido C. Estos resultados han conllevado a que algunos autores apoyen el uso de glucosa salival para evaluar el estado glucémico en personas con diabetes mientras que otros no apoyan la idea de una relación constante. La medida de la glucosa salival podría ofrecer ventajas con respecto a la medida en sangre por ser menos invasiva; a pesar de esto, ha sido un tema de debate actual; ya que aún existe controversia entre la relación de este parámetro con marcadores de función de célula beta por lo que el objetivo de nuestro estudio es determinar la correlación de la glucosa salival con marcadores de disfunción de célula beta como la glucosa basal, la HbA1c y el péptido C en personas con DM2 con buen y mal control metabólico
MATERIALES Y MÉTODOS
Diseño y población del estudio
Se realizó un estudio transversal llevado a cabo en el Centro de Diabetes Obesidad y Nutrición (CIDON), Lima-Perú. Los participantes tenían entre 18 a 65 años y fueron reclutados entre pacientes con DM2 que acudían regularmente al centro durante el año 2021. Los sujetos que tenían historia de otro tipo de diabetes, uso de insulina exógena, complicaciones crónicas por diabetes, enfermedades sistémicas, lesiones en la mucosa oral, cirugías de glándulas salivales o radioterapia y uso de otros medicamentos que no sean hipoglucemiantes orales fueron excluidos del estudio. Un total de 142 pacientes con DM2 fueron enrolados en este estudio.
Recolección de datos antropométricos, bioquímicos e inmunológicos
Se recopiló datos demográficos básicos (edad, sexo) y antecedentes clínicos relevantes (tiempo de enfermedad de la DM2 y medicación concomitante) del registro médico del participante. La medida del peso y talla fue llevada a cabo por personal sanitario experimentado utilizando una báscula y un estadiómetro previamente calibrados. El índice de masa corporal (IMC) fue calculado como el peso (kg) dividido por el cuadrado de la talla (metros). Para la realización de las pruebas sanguíneas los participantes acudieron con un previo ayuno de 10 horas y sin modificar el horario de su tratamiento antidiabético oral. Se recolectó una muestra de sangre en ayunas para medir glucosa, HbA1C y péptido C. La glucosa basal se cuantificó en el analizador bioquímico Semiautomatizado BC-300 (CONTEC) que utiliza el método de glucosa-oxidasa.17
La determinación del péptido C se realizó en el equipo Maglumi 4000 (Snibe) por el método de quimioluminiscencia. La medición de la HbA1c se realizó en el equipo ADAMS A1c 8180 (ARKRAY) que usa la metodología de HPLC (cromatografía líquida de alto performance). Se realizaron pruebas de calibración y uso de controles diariamente en todos los equipos utilizados.
Recolección de la saliva no estimulada
La saliva fue coleccionada entre las 8:00 - 10:00 a.m. con los sujetos sentados en una habitación aislada y tranquila. Se indicó previamente que 10 horas antes no deberían fumar, ni cepillarse los dientes y se quitaran las prótesis dentales antes de la recolección de la saliva. Se recolectó inmediatamente después de la toma de muestra de sangre. Se les pidió antes de la recolección enjuagarse la boca con 10 ml de agua destilada y que se relajaran por 5 minutos. Estando sentado el participante se le pidió que inclinara la cabeza hacia adelante sobre el tubo de ensayo y que abrieran ligeramente la boca y dejar caer la saliva en el tubo durante 5 minutos. (18 Las muestras se almacenaron en hielo y se enviaron al laboratorio para ser procesadas inmediatamente.
Validación del método y estimación de la glucosa salival
Para la validación del método se recolectó la muestra de un paciente sano y se le tomó la muestra en 3 momentos para la recolección de 5 ml en total. Esta misma indicación se utilizó con los participantes con DM2. La saliva no estimulada se centrifugó a 3500 rpm durante 5 minutos, luego se separó el sobrenadante del sedimento y se alícuota en 12 crioviales estériles a -20°C para realizar el análisis de precisión intraensayo e interensayo. Se realizaron las diluciones del estándar del kit de Glucosa oxidasa (QCA - Lote 212010 exp: 06/24) con la saliva para obtener distintas concentraciones teóricas (0.32, 0.75, 1.25, 2.5, 5 y 10 mg/dl). Se utilizó la fórmula: concentración inicial (Ci) x volumen inicial (Vi) = concentración final(Cf) x volumen final (Vf) para hallar el volumen inicial del estándar, ser diluido y obtener un volumen final de 200 μl, con el fin de utilizar 100 μL de esa nueva concentración y ser procesada como muestra. Los niveles de glucosa en saliva se midieron del sobrenadante utilizando el método colorimétrico de la glucosa-oxidasa (14,17) en el analizador bioquímico semiautomatizado BC-300 (CONTEC). Se realizó la calibración obteniendo el Factor ((std)/abs) = 46.432. La muestra de saliva (100 μL) se mezcló con 1000 μL de reactivo (glucosa-oxidasa) de la marca Química líquida Aplicada (QCA)(20) y se incubó durante 5 minutos a 37 ° C. Los valores de absorbancia se midieron a 505 nm según lo sugerido por el protocolo del fabricante. Se obtuvo el promedio de las absorbancias y el cálculo de las concentraciones de glucosa salival para cada dilución obteniendo la ecuación lineal y = 0.0214x - 3 E-05, R2 = 1 (Criterio de Aceptación: R cuadrado ≥ 0.95 y error índice máximo ± 1.0), obteniendo un valor mínimo de glucosa salival de 0. 51 mg/dl y máximo de 16.7 mg/dl. Con estos valores se procedió a realizar el análisis de precisión intraensayo (se realizó la lectura 20 veces en un mismo momento) e interensayo (se realizó la lectura 2 veces, al inicio y final del día durante 10 días) en dos niveles (bajo y alto). El requerimiento analítico de CLIA para glucosa es de 10 %, nosotros obtuvimos un CV % de 5.69 % y 1.74 % para el estudio de precisión intraensayo para los niveles mínimo y máximo de glucosa salival respectivamente. Para el estudio de precisión interensayo el requerimiento de CLIA para glucosa es 10 %, obteniendo un CV % de 3. 84 % y 1.23 % para los valores máximos y mínimos de glucosa salival. Por lo que se concluyó que el estudio es aceptable. Las muestras de glucosa salival fueron repetidas en 2 oportunidades y se utilizó el promedio para el análisis. Todas las pruebas laboratoriales fueron procesadas y validadas en un laboratorio privado bajo la supervisión de los investigadores.
Análisis estadístico
La población de estudio se dividió en 2 grupos. Grupo 1: buen control metabólico (HbA1c<7 %) y Grupo 2: mal control metabólico (HbA1c≥7 %). Las variables categóricas se reportaron en porcentajes. Las variables con distribución normal se resumieron utilizando media y desviación estándar, mientras que la mediana y rango intercuartílico para las variables con distribución no normal. En el análisis bivariado, comparamos la distribución de la edad, sexo, tiempo de enfermedad, parámetros antropométricos y de laboratorio en los grupos de estudio mediante la prueba de Fischer o Chi-cuadrado para variables categóricas, y la prueba de T Student o U de Mann-Whitney para las variables continuas según corresponda. Se utilizó el coeficiente de correlación de Spearman para hallar la correlación entre la glucosa salival y los marcadores de disfunción de célula beta. La interpretación del coeficiente rho de Spearman fue según Prion y Haerling (2014).19 Se consideró un p ≤ 0.05 como estadísticamente significativo. El análisis estadístico se realizó utilizando Stata versión 14 para Windows (StataCorp LP, College Station, Texas, Estados Unidos) y las gráficas se realizaron en Medcal software versión 20.113.
RESULTADOS
Características demográficas, antropométricas y de laboratorio de personas con DM2 con buen control metabólico (HbA1c<7 %) y mal control metabólico (HbA1c≥7 %).
Un total de 142 personas con DM2 con edades entre 18 a 65 años participaron en el estudio y fueron distribuidos en dos grupos: buen control metabólico (HbA1c< 7 %) y mal control metabólico (HbA1c ≥ 7 %). Algo más de la mitad de las personas con diabetes tenían buen control metabólico (n=73) y tenían una edad media (± desviación estándar) de 54.97 ± 7.80. Hubo variaciones mínimas en la distribución de la variable sexo. Las personas con DM2 con mal control metabólico tenían una mediana (rango intercuartílico) del tiempo de enfermedad significativamente superior a los que tenían buen control metabólico (p = 0.03). La mayoría de las personas con diabetes tipo 2 (n=116) utilizaba una Biguanida como antidiabético oral. La media de HbA1c fue mayor en los que tenían mal control metabólico (p<0.01). La mediana (primer cuartil-tercer cuartil) de la glucosa en ayunas fue mayor en los que tenían mal control metabólico (177 (151- 207) frente a 117 (101 - 129); p<0.01), de la misma forma la glucosa salival fue mayor en los que tenían mal control metabólico (2.93 (2.14 - 3.86) frente a 2.43 (1.82 - 3.17); p<0.01), mientras que el péptido C fue menor en los que tenían mal control metabólico (0.89 (0.78 - 1.01) frente a 1.45 (1.15 - 1.87); p<0.01). (Tabla 1).
Tabla 1 Características demográficas, antropométricas y de laboratorio de personas con DM2 con buen control metabólico (HbA1c<7 %) y mal control metabólico (HbA1c≥7 %)
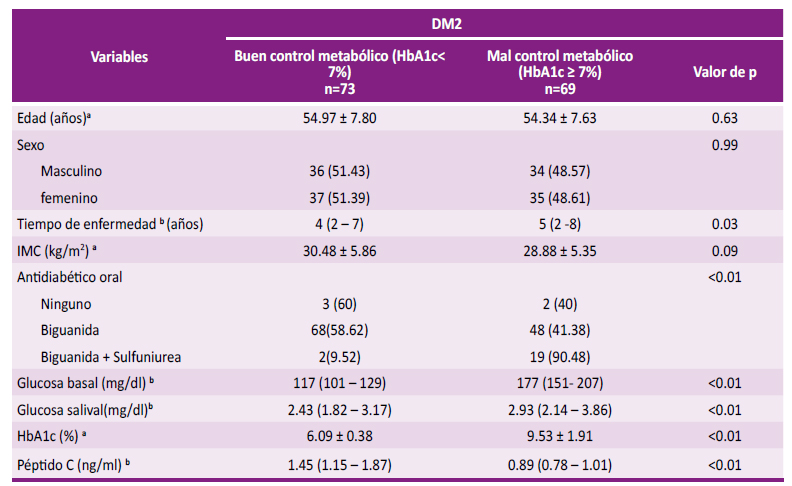
IMC: índice de masa corporal. HbA1c: Hemoglobina glicada. a media± desviación estándar. b mediana (primer cuartil-tercer cuartil). De lo contrario n (%).
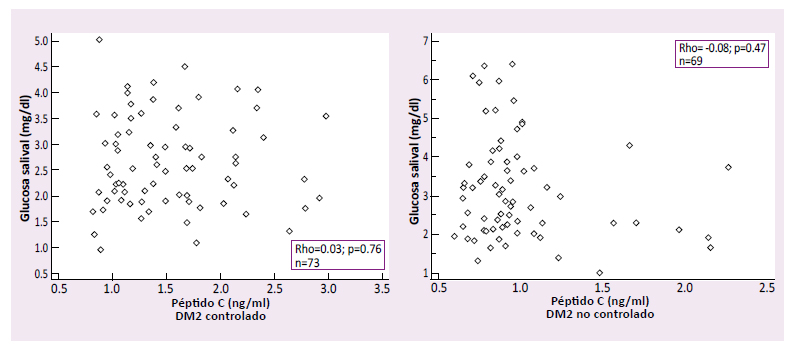
Correlación entre la glucosa salival y los marcadores de disfunción de célula beta (glucosa basal, HbA1c y péptido C) en personas con DM2 con buen control metabólico (HbA1c<7 %) y mal control metabólico (HbA1c≥7 %)
En los diabéticos con mal control metabólico, la glucosa salival mostró una correlación positiva débil significativa con la glucosa basal (r=0.23; p =0.04) y la HbA1c (r=0.26; p =0.02). El coeficiente de correlación entre la glucosa salival y el péptido C mostró una correlación negativa insignificante no significativa (r=
-0.08; p=0.47). En los diabéticos controlados los marcadores de disfunción de célula beta mostraron coeficientes de correlación insignificantes como se detalla en la tabla 2 y figuras 1,2 y 3.
Tabla 2 Correlación entre la glucosa salival y los marcadores de disfunción de célula beta (glucosa basal, HbA1c y péptido C) en personas con DM2 con buen control metabólico (HbA1c<7 %) y mal control metabólico (HbA1c≥7 %) mediante análisis de correlación de Spearman.
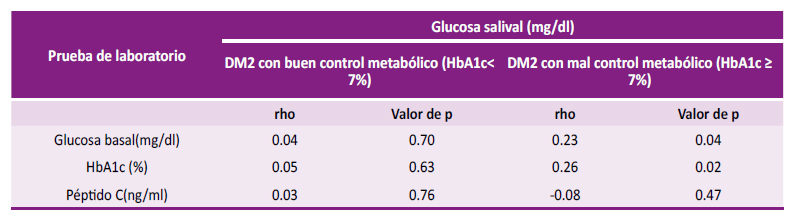
DM2: diabetes tipo 2. HbA1c: Hemoglobina glicada.
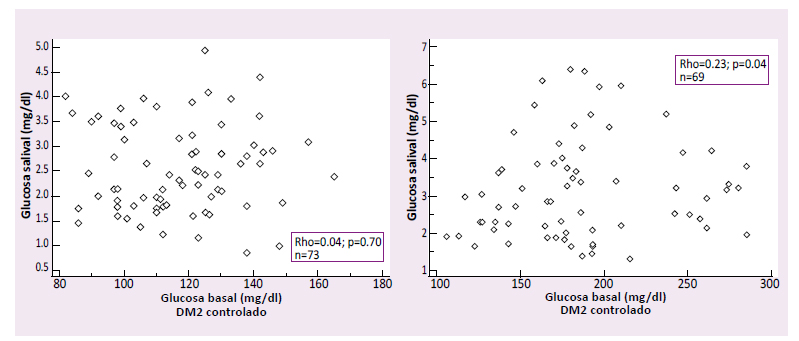
Figura 1 correlación entre la glucosa salival y la glucosa basal en personas DM2 con buen control metabólico (HbA1c<7 %) y mal control metabólico (HbA1c≥7 %).
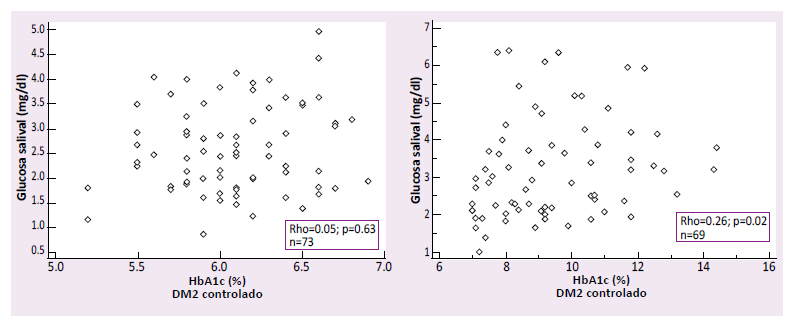
Figura 2 correlación entre la glucosa salival y la Hba1c en personas DM2 con buen control metabólico (HbA1c<7 %) y mal control metabólico (HbA1c≥7 %).
DISCUSIÓN
El presente estudio demuestra que las personas con DM2 con mal control metabólico (HbA1c≥7 %) presentan niveles de glucosa salival más elevada que los que tienen buen control metabólico; además de una correlación positiva significativa entre la glucosa salival con la glucosa basal y la HbA1c mientras que con el péptido C no se encontró correlación.
El valor normal de glucosa salival en población sana sin diabetes es < 2mg/dl.20 La mayoría de los estudios muestran que la glucosa en saliva de personas con DM2 en condiciones de ayuno es más elevada que en controles sanos. 21 Nuestro estudio encontró una mediana en los niveles de glucosa salival más elevados en diabéticos con mal control metabólico. Kumar et al (14), observó que los valores de glucosa salival en diabéticos controlados y no controlados oscilaban entre 7.4-17.8 mg/dL y 10.4-15.4 mg/dl respectivamente. Asimismo, Mishra et al 22), muestra resultados similares con valores de 9.34 ± 2.99 mg/dL en DM2 no controlados. Estos valores son más elevados que los mostrados en este reporte posiblemente debido a que usan como parámetro de control metabólico los niveles de glucosa (≥ 200mg/dl), nosotros utilizamos como referencia la HbA1c que es lo recomendado por las guías internacionales. 23) Nuestros datos son similares a los mostrados por Abikshyeet et al 24) el cual usa como referencia de control metabólico a la HbA1c e indica valores de glucosa salival 2.30 mg/dl (HbA1c< 7 %), 3.81 mg/dl (HbA1c< 7-8 %) y 6.72 mg/dl (HbA1c> 8%).Todos los estudios mencionados anteriormente incluido el nuestro utiliza como método de recolección la saliva no estimulada debido a que con esta técnica se obtiene mayor concentración de glucosa en saliva. 25
Diferentes estudios encuentran una correlación significativa entre la glucosa salival y glucosa basal en personas con diabetes y controles sanos 13,14,26), otros no han evidenciado correlación 27,28), por lo que aún es inconsistente la evidencia. Gupta et al 29) y Kumar et al 14) encontraron una correlación alta entre valores de glucosa salival y en sangre tanto en personas con DM2 controladas como no controladas, esto difiere de nuestro estudio que encontró una correlación débil pero significativa, esto podría deberse a la diferente metodología usada ya que ellos utilizan como control metabólico los niveles de glucosa basal y nosotros utilizamos la HbA1c. Algunos estudios han examinado la correlación entre la glucosa salival y la HbA1c demostrando correlaciones bajas o moderadas esto en personas con diabetes y controles sanos 30,31) a diferencia de Sashikumar et al 32) el cual no encontró una correlación entre los mismos. Nuestros resultados muestran una correlación positiva significativa entra glucosa salival y HbA1c en diabéticos con mal control metabólico. Si bien es cierto la correlación obtenida es débil esto puede deberse a que la HbA1c es el promedio de la glucosa en 3 meses pudiendo variar según el control que lleve el paciente a diferencia de los datos de glucosa en sangre que son de un día determinado y es más variable, por lo que nosotros recomendamos la evaluación con HbA1c como marcador de control metabólico. El péptido C indica cuánta insulina produce el páncreas y es utilizada para valorar la función de la célula beta 7), nuestro estudio muestra una mediana de péptido C menor en los diabéticos mal controlados; además, no se pudo demostrar una relación estadísticamente significativa entre el nivel sérico de péptido C y la glucosa salival. Banu et al 33) no encontró correlación entre valores de HbA1c y el péptido C, asimismo Relimpio et al 34) encontró correlaciones no significativas tanto entre la glucosa basal y HbA1c con el péptido C, indicando que el tratamiento antidiabético no afectó sus resultados. Estos hallazgos podrían deberse a varios factores como la edad, el tiempo de duración de la enfermedad, las comorbilidades presentes, la resistencia a la insulina y el grado de disfunción de célula beta,35) esto podría extrapolarse a la glucosa salival.
La glucosa es una molécula pequeña que se difunde fácilmente a través de las membranas semipermeables. 36) Las glándulas salivales actúan como filtros de glucosa y la hiperglucemia puede conducir a alteraciones en la membrana haciéndola más permeable conduciendo así a un aumento de la glucosa en la saliva. 37) El aumento de la glucosa salival podría explicarse por varios mecanismos, por ejemplo, los valores elevados de la glucosa en sangre se han relacionado como aumento en la formación de producto terminales de glicosilación avanzada generando alteración de la membrana basal y disfunción endotelial por lo que estados hiperglucémicos crónicos pueden formar productos como diacilglicerol, sorbitol y fructuosa 6 fosfato lo cual también puede generar un aumento de la permeabilidad generando una fuga de la glucosa a la saliva. 38) Por lo tanto, podemos inferir que en las personas con diabetes tipo 2 con mal control metabólico habrá un mayor cambio en la permeabilidad de la membrana basal llevando a una mayor cantidad de glucosa en la saliva.
Nuestro estudio tiene limitaciones. En primer lugar, existe la posibilidad de sesgo de selección debido a que solo se incluyó personas con DM2 y de un centro de investigación privado como CIDON por lo que nuestros resultados no pueden extrapolarse a la población en general. En segundo lugar, encontrar una correlación débil significativa podría sugerir que la glucosa salival tenga un impacto, pero podría haber otros factores que podrían ser determinantes importantes, por ejemplo, el estrés psicológico, estrés físico y tiempo de ayuno pudiendo incrementar el nivel de amilasa salival aumentando la descomposición del almidón en glucosa. 38) En tercer lugar, la correlación débil encontrada también podría deberse a factores como la utilización de la glucosa por las bacterias, la retención oral de carbohidratos de la dieta y la liberación de carbohidratos de glicoproteínas salivales como las mucinas, alfa amilasa, lactoferrina, etc. 39) En cuarto lugar, la glucosa en saliva no es de origen exclusivo de las glándulas salivales ya que también estudios indican valores de glucosa elevado en el líquido crevicular gingival.13) En quinto lugar, el uso de algunos medicamentos incluso los antidiabéticos como la sulfonilureas podrían alterar no solo la secreción de insulina sino también la secreción y el flujo salival. 38) En sexto lugar no existe un reactivo específico para estimar la glucosa salival, se realizó su estimación con la metodología de la medida de la glucosa en sangre según lo reportado en los diferentes estudios. (14) Finalmente, el método utilizado en este estudio para valorar la glucosa salival fue la oxidasa-peroxidasa la cual se puede sobreestimar debido a la acción antimicrobiana ejercida por la peroxidasa salival la cual detiene la formación de peróxido de hidrogeno por parte de las bacterias38. Por otro lado, la fortaleza de este estudio se basó en encontrar una correlación de la glucosa salival con parámetros de disfunción de célula beta incluyendo al péptido C, validando el método de estimación y usando como parámetro de control metabólico la HbA1c.
En conclusión, nuestro estudio demuestra que la glucosa salival es mayor en personas con DM2 con mal control metabólico. Además, se observó una asociación significativa y positiva entre los niveles de glucosa salival con la glucosa en sangre y la HbA1c, pero no con el péptido C. Sin embargo, a pesar de estos resultados la glucosa salival no genera suficiente precisión diagnóstica y predictiva para el monitoreo de la DM2, por lo que es necesario realizar estudios teniendo en cuenta los posibles factores que puedan alterar su medición y así estandarizar el método de detección para poder tener una herramienta no invasiva útil para monitorizar el control glucémico en esta población.