INTRODUCCIÓN
La enfermedad por el virus de inmunodeficiencia humana (VIH) hasta hoy continúa siendo una problemática de salud pública mundial. A pesar de los avances en las estrategias de prevención, diagnóstico y manejo del VIH desde su aparición en 1981, esta infección aún sigue siendo una problemática de salud pública global 1-3. Las gestantes pueden transmitir el VIH a sus hijos durante el trabajo de parto y la lactancia 4,5. En Perú, la normativa vigente indica que en el caso de gestantes, se utilizan pruebas rápidas de detección de VIH y ELISA para el tamizaje 6-8.
Durante la gestación es importante recibir terapia antirretroviral (TARV) tanto para la prevención de la transmisión perinatal de VIH como para mantener la salud de la madre. Los antirretrovirales son eficaces para disminuir la mortalidad y la carga viral en la población con VIH, siempre y cuando se siga el régimen de tratamiento de forma continua. Sin embargo, los efectos tóxicos y las reacciones adversas asociadas a estos medicamentos pueden dificultar la adherencia de los pacientes al tratamiento 9,10,12. Haber permitido que más mujeres seropositivas se embaracen, sumado a un adecuado control y adherencia al tratamiento, ha reducido significativamente uno de los mayores miedos de las mujeres infectadas por el VIH: el riesgo de transmisión madre a hijo (TMI); la probabilidad de que esto ocurra con la adecuada medicación se ha reducido considerablemente a menos del 1% 11,13-15. Además, tanto el paciente como su pareja recibirán consejería y educación sanitaria, y la paciente será informada anticipadamente ante posibles riesgos y beneficios del TARV 6,7.
La infección por VIH en gestantes se relaciona con un riesgo aumentado de resultados adversos neonatales (RAN), principalmente debido a la exposición fetal al TARV. La falta de tratamiento se relaciona con un incremento en la incidencia de TMI, muerte fetal (MF), parto pretérmino (PP), peso bajo al nacer (BPN) y neonatos pequeños según edad gestacional (PEG) 12,16-20. Existen estudios donde se indica que el momento de inicio de TARV puede tener un impacto en los RAN. Estos estudios compararon el momento de inicio del TARV preconcepción y durante la concepción, y encontraron una mayor incidencia de RAN en los casos en los que el TARV se inició preconcepción. Entre los RAN más frecuentes en este grupo se encontraron BPN, PP y PEG 21,22,25.
La asociación de inicio de TARV y RAN continua en evaluación; un estudio realizado por Snijdewind I, et al. (2018) determinó si existía asociación entre el inicio de TARV y la aparición de PEG. Se analizaron a 1392 gestantes VIH positivos, de las cuales 550 mujeres utilizaron TARV preconcepción y 842 usaron TARV posconcepción. Las pacientes que comenzaron TARV preconcepción habían estado recibiendo tratamiento durante una media de 3,48 años. Los resultados fueron que los neonatos de mujeres que usaron TARV preconcepción fue de 27,3% comparado con 21,5% que iniciaron TARV posconcepción (p=0,01). Al estratificar para un régimen TARV basado en IP o NNRTI, el análisis multivariado también indicó un riesgo significativamente mayor de PEG entre las madres que usaron un régimen basado en IP preconcepción en comparación con aquellas que usaron este régimen solo después de la concepción 24.
Mas tarde, Hoffman et al. (2019) evaluaron los RAN en 277 mujeres de las cuales 266 tuvieron una gestación. Las pacientes incluidas eran mujeres posparto de 42 días a las que separaron en dos equipos; el primer grupo, con 140 mujeres, continuó el TARV hasta la concepción y posterior parto. El segundo grupo de 126 pacientes interrumpieron la TARV y lo reiniciaron durante la gestación. Los resultados revelaron que hubo una mayor incidencia de casos en el primer grupo. El primer grupo presentó 27 casos de aborto espontáneo (AE), es decir el 19,3%; además, muestra resultados de la combinación de AE y MF en 33 casos, que representó el 23,6% del total de casos del primer grupo comparado con el segundo grupo que presentó 10,3 y 11,9% de casos, respectivamente. El régimen de TARV mayoritariamente usado en ambos grupos empleó un IP en combinación con otros antirretrovirales; en el primer grupo 86% lo utilizaron en tanto que en el segundo lo usaron 53%. Los resultados indicaron que aquel grupo que tenían en su esquema un IP mostraba menor incidencia de RAN en comparación con el uso únicamente de inhibidor de transcriptasa inversa no nucleósido (NNRTI) 23. También Ikumi et al. (2021) examinaron la patología de la placenta de 130 gestantes, a las cuales separaron en dos grupos: una población de 53 (40,8%) mujeres que iniciaron TARV preconcepción y un grupo de 77 (59,2%) que iniciaron TARV durante la gestación. Los resultados mostraron un aumento en la incidencia de BPN (11,3%), PP (7,5%) y PEG (15,1%) en el grupo que inició TARV preconcepcional comparado con el que inició durante la gestación. En cuanto al esquema antirretroviral utilizado, el 91,5 % de mujeres estaban en un régimen de dosis fija de tenofovir (TDF)+ lamivudina (3TC) + efavirenz (EFV); dos mujeres (1,5 %) estaban en zidovudina (AZT) + 3TC + nevirapina (NVP); seis 6 (4,6%) estaban en AZT + emtricitabina (FTC) o 3TC + EFV y tres (2,3%) estaban en un régimen basado en un inhibidor de proteasa (IP); no hubo diferencia en los resultados sobre el régimen utilizado 18. Ante estas evidencias, buscamos determinar la asociación entre el inicio de TARV y la aparición de RAN en mujeres con diagnóstico confirmado por VIH.
MATERIALES Y MÉTODOS
Tipo de estudio
Se realizó un estudio observacional comparando dos cortes retrospectivas a partir de la revisión de historias clínicas disponibles en el archivo de un hospital de referencias regional Nivel III (Hospital Belén) en la ciudad de Trujillo, pertenecientes a gestantes que iniciaron TARV entre enero 2015 hasta marzo 2023.
Población y muestra
La muestra se obtuvo mediante muestreo aleatorio simple. Se utilizó una estimación basada en una diferencia de proporciones del 20% en base a una potencia estadística del 80% y un nivel de confianza del 95%. Para el cálculo de la muestra se utilizó el programa EPIDAT 4.2 27. Para la selección aleatoria de los participantes se empleó el programa IBM SPSS Stadistics 27.0. A través de un proceso de selección aleatoria simple se logró la participación de 84 gestantes que habían iniciado el TARV preconcepción y 84 gestantes que habían comenzado TARV durante la gestación en el Hospital Belén de Trujillo (HBT) durante el periodo 2015 hasta marzo del año 2023, lo que constituyó una muestra total de 168 pacientes para el estudio.
Se incluyen a pacientes mujeres mayores de 18 años a 40 años, con diagnóstico de VIH, con indicación de inicio de TARV en el Servicio de Infectología del HBT. Se incluyó a pacientes que inician TARV preconcepción y durante la gestación, pacientes que se encuentran dentro del programa TARGA, pacientes que cumplen el TARV sin interrupción y se controlan adecuadamente. Se excluyeron del estudio a pacientes con VIH mal controlado o con mala adherencia a TARV, pacientes con VIH que abusan de alcohol o drogas, pacientes VIH con trastornos psiquiátricos, y pacientes con VIH con datos incompletos en historia clínica o no cuenta con ella.
Variables
La variable independiente fue: el momento de inicio de TARV (antes de la concepción vs. después de la concepción). Las variables dependientes fueron: RAN donde se incluyó a BPN (peso menor a 2500 g), parto prematuro (nacimiento antes de las 37 semanas de gestación), PEG (peso y/o talla este menos del percentil 10 o menor a 2 desviaciones estándar), TMI (neonato con prueba confirmatoria positiva a VIH) y aborto espontaneo (muerte de feto antes de las 20 semanas de gestación). Las variables intervinientes fueron: edad materna, lugar de procedencia (urbano o rural), estado civil materno, comorbilidades (hipertensión arterial, diabetes mellitus, obesidad, hipotiroidismo, tuberculosis), grado de instrucción, valor de recuento de linfocitos TCD4 y tipo de TARV utilizada.
Procedimientos
La fuente primaria de los datos constituyó el registro de los pacientes del servicio de infectología y las historias clínicas hospitalarias del archivo de estadística del HBT. Para la obtención de datos se procedió a llenar una ficha que contempló las variables del estudio, la cual sirvió, además, para el seguimiento de los eventos. En un principio se presentó la solicitud para registrar el trabajo en la Escuela de Medicina Humana de la Universidad Privada Antenor Orrego; después de recibir la aprobación, se procedió a presentar la solicitud al Comité Institucional de Ética en Investigación del HBT para su ejecución. Se solicitó al área de Archivo del hospital un grupo de 168 historias clínicas que fueron obtenidas previamente al azar. Después de obtener la aprobación correspondiente se llevó a cabo la recopilación de historias clínicas que cumplieron con los criterios de inclusión y exclusión establecidos. Los datos fueron recabados utilizando las fichas predeterminadas detalladas. Posteriormente, estos datos fueron transferidos a tablas en Microsoft Excel 2016 y luego analizados en IBM SPSS 27.0 para su posterior tabulación y análisis.
Análisis de datos
El análisis estadístico se realizó con el paquete estadístico IBM SPSS Statistics 27.0. Las variables cualitativas fueron tabuladas utilizando tablas cruzadas, presentando las frecuencias absolutas y porcentuales. En cuanto a las variables cuantitativas, se presentan las medias y/o desviaciones estándar. Se empleó la prueba de chi cuadrado junto con el riesgo relativo, utilizando intervalos de confianza del 95%. Las pruebas T de Student fueron usados para variables cuantitativas (según distribución normal o no) Para establecer la significancia estadística se utilizó un valor del 5% (p<0,05). Debido a la naturaleza del estudio, se utilizó el riesgo relativo (RR) como estimación de la magnitud de asociación, junto con su intervalo de confianza del 95%. No se hicieron modelos multivariados debido al tamaño muestral limitado.
Aspectos éticos
Al ser un estudio de revisión de datos de las historias clínicas, parte del investigador, por lo que no se requirió consentimiento se solicitó revisión y aprobación por el Comité de Ética del HBT.
Se respetó y se mantuvo la confidencialidad de los datos. No se realizó ningún tipo de intervención directa en el paciente por parte del investigador, por lo que no se requirió consentimiento informado. En este estudio se obtuvo la aprobación tanto del
Tabla 1 Características sociodemográficas y clínicas de las mujeres con diagnóstico de VIH y el momento de inicio de TARV en el tratamiento de VIH en HBT durante 2015-2023
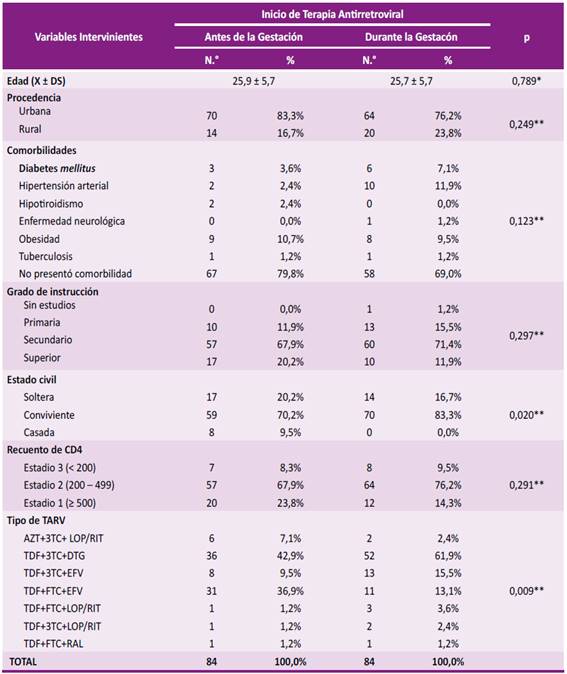
Fuente: Hospital Belén de Trujillo - Fichas de recopilación: 2015-2023.
AZT: zidovudina. 3TC: lamivudina. LOP/RIT: lopinavir/ ritonavir. TDF: tenofovir. DTG: dolutegravir. EFV: efavirenz. FTC: entricitabina. RAL: raltegravir.
p: Prueba chi cuadrado
* Prueba t de Student
** Prueba chi cuadrado
Comité de Ética de la Universidad Privada Antenor Orrego (Resolución de comité de bioética N.° 0732 - 2023-UPAO), así como del Hospital Belén de Trujillo (constancia de aprobación ética N.° 047-2023-HBT). Los datos recopilados durante la investigación fueron manejados de manera confidencial y utilizados exclusivamente por los investigadores 28-31.
RESULTADOS
Se examinaron 84 mujeres que comenzaron TARV preconcepción y 84 mujeres que iniciaron la TARV durante la gestación, todas ellas cumplieron con los criterios de selección establecidos. Al analizar las características sociodemográficas, como la edad materna, el nivel educativo, las comorbilidades, el lugar de origen y el recuento de linfocitos TCD4, no se encontró ninguna asociación significativa con el inicio de TARV (p>0,05). Los resultados indican que el estado civil (p=0,02) y el tipo de terapia antirretroviral (p=0,009) mostraron asociaciones significativas con el momento de inicio de TARV. Específicamente, se observó que un mayor porcentaje de mujeres solteras (20,2%) y personas que recibieron la combinación de TDF+ FTC+ EFV (36.9%) comenzaron TARV preconcepción (Tabla 1).
La frecuencia de resultados adversos neonatales fue 48,8% en mujeres que iniciaron TARV antes de la concepción y 21,4% en las que iniciaron terapia posconcepción, siendo esta diferencia significativa (p<0,001). Es crucial destacar que el inicio de TARV preconcepción se identifica como un factor de riesgo significativo para la presentación RAN, con un riesgo relativo (RR) de 2,27 (IC 95%: 1,42 - 3,62, p <0,001). Esto implica que en preconcepción existe más del doble de probabilidades que se produzca RAN en comparación con las gestantes que inician la TARV durante la concepción (Tabla 2).
Tabla 2 Comparación del inicio de TARV antes versus durante la gestación como factor de riesgo asociado a resultados neonatales adversos en el tratamiento de VIH en HBT durante 2015-2023
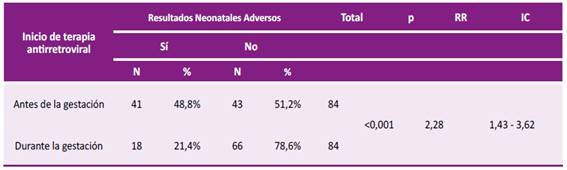
FUENTE: Hospital Belén de Trujillo - Fichas de recopilación: 2015-2023.
p: prueba chi cuadrado
RR: prueba riesgo relativo
IC: intervalo de confianza
Se observa una asociación significativa entre BPN (p=0,01) y PEG (p=0,03) con el inicio de TARV preconcepción. Es esencial destacar que el inicio de la TARV antes del embarazo se identifica como un factor de riesgo significativo para la presentación de RAN, tanto en BPN con un riesgo relativo (RR) de 1,70 como en el recién nacido PEG con un RR de 1,58. Esto implica que en preconcepción existe una probabilidad 1,7 y 1,5 veces mayor de que se produzcan RAN en comparación con las gestantes que inician la TARV durante la gestación (Tabla 3).
Tabla 3 Comparación del inicio de TARV antes versus durante la gestación como factor de riesgo asociado a resultados neonatales adversos en el tratamiento de VIH en HBT durante 2015-2023
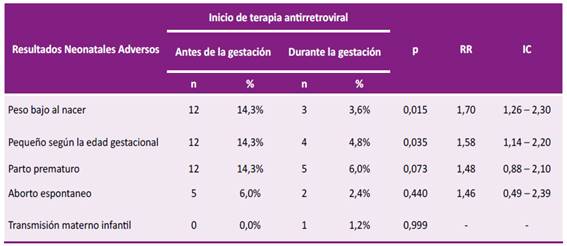
FUENTE: Hospital Belén de Trujillo - Fichas de recopilación: 2015-2023.
p: prueba chi cuadrado
RR: prueba riesgo relativo
IC: intervalo de confianza
DISCUSIÓN
La administración adecuada de la TARV no solo es crucial para mejorar la salud de la persona afectada, sino además previene la transmisión perinatal del VIH y otros resultados adversos que pueden afectar al recién nacido. De acuerdo con las directrices establecidas por la OMS se recomienda que toda la población infectada por el VIH, incluyendo las mujeres embarazadas, reciban una combinación de tres medicamentos antirretrovirales 26. Desde el año 2013 se ha sugerido iniciar la TARV sin importar el resultado del recuento de linfocitos CD4, con el objetivo de proporcionar manejo terapéutico a toda la población con diagnóstico positivo de VIH 1. Este enfoque busca mejorar los resultados en las mujeres y en los neonatos al minimizar el riesgo de transmisión perinatal y otros efectos adversos relacionados con el VIH. Escoger el TARV adecuado depende de diversos elementos, tales como la farmacocinética, la efectividad en la reducción de la carga viral, la seguridad del fármaco, los posibles efectos secundarios, la resistencia a los medicamentos, la dosis y la biodisponibilidad del mismo 32.
Mecanismo fisiopatológico del TARV en el feto
Comenzar la TARV antes o durante el embarazo incrementa la exposición del feto a estos medicamentos, lo que podría aumentar el riesgo de RAN, como BPN, PP y PEG 18,26,32. Se ha teorizado que la exposición materno-fetal a TARV que contienen IP podría provocar alteraciones en el desarrollo y funcionamiento del útero y la placenta, debido a modificaciones en las concentraciones plasmáticas de estradiol-progesterona materna 32. Según los mecanismos fisiopatológicos, se sugiere que el desarrollo adecuado del feto depende de una vascularización apropiada y de factores de crecimiento que facilitan los procesos adecuados de angiogénesis y vasculogénesis. Se ha sugerido que la infección materna puede provocar complicaciones neonatales adversas al desregular los factores angiogénicos, creando un estado antiangiogénico debido a la disminución de concentraciones de factores como el PIGF (factor de crecimiento placentario) y al aumento de proteínas como la endoglina. En cuanto a la influencia de TARV en el surgimiento de estas complicaciones, se ha observado una inflamación sistémica crónica debido al aumento del receptor 2 del factor de necrosis tumoral (TNF). Como se mencionó anteriormente, se ha observado una desregulación crónica en la cascada inflamatoria y una alteración en los procesos de angiogénesis a nivel uterino y placentario, lo que podría explicar la aparición de RAN 25,36.
Asociación entre tipo de esquema antirretroviral y la frecuencia de RAN
En el análisis de la variable interviniente, que fue el tipo de TARV utilizado, se observó que la combinación de TDF + FTC + EFV, que no incluía un IP, fue una de las opciones más utilizadas. Se encontró una asociación significativa (p<0,01) entre la utilización de este tipo de TARV y el inicio del tratamiento, así como la aparición de RAN en mujeres con VIH. Los resultados encontrados muestran similitudes con los hallazgos presentados por Hoffman et al, quienes observaron que el tipo de esquema utilizado, específicamente la combinación de fármacos que no contenía IP, tenía la mayor tasa de incidencia de RAN, como AE y MF, con un 2,0% y HR de 4,70 (IC 95 %, 1,34-16,53) 23. Por otro lado, en el trabajo presentado por Sexton et al. también exploró la asociación entre el inicio del TARV preconcepción y la aparición de RAN. En sus resultados no se halló una asociación significativa entre el régimen que contenía IP y el régimen basado únicamente en NNRTI (RR 1,16; IC del 95%: 0,98 a 1,37) 21. Estos descubrimientos subrayan la complejidad de los resultados y resaltan la necesidad de considerar múltiples factores al evaluar el impacto del TARV en los RAN.
Asociación entre momento de inicio de TARV y la frecuencia de RAN
En este estudio, tras evaluar a 168 gestantes diagnosticadas con VIH que estaban recibiendo TARV, se observó que el 48,8% de las gestantes que comenzaron el TARV antes de quedar embarazadas tuvieron recién nacidos con resultados adversos. Estos resultados difieren de los presentados en el estudio de Hugo et al. donde solo el 2% de las mujeres que iniciaron la terapia antirretroviral antes del embarazo tuvieron recién nacidos prematuros y con bajo peso para su edad gestacional, considerados ambos como resultados adversos. Esta discrepancia estadística podría ser el resultado de las diferencias en las metodologías empleadas en ambos estudios, que incluyen el tipo y diseño del estudio, así como el tamaño muestral. Estas diferencias limitan la comparación de la información y sugieren la necesidad de llevar a cabo estudios más amplios relacionados con el enfoque temático planteado a nivel nacional y local 38.
Al examinar a las gestantes que comenzaron TARV durante su embarazo, se encontró que el 21,4% tuvieron recién nacidos con RAN. Hallazgos casi similares fueron observados por Carbajal y Urdiales et al., quienes demostraron que el 30,96% de las mujeres que evaluaron e iniciaron el TARV durante la gestación presentaban RAN. Esto sugiere que iniciar el TARV después de la concepción podría aumentar la frecuencia de eventos adversos en el neonato. Por lo tanto, se destaca la importancia de la atención prenatal en estas mujeres para minimizar estos desenlaces 39.
Posteriormente, se demostró que iniciar TARV preconcepción era factor de riesgo para presentar RAN (p<0,01, RR=2,27), ya que el 48,8% de los neonatos con RAN correspondían a mujeres que habían comenzado el TARV preconcepción. En contraste, las mujeres que habían iniciado el TARV durante su embarazo, principalmente, no tuvieron RAN en sus bebés (78,6%). Sin embargo, Sexton et al. presentaron conclusiones completamente opuestas pues afirmaron que la exposición antes de la concepción no estaba asociada con el riesgo de resultados perinatales adversos 21. La discrepancia en las evidencias encontradas podría atribuirse a la diferencia en los tipos de estudio, ya que los autores mencionados llevaron a cabo una revisión secundaria basada en 25 investigaciones primarias.
Los RAN principalmente identificados en los bebés de madres con terapia antirretroviral preconcepción fueron BPN y PEG, con una incidencia del 14,3% en ambos casos. Estos desenlaces adversos están significativamente asociados con el inicio del TARV antes del embarazo. En un estudio similar, Ikumi et al. encontraron que el BPN era más común en los neonatos de mujeres que inician el TARV preconcepción (15,1%), en comparación con aquellas madres que comenzaron la TARV durante la gestación (5,2%), aunque se encontró que esta diferencia no fue significativa estadísticamente 18. Por otro lado, Snijdewind et al. identificaron que PEG eran más comunes en aquellas madres que comenzaron su TARV preconcepción, asociación que fue significativa (p<0,01) en comparación con los recién nacidos de mujeres que iniciaron TARV después de la concepción 24. Estos hallazgos resaltan la importancia del momento de inicio del TARV en relación con RAN.
Limitaciones
La principal limitación de este estudio es que no pudieron ajustar los riesgos relativos debido al tamaño muestral limitado. Por lo tanto, es posible que los resultados exploratorios obtenidos sean afectados por posibles confusores como tiempo en TARV, presencia de resistencia a TARV, estadio de la enfermedad y la carga viral. Tampoco se pudo abordar las posibles complicaciones y resultados adversos del TARV en la mujer antes y durante la gestación; en este estudio se reconoce que estas son áreas de investigación relevantes y merecen una consideración cuidadosa en futuros estudios para comprender completamente el impacto de TARV en la salud materna. La información recopilada abarca un sector de población (solo data del Ministerio de salud de Perú), sumado a que el tamaño poblacional únicamente se centró en una sede hospitalaria y, además, en no todos los pacientes se encontró exámenes de laboratorio actualizados, ya sea por falta de recursos del paciente o por falta de cobertura de los mismos por parte del SIS (Seguro Integral de Salud). Es cierto que en estudios sobre VIH y TARV no es ético ni práctico tener un grupo de pacientes que no reciban tratamiento. La TARV es el estándar de atención para el VIH y se ha demostrado que mejora considerablemente la calidad de vida y prolonga la sobrevida de las personas con VIH. Por lo tanto, no se puede tener un grupo de control no expuesto al TARV en este contexto.
CONCLUSIONES
Finalmente determinamos que al comparar ambos grupos que inician TARV, se encontró una mayor incidencia de RAN en las mujeres que iniciaron la TARV preconcepción en comparación con aquellas que la comenzaron durante la gestación como parte del tratamiento para el VIH (48,8 % vs. 21,4%, respectivamente) en un hospital de Trujillo. Lo que nos hace concluir finalmente que el inicio de la TARV preconcepción se identificó como un factor de riesgo asociado para los RAN en comparación con el inicio de la TARV durante la gestación en el tratamiento del VIH. Entre los RAN principalmente identificados en los neonatos de mujeres que inician terapia antirretroviral preconcepción se hallaron BPN y PEG.















