Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.72 n.4 Lima oct./dic. 2006
Derivados de bencimidazol cristales líquidos
Benzimidazole-based liquid crystals
Oscar Ninán,a,b Robert Chareyron,c Oscar Figuereido,c Julio Santiagob,d
a) Sección Química, Pontificia Universidad Católica del Perú, Av. Universitaria Cdra. 18, Lima 32, Perú.
b) Fac. Química e Ing. Química, Universidad Nacional Mayor de San Marcos, Lima 1, Perú
c) Laboratoire de Chimie Analytique Industrielle, CPE Lyon, 43 boulevard du 11 novembre 1918, 69616 Villeurbanne, Lyon, France.
d) Investigación y Desarrollo Tecnológico, Instituto Peruano de Energía Nuclear, Av. Canadá 1470, Lima 41, Perú. jsantiago@ipen.gob.pe
RESUMEN
Se ha sintetizado el 2-pentadecilbencimidazol (I) y el 1,1'-bis(octadecil)-2,2'- bibencimidazol (II) y caracterizado por diferentes técnicas espectroscópicas, 1H- RMN, 13C-RMN, FT-IR, UV-Visible, y análisis elemental. Se ha estudiado sus propiedades mesomórficas por calorimetría diferencial de barrido y microscopía óptica con luz polarizada. I exhibe una fase esméctica C enantiotrópica entre 93 y 102 °C, mientras que II exhibe una fase monotrópica colestérica entre 52 y 29 °C. La aparición de esta fase es inusual teniendo en cuenta que la molécula no es quiral. I y II representan los primeros cristales líquidos con derivados de bencimidazol.
Palabras clave: Derivados de bencimidazol, bibencimidazol, cristal líquido, Colestérico
ABSTRACT
2-pentadecylbenzimidazole (I) and 1,1'-bis(octadecyl)-2,2'-bibenzimidazole (II) have been synthesized and characterized by 1H-RMN, 13C-RMN, FT-IR, UV-Visible spectroscopy and elemental analysis. Their mesomorphic properties have studied by differential scanning calorimetry and optical microscopy with polarized light. I exhibit an enantiotropic smectic C phase between 93 and 102 °C, whereas II exhibit a monotropic cholesteric one between 52 and 29 °C. The appearance of this phase is unusual considering that the molecule is not quiral. I and II represent the first benzimidazole-based liquid crystals.
Key words: Benzimidazole derivatives, bibenzimidazole, liquid crystal, cholesteric phase
INTRODUCCIÓN
El bencimidazol es un heterociclo muy conocido por sus buenas propiedades antibacterianas y antifúngicas.1 Igualmente, algunos derivados del bencimidazol, como el omeprazol, actúan como inhibidores de la bomba de protones de manera selectiva e irreversible en la región gástrica. La farmacocinética y farmacodinámica de estos inhibidores es ideal para el tratamiento de úlceras estomacales, y, en combinación con otros fármacos, erradicación del Helicobacter pylori. 2,3 También se ha estudiado su actividad frente a diversos virus, como el Human cytomegalovirus, HCMV,4 y el virus de la influenza. 5
El estudio del bencimidazol y sus derivados en ciencia de materiales data de hace mucho tiempo. Por ejemplo, se han preparado películas protectoras de gran estabilidad térmica a partir de polímeros organometálicos de bencimidazol con Cu y Zn. La estabilidad térmica de estos polímeros varía según el metal: 250 °C para el de cobre y hasta 500 °C para los de zinc.6 Junto con otras moléculas de bajo peso molecular, el bencimidazol ha sido evaluado como fotodetector y como membranas conductoras de protones en celdas solares.7-9 Recientemente, el bencimidazol y sus derivados poliméricos han sido estudiados por sus propiedades ópticas no-lineales. La generación de ondas armónicas secundarias en el bencimidazol fue cinco veces mayor que en el hidrógeno fosfato de potasio (KDP), material de referencia. 10,11
El bibenzimidazol ha sido muy estudiado por su similitud estructural con la bipiridina, especialmente por sus potenciales propiedades optoelectrónicas.12 De otro lado, recientemente se está estudiando sus propiedades biológicas. Por ejemplo se ha estudiado su actividad inhibitoria de la topoisomerasa I. 13
Los cristales líquidos son sustancias que están en un estado intermedio de la materia, con la fluidez de un líquido y algunos parámetros de orden de un sólido cristalino. Un cristal líquido tiene geometría anisotrópica, por lo general en forma de cilindro o disco, lo que permite a las moléculas apilarse en forma paralela; sin embargo, tienen la facilidad de deslizarse entre ellas conservando la dirección del eje longitudinal. Una consecuencia de del apilamiento de las moléculas es la anisotropía de sus propiedades físicas, es decir, las propiedades dependen de la dirección en la que se miden. La viscosidad, por ejemplo, es menor en el sentido del eje director. Se necesita menos energía para deslizar las moléculas a lo largo del eje principal que hacia los lados. 14
Los cristales líquidos son considerados como uno de los grupos más promisorios de materiales para la aplicación en dispositivos optoelectrónicos por la facilidad con la que se orientan sus moléculas por acción de un campo eléctrico y/o magnético externo, cosa que no ocurre en un cristal fotónico. Los electrones y núcleos de los cristales fotónicos oscilan en respuesta a la radiación electromagnética, cualidad que es aprovechada en aspectos como el almacenamiento o transmisión de información en electrónica. Sin embargo, la modulación de la diferencia energética entre la banda de valencia y la banda de conducción de estos materiales sería posible si se cambia la orientación de las moléculas durante una transición de fase líquido cristalina.
Los derivados de bencimidazol no han mostrado, hasta la fecha, propiedades líquido-cristalinas o mesomórficas. Entre los ejemplos más cercanos podemos mencionar los complejos de Ag(I)-alquilimidazol que presentan una fase esméctica A.15 Sin embargo, los complejos análogos con alquilbencimidazol ni los ligandos orgánicos presentaron dichas propiedades.
En el presente trabajo se ha preparado y estudiado las propiedades térmicas del 2-pentadecilbencimidazol y el 1,1'-bis(octadecil)-2,2'-bibenzimidazol.
PARTE EXPERIMENTAL
Materiales:
La o-fenilendiamina (Aldrich) y los solventes se utilizaron tal como se recibieron. El cloruro de oxalilo fue destilado previamente para la síntesis de la oxamida.
Los compuestos sintetizados se purificaron por recristalización y por cromatografía de columna, utilizando sílica gel G-60 mesh 10-230 ASTM. La pureza se evaluó por cromatografía de capa fina utilizando cromatofolios con silicagel 60 F254 sobre aluminio (Merck) y su evaluación se hizo bajo luz ultravioleta 254 a 366nm y/o 254nm.
Los espectros infrarrojo se obtuvieron en un Perkin Elmer FT1600, utilizando discos de KBr preparados con mezclas de muestra y KBr (1:100). Los espectros RMN se obtuvieron con un espectrómetro Bruker DRX500, con CDCl3 como solvente.
Los termogramas se obtuvieron con un calorímetro Mettler DSC12E y las observaciones de las texturas desarrolladas fueron hechas con un microscopio Nacher equipado con una platina de calentamiento Mettler FP80 y controlador de temperatura Mettler FP82. Las imágenes fueron visualizadas y capturadas con una cámara video Sony CDD-IRIS.
Síntesis del 2-pentadecilbencimidazol (I)
5g (46,3 mmol) de o-fenilendiamina se mezclaron con 10,64g (46,3 mmol) de ácido palmítico en 50mL de 1,2-diclorobenceno. La mezcla se mantuvo bajo reflujo por 38h. Al enfriar se obtiene una solución de color oscuro, la cual se guardó en congelador por una noche. El precipitado que se formó se filtró y se lavó con hexano, el sólido se recristalizó varias veces en hexano utilizando carbón activado, hasta llegar a obtener un sólido cristalino de color blanco. Punto de fusión: 93,6 ºC. Rendimiento 30%. IR (cm-1): 3103, 2925, 2856, 1536, 1459, 1413, 1394. 1H-RMN (δ: ppm): 0,89 (t, -CH2CH3) 1,25m 1,85 (quint, NCH2CH2CH2) 2,93 (t, NCH2CH2) 7,26 (dd, CH arom.) 7,57 (dd, CH arom.). 13C-RMN (d: ppm): 14,08; 22,67; 28,25; 29,67; 31,91; 114,64; 122,19; 138,40; 155,15. Análisis elemental (C22H36N2 ): Calculado: C(80,43 %) H(11,04 %) N(8,53 %). Encontrado: C(80,32 %), H(10,91 %), N(8,38 %).
Síntesis de 2,2'-bibencimidazol
2,45 g (22,72 mmol) de o-fenilendiamina se mezclaron con 1g (11,36 mmol) de oxamida en 15 mL de etilenglicol y se mantuvo bajo reflujo por 24 horas. Luego se dejó enfriar y se agregaron 100 mL de agua caliente y se filtró inmediatamente. El producto se recristalizó en etilenglicol, previo tratamiento con carbón activo. Esta operación se repitió varias veces hasta obtener cristales de color amarillo en forma de pequeñas agujas. Rendimiento 17%. El producto no funde hasta 300 ºC. IR (v: cm-1): 3062, 2586, 1625, 1584, 1501, 1426, 1396, 1342, 1138, 946, 741. UV-vis (λ: nm) (ε: L mol-1 cm-1): 315 (1789), 324 (2386), 341 (1930).
Síntesis de 1,1'-bis(octadecil)-2,2'-bibencimidazol (II)
En un balón de 50 mL se mezclaron 15 mL de DMF y 0,5g de KOH; se agitó por 1 hora a temperatura ambiente y luego se agregaron 0,4 g (1,69mmol) de 2,2'- bibencimidazol. Se agita por media hora más, hasta completa disolución, entonces se adicionaron 1,24 g de 1-bromooctadecano. Esta mezcla se mantuvo bajo agitación por 48h. Luego la mezcla se vertió sobre 150g de hielo y se filtró. El sólido se lavó con etanol, y purificó por cromatografía de columna (silicagel, CHCl3). Finalmente fue recristalizado en hexano obteniéndose cristales pequeños en forma de agujas de color amarillo pálido. Punto de fusión: 93,5 ºC. Rendimiento 27%. IR (v: cm-1): 3048, 2950, 2919, 1390, 1345, 742. 1H-RMN (δ: ppm): 0,88 (t, -CH2CH3), 1,26 (m, CH3(CH2)14 ) 1,85 (quint, NCH2 CH2 CH2 ), 4,89 (t, NCH2CH2 ), 7,33 (t, CH arom.), 7,38 (t, CH arom.), 7,49 (d, CH arom.), 7,85 (d, CH arom.).13 C-RMN (d: ppm): 14,09; 22.68; 26,78; 29,11; 29,69; 29,95; 31,32; 45,20; 110,35; 120,48; 122,53; 123,64; 135.52; 142,84; 142,98. UV-vis (λ: nm) (ε: L mol-1 cm-1): 395 (2637), 415 (2854), 435 (2284). Análisis Elemental: Calculado (C50H82N4 ):(81,24%) N(11,18%) H(7,58%). Encontrado: (81,11%) N(11,37%) H(7,33%).
RESULTADOS Y DISCUSIÓN
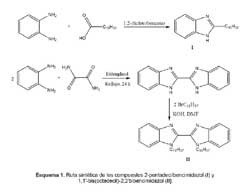
Síntesis
Los compuestos I y II fueron preparados según el esquema 1. La síntesis del 2-pentadecilbencimidazol se realizó utilizando el 1,2- diclorobenceno como solvente, a diferencia de otros métodos que realizan la reacción sin solventes,16 en HCl 4M 17 o ácido polifosfórico.18 El compuesto obtenido inicialmente fue de color marrón oscuro por lo que fue necesario recristalizarlo varias veces con hexano.
Las propiedades físicas del 2,2'-bibencimidazol obtenido se ajustan a las descritas por la literatura, es decir, es muy poco soluble en solventes orgánicos y agua, forma cristales de color amarillo verdoso cuando se recristaliza en etilenglicol, sublima lentamente a partir de 200 ºC y no funde hasta los 300 ºC. Su espectro IR se caracteriza por presentar una serie de picos en la región entre 3300 y 2500. 19
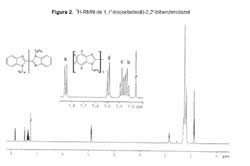
El espectro infrarrojo del 1,1'-bis(octadecil)-2,2'-bibencimidazol presenta señales muy intensas correspondientes a los numerosos enlaces C H aromáticos 3048 y alquílicos 2925 y 2858 cm-1, Figura 1. Al mismo tiempo ya no se observan las señales debidas al grupo NH del 2,2'-bibencimidazol que aparecen en la misma región. El espectro 1H-RMN de II, Figura 2, es concordante con lo reportado por la literatura, el grupo metileno próximo al nitrógeno aparece a 4,90 ppm,20 mientras que en nuestro caso esta señal se presenta a 4,89 ppm. Existe un centro de simetría en la molécula, lo que simplifica el espectro 1H-RMN. Los protones correspondientes al resto aromático no son equivalentes por lo que cada uno emite una señal diferente.
El espectro ultravioleta -visible presenta un conjunto de señales que se asemejan a las del bibenzimidazol, sólo que están desplazadas ligeramente hacia la derecha, debido a la presencia del grupo alquilo en posición 2.
Estudio de las propiedades mesomórficas
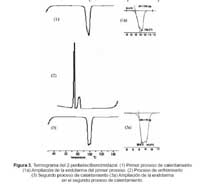
El termograma del primer calentamiento de I presenta un pico con un hombro, correspondiente a un proceso endotérmico, Figura 3. El termograma del segundo proceso de calentamiento es similar al primero, lo que indica que el compuesto es térmicamente estable. Las temperaturas de cambio de fase y las entalpías de transición se muestran en la Tabla 1. La fusión de I empieza a 93,6 ºC, mientras que la temperatura de aclaramiento (clearing point), correspondiente a la transición cristal líquido-líquido, es 102 °C. En este rango de temperatura se observa al microscopio de luz polarizada la presencia de una textura característica de una fase esméctica C (Sm C), a manera de abanicos (fan shape), figura 4a.21 El termograma del proceso de enfriamiento presenta dos bandas exotérmicas que se puede diferenciar claramente. Nuevamente, en este rango de temperatura se observa la textura de la fase esméctica C. Las temperaturas a las que se presentan estas bandas son menores a las del calentamiento debido al sobreenfriamiento. En este proceso se puede encontrar una buena diferencia de temperaturas que permite determinar las entalpías de las transiciones. La transición que aparece a 85,9 ºC, corresponde a la solidificación
a Valores obtenidos durante el enfriamiento. b Valores obtenidos por microscopía. Cr=cristal; SmC = fase esméctica C; N*= fase nemática quiral; Iso=líquido isotrópico
Los termogramas de II para el primer y segundo proceso de calentamiento son idénticos, a excepción de un pequeño pico exotérmico que aparece en el segundo calentamiento a 83 °C; sin embargo, al microscopio con luz polarizada no se observa ningún cambio a esta temperatura. Durante el calentamiento, II pasa directamente del estado sólido al estado líquido a 93.5 °C, pero durante el enfriamiento se observa la aparición de una fase colestérica o nemática quiral (N*) a 56 °C caracterizada por anillos concéntricos, Figura 4b. La presencia de esta fase colestérica no es normal, pues ella se presenta en compuestos con centros quirales. La rotación restringida en el enlace que une los grupos bencimidazol, debido a la presencia de las largas cadenas alifáticas, no es suficiente para generar estructuras quirales puesto que la molécula posee un centro de inversión. Una posible explicación es que II esté contaminado con trazas del compuesto parcialmente alquilado, el 1-octadecil-2,2'-bibencimidazol, el que sí podría generar estructuras quirales. Sin embargo, esta posible contaminación de II no ha sido detectada por RMN; además, el análisis elemental de este compuesto es concordante con los valores esperados. La cristalización se da a 28 °C.
CONCLUSIONES
Se ha estudiado las propiedades térmicas de derivados alquílicos del bencimidazol y bibencimidazol. El compuesto 2-pentadecilbencimidazol presenta una fase enantiotrópica esméctica C en un rango muy pequeño de temperatura, de 93 a 98 °C. En cambio, el 1,1'-bis(octadecil)-2,2'-bibenzimidazol presenta anormalmente una mesofase nemática quiral, de acuerdo a lo observado por microscopio con luz polarizada. La confirmación de esta mesofase por rayos-X para polvos queda pendiente.
Estos compuestos representan los primeros cristales líquidos con derivados del benzimidazol y 2,2'-bibencimidazol.
AGRADECIMIENTOS
Estamos muy agradecidos con el Dr. H. Komber, Leibniz Institute of Polymer Research Dresden, Alemania, por obtener los espectros de RMN y discusiones de asignación de las señales correspondientes.
BIBLIOGRAFÍA
1. V. Klimesova, J. Koci, M. Pour, J. Stachel, K. Waisser, J. Kaustova, Eur. J. Med. Chem., 2002, 37, 409.
2. Elaine Chong, Mary H. H. Ensom, Pharmacotherapy 2003, 23, 460.
3. Stedman CAM, Barclay ML, Aliment Pharmacol Ther., 2000, 14, 963.
4. K. Gudmundsson, J. Tidwell, N. Lippa, G. Koszalka, N. van Draanen, R. Ptak, J. Drach, L. Townsend, J. Med. Chem., 2000, 43, 2464.
5. P. Sehgal, E. Derman, G. Molloy, I. Tamm, J. Darnell, Science, 1976, 194, 431.
6. G. Brown, S. Aftergut, J. Polym. Sc. A, 1964, 2, 1839.
7. P. Peumans, A. Yakimov, S. Forrest, J. Appl. Phys., 2003, 93, 3693.
8. J. Asensio and P. Gómez-Romero, Fuel Cells, 2005, 5, 336.
9. J. Asensio, S. Borrós, P. Gómez-Romero, J. Polym. Sc. A, 2002, 40, 3703.
10. A. Carella , R. Centore, A. Sirigu, A. Tuzi, A. Quatela, S. Schutzmann, M. Casalboni, Macrom. Chem. Phys., 2004, 205, 1948.
11. N. Vijayan, G. Bhagavannarayana, T. Kanagasekaran, R. Ramesh Babu, R. Gopalakrishnan, P. Ramasamy, Cryst. Res. Technol., 2006, 41, 784.
12. S. Rau, T.Bütner, C.Temme, M.Ruben, H. Görls, D. Walther, Inorg. Chem., 2000, 39, 1621.
13. S. Jin, J. Kim, S.-P. Sim, A. Liu, D. Pilch, L. Liu, E. LaVoie, Bioorg. Med. Chem. Letters, 2000, 10, 719.
14. J.W. Goodby, Liq. Cryst., 1998, 24, 25.
15. C. Lee, K. Hsu, C. Tsai, C. Lai, I. Lin, Dalton Trans., 2004, 1120.
16. W. Pool, H. Harwood, A. Ralston, J. Amer. Chem. Soc., 1932, 59, 178.
17. M. Philips, J. Chem. Soc., 1928, 2393.
18. D. Hein, R. Alheim, J. Leavitt, J. Amer. Chem. Soc., 1957, 79, 427.
19. D. Boinnard, P. Cassoux, V. Petrouleas, J. Savariault, J. Tuchagues, Inorg. Chem., 1990, 29, 4114.
20. Z. Shi y R. Thummel, J. Org. Chem., 1995, 60, 5935.
21. H. Stegmeyer, Guest Ed. "Liquid Crystals" Ed. Steinkopff Darmstadt. (1994).