Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.72 no.4 Lima Oct./dic. 2006
Características bioquímicas de una proteína antibacteriana aislada del veneno de Lachesis muta Shushupe
Yori Cisneros1, Fanny Lazo1, Susana Gutiérrez2, Armando Yarlequé1
1 Laboratorio de Biología Molecular - Facultad de Ciencias Biológicas - UNMSM
2 Laboratorio de Microbiología y Biotecnología Microbiana - Facultad de Ciencias Biológicas - UNMSM.
* Dr. Armando Yarleque: ayarlequec@unmsm.edu.pe teléfono: 6197000-1528
RESUMEN
Se ha purificado una L-aminoácido oxidasa (LAO) del veneno de Lachesis muta a través de una columna de intercambio catiónico en CM-Sephadex C-50 y una filtración molecular en Sephadex G-100 SF a pH 6 con buffer acetato de amonio 0,1M. LAO fue recuperada con un rendimiento del 32% y una purificación de 8 veces; mostrando una sola banda electroforética en PAGE-SDS en condiciones reductoras, con un peso molecular de 60,6 kDa. La enzima es una proteína ácida homodimérica, con pH óptimo de 7,5 usando L-leucina como sustrato, además fue fuertemente afectada por la diálisis y en presencia del ion Zn2+ 7,5mM pierde hasta el 63% de su actividad inicial; de la misma manera es inhibida por L-cisteína, ácido yodoacético y glutation; en tanto que EDTA y el ácido glutámico no la afectan. Los ensayos con cultivos bacterianos de Staphylococcus aureus y Vibrio cholerae mostraron la potencia de LAO para inhibir el crecimiento, tanto por el método de cilindro en placa como en disco, por lo que se concluye que se trata de una proteína antibacteriana que afecta a microorganismos Gram positivos y Gram negativos.
Palabras clave: veneno, serpiente, L-aminoácido oxidasa, enzima, antibacteriano
ABSTRACT
An L-amino acid oxidase from the venom of Lachesis muta snake was obtained through CM-Sephadex C-50 cation-exchange chromatography followed by Sephadex G-100 SF gel filtration at pH 6 with 0,1M ammonium acetate buffer. LAO was recovered with 32% of yield and 8 folds showing a single electrophoretical band on PAGE-SDS with 60,6 kDa molecular weight under reduction conditions. It is an acid protein and homodimeric protein with 7,5 as optimum pH using L-leucine as substrate. Dialysis produced a severe effect on this activity, while 7,5 mM Zn2+ ions produced low activity until 63%. In the same manner, the enzyme was inhibited by L-cysteine, iodoacetate and glutation. Glutamic acid and EDTA were unaffected agents. Assays on Staphylococcus aureus and Vibrio cholerae bacterial cultures showed a potent grow inhibition. Therefore LAO is an antibacterial protein either on Gram positive and Gram negative bacterials.
Key words: Venom, snake, L-amino acid oxidase, enzyme, antibacterial
INTRODUCCIÓN
Las L-aminoácido oxidasas (EC. 1.4.3.2) catalizan la desaminación oxidativa de los L-aminoácidos y producen un cetoácido, amoníaco y peróxido de hidrógeno. Estas enzimas están ampliamente distribuídas en la naturaleza, encontrándoseles también en venenos de ofidios de las familias Elapidae y Viperidae (Tu, 1977) 1.
A pesar de que su función biológica ha sido poco comprendida, esta enzima posee una potencial utilidad en la investigación bioquímica y ha sido utilizada en la identificación de L-aminoácidos (Avrameas y Uriel, 1965) 2, en la preparación de a-cetoácidos (Buckey y Porges, 1956) 3, en la obtención de FAD (Singer y Kearney, 1950) 4.
En venenos de serpientes, su rol aunque aún poco estudiado, podría estar relacionado con la degradación de aminoácidos durante la digestión, así como con la protección contra microorganismos presentes en la presa ingerida (Yarlequé y col., 1997)5. El color amarillo característico de algunos venenos se debe a la presencia de esta enzima, ya que ella posee FAD como cofactor.
Investigaciones previas sobre la acción antibacteriana de la L-aminoácido oxidasa encontrada en el veneno de Bothrops brazili (Solís y col., 1999)6 motivaron el presente estudio destinado a caracterizar la enzima de la ponzoña de L. muta, serpiente que habita en diversas regiones de la amazonía peruana y que por el gran volumen de veneno que produce constituye una buena fuente biológica de especial interés en la búsqueda de principios activos de utilidad médica.
PARTE EXPERIMENTAL
Veneno.- Fue obtenido de ejemplares adultos de Lachesis muta, mantenidos en cautiverio en el Serpentario Oswaldo Meneses de la UNMSM y que procedieron de la zona del Alto Marañón (Dpto. de Amazonas). El veneno luego de ser extraído fue liofilizado y mantenido a 4 °C.
Cantidad de proteína.- La concentración proteica en el veneno y en la enzima purificada fue estimada por el método de absorción ultravioleta a 280 nm (Warburg y Christian, 1941)7 y por el método de Lowry y col., 19518, usando como estándar de proteína, la albúmina sérica bovina.
Actividad enzimática.- La actividad de LAO se determinó a 37 °C por el método descrito en el Worthington Enzyme Manual (1977)9. La mezcla de reacción contenía L-leucina 0,1%, O-dianisidina 0.0065% en buffer imidazol 0,2M pH 7,6 y peroxidasa al 0,001% en un volumen final de 3 mL.
Luego de agregar 25 μL de la enzima, se midió el incremento de la absorbancia en un espectrofotómetro Shimadzu a 436 nm. La actividad específica se expresó en Unidades/miligramo de proteína. Una unidad, oxida 1 μmol de L-leucina por minuto en las condiciones especificadas.
Purificación de la enzima.- 160 mg de veneno liofilizado de L. muta fueron disueltos en 2 mL de buffer acetato de amonio 0,1M, pH 6 y centrifugados a 4 000 rpm durante 10 minutos. El sobrenadante fue aplicado a una columna de CMSephadex C-50 (37 x 1,2 cm), equilibrada con buffer acetato de amonio 0,1M pH 6 y a un flujo de 10 ml/h a temperatura ambiente. Se colectaron fracciones de 2 ml y aquellas fracciones con actividad de LAO fueron reunidas y aplicadas a una columna de Sephadex G-100 SF (48 x 1,1 cm) equilibrada con el mismo buffer, colectándose fracciones de 2 ml, para medir en cada una de ellas la actividad de LAO, formándose luego el pool correspondiente.
Análisis electroforético.- Con la finalidad de evaluar la pureza y el peso molecular de la enzima, se empleó electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (PAGE-SDS)10 en presencia de 2-mercaptoetanol, usando una cámara electroforética de mini-slab a voltaje constante de 100 voltios durante una hora. Las bandas de proteína fueron reveladas con azul brillante de Coomasie y se utilizaron como proteínas marcadoras: albúmina sérica bovina (66 kDa), ovoalbúmina (45 kDa) y lisozima (14, 3 KDa).
pH óptimo de la enzima.- Se utilizó buffer acetato de amonio 0,2M en un rango de pH de 5 a 6,5 y buffer tris HCl 0,2M en un rango de 7 a 9, midiéndose la actividad de LAO con cada uno de ellos.
Ensayo de diálisis.- Se empleó 1,5 mL de veneno crudo (2 mg/mL) y 1 mL de la enzima purificada (0,62 mg/mL), colocándoseles por separado en bolsas de diálisis para realizar este proceso contra buffer acetato de amonio 0,1M pH 6 durante 9 horas a 4 °C con dos cambios de buffer. Luego se midió la actividad de LAO en ambas muestras.
Actividad sobre L-aminoácidos.- Para esta prueba se utilizaron como sustratos L-aminoácidos como: L-leucina, L-alanina, L-lisina, L-metionina, L-histidina y Lácido aspártico a concentraciones de 0,1% en buffer Tris HCl 0,2M pH 7,6 midiéndose luego la actividad enzimática.
Efecto de algunos agentes químicos.- Se probó el efecto de iones divalentes como calcio, magnesio y zinc bajo la forma de cloruros y también se ensayaron los siguientes agentes: ácido L-glutámico, glutation, L-cisteína, ácido yodoacético y EDTA a concentraciones finales de 1, 2,5 y 7,5 mM sobre la enzima purificada. En cada caso se preincubó cada agente con la enzima a 37 °C durante 10 minutos, midiéndose a continuación su actividad.
Actividad antibacteriana.- Para estudiar el efecto antibacteriano del veneno crudo y la enzima purificada, se usaron cepas de Staphylococcus aureus ATCC 6538 y Vibrio cholerae serotipo Inaba INS, de acuerdo a los métodos de cilindro en placa11 y en disco12. En ambos casos se usó como control de inhibición positiva tetraciclina a diferentes concentraciones (0,78 a 25 μg).
RESULTADOS Y DISCUSIÓN
Purificación de L-aminoácido oxidasa
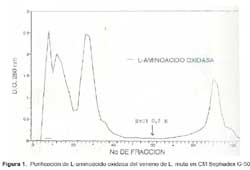
El primer paso para aislar LAO de L. muta fue una cromatografía en CMSephadex C-50 donde se obtuvieron tres picos de proteína, eluídos directamente con el buffer de corrida, representando el 46,5% del total de la proteína colocada. Además, se obtuvo un pico adicional al aplicarle el mismo buffer de corrida conteniendo NaCl 0,2M (Fig. 1).
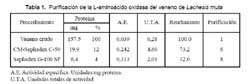
Las fracciones que contenían LAO al ser cromatografiadas en la columna de Sephadex G-100 SF, produjo cuatro picos de proteína, tal como se muestra en la Fig. 2, encontrándose en el primer pico la actividad de la enzima. Con este procedimiento desarrollado para aislar LAO de L. muta se logró finalmente un rendimiento de 32%, una purificación de ocho veces y la proteína total activa recuperada fue 4% (Tabla 1).
El hecho de que la actividad de la enzima se detecte en el primer pico de proteína en ambos pasos y de que eluya directamente de la columna de intercambio catiónico a pH 6, nos revela que se trata de una proteína de alto peso molecular contenida en el veneno y que, además, posee un PI menor a 6. Lo que indica que la enzima es de naturaleza ácida con una fuerte carga negativa en las condiciones experimentales usadas.
Estos resultados son similares a los reportados por Sánchez y Magalhaes (1991)13, quienes obtuvieron LAO del veneno de L. muta del Brasil, utilizando en un primer paso de purificación, una columna de Sephadex G-100 y luego en un segundo paso una columna de DEAE Celulosa, registrando una purificación de once veces y un rendimiento del 40%. Así mismo Solís y col. (1999)6, aislaron LAO del veneno de Bothrops brazili, usando un primer paso en Sephadex G-100 seguido de una cromatografía de intercambio catiónico en CM-Sephadex C-50, logrando un rendimiento de 30,9% y una purificación de 29,3 veces. Adicionalmente varias proteínas con actividad de LAO han sido purificadas de venenos ofídicos, como es el caso de la reportada en la Cobra rey de la India Ophiophagus hannah (Tan y Saifuddin 1989)14 y Trimeresurus sumatranus sumatranus (Tan y Tan 1989)15, en este último veneno se encontraron dos isoformas de LAO con actividades de 3346 y 2489 U/mg de proteína, respectivamente.
Peso molecular
El análisis de pureza efectuado por PAGE-SDS mostró una sola banda proteica con un peso molecular de 60,6 kDa, valor que fue calculado comparándolo con la movilidad electroforética de tres proteínas de peso molecular conocido.
Estos resultados pueden contrastarse con los hallados por Li y col. (1994)16 para la enzima de Ophiophagus hannah donde se determinó que LAO tiene un peso molecular de 65 kDa por PAGE-SDS, tanto en su forma reducida como no reducida.
En un estudio sobre varias LAOs de origen ofídico, Iwanaga y Suzuki (1979)17, demostraron que los pesos moleculares de estas enzimas están en el rango de 100 a 140 kDa por filtración molecular y de 50 a 70 kDa por PAGE-SDS. Estos datos junto con los encontrados por nosotros, indican que estas enzimas son dímeros constituidos por dos subunidades homólogas. Así mismo, el hecho de encontrar una proteína de este peso en el veneno en estudio, demuestra que L. muta posee por lo menos dos proteínas de alto peso molecular como son LAO y la hialuronidasa (Lerma 2005) 18. Sin embargo se ha reportado la existencia de LAO bajo la forma monomérica, como es el caso de Echis macmahoni (Ali y col., 2000) 19.
Efecto de la diálisis
Tanto la enzima purificada como la contenida en el veneno crudo sufren la parcial reducción de su actividad por este proceso, observándose que la enzima purificada pierde el 38,4% de su actividad inicial mientras que, al dializar el veneno crudo la pérdida de la actividad enzimática fue del 18%. Estos datos indican que a diferencia de lo que ocurre con otras enzimas ofídicas, LAO no debe ser sometida a este proceso pues su actividad es marcadamente afectada. Coles y col. (1977) 20 demostraron que una parte significativa del FAD es separado de la enzima durante la diálisis, lo que explicaría la razón de la pérdida de la actividad enzimática.
pH óptimo
En la exploración del pH óptimo se observó que a partir de pH 6 la actividad enzimática se incrementa, alcanzando su máximo valor a pH 7,5 y luego desciende rápidamente la actividad a valores de pH alcalinos.
LAO de L. muta presenta un pH óptimo de 7,5 utilizando como sustrato Lleucina. En cambio, la enzima aislada del veneno de Agkistrodon caliginosus fue muy activa a pH 8-8,5 usando el mismo substrato. Debemos aclarar que el pH óptimo de LAO está en función del aminoácido que se utilice como substrato, de manera que LAO no oxida lisina a pH 7,5 pero sí a 9,4 (Lee, 1979) 21.
Paik y Kim (1965)22 estudiaron la relación entre sustrato y pH e investigaron que la enzima aislada del veneno de Crotalus adamanteus exhibe seis formas diferentes de curvas de pH dependiendo del aminoácido usado. En todos los casos el pH óptimo de las LAOs estudiadas, está en el rango de 7 a 9
Actividad sobre L-aminoácidos
Los resultados obtenidos al probar la actividad de la enzima sobre diferentes Laminoácidos mostraron que la L-leucina es el mejor sustrato, mientras que Lmetionina y L-histidina solo alcanzan una actividad de 19,75 y 10,24 %, respectivamente. Otros aminoácidos como L-lisina, L-alanina y L-ácido aspártico representaron respectivamente el 3,58, 2,96, y 0,6 % de la actividad máxima lograda. Del mismo modo, Tan y col. (1992)23 al investigar las propiedades de LAO del veneno de Naja naja kaouthia encontraron que la enzima fue muy activa con Lfenilalanina y L-triptofano y moderadamente activa con L-leucina, L-metionina y L-triptofano cuando se la evalúa a pH óptimo de 8,5. De acuerdo a Ueda y col.(1988)24, LAO del veneno de Trimeresurus mucrosquamatus oxida Lmetionina rápidamente y en cambio, LAO de L. muta no oxida este sustrato fácilmente.
En los venenos de serpientes la especificidad del sustrato para esta enzima varía de una especie a otra (Zeller y Maritz, 1944)25; por lo tanto, tenemos que considerar que el valor de pH para la reacción enzimática, dependerá de la capacidad oxidativa de LAO sobre un determinado aminoácido.
Acción sobre algunos agentes químicos
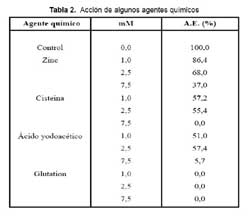
Los ensayos efectuados con algunos iones metálicos divalentes, mostraron que el Ca2+ y Mg2+ en concentraciones finales de 1 a 7,5 mM modifican ligeramente la actividad de LAO, en tanto que el ion Zn2+ ocasiona una fuerte inhibición de 63% a 7,5 mM. Así mismo EDTA no ejerció ningún efecto sobre la enzima, lo que concuerda con Ueda y col., 198824, quienes efectuaron los mismos ensayos con el quelante. Por tanto, LAO no contiene iones metálicos asociados a su estructura, capaces de ser reconocidos por quelantes. Por otro lado, el tripéptido glutation produce una inhibición total de la actividad de LAO a cualquiera de sus concentraciones, siendo la cisteína y el ácido yodoacético también fuertes inhibidores. En cambio, el ácido glutámico no afectó la actividad, lo que demuestra que en el caso de glutation es la presencia de cisteína lo que causa esta fuerte inhibición enzimática. La inhibición por ácido yodoacético sugiere que la reacción con los grupos sulfhidrilos cercanos al sitio activo ocasionaría esta inactivación (Tabla 2).
Efecto antibacteriano
La enzima purificada produjo inhibición del crecimiento de Staphylococcus aureus y Vibrio cholerae, siendo el diámetro de la zona de inhibición proporcional a la concentración de la enzima utilizada con el método en disco. Los máximos halos de inhibición fueron de 25 y 26 mm para S. aureus y V. cholerae al usar 25 μg de la enzima y con 3.1 μg se consiguió un halo de inhibición de 19 y 17 mm para S. aureus y V. cholerae respectivamente.
Con el método de cilindro en placa, el máximo halo de inhibición se produjo sobre S. aureus (27 mm), utilizando 25 μg de la enzima, mientras que sobre V. cholerae no se produjo halo de inhibición alguno. Debemos tener en cuenta que la acción de la tetraciclina sobre ambas cepas bacterianas produjo una zona de inhibición de 14 y 11 mm, respectivamente, usando 3,1 μg de la enzima.
Estos resultados los podemos contrastar con los encontrados por Stiles y col. (1991)26, puesto que al utilizar 6.25 μg de LAO aislada de Pseudechis australis produjo un halo de inhibición de 10 mm sobre S. aureus; del mismo modo cuando utilizamos la misma cantidad de LAO de L. muta el halo de inhibición fue de 20 mm. De acuerdo al Manual Difco (1984)27 30 μg de tetraciclina producen halos de inhibición mayores o iguales a 19 mm sobre bacterias Gram positivas y Gram negativas si se considera que el microorganismo es sensible a la droga; nosotros con LAO de L: muta, utilizando 3,1 μg de la enzima al actuar sobre S. aureus y V. cholerae obtuvimos halos de inhibición de 19 y 17 mm, respectivamente. Estos resultados demuestran que la potencia antibacteriana de LAO obtenida de L. muta puede ser más efectiva, por lo que se puede inferir que esta enzima podría utilizarse sobre otras bacterias con significativa eficiencia.
Este efecto también ha sido observado en LAOs de otras serpientes tales como Crotalus adamanteus (Skarnes, 1970)28 y Pseudechis australis (Stiles, 1991)26. La acción antibacteriana de LAO es atribuida al peróxido de hidrógeno generado como producto durante la desaminación oxidativa de los L-aminoácidos, ya que otras enzimas como la glucosa oxidasa (Roberts y col., 1943)29 y la xantina oxidasa (Green y Pauli, 1943)30 que también liberan peróxido de hidrógeno durante la oxidación de sus substratos, tienen efecto antibacteriano. Sin embargo la Daminoácido oxidasa que libera peróxido de hidrógeno no presenta dicho efecto, lo que ha sido atribuido a su tendencia a polimerizar, lo que interfiere con la obtención de una concentración letal de peróxido de hidrógeno (Meister y Wellner, 1963) 31.
CONCLUSIONES
La purificación de la L-aminoácido oxidasa del veneno de L. muta abre un nuevo camino no sólo para evaluar la acción biológica de esta proteína como componente fundamental de la ponzoña sino su potencial utilidad como agente antibacteriano; lo que constituiría una alternativa para el tratamiento de peligrosas enfermedades bacterianas que afectan a la humanidad.
AGRADECIMIENTO
Los autores agradecen al Consejo Superior de Investigaciones (CSI) de la UNMSM por el apoyo económico que nos brindaron, para la realización de este trabajo.
REFERENCIAS
1. Tu, A. 1977. Venoms: Chemistry and Molecular Biology. New York.Wiley &Sons. 560 p.
2. Avrameas, S. and Uriel, J. 1965. L-amino acid oxidase. Toxicon 261: 584.
3. Buckey, E. and Porges, N. 1956. Venoms. American Association of the Advancement of Science, 1st ed. 2295-2302.
4. Singer, T. and Kearney, E. 1950. The L- amino acid oxidases of snake venoms II. Arch. Biochem. Biophys. 29: 190-209.
5. Yarlequé, A.; Cárdenas, J.; Escobar, E. y Gutiérrez, S. 1997. Some biochemical properties and antibacterial action of L-amino acid oxidase from Peruvian snake venoms. Fourth Asia Pacific Congress on Animal, Plant and Microbal Toxins. Toxicon 35: 489.
6. Solís, C.; Escobar, E.; Yarlequé, A y Gutiérrez, S. 1999. Purificación y caracterización de la Laminoácido oxidasa del veneno de la serpiente Bothrops brazili Jergón Shushupe. Rev. Peru biol. 6 (1): 75-84.
7. Warburg, O. and Christian, W. 1941. Isolierung and cristallisation of garungs ferments. Biochem. Z. 310: 384-421.
8. Lowry, O.; Rosebrough, N.; Farr, A. and Randall, R. 1951. Protein measurement with the folin phenol reagent. J. Biol. Chem. 193: 265-275.
9. Worthington Biochemical Corporation. 1977. L-amino acid oxidase. The Worthington Manual Enzyme: reagents related biochemicals. New Jersey. P 49
10. Laemmli,U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227: 680-685
11. Grove, D. and Randall, W. 1955. Assay of antibiotics Medical Enciclopedy. Inc. New York 1st ed. Pp 78-86.
12. Bauer, A.; Kirby, W.; Sherris, J. and Turk, M. 1966. Antibiotic susceptibility testing by a standardized single disck method. Am. J.Clinic Path. 45: 493-496.
13. Sánchez, E. and Magalhaes, A. 1991. Purification and characterization of L- amino acid oxidase of Lachesis muta venom. Brazilian. J. Med. Biological Res. 24: 249-260.
14. Tan, N.H. and Saifuddin, M.N. 1989. Isolation and characterization of an unusual form of L-amino acid oxidase from King Cobra (Ophiophagus hannah) venom. Biochem International. 19: 937-944.
15. Tan, N.H. and Tan C.S. 1989. Fractionation of Sumatran pit viper (Trimeresurus sumatranus sumatranus) venom by DEAE Sephacel ion exchange chromatography and some biological properties of the fractions. Toxicon. 27: 697-702.
16. Li, Z.Y.; Yu, T. and Liam, E. 1994. Purification and characterization of L- amino acid oxidase from King Cobra (Ophiophagus hannah) venom and its effects on human pkatelet aggregation. Toxicon .32: 1349-1358.
17. Iwanaga , S. and Suzuki, T. 1979. L-amino acid oxidase. Handbook of Experimental Pharmacology: Snake venoms.Springer-Verlag Berlin Heidelberg New York 52:65.
18. Lerma, L. 2006. Evaluación bioquímica y biológica de una hialuronidasa del veneno de la serpiente peruana Lachesis muta. Tesis para optar al Título profesional de Biólogo. UNMSM
19. Ali, S.; Stoeva,S.; Abbasi, A.; Alam,J.; Kayed,R.; Faigle, M.; Neumeister, B. and Voelter, W. 2000. Isolation, structural and functional characterization of an apoptosis-inducing L-amino acid oxidase from leaf-nosed viper (Eristocophis macmahoni) snake venom. Arch. Biochem. Biophys. 384:216- 226.
20. Coles, C.; Edmondson, D. and Singer, T. 1977. Reversible inactivation of L-amino acid oxidase. J. Biol. Chem. 252: 8035-8039.
21. Lee, Ch.Y. 1979. Snake venoms: Handbook of Experimental Pharmacology. Springer-Verlga Berlin Heidelberg New York. 52, 75-84.
22. Paik, W. and Kim, S. 1965. pH-sustrato relation of L-amino acid oxidases from snake venom and rat kidney. Biochemistry Biophys Acta. 139: 49.
23. Tan, N. and Swaminathan, S. 1992. Purification and properties of the L-amino acid oxidase from monocellate cobra (Naja naja kaouthia) venom. International Journal Biochem. 24: 967-973.
24. Ueda, M., Chang, C. and Ohno, M. 1988. Purification and characterization of L-amino acid oxidase from the venom of Trimeresurus mucrosquamatus. Toxicon.26: 695-706.
25. Zeller, E. and Maritz, A. 1944. Uber eine L-aminosaure oxidase. Helvetica Chimica Acta. 27: 1888- 1902.
26. Stiles,B.; Sexton,F. and Weinstein, S. 1991. Antibacterial effects of different snake venoms: purification and characterization of antibacterial proteins from Pseudechis australis (Australian king brown or mulga snake venom. Toxicon. 29: 1129-1141.
27. Manual Difco. 1984. Medios de cultivo deshidratados y reactivos para microbiología. 10ma. Ed. Michigan-USA.pp 844-850.
28. Skarnes, R. 1970. L-amino acid oxidase, a bactericidal system. Nature. 225: 1073.
29. Roberts,E.; Cain,C., Muir, R.; Reithel, F., Gaby, W.; Bruggen, J.; Homan, D.; Katzman, P.; Jones, R.; and Doisy, E. 1943. The glucose oxidase. J. Biol. Chem. 147:47.
30. Green, E. and Pauli, R. 1943. Xantine oxidase. Pro. Soc. Exp. Biol. And Med. 54: 148.
31. Meister, A. and Wellner, D. 1963. The enzymes. Comp: Bojer, P., Lardy,H., & Myrback, K. New York. Edit Academic Press. 1st ed. P. 26.