Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.73 n.1 Lima ene./mar. 2007
Evaluación de la actividad antioxidante y contenido de compuestos fenólicos en vinos producidos en Perú
Evaluation of the antioxidant activity and content of phenolics compounds in wines produced in Peru
Ana María Muñoz Jáuregui1, Alicia Fernández Giusti2, Fernando Ramos Escudero1, Carlos Alvarado-Ortiz Ureta1
1 Centro de Investigación de Bioquímica y Nutrición. Facultad de Medicina Humana. Universidad de San Martín de Porres. Av. Alameda del Corregidor Nº 1531. La Molina – Lima (Perú), amariamj@yahoo.es
2 Facultad de Medicina Humana UNMSM
RESUMEN
Los componentes fenólicos juegan un rol importante en el color y sabor de los alimentos y bebidas; su consumo ha sido asociado con efectos benéficos para la salud humana. Se estudiaron 13 tipos de vinos peruanos elaborados en los departamentos de Ica y Lima. El contenido de compuestos fenólicos se estimó usando el método Folin-Ciocalteau, obteniéndose valores de 627 a 3321 mg GAE/L. La actividad antioxidante se realizó usando dos métodos: primero aplicando el método DPPH●, los valores están entre 32 a 873 μM DPPH, para un monitoreo de 5 minutos; luego usando el catión ABTS+●, los resultados se expresaron en TEAC (capacidad antioxidante trolox equivalente) y estuvieron entre 2,4 a 17,6 mM Trolox. Los compuestos fenólicos se cuantificaron por HPLC: clorogénico entre 0,13 – 3,28 mg/L, cafeico entre 0,47 – 15,08 mg/L, ferúlico entre 0,21 – 5,57 mg/mL, rutina entre 0,017 – 0,57 mg/L, quercetina entre 0,19 – 7,74 mg/L y kaemferol entre 0,023 – 1,39 mg/L. El vino elaborado con las variedades Tannat y Petit Verdot presentó mayor concentración de compuestos fenólicos y actividad antioxidante por ambos métodos. La presencia de estos compuestos antioxidantes permitiría, un criterio de clasificación que debería considerarse en la información nutricional en la etiqueta de los vinos, proporcionando ventajas para productores y consumidores.
Palabras claves: Vinos, actividad antioxidante, polifenoles, antocianinas, flavonoides.
ABSTRACT
The phenolics compounds play an important role in the color and flavor of the food and drinks; his consumption has been a partner with charitable effects for the human health. There were studied 13 types of Peruvian wines elaborated in departments Ica and Lima. The content of compounds fenólicos estimated by the Folin-Ciocalteu method, values being obtained from 627 to 3321 mg GAE/L. The antioxidant activity was realized using two methods: first applying the DPPH● method, the values are between 32 to 873 μM DPPH● for a monitoring of 5 minutes; then using the catión ABTS+● the results expressed in TEAC and were between 2,4 to 17,6 mm Trolox. The phenolics compounds were quantified by HPLC: chlorogenic acid among 0,13 - 3,28 mg/L, caffeic acid among 0,47 - 15,08 mg/L, ferulic acid among 0,21 - 5,57 mg/mL, rutin among 0,017 - 0,57 mg/L, quercetin among 0,19 - 7,74 mg/L and kaempferol among 0,023 - 1,39 mg/L. The wine elaborated with the varieties Tannat and Petit Verdot presented major concentration of phenolic compounds and antioxidant activity for both methods. The presence of these antioxidant compounds would allow, a criterion of classification that should be considered in the nutritional information in the etiquette of the wines, providing advantages for producers and consumers.
Key words: Wines, antioxidant activity, polyphenols, anthocyanins, flavonoids.
INTRODUCCIÓN
Las sustancias fenólicas se encuentran entre los constituyentes fundamentales de los vinos. Ellas determinan importantes características organolépticas, relacionadas con el color y el gusto. Dentro de los fenoles, los antocianos son responsables esenciales del color rojo, mientras los taninos se asocian con sensaciones gustativas, unas veces agradables relacionado a su estructura y concentración y otras desagradables como amargo, aspereza, sequedad, astringencia1.
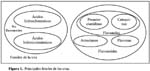
Los compuestos fenólicos constituyen un enorme grupo de sustancias, en su mayoría de origen vegetal, ampliamente distribuidas en la naturaleza. Se han clasificado en distintos grupos según el número de átomos de carbono y la estructura de su esqueleto base. El vino contiene gran cantidad y variedad de estos compuestos antioxidantes, principales responsables de la buena fama de este extracto natural2. En la figura 1, se muestran esquemáticamente los distintos grupos químicos que componen los principales fenoles de la uva.
Presentan propiedades antioxidantes que contribuyen a reducir el riesgo de enfermedades cardiovasculares, así como el resveratrol, ácido gálico, y quercetina han sido confirmados por tener actividad contra alergias, inflamación, hipertensión, artritis y carcinógenos3.
El tipo y la concentración de compuestos fenólicos en vinos es influenciado por la composición química de la materia prima, el cual depende de la variedad, estado de maduración, condiciones atmosféricas durante la maduración y tipo de suelo. La técnica usada durante el proceso de elaboración del vino y las condiciones de envejecimiento también son importantes4. Los fenoles aldehídos (vanillin), ácido benzoico (ácido gálico), ácidos hidroxicinnámicos (cafeico, ferúlico, p-coumárico) y sus ésteres obtenidos por condensación con ácido tartárico (ácido hidroxicinnamoiltartárico), flavanoles, flavonoles (quercetina) y antocianinas, son extraídos de la uva durante el proceso de elaboración. También flavanoles, como catequinas, presentes en las semillas como monómeros o polimerizados para formar proantocianidinas y taninos hidrolizables, estilbenos como resveratrol o éstos en forma de glucósidos presentes en los vinos.
El presente trabajo tiene como objetivo evaluar la capacidad antioxidante de los vinos, utilizando dos métodos: mediante el ensayo de 1,1-diphenyl-2-picrylhydrazyl (DPPH) y 2,2'- azinobis-(3-ethylbenzothiazoline)-6 sulfonic acid (ABTS); determinar el contenido de polifenoles totales, -antocianinas, relación color-antocianinas- y cuantificar ácidos fenólicos (clorogénico, ferúlico, cafeico) y flavonoles (quercetina, kaempherol, rutina).
PARTE EXPERIMENTAL
Materiales
Acetonitrilo grado gradiente, metanol grado HPLC, ácido o-fosfórico al 85 % de Merck KGaA (Darmstadt, Alemania), 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2'-azobis(2- methylpropion-amidine) dihydrochloride (ABAP), 6-hydroxy-2,5,7,8-tetramethilchroman- 2-carboxylic acid (TROLOX) de Aldrich® (St.Louis, MO, USA), 2,2'-azino-bis(3- ethylbenzo-thiazoline-6-sulfonic acid) diammonium salt (ABTS) de Sigma® (Steinheim, Alemania). Agua ultrapurificada con una conductividad de 18 MÙ/cm, preparado para un sistema Elix® o de ósmosis inversa (Millipore, Symplicity, USA). Los estándares quercetina, kaempherol, rutina, ácido gálico, ácido cafeico fueron obtenidos de Sigma® (Steinheim, Alemania) y ácido ferúlico, ácido clorogénico fueron obtenidos de Aldrich® (St.Louis, MO, USA).
Muestra
Fueron colectadas de la sección vinos de las cadenas de supermercados de Lima. Se muestrearon 13 tipos de vinos que, posteriormente, fueron analizados por triplicado en el Centro de Investigación de Bioquímica y Nutrición de la Facultad de Medicina Humana de la Universidad de San Martín de Porres. Los vinos fueron estudiados según el tipo de uva y zona de procedencia.
Preparación
Un volumen de 10 mL de vino fue extraído cuatro veces con 7 mL de acetato de etilo. Los extractos de acetato de etilo fueron combinados y evaporados a 50º C en baño maría. El residuo fue disuelto in 10 mL de la mezcla metanol/agua (6:4 v/v); posteriormente fue filtrado con GHP Acrodisc® Syringe filtro 25 mm con 0.45 μm membrana de Pall Corporación (Ann Arbor, USA) y analizado por cromatografía líquida.
Equipos y condiciones del análisis
Determinación de ácidos fenólicos y flavonoles por HPLC
El análisis por cromatografía fue desarrollado con un cromatógrafo líquido de alta performance (HPLC), LaChrom D-7000 HPLC (Merck-Hitachi, Tokio, Japón). Los datos de las corridas fueron recogidos mediante un software D-7000 HPLC System Manager versión 4.0 (Merck KGaA, Alemania y Hitachi Instruments, Inc., San José, CA, USA).
La separación fue desarrollada a temperatura ambiente con una columna Purospher® STAR RP-18e (250 mm x 4,6 mm, 5 μm de tamaño de partícula) (Merck KGaA, Alemania). Las muestras fueron inyectadas usando 80 μL por vuelta.
La corrida cromatográfica se realizó a un flujo de 1000 μL min-1 y la fase móvil consistió de una mezcla de eluyente A (agua – ácido o-fosfórico, pH 2.5) y eluyente B (acetonitrilo) bajo la siguiente condición de gradiente: 0 min, 100 % de A; 2 min, 80 % de A y 20 % de B; 15 min, 70 % de A y 30 % de B; 16 min, 40 % de A y 60 % de B; 22 min, 60 % de A y 40 % de B; 26 min, 100 % de A; 28 min, 100 % de A.
Análisis de polifenoles por Folin-Ciocalteu
El contenido de polifenoles fue determinado acondicionando al método descrito por Ivanova et al.5 Una curva de calibración fue obtenida con soluciones de trabajo de ácido gálico cuyo rango de concentraciones fue de 1 a 25 mg/L y los resultados fueron expresados en mg GAE/L de vino. La muestra fue diluida con etanol al 50 % entre 30 y 50 veces dependiendo del contenido de polifenoles (pruebas preliminares), se utilizó una alícuota de las diluciones y se añadieron 750 μL de Folin-Ciocalteu; la reacción fue neutralizada por la adición de carbonato de sodio al 7,5 %. Los tubos fueron mezclados e incubados a 50 ºC/10 min; la absorbancia fue medida a 760 nm, usando una celda de poliestireno de (4,5cm x 1,0cm x 1,0cm), de 1000 μL de capacidad; las mediciones se tomaron con un espectrofotómetro (Shimadzu Uv/Vis 2550, con interfase a una PC, Shimadzu Scientific Instruments, MD, USA.). El vino y el estándar fueron analizados por triplicado.
Antocianinas totales
Los antocianos totales de los vinos fueron medidos por el método descrito por Ribéreau- Gayon y Stonestreet6. Consistió en tomar 200 μL de vino y diluir con una cantidad de solvente (metanol) en medio fuertemente ácido; otra cantidad de vino similar a la anterior se blanqueó con bisulfito de sodio al 15 %. Se escaneó una curva de espectro entre 450 y 600 nm y se tomó como longitud de onda máxima 520 nm; los resultados se expresaron como malvidina-3-O- glucósido, usando una absortividad molar de 28 000 y un peso molecular de 493,57. Las antocianinas totales se expresaron como mg/L de vino.
Parámetros de color
En vinos, el color es uno de los principales parámetros cualitativos, debido a que presenta un factor organoléptico que percibe el degustador, y que es una característica importante de aceptabilidad. Los parámetros de color de los vinos se acondicionó al método descrito por Casassa y Sari8. Las mediciones de absorbancia fueron registradas sobre una curva de espectro entre 400 y 700 nm; los parámetros clásicos de glories están dados por el registro de valores de absorbancia a 4 longitudes de onda 450, 520, 570, 630 nm; los valores triestímulo X, Y, Z, permitirá obtener los valores de luminosidad, tonalidad, saturación, intensidad de color rojo, azul y amarillo.
Secuestro de radical DPPH● y ABTS●+
La actividad de secuestro del radical libre fue determinado por inhibición de 1,1- diphenyl-2-picrylhydrazyl (DPPH), método propuesto por Brand-Williams et al.9. Los valores de absorbancia fueron medidos durante 10 min y ajustados a una curva de calibración DPPH (absorbancia = 0.01[μM DPPH] + 0.0253) R2 = 0.9989 en un rango de (1 – 100 μM). Las mediciones fueron realizadas a 515 nm.
La actividad de secuestro para el catión ABTS●+ (TRAP) fue desarrollada por mediciones del ensayo ABAP/ABTS. El radical ABTS fue generado en reacción con ABAP, el cual actúa como oxidante después de una descomposición térmica. En adición a la actividad antioxidante, la concentración depende de los radicales ABTS y por lo tanto, una disminución en las absorbancias. Se utilizó Trolox análogo de la vitamina E, como antioxidante de referencia; el TRAP fue expresado como capacidad antioxidante Trolox equivalente (TEAC); los valores fueron calculados mediante la siguiente ecuación: (% inhibición = 49.766[mM TEAC] -1.572) R2 = 0.9979 (Overveld et al.10 ).
RESULTADOS Y DISCUSIONES
Ácidos fenólicos y flavonoles, por HPLC
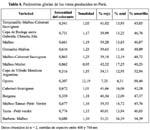
En la Tabla 1, se muestra los resultados del contenido de ácidos fenólicos y flavonoles de los vinos estudiados. Tal como se observa en la Tabla 1, los contenidos de los ácidos fenólicos y flavonoles es muy variable entre los vinos analizados, cuyos coeficientes de variabilidad se encuentran alrededor de 79 y 134 %; lo que indica una alta variabilidad; esta dispersión está asociada con las diferentes variedades de uva, área geográfica (condiciones climáticas, altura, etc), edad del vino y el proceso de vinificación (Gambelli y Santaroni)11. Por otro lado, los componentes, como el ácido cafeico y rutina presentan una menor variabilidad respecto a la quercetina, kaempherol, ácido clorogénico y ácido ferúlico. Nuestros datos fueron confrontados con otros obtenidos por Gambelli y Santaroni11, los que muestran una concentración de ácido cafeico entre 2,5 a 17,9 mg/L y quercetina entre 1,5 y 12,8 mg/L mientras los vinos procesados en Perú contienen quercetina entre 0,19 a 7,74 mg/L y cafeico entre 0,47 y 15,08 mg/L.
Polifenoles totales por Folin-Ciocalteu
En la Tabla 2, se muestra el contenido de componentes fenólicos de los vinos peruanos y el número de picos encontrados por HPLC.
De los datos mostrados en la Tabla 2, el contenido de polifenoles totales es muy variable; sin embargo, el número total de picos vrs. polifenoles totales presentan una correlación ligeramente baja con un R2 de 37,49 %. Esta variación entre estos parámetros es importante ya que los vinos difieren en su composición con el tiempo de fabricación 6.
Antocianinas totales
El contenido de antocianinas se presenta en la Tabla 3, los cuales son responsables del color rojo en los vinos.
En la Tabla 3 se muestra el contenido de antocianinas de los vinos producidos en Perú, los cuales presentan una disminución en el contenido de antocianos. En otros estudios realizados se reporta que en vinos con edad mayor de 5 años sólo la malvidina-3-O-glucósido se encuentra en mayor concentración que el resto de antocianos; sin embargo, la petunidina está presente en vinos jóvenes; por otro lado, la peonidina y la cianidina decrecen durante el envejecimiento, mientras que la delfinidina se encuentra en concentraciones bastante reducidas.11
Parámetros de color
En la Tabla 4 se muestra los resultados de intensidad del colorante, tonalidad, % de rojo, % de azul, y % de amarillo. De la Tabla 4, se observa que el color en los vinos es uno de los principales parámetros cualitativos, especialmente en vinos tintos, debido a que representan el primer factor organoléptico que percibe el degustador.
Secuestro de radical DPPH● y ABTS●+
En la Tabla 5, se muestra los resultados del ensayo de DPPH frente a los vinos; los valores se registraron a 515 nm, durante 5 y 10 minutos; se usó una curva de calibración de DPPH, la que se encontraba en un rango de 1 a 100 μM (y = 0,01x - 0,0253, R2 = 0,9989).
Estos resultados demuestran que el vino formulado con la variedad de uva tanta-petit verdot presentó una mayor capacidad de secuestro frente al radical DPPH; sin embargo, el contenido de polifenoles, versus la actividad antioxidante, presentaron una alta correlación; los vinos de menor color tienen una menor actividad. En la figura 2, se muestra esta correlación. En la Tabla 6, se muestra los resultados del porcentaje de ABTS, inhibición y TEAC; para los radicales generados por el sistema ABAP/ABTS, también se reportó que la misma variedad presentó una alta capacidad de secuestro.
Sin lugar a duda, los vinos presentan una buena capacidad antioxidante frente a los radicales libres; diversas investigaciones tratan de identificar qué polifenol o grupos de polifenoles presentes en vinos contribuyen más a su capacidad antioxidante. El número de grupos fenoxil incrementan esta actividad, como se determinó para el ensayo DPPH y ABTS.
CONCLUSIONES
Los resultados obtenidos muestran que, de los vinos evaluados, el que fue elaborado con las variedades Tannat y Petit Verdot presentó mayor concentración de compuestos fenólicos y capacidad antioxidante, por ambos métodos. Además, se encontró que en los vinos estudiados el contenido de compuestos fenólicos y antocianinas es variado, lo que puede deberse a condiciones de edad, tipo de proceso, altura y variedad de las uvas; estos factores también afectan la capacidad antioxidante de los vinos. Por lo que es necesario monitorear el comportamiento de compuestos fenólicos durante el envejecimiento de los vinos, para elaborar una cartilla de identificación nutricional. Es importante también, en función de los resultados obtenidos, elaborar una clasificación resaltando la capacidad antirradical, que servirá de conocimiento para las vitivinícolas en el momento del procesamiento de los vinos, tratando de optimizar al máximo cada uno de los procesos y operaciones, cuidando no sólo las condiciones organolépticas del vino sino también los metabolitos secundarios que presentan efectos benéficos para la salud.
AGRADECIMIENTOS
Al Dr. Frank Valentín Lizaraso Caparó, Decano de la Facultad de Medicina Humana y al Dr. Benjamín Castañeda Castañeda, Director del Instituto de Investigación de la FMH-USMP.
REFERENCIAS
1. Vila H. 2002. Efecto del tiempo de maceración sobre el color, la composición tánica y la astringencia de vinos Cabernet-Sauvignon y Malbec. Tesis Maestría. Facultad de Ciencias Agrarias, Universidad Nacional de Cuyo. Mendoza, Argentina. pp 6 -7.
2. Frankel EN, Watherhouse AL, Teissedre PL. 1995. Principal phenolic phytochemicals in selected California wines and their antioxidant activity in inhibiting oxidation of human low-density lipoproteins. J. Agric. Food Chem. 43: 890 – 894.
3. Fernández-Pachón M.S, Villaño D, García-Parrilla M.C, Troncoso A.M. 2004. Antioxidant activity of wines and relation with their polyphenolic composition. Analytica Chimica Acta 513 (1): 113 - 118.
4. Bravo MN, Silva S, Coelho AV, Vilas-Boas L, Bronze MR. 2006. Analysis of phenolic compounds in Muscatel wines produced in Portugal. Analytica Chimica Acta 563: 84 - 92.
5. Ivanova D, Gerova D, Chervenkov T, Vankova T. 2005. Polyphenols and antioxidant capacity of Bulgarian medicinal plants. Journal of Ethnopharmacology 96: 145 – 150.
6. Ribéreau-Gayon J, Stonestreet J. 1965. Le dosage des anthocyanes dans le vin rouge. En : Casassa F, Sari S. 2006. Aplicación del sistema Cie-Lab a los vinos tintos: correlación con algunos parámetros tradicionales. Revista de Enología Nº 5/8 Año III.
7. Orak HH. 2006. Total antioxidant activities, phenolic, anthocyanins, polyphenoloxidase activities and its correlation of some important red wine grape varieties which are grown in Turkey. Electronic Journal of Polish Agricultural Universities: Food Science and Technology 9(1): 9 p.
8. Casassa F, Sari S. 2006. Aplicación del sistema Cie-Lab a los vinos tintos. Correlación con algunos parámetros tradicionales. Revista de Enología Nº 5/8 Año III.
9. Brand-Williams W, Cuvelier ME, Berset C. 1995. Use of free radical method to evaluate antioxidant activity. Lebensmittel Wissenschaft und Technologie 28: 25 - 30.
10. Overveld FWPC, Haenen GRMM, Rhemrev J, Vermeiden JPW, Bast A. 2000. Tyrosine as important contributor to the antioxidant capacity of seminal plasma. Chemico-Biological Interactions 127: 151 - 161.
11. Gambelli L, Santaroni GP. 2004. Polyphenol content in some Italian red wines of different geographical origins. Journal of Food Composition and Analysis 17: 613 - 618.