Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.73 n.2 Lima abr./jun. 2007
TRABAJOS ORIGINALES
Equilibrio ácido-base de algas marinas del litoral peruano elucida su alta afinidad por contaminantes ambientales
Acid-base equilibrium of marine seaweeds from the peruvian coast elucidates its high affinity by environmental pollutants
Norma A. Cuizano1 ; Bertha P. Llanos1 ; Lily Chang1 ; Abel E. Navarro2
1 Departamento Académico de Química, Facultad de Ciencias y Filosofía Alberto Cazorla Talleri Universidad Peruana Cayetano Heredia, Urb. Ingeniería, Lima, Perú.
2 Chemistry Department, Graduate School of Arts and Science, New York University, New York, NY, 10003, US. E-mail: aen234@nyu.edu
RESUMEN
Se evaluaron las propiedades ácido-básicas de dos algas marinas recolectadas del litoral peruano: Macrocystis integrifolia Bory y Lessonia nigrescens Bory mediante titulación potenciométrica. Ambas algas muestran fuertes propiedades ácidas con pKa de 2,13 y 2,67, respectivamente. Esta ligera diferencia se atribuye a la relación en contenido fucoidanos/alginato más las proteínas fosfatadas presentes en las algas. También se demuestra que la superficie de Macrocystis integrifolia Bory está cargada negativamente a pH mayores de su pKa en mayor proporción que Lessonia nigrescens Bory, porque contienen 2,76 y 2,14 mmol de grupos carboxilo por gramo de alga. De los resultados, las algas estudiadas son biosorbentes potenciales para su aplicación en la eliminación de contaminantes de aguas residuales a condiciones reales, las cuales son extremas por su composición y acidez.
Palabras clave: pKa, algas marinas, pH, biosorción.
ABSTRACT
Acid-base properties of two seaweeds: Macrocystis integrifolia Bory y Lessonia nigrescens Bory collected from the Peruvian coast were evaluated using potentiometric titrations. Both algae showed strong acidic properties with pK values of 2,13 and 2,67, a respectively. This slight difference is attributed to the fucoidan/ polyalginate plus phosphorilated proteins ratio, present in the algae content. Macrocystis integrifolia Bory also demonstrated a higher negatively charged surface at pH higher than its pKa compared to Lessonia nigrescens Bory, because they contained 2,76 and 2,14 mmol of carboxyl groups per gram of algae. The results demonstrate, these algae are potential biosorbents for their application in the removal of contaminants from residual waters at real conditions; which are extreme due to their composition and acidity.
Keywords: pKa, seaweed, pH, biosorption.
INTRODUCCIÓN
Los avances en la ciencia y tecnología desde la revolución industrial han acelerado el desarrollo de industrias extractivas de metales pesados usados como materia prima, trayendo como consecuencia que los ambientes acuáticos situados en la cercanía de ellas presenten concentraciones de metales que exceden los criterios de calidad de agua, diseñado para proteger el medio ambiente, animales y humanos 1,2.
Además, la introducción repentina de compuestos químicos xenobióticos o la reubicación masiva de materiales naturales en diferentes compartimientos ambientales, con frecuencia pueden abatir la capacidad de auto-limpieza de los ecosistemas receptores y, por lo tanto, dar como resultado la acumulación de contaminantes a niveles problemáticos y hasta perjudiciales. Se hace necesario acelerar la eliminación de los contaminantes para remediar los problemas existentes y disminuir el impacto de incidentes futuros mediante el control del ingreso de contaminantes 3.
Un sinnúmero de esfuerzos han sido realizados con el fin de eliminar dichos contaminantes tóxicos de aguas de desecho, entre los que destacan: microprecipitación, electrodeposición, ósmosis, filtración, adsorción, ultracentrifugación, resinas de intercambio iónico, etc. obteniendo resultados satisfactorios. Desafortunadamente, dichos métodos no son efectivos ni aplicables a bajas concentraciones de contaminante en disolución, tornándose altamente costosos y de bajo rendimiento a condiciones reales 4,5. Como por ejemplo, la precipitación química y tratamiento electroquímico son ineficientes para la eliminación de metales pesados, especialmente cuando la concentración del metal en disolución acuosa es alrededor de 100 mg/L y además producen una elevada cantidad de lodo, cuyo tratamiento, es de por sí, difícil y costoso. Las resinas de intercambio iónico, adsorción por carbón activo y tecnología de membranas, son procesos extremadamente caros, especialmente cuando se tratan grandes volúmenes de aguas de desechos conteniendo mezclas de metales pesados y especies orgánicas en bajas concentraciones, lo que los hace poco recomendables para su aplicación a gran escala 6,7.
En la década pasada, los procesos biotecnológicos han llamado la atención de la comunidad científica por la variedad de métodos detoxificantes de metales pesados 8. Dentro de este contexto, la biotecnología ha separado dos grandes áreas dentro del mismo objetivo: bioacumulación y biosorción. Se entiende por bioacumulación al proceso activo de eliminación de contaminantes mediante mecanismos metabólicos involucrando biomasa viviente, y biosorción como un proceso pasivo mediante un mecanismo propiamente fisicoquímico, por medio de biomasa inerte. Por ende, la biosorción es un área de investigación con muchos aportes a la comunidad industrial, velando por su integridad, brindándole alternativas tecnológicas y económicamente viables; además, es considerada una tecnología limpia en la eliminación de contaminantes ambientales de aguas residuales o de desecho de actividades productivas 9.
Por razones económicas, la biotecnología ha prestado mucha atención a las algas marinas, porque son producidas naturalmente en grandes cantidades, yaciendo en las orillas de las playas y siendo alguna de ellas consideradas material de desecho. Su aplicación como biosorbentes para la eliminación de contaminantes 10,11, podría interpretarse como el uso de desechos para eliminar desechos. Las embarcaciones pesqueras que arrastran enormes cardúmenes de peces, arrastran también gran cantidad de algas, las cuales pueden ser vendidas, ahorrándose de esta manera el gasto asociado a su eliminación 12. La efectividad de las algas para adsorber selectivamente contaminantes ambientales en presencia de otras sustancias, se debe a la presencia de grupos funcionales ácidos, los cuales al ionizarse, exhiben alta densidad electrónica, tales como alginatos (pKa ~ 3,5–4,5) y fucoidanos (pKa ~ 1-2). Siendo los alginatos los más abundantes 13.
Numerosos estudios han mostrado que el pH es un factor preponderante en la biosorción de contaminantes por biomateriales 14,-16. Se ha observado una importante relación entre la adsorción de contaminantes y la magnitud de la carga negativa en la superficie del adsorbente, la cual está vinculada a la superficie de sus grupos funcionales 17. La forma iónica del metal en disolución y la carga eléctrica en la superficie del adsorbente, dependen fuertemente del pH de la disolución. A valores de pH más altos del pKa de estos grupos ácidos, los sitios activos están principalmente en su forma disociada y pueden intercambiar fácilmente iones hidronio con contaminantes polares o iones metálicos en disolución. A valores de pH menores del pKa de estos grupos, se podría presentar un fenómeno de acomplejamiento, especialmente mediante grupos carboxilo 18. El pH es un factor ambiental que no afecta únicamente a la disociación de 14 sitios activos del adsorbente, sino también la química acuosa de los contaminantes14 (iones metálicos o moléculas polares) mediante hidrólisis, acomplejamiento por ligandos orgánicos e inorgánicos, reacciones rédox y precipitación. Por lo expuesto, en el presente estudio se propuso determinar la constante de ionización (pKa) y las propiedades ácido-básicas de algas a marinas las cuales permitirán conocer el pH adecuado para maximizar la capacidad de adsorción de contaminantes ambientales de aguas residuales y de desecho.
PARTE EXPERIMENTAL
Muestreo de campo
Las algas Macrocystis integrifolia Bory y Lessonia nigrescens Bory crecen y yacen en forma silvestre en el mar, cercanas a las orillas peruanas del océano Pacífico. Para el presente estudio, el alga Macrocystis integrifolia Bory fue extraída y recolectada del zócalo continental de las playas de Marcona (Ica) a una distancia de 200 m de la orilla. Se procedió de la misma forma con el alga Lessonia nigrescens Bory, de la isla Morro (Tacna). Las algas fueron lavadas con agua potable para eliminar partículas sólidas y se trasladaron al laboratorio para su identificación taxonómica, conservándose a temperatura menor que la del ambiente y en las mismas aguas de mar de donde fueron recolectadas.
Reactivos y soluciones
Todas las sales y reactivos usados en el experimento fueron de grado analítico (MERCK). Las soluciones fueron preparadas con agua tipo I purificada por ósmosis reversa mediante el equipo Barnstead/Thermolyne (Dubuque IA) D2714, el cual proporciona agua con una conductividad de 18 mÙ. El titulante fue estandarizado con biftalato de potasio. Durante la titulación, el pH fue controlado mediante un potenciómetro Chem-Cadet 5986-25 Cole Parmer; asimismo se controló la conductancia de la solución para detectar cambios bruscos en el pH.
Pretratamiento de las algas
Se lavó las algas con abundante agua potable y luego con agua tipo I; se secó a temperatura ambiente, se molió y se separó diferentes tamaños mediante tamizado hasta alcanzar tamaño de partícula (d < 75um) y (75um>d2 >106um). Luego se suspendió con 1 2 agitación constante en 0.1N de HCl por una hora con el fin de protonar todos sus sitios activos y se filtró al vacío; se enjuagó con abundante agua tipo I para eliminar el exceso de ácido. Finalmente, se secó las algas en la estufa a 40°C, durante 24 horas y luego se almacenó en frascos herméticos de plástico, refrigerados hasta su uso.
Titulación potenciométrica
Se agregó 4 gramos de alga de diámetro de partícula d pretratado con HCl, a 100mL de 1 una solución 0,1N de KCl, con el fin de mantener una fuerza iónica estable durante toda la titulación. Se tituló con una solución valorada 0,2663 N de KOH, en el intervalo de pH 2 hasta aproximadamente 13. La titulación se realizó a 25°C mediante un baño de temperatura y se mantuvo el recipiente con burbujeo constante de nitrógeno para mantener un ambiente inerte libre de dióxido de carbono y oxígeno. Se procedió de la misma manera para los tipos de algas y también con el otro tamaño de partícula d2 para descartar efecto del tamaño de partícula en la titulación.
RESULTADOS Y DISCUSIÓN
Sheng et al.13 determinaron que los grupos funcionales que se unen a metales pesados en las algas marinas son carboxilo, fosfatos y ácidos sulfónicos, bajo las formas de proteínas fosfatadas, alginato y fucoidanos cuyos pKa son 3-4, 3,5-4,5 y 1-2 respectivamente 13,19. De las a Figuras 1 y 2, se observa empíricamente puntos de equivalencia alrededor del pH 7, el cual puede atribuirse a distintos grupos funcionales con diferentes propiedades químicas presentes en ambas algas marinas. Si bien ambas curvas de titulación muestran similares puntos de equivalencia, cabe resaltar un mejor comportamiento para el alga Macrocystis integrifolia Bory (Figura 1), que evidencia a la presencia mayoritaria de pocos grupos funcionales ácidos que predominan en su equilibrio ácido-base, mientras que en el caso de Lessonia nigrescens Bory, podría presentar, además, otros grupos interferentes, como proteínas fosfatadas, que son anfóteras, en mayor proporción, que alteraría dicho equilibrio.
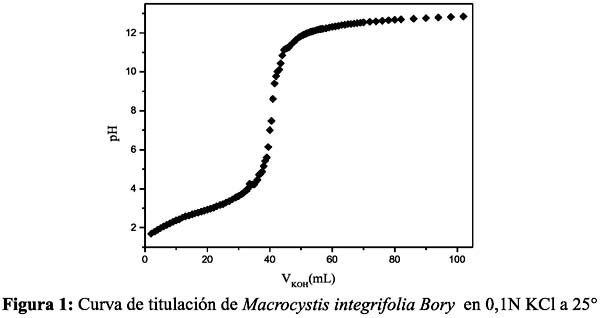
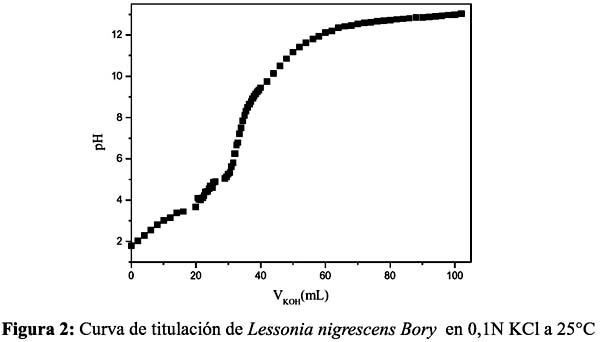
Desafortunadamente, el grupo hidroxilo no es ionizable bajo estas condiciones experimentales, por lo que no se puede determinar su contribución en la adsorción. Con el propósito de explicar este fenómeno mediante modelos matemáticos, se procedió a calcular la constante de ionización pKa aparente de los adsorbentes y la concentración total de grupos carboxilos, cuya alta capacidad de adsorción de metales pesados ha sido confirmada.
La concentración total de grupos carboxilo presente en cada gramo de alga marina, [COOH] puede ser calculado en mmol/g tomando en cuenta el volumen de titulante t consumido para alcanzar el punto de equivalencia, Ve, de la curva de titulación e potenciométrica usando una masa m de adsorbente. La ecuación I demuestra lo expuesto mediante la relación:
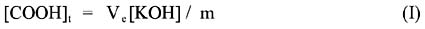
De acuerdo a los resultados, el alga Macrocystis integrifolia Bory presenta 2,76 mmol/g, mientras que Lessonia nigrescens Bory tan solo 2,15 mmol/g. Estudios previos, muestran concentraciones cercanas a 1mmol/g para hongos comestibles16 y Rey-Castro et al. muestran resultados comparables a los nuestros, cercanos a 2 mmol/g para algas marinas 20.
Katchalsky et al 21, demostró que la curva de titulación de un poliácido puede ser descrita por la ecuación II, basado en las constantes pK y n:
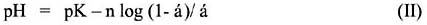
Donde α representa el grado de disociación definida en la ecuación III y n es una constante empírica, cuyo valor aceptable es positivo y cercano a uno. La ecuación III se resume mediante la siguiente expresión:
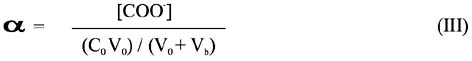
Donde Vb representa el volumen de base empleado y C0 es la concentración inicial de grupos ácidos calculado en forma similar a la ecuación I, pero referida al volumen de la - disolución, donde ahora V0 sustituye a la masa m. La variable [COO-] puede ser calculada mediante balance de cargas de la ecuación IV, donde Cb representa la concentración del titulante:
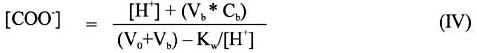
Luego del análisis de regresión lineal pH versus log (1-α)/ α, se determinaron los valores de pK y n de ambas algas marinas como se muestran en las Figuras 3 y 4 con un buen coeficiente de correlación lineal. Se procedió mediante el mismo análisis con ambas algas de tamaño de partícula d2, obteniendo resultados similares (datos no mostrados).
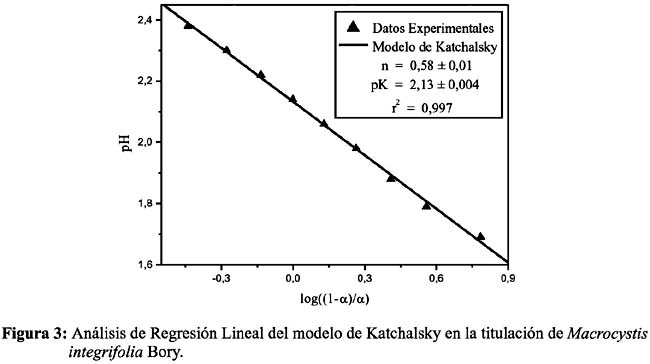
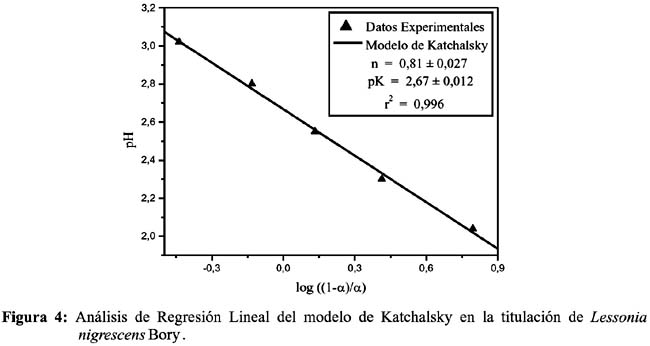
Para ambas algas, se obtuvo un pKa dentro del rango 2,1 - 2,7, siendo el alga Macrocystis integrifolia Bory, la que muestra una mayor acidez (pKa = 2,13) y también una mayor concentración de grupos carboxilo por gramo de biomasa, lo cual indica que no sólo tiene grupos ácidos ionizables a bajo pH, sino que su superficie se encuentra bastante poblada de estos grupos cargados a comparación de Lessonia nigrescens Bory la cual sólo representa un 77% de su análoga y posee un pKa de 2,67. De estos resultados se podría concluir que Macrocystis integrifolia Bory presenta mayor concentración de fucoidanos en su estructura, debido a su menor pKa, mientras que Lessonia nigrescens Bory, presenta mayor cantidad de alginatos y/o mayor contenido en proteínas fosfatadas que no sólo elevan el pKa sino también a alteran la resolución de la curva de titulación.
En la biosorción de metales pesados, Ramos et al, 16,22 demostraron que el hongo comestible Lentinus edodes adsorbe iones cadmio en menor proporción que las algas marinas10,11,23 y, efectivamente, el pKa de Lentinus edodes está muy por encima de los resultados obtenidos para algas marinas y, es más, la concentración de grupos ácidos ionizables sólo representa un 45% del de las algas.
Por otro lado, la constante de ionización ácida de las algas marinas concuerda con el promedio de los pKa de los grupos funcionales presentes, tales como polialginatos y a fucanoides mencionados anteriormente y ratifican la alta capacidad de adsorción por metales pesados a pH mayor de 3 11,13, colorantes artificiales 24 y, recientemente, nuestro grupo de investigación demostró su eficiencia con moléculas polares, como fenoles.
CONCLUSIONES
Las algas marinas recolectadas del litoral peruano Macrocystis integrifolia Bory y Lessonia nigrescens Bory, muestran fuertes propiedades ácidas, con una concentración de grupos carboxilo de 2,76 y 2,14 mmol/g respectivamente; por lo tanto las convierte en potenciales adsorbentes para la eliminación de contaminantes ambientales, tales como metales pesados, moléculas orgánicas, colorantes y otros. La constante de ionización aparente refleja el pH al cual la superficie de las algas están cargadas negativamente afianzando sus propiedades adsorbentes, debido a la presencia mayoritaria de grupos funcionales como polialginatos y fucanoides. Macrocystis integrifolia Bory presenta un pKa de 2,13 elucidando a una mayor concentración de fucoidanos, mientras que Lessonia nigrescens Bory posee un pK a de 2,67, aparentemente debido a una mayor cantidad de proteínas fosfatadas y/o alginatos. De los resultados, ambas algas son capaces de ionizarse a bajos valores de pH, incrementando sus propiedades adsorbentes y las convierte en una alternativa útil para la detoxificación de aguas residuales reales, cuyas condiciones son extremas.
AGRADECIMIENTOS
Los autores deseamos agradecer al Departamento de Química y al Laboratorio de Investigación y Desarrollo de la Facultad de Ciencias de la Universidad Peruana Cayetano Heredia, a las señoritas Ángela Manrique, Ivonne Chion y Rosario Agapito, por el apoyo en el trabajo experimental y a Sean M. Hunt por sus comentarios. El presente trabajo fue financiado por el proyecto 152-2006-CONCYTEC-OAJ concedido por el Consejo Nacional de Ciencia y Tecnología y por el Fondo Concursable para la Investigación de la UPCH.
REFERENCIAS
1. K. Yew-Hoong, YZ. Tang, MA. Aziz, Water Res., 2002, 36, 1313-1323.
2. E. Guibal, N. von Offenberg, M. Zikan, T. Vincent, JM. Tobin, Int J Biol Macromol., 2001, 28, 401-408.
3. S. Liu, JM. Suflita, Trends Biotechnol., 1993, 11, 344-35.
4. F. Veglio, F. Beolchini, M. Prisciandaro. Water Res., 2003, 37, 4895-4903.
5. R. Jalali, H. Ghafourian, Y. Asef, S. Davarpanah, S. Sepher, J. Hazar. Mater., 2002, B92, 253-262.
6. JC. Ng, WH. Cheung, G. McKay. J. Colloid. Interface Sci., 2002, 255, 64-74.
7. B. Volesky. Biosorption and biosorbents. Florida CRC press, 1990, 3-5.
8. B. Volesky, Hydrometallugy, 2001, 59, 203-216.
9. R. Vieira y B. Volesky, International Microbiology, 2000, 3, 17-24.
10. AE. Navarro, D. Blanco, B. Llanos, J. Flores, H. Maldonado. Rev. Soc. Quím. Perú., 2004, 70, 147-157.
11. D. Blanco, B. Llanos, N. Cuizano, H. Maldonado, AE. Navarro. Rev. Soc. Quím, Perú., 2005, 71, 237-245.
12. A. Kapoor, T. Viraraghavan, Bioresour. Technol., 1995, 53, 195-206.
13. PX. Sheng, YP. Ting, JP. Chen, L. Hong., J. Colloid, Interface Sci., 2004, 275, 131-141.
14. AE. Navarro, K. Ramos, K.Campos, H. Maldonado, Rev. Iberoamer. Polím., 2006, 7, 2, 113-126.
15. YS. Ho, Bioresour. Technol., 2005, 96, 1292.
16. AE. Navarro, K. Ramos, R. Agapito, N. Cuizano, Rev. Latinoamer. Rec. Natur., 2006, 2, 45-52.
17. A. Selatnia, M. Bakhiti, A. Madani, L. Kertous, Y. Mansouri., Hydrometallurgy, 2004, 75, 11.
18. E. Fourest, B. Volesky, Environ. Sci. Technol., 1996, 30, 277.
19. T. Davis, B. Volesky, A. Mucci, Water Res., 2003, 37, 4311-4330.
20. C. Rey-Castro, P. Lodeiro, R. Herrero, M. Sastre de Vicente, Environ. Sci. Technol. 2003, 37, 5159-5167.
21. A. Katchalsky, N. Shavit, H. Eisenberg, J Polimer Sci B, 1954, 13, 69-84.
22. K. Ramos, AE. Navarro, L. Chang, H. Maldonado, Rev. Soc. Quím. Perú, 2004, 70, 137- 146
23. N. Cuizano, AE. Navarro, An. Quím., 2007, en prensa.
24. V. Vilar, C. Botelho, R. Boaventura, J. Hazar. Mater., 2007, en prensa.













