Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.73 no.3 Lima July/set 2007
Algunas propiedades bioquímicas de una L-aminoácido oxidasa aislada del veneno de la serpiente Bothrops atrox
Some biochemical properties of a L- amino acid oxidase isolated from Bothrops atrox snake venom
Fanny Lazo1 , Orestes Málaga1, Armando Yarlequé1 , Ruperto Severino2
1 Laboratorio de Biología Molecular - Facultad de Ciencias Biológicas - UNMSM flazom@unmsm.edu.pe
2 Laboratorio de Zoología de Invertebrados - Facultad de Ciencias Biológicas - UNMSM
RESUMEN
Se ha purificado y caracterizado una L-aminoácido oxidasa (LAO) del veneno de Bothrops atrox, empleando dos pasos cromatográficos, una columna de filtración molecular sobre Sephadex G-100 y otra de intercambio catiónico sobre CM Sephadex C-50, equilibrada con buffer acetato de amonio 0,05M pH 6. El grado de purificación fue de 12,14 veces, con una actividad especfica de 4,13 U/mg. La enzima es una glicoproteína ácida con 17% de carbohidratos asociados, homodimérica con un peso molecular de 127, 879 Daltons y conformada por dos subunidades de 63,128 Daltons cada una, conteniendo por lo menos un enlace disulfuro intracatenario, que es importante para su actividad. La enzima mostró un pH óptimo de 8,3 usando L-leucina como substrato; es inestable en el rango de pH alcalino a partir de 9; pierde actividad en presencia de Zn2+ (6mM) y tolera temperaturas hasta los 55 °C. Los ensayos de inmunodifusión e inmunoelectroforesis con antiveneno botrópico polivalente demostraron que LAO es una proteína antigénica.
Palabras clave: L-aminoácido oxidasa, serpiente, enzima, Bothrops atrox, veneno
ABSTRACT
A L-amino acid oxidase enzyme was purified and characterized from Bothrops atrox snake venom by two steps. It used a Sephadex G-100 coulmn and ion exchange on CM Sephadex C-50 at pH 6. The p grade was 12,14 folds with a specific activity of 4,13 U/mg. The enzyme with a molecular weight of 127, 879 Daltons as determined by gel filtration, is a noncovalent dimmer consisting of two subunits with a molecular weight each of 63, 128 Daltons as determined by SDS-PAGE, with at least one intrachain disulfide bond that is important for its activity. The enzyme exhibited a opt pH 8,3 using L-leucine as substrate. It is an acid glicoprotein containing 17% carbohydrates, being thermoestable till 55,labil to alkaline pH and susceptible to presence of Zn2+ (6mM). Immunodiffusion and immunoelectrophoresis assays, using polivalente botropic antivenom, showed that LAO is antigenic protein.
Key words: L-amino acid oxidase, snake, enzyme, Bothrops atrox, venom
INTRODUCCIÓN
El estudio de los recursos naturales es muy importante, ya que ellos son fuente de principios activos con una gran variedad de efectos farmacológicos. En este sentido, los venenos de serpientes constituyen una excelente fuente biológica para el aislamiento de moléculas con potencial uso en el campo de la medicina.
Dentro de los numerosos componentes enzimáticos del veneno de la serpiente B. atrox, causante de la mayoría de accidentes ofídicos en la región selvática (Carrillo e Icochea, 1995)1, se encuentra la L-aminoácido oxidasa (LAO), la cual es una flavoenzima responsable del color amarillo de los venenos, que cataliza y es específica para la desaminación oxidativa de un L-aminoácido usado como substrato a un á-cetoácido con la producción de amoniaco y peróxido de hidrógeno. Estas enzimas están ampliamente distribuidas en la naturaleza encontrándose en venenos de ofidios de las familias viperidae y elapidae (Tu, 1977)2
Antes de la década del 90, el aislamiento y caracterización de LAO de venenos de serpientes estaba dirigido principalmente al estudio de las propiedades enzimáticas y fisicoquímicas tales como mecanismos de acción e inactivación por cambios de pH o congelamiento (Porter y Bright, 1980)3. Además, Curti et al. (1992)4 revisó en detalle las propiedades enzimáticas de las L - y D - aminoácido oxidasas. En los últimos años las Laminoácido oxidasas de venenos están siendo aisladas y purificadas para estudiar las interacciones que presentan durante los procesos de agregación plaquetaria (Takatsuka et al., 2001)5 e inducción de hemorragia y apoptosis (Torii et al., 2000)6.
A pesar de que su función biológica ha sido poco comprendida, LAO posee una potencial utilidad en la investigación bioquímica y ha sido utilizada en la identificación de L- aminoácidos (Avrameas y Uriel, 1965)7, en la preparación de á-cetoácidos (Buckey y Porges, 1956)8 y en la obtención de FAD (Singer y Kearney, 1950)9. En venenos de serpientes, su rol biológico aunque aún poco estudiado, podría estar relacionado con la degradación de aminoácidos durante la digestión, así como la protección contra microorganismos presentes en la presa ingerida (Yarlequé et al., 1997)10. Por estas razones, el presente trabajo ha consistido en aislar y purificar LAO del veneno de B. atrox y determinar sus propiedades bioquímicas como paso previo al estudio de su acción biológica.
MATERIALES Y MÉTODOS
Veneno
Se utilizó veneno crudo de especímenes adultos de la serpiente Bothrops atrox, procedentes de la zona de Pucallpa, departamento de Ucayali, mantenidos en el Serpentario Oswaldo Meneses de la UNMSM. El veneno extraído por presión manual de las glándulas, fue liofilizado y conservado a –8 ºC.
Cuantificación de proteína
En todos los ensayos la concentración proteica en el veneno y en la enzima purificada fue estimada por el método de absorción ultravioleta a 280 nm (Warburg y Christian, 1941)11 y por el método de Lowry et al. (1951)12, usando como estándar de proteína albúmina sérica bovina.
Actividad enzimática
Se determinó por el método descrito en el Worthington Enzyme Manual (1993)13. En 2,9 ml de buffer Tris HCl 0,2M pH 7,5 conteniendo L-leucina 0,1% y O-dianisidina 0,0065%, se agregaron 10 ìl de peroxidasa al 0,001%. La mezcla se incubó durante 5 minutos a 37 ºC y luego se agregaron 25 ìl de la solución de enzima o veneno crudo, determinándose el incremento de absorbancia a 436 nm. La actividad enzimática fue expresada en ìmoles de Lleucina oxidados por minuto.
Estabilidad al pH
Se evaluó usando buffer acetato de amonio 0,1M pH 5, 6, y buffer Tris HCl 0,1M pH 7,8 y 9. De cada buffer se tomaron 2,8 ml y se agregó 0,2 ml del veneno crudo de B. atrox 2 mg/ml. Las muestras fueron colocadas a 20 ºC, midiéndose la actividad enzimática desde 0 a 96 horas.
Purificación de la enzima
80 mg del veneno liofilizado de Bothrops atrox se resuspendieron en buffer acetato de amonio 0,05M pH 6 y luego se centrifugaron a 4000 rpm por 20 minutos. El sobrenadante obtenido fue aplicado a una columna de filtración de Sephadex G-100 (49 x 1,1 cm), utilizándose el mismo buffer como eluyente a 20 ºC a un flujo de 7,45 ml/h. Se colectaron fracciones de 2 ml, determinándose en ellas la concentración de proteína, así como la actividad enzimática. Las fracciones con mayor actividad específica fueron reunidas y aplicadas a una columna de intercambio catiónico de CM -Sephadex C-50 (23 x 1,2 cm), equilibrada con el mismo buffer, colectándose fracciones de 1 ml a una velocidad de flujo de 17 ml/h. Las fracciones con mayor actividad de LAO fueron reunidas para evaluar su pureza y su posterior caracterización.
Pureza
La pureza de la LAO fue determinada por electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (PAGE-SDS), de acuerdo al método de Laemmli (1970)14 . Adicionalmente, la pureza fue evaluada por inmunodifusión e inmunoelectroforesis en geles de agarosa al 1% preparados sobre láminas portaobjetos (Ouchterlony y Nilsson, 1978)15
Caracterización bioquímica
Determinación del peso molecular: Se determinó mediante electroforesis en PAGESDS en una cámara electroforética en mini slab vertical bajo condiciones reductoras y no reductoras a voltaje constante de 100 voltios durante una hora. Las bandas de proteína fueron reveladas con azul brillante de Coomasie y se utilizaron proteínas marcadoras: albúmina sérica bovina (66 kDa), ovoalbúmina (45 kDa) y lisozima (14 300 kDa). Adicionalmente a la técnica electroforética se utilizó una columna de Sephacryl S-200 (42,4 X 1,1 cm), equilibrada con buffer Tris HCl 0,05M NaCl 0, 15M pH 7,5 en la cual se aplicaron por separado la proteína en estudio y las proteínas estándares: alcohol deshidrogenasa (150kDa), albúmina sérica bovina (66 kDa) y anhidrasa carbónica (29 kDa). Para el cálculo del peso molecular se plotearon los Ve/Vo versus el logaritmo de los pesos moleculares (Andrews, 1964)16.
Termoestabilidad: Se evaluó en el rango de 37 a 100 C durante 10 minutos. Luego de este tiempo las muestras fueron enfriadas a 4 ºC por 30 minutos, midiéndose luego la actividad a pH 8,3 con 20 l de la muestra.
pH óptimo: Se determinó usando buffer acetato de amonio 0,2M (pH 5 a 6) y buffer tris HCl 0,2M ( pH 7 a 9), con 25 μl de la enzima.
Efecto de iones metálicos: Se probó el efecto de los iones Mg , Ca2+, Mn2+ y Zn2+ bajo la forma de cloruros a concentraciones finales de 0,75, 1,5, 3 y 6 mM. La enzima fue preincubada con cada uno de los iones a 37 ºC por cinco minutos y luego se midió la actividad enzimática.
Efecto de algunos inhibidores enzimáticos: Se evaluó el efecto del ácido iodoacético, mercaptoetanol, ácido glutámico, EDTA y glutation a concentraciones de 2,5, 5 y 10 mM. Estos agentes fueron ensayados de modo similar al anterior.
Contenido de carbohidratos: Los azúcares neutros y las hexosaminas se determinaron por el método de Winzler (1955)17 y el ácido siálico por el método de Warren (1959)18, tanto en la enzima purificada como en el veneno crudo.
RESULTADOS Y DISCUSIÓN
Estabilidad
Los resultados de la estabilidad de la enzima a diferentes pH, en el veneno crudo, muestran que la enzima es estable a pH 5, 6 y 7, mientras que a pH 8 y 9 la actividad se pierde rápidamente. Esto nos permitió seleccionar el buffer acetato de amonio 0,05M a pH 6 para realizar el aislamiento de la enzima.
Purificación de LAO
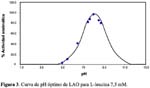
En el primer paso de purificación usando Sephadex G-100 a pH 6, se logró resolver 3 picos de proteína. La actividad LAO, se localizó en el primer pico, tal como se observa en la Figura 1.
Las fracciones enzimáticas obtenidas en el primer paso y cromatografiadas en un intercambiador catiónico CM Sephadex C-50, permitió obtener un solo pico de proteína eluido directamente y un pico adicional al usar el buffer de elusión con NaCl 1M (Figura 2), correspondiendo la actividad LAO al primer pico. La purificación fue de 12,14 veces con un rendimiento del 26,4% y una recuperación de proteína activa de 2,17%.
El hecho de que la enzima se detecte en el primer pico de proteína obtenido en la cromatografía de filtración y de que eluya directamente de la columna de intercambio catiónico a pH 6, nos revela que se trata de una de las proteínas de mayor peso molecular del veneno y que además, es de naturaleza ácida y que posee un punto isoeléctrico menor a 6. Estos resultados son comparables a los obtenidos por Sánchez y Magalhaes (1991)19, quienes la aislaron del veneno de Lachesis muta del Brasil y Solís et al. (1999)20, que la obtuvieron del veneno de Bothrops brazili del Perú. En ambos casos la enzima eluye isocráticamente en una columna de intercambio catiónico, lo que evidencia su carga negativa a pH 6, así como su alto peso molecular.
Peso molecular
La proteína obtenida se mostró como una entidad homogénea, con una sola banda proteica tanto en condiciones reductoras como no reductoras en PAGE.SDS, y por cromatografía de filtración se estableció que la enzima es homodimérica, con un peso molecular de 127 kDa, constituída por dos subunidades de 63 kDa, las cuales tienen al menos un enlace disulfuro. La presencia de puentes disulfuros ha sido determinada en la enzima purificada de otros venenos, como el de Crotalus adamanteus (De Kok y Rawitch, 1969)21 y en el caso de la enzima de Ophiophagus hannah. Mediante estudios de carboximetilación (Li et al., 1994)22 se ha demostrado que por PAGE-SDS, en presencia o ausencia de ß-mercaptoetanol, aparecía una banda de similar movilidad con un peso molecular de 65 kDa. Sin embargo, también se han encontrado enzimas de este tipo con estructuras monoméricas, como la de Echis macmahoni (Ali et al., 2000)23, en la que por espectrofotometría de masa se tuvo un valor de 58,7 kDa en condiciones no reductoras, la de Trimeresurus flavoviridis (Takatsuka et al., 2001)5 y de Agkistrodon halys blomhoffii (Abe et al., 1998)24 que registraron pesos moleculares de 55 y 60 kDa, respectivamente.
pH óptimo y termoestabilidad
El análisis de la actividad LAO en función del pH, mostró que la enzima tiene una máxima acción a pH 8,3 usando L-leucina como substrato, en tanto que, en el rango ácido, es decir, a pH 5 o por encima de 9, los valores decaen (Figura 3). Así mismo, las pruebas con LAO en el rango de temperaturas de 37 a 100 ºC, revelaron que la enzima es una proteína que soporta calentamiento hasta los 55 ºC, reduciendo su actividad al 50% a los 65 ºC y perdiéndola totalmente a los 75 ºC. Esto contrasta con lo hallado para LAO de A. piscivorus en la que el grado de inactivación se incrementa en el rango de 25 a 45 ºC (Singer y Kearney, 1950)9. Por otro lado LAO de B. atrox al ser calentada a 60 ºC por una hora, disminuye su actividad en un 50%, comportamiento muy similar a la proteína de B. brazili (Solís et al., 1999)20, más no a la de C. adamanteus que pierde toda su actividad a 60 ºC por 30 minutos (De Kok y Rawitch, 1969)21.
Efecto de iones metálicos
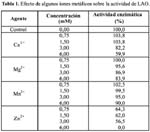
Tal como se aprecia en la Tabla 1, los iones Mg2+, Ca2+ y Mn2+ inhiben ligeramente la actividad de LAO, mientras que con el ion Zn2+ pierde totalmente su actividad, utilizando la concentración de 6 mM; lo que indicaría que la enzima no los requiere salvo el caso del ion zinc que ejerce efecto inhibitorio. Estos datos tienen similitud a los hallados con las enzimas de L. muta y B. brazili (Cisneros et al., 200625; Solís et al., 199920) que mostraron ser inhibidas por Zn2+.
En cuanto a los iones Zn2+, a diferencia de Ca2+ , Mg2+ y Mn2+ en solución, tienden a formar más fácilmente iones complejos con iones negativos u otras moléculas pequeñas llamadas ligandos; éstos tienen como característica común un par de electrones no compartidos que pueden donar al ion metálico (Bender y Brubacher, 1977)26. Así pues, para mencionar sólo dos posibilidades, las proteínas a través de los átomos de nitrógeno del grupo imidazol de un residuo de histidina o a través del grupo sulfihidrilo de la cisteína podrían unirse a este ion metálico.
La acción inhibitoria del ion metálico podría deberse a su capacidad de inducir un cambio conformacional en la proteína de manera que reduzca su actividad enzimática, o la de unirse a un residuo esencial del centro activo de la enzima, de modo reversible (Bender y Brubacher, 1977)26.
Acción de inhibidores enzimáticos
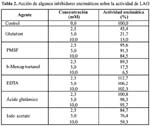
La Tabla 2 muestra las variaciones en la actividad de LAO, según el agente empleado. Se puede observar que de ellos el mercaptoetanol y el glutation inhiben la actividad enzimática a medida que se incrementan las concentraciones (2,5, 5 y 10 mM ) de los agentes en estudio. Por su parte el iodoacetato y PMSF 5mM tuvieron un ligero efecto en la actividad enzimática. El -mercaptoetanol es un agente reductor capaz de escindir enlaces disulfuros, y su acción demostraría que los enlaces disulfuros intracatenarios, evidenciados por PAGE-SDS, son esenciales para mantener la actividad de la enzima. Sin embargo, no se puede descartar que adicionalmente, el glutatión cause la escisión de enlaces disulfuros presentes en la enzima purificada, debido a que el agente posee un grupo sulfihidrilo (Barker, 1975)27.
Carbohidratos asociados
La enzima purificada es una glicoproteína ácida que contiene 17% de azúcares totales. Esto también fue observado en las enzimas de Crotalus adamanteus (Dekok y Ratwitch, 1969)21, Lachesis muta (Sánchez y Magalhaes, 1991)19 y en Ophiophagus hannah (Li et al., 1994). Las cadenas de oligosacáridos de la enzima, al parecer, no sólo modelarían sus propiedades físico-químicas, tales como estabilidad, carga, solubilidad y viscosidad, sino también la protegerían de la proteolisis, teniendo en cuenta el entorno fuertemente proteolítico que rodea a la enzima en el veneno (Dos Santos et al., 1993)28.
Antigenicidad
Los ensayos de inmunodifusión e inmunoelectroforesis, usando suero antibotrópico polivalente (INS-Lima) revelan que la enzima es antigénica, lo que indicaría que puede ser neutralizada por el antiveneno botrópico (Figura 4).
CONCLUSIONES
La presente investigación ha permitido establecer que el veneno de la serpiente Bothrops atrox posee una L-aminoácido oxidasa, la cual fue purificada al estado homogéneo. Siendo una glicoproteína ácida, homodimérica, con un peso molecular de 127, 879 Daltons y es inmunogénica al antiveneno botrópico polivalente.
COMENTARIO Y AGRADECIMIENTO
El presente trabajo es parte de la Tesis de Magíster en Biotecnología de uno de los autores (F. L.). Los autores del presente trabajo, agradecen al Consejo Superior de Investigaciones (CSI) de la UNMSM, por el apoyo financiero que nos brindaron para llevar a cabo esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Carrillo N., Icochea J. Lista taxonómica preliminar de los reptiles vivientes del Perú. Pub. Mus. Hist. Nat. Javier Prado-UNMSM. 1995; Serie A (49):27.
2. Tu A.Venoms: Chemistry and Molecular Biology. Wiley & Sons. New York; 1977.
3. Porter DJ, Bright HJ. Interpretation of the pH dependance of flavin reduction in the Lamino acid oxidase reaction. J Biol Chem 1980; 255: 2969-2975.
4. Curti B, Ronchi S., Imonetta S. D- and L- amino acid oxidases.In: Mueller F, editor. Chemistry and Biochemistry of Flavoenzyme. Boca Ratón: CRC Press. 1992; p 69-94.
5. Takatsuka H., Sakurai Y., Yoshioka A., Kokubo T., Usami Y., Suzuki M., Matsui T., Titani K., Yagi H., Matsumoto M., Fujimura Y. Molecular characaterization of L- amino acid oxidase from Agkistrodon halys blomhoffii with special reference to platelet aggregation. Biochim Biophys Acta 2001; 1544: 267-277.
6. Torii S., Yamane K., Mashima T., Haga N., Yamamoto K., Fox J., Naito M., Tsuruo T.. Molecular cloning and functional analysis of apotoxin I, a snake venom-derived apoptosis-inducing factor with L-amino acid oxidase activity. Biochemistry 2000; 39:3197-3205.
7. Avrameas S., Uriel J. Methode de coloration des acides amines a Paide de la Laminoacideoxhidrase. J Compy Rend 1965; 261: 584-586.
8. Buckey E., Porges N. Venoms. American Association of the Advancement of Science. 1st ed. 1956; 2295-2302.
9. Singer T., Kearney E. The L-amino acid oxidases of snake venoms. II Isolation and characterization of homogeneus L- amino acid oxidase. Arch Biochem Biophys 1950; 29: 190-209.
10. Yarlequé A., Cárdenas J., Escobar E., Gutiérrez S. Some biochemical properties and antibacterial action of a L- amino acid oxidase from Peruvian snake venoms. Toxicon 1997; 35(4): 489.
11. Warburg O., Christian W. Isolierung and cristallisation del Garung ferments enolase. Biochemische Zertschrift. 1941; 31: 384-421.
12. Lowry O., Rosebrough N., Farr A., Randall R. Protein measurement with the folin phenol reagent. J. Biol Chem 1951; 193: 265-275.
13. Worthington Biochemical Corporation. L-amino acid oxidase..New Jersey. The Worthington Manual Enzymes Related Biochemicals. 1993; p. 34-35.
14. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227:680-685.
15. Ouchterlony O., Nilsson L. Inmunodiffusion and inmunoelectrophoresis. In: Weir D. Editor. Handbook of Experimental Inmunology. Vol 1. Inmunochemistry. 4th ed. Oxford: Blackwell Scientific Publications.1978; p 32.1- 32.5.
16. Andrews P. Estimation of the molecular weights of proteins by Sephadex gel filtration. Biochem J. 1964; 91: 222-233.
17. Winzler R. Determinations of serum glycoproteins. In: Lundbard R, Fenton J, Mann K, editors. Method of Biochemical Analysis.1st ed. New York: Interscience Publisher Inc. 1955; 2: 279-311.
18. Warren L. The thiobarbituric acid assay of sialic acids. J. Biol Chem. 1959; 234(8): 1971- 1975.
19. Sánchez E., Magalhaes A. Purification and partial characterization of a L- amino acid oxidase from Bushmaster snake (Surucucu pico de jaca) Lachesis muta muta venom. Brazilian J Med Biol. Res. 1991; 24: 249-260.
20. Solís C., Escobar E., Yarlequé A. Gutiérrez S. P y caracterización de la L-aminoácido oxidasa del veneno de la serpiente Bothrops brazili J shushupe. Rev Peru Biol. 1999; 6(1): 75-84.
21. De Kok A., Rawitch. Studies on L- amino acid oxidase. II Dissociation and characterization of its subunits. Biochemistry. 1969; 8(4): 1405-1410.
22. Li Z, Yu T, Lian E. P and characterization of L- amino acid oxidase from King cobra (Ophiophagus hannah) venom and its effects on human platelet aggregation. Toxicon 1994 32 (11): 1349-1358.
23. Ali S., Stoeva S., Abbasi A., Alam J., Kayed R., Faigle M., Neumeister B., Voelter W. Isolation, structural and functional characterization of an apoptosis- inducing L- amino acid oxidase from leaf-nosed viper (Eristocophis macmahoni) snake venom. Arch Biochem Biophys. 2000; 384: 216-226.
24. Abe Y., Shimoyama Y., Munakata H., Ito J., Nagata N., Ohtsuki K. C of an apoptosisinducing factor in Habu snake venom as a glucyrrhizin (GL)-binding protein potently inhibited by GL in vitro. Biol. Pharm Bull 1998; 21: 924-927.
25. Cisneros Y., Lazo F., Gutiérrez S., Yarlequé A. Características bioquímicas de una proteína antibacteriana aislada del veneno de Lachesis muta Shushupe. Rev Soc Quim Perú. 2006; 72 (4): 187-196.
26. Bender M., Brubacher L. Catálisis y Acción Enzimática. 1ra. ed. Barcelona. Edit. Reverté. 1977.
27. Barker R. Química Orgánica de los Compuestos Biológicos. 1era. ed. Barcelona. Edit. Alambra. 1975.
28. Dos Santos M., Ferreira L., Dias Da Silva W., Furtado F. Caracterización de las actividades biológicas de los venenos amarillo y blanco de Crotalus durissus ruruima comparados con el veneno de Crotalus durissus terrificus. Poder neutralizante de los antivenenos frente a los venenos de Crotalus durissus ruruima. Toxicon 1993; 31 (11): 1459-1470.