Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.73 n.3 Lima jul./set. 2007
Propiedades antimicrobianas de películas de quitosano-alcohol polivinílico embebidas en extracto de sangre de grado
Antimicrobial properties of chitosan-poly (vinyl alcohol) films containing dragon blood extract
Kety León1 , Julio Santiago1,2
1 Investigación y Desarrollo, Instituto Peruano de Energía Nuclear, Av. Canadá 1470, Lima 41, Perú. jsantiago@ipen.gob.pe
2 Fac. Química e Ing. Química, Universidad Nacional Mayor de San Marcos, Lima 1, Perú
RESUMEN
Se han preparado películas de quitosano-alcohol polivinílico por radiación gamma. Estas películas fueron embebidas en extractos hidroalcohólico, alcohólico y acuoso de sangre de grado (Croton lechleri), y se evaluaron sus propiedades antimicrobianas frente a cepas bacterianas de Staphylococcus aureus, Escherichia coli y Pseudomonas aeruginosa. Se encontró que estas películas, al igual que el látex de sangre de grado, tienen actividad sólo frente a S. aureus. Estas películas tienen potencial aplicación en el tratamiento de heridas.
Palabras clave: Sangre de grado, Croton lechleri, quitosano, alcohol polivinílico, hidrogel, irradiación gamma
ABSTRACT
Hydro alcoholic, alcoholic and aqueous Dragon's blood (Croton lechleri) extracts were introduced in gamma irradiated chitosan-poly (vinyl alcohol) films and their antimicrobial properties against Staphylococcus aureus, Escherichia coli y Pseudomonas aeruginosa have been evaluated. These films as well as the latex exhibit activity against S. aureus only and have potential application as wound healing material.
Keywords: Dragon blood, Croton lechleri, chitosan, poly (vinyl alcohol), hydrogel, gamma radiation.
INTRODUCCIÓN
Para el tratamiento de heridas de difícil cicatrización (quemaduras graves, úlceras) se han desarrollado diferentes materiales, en forma de esponjas o películas, que contienen medicamentos, nutrientes y biomoléculas con diferentes grados de éxito.1-3 Estos materiales deben poseer propiedades similares a la piel normal: no poseer toxinas, proporcionar un ambiente que previene la resequedad de la herida, reducir la penetración de bacterias, evitar pérdidas de calor, agua, proteínas y glóbulos rojos, además de promover una rápida cicatrización. Con este fin se han empleado piel de cadáver (homoinjertos), piel porcina (xenoinjerto) y membrana amniótica humana, desarrollados específicamente para uso en heridas de quemaduras.
Los recubrimientos con hidrogeles (materiales poliméricos entrecruzados en forma de red tridimensional) están considerados entre los más avanzados en el tratamiento de heridas de difícil cicatrización.4 Ayudan a mantener la zona afectada con una adecuada humedad, facilitan el debridamiento autolítico y actúan como una barrera eficaz para evitar que las bacterias ambientales infecten la herida.5 Los hidrogeles tienen la capacidad de absorber una gran cantidad de agua y cualquier sustancia disuelta en ella. De esta manera es posible introducir en los hidrogeles componentes activos que tengan reconocida actividad biológica para acelerar la cicatrización de las heridas.
Entre los polímeros más utilizados para la preparación de hidrogeles para el tratamiento de quemaduras tenemos el quitosano6 y el alcohol polivinílico (PVA)7 debido a su biocompatibilidad, biodegradabilidad y no toxicidad. El quitosano es un polisacárido, que se obtiene por desacetilación de la quitina (obtenida a partir de los desechos de crustáceos), y está compuesto de dos subunidades, D-glucosamina y N-acetil-D-glucosamina, unidas por un enlace glucosídico ß-(1,4). Posee carácter antimicrobiano debido principalmente a la presencia de grupos amino, cargados positivamente, que interaccionan con la membrana celular de la bacteria, cargada negativamente, provocando el deterioro de las proteínas y de otros componentes de la membrana de los microorganismos. Por su parte, el alcohol polivinílico es un polímero sintético, obtenido por hidrólisis ácida o básica del acetato de polivinilo, muy utilizado en la preparación de películas por sus propiedades elásticas, mecánicas y permeabilidad.
La formación de hidrogeles a partir de quitosano y PVA puede realizarse por métodos físicos o químicos. Los agentes químicos utilizados para el entrecruzamiento de las cadenas poliméricas son principalmente el glutaraldehído8 y la genipita (un compuesto natural).9 Entre los métodos físicos se puede mencionar el de enfriamiento-calentamiento,10 y el que utiliza radiación gamma.11 De todos ellos, el que mejor se presta para la obtención de películas para aplicaciones biomédicas es el método de entrecruzamiento por radiación gamma, tanto por la estabilidad mecánica, grado de hinchamiento y por la ausencia de residuos tóxicos.12 También se han preparado hidrogeles entrecruzando primero el PVA con radiación gamma y, luego, introduciendo una solución de quitosano.13
Para incrementar las propiedades biológicas de las películas de quitosano-PVA se han introducido diferentes aditivos como hormonas de crecimiento14 y fibroblastos.15 También se ha utilizado extractos de plantas, principalmente del Aloe vera en PVA y polivinil pirrolidona.16
El látex de la sangre de grado (Croton lechleri) es muy utilizado en la medicina tradicional en el tratamiento de úlceras estomacales, gastritis crónicas, cirrosis al hígado, y como cicatrizante de heridas internas y externas. El estudio fitoquímico del látex muestra que está constituido de alcaloides (taspina), lignanos, derivados de la catequina (epicatequina, gallocatequina y epigallocatequina), polifenoles, proantocianidinas, etc. A la taspina se le atribuyen las cualidades cicatrizantes, antiinflamatorias y citotóxicas en células tumorales. El proceso de cicatrización es coadyuvado por las proantocianidinas (efecto antioxidante) y los lignanos. Asimismo, el efecto antimicrobiano de los polifenoles coadyuva al efecto cicatrizante general de la resina, provocando la precipitación de las proteínas de las células, formándose una costra que cubre la herida. Adicionalmente, el contenido de la proantocianidina oligomérica SP-303 presenta actividad antiviral.17
La sangre de grado presenta actividad antimicrobiana frente a gram-positivos, como: S. aureus ATCC 6538 y S. epidermidis ATCC 12228; y a gram-negativos: Pseudomonas y Klebsiela FDA 602.18 Igualmente, se ha encontrado que la sangre de grado inhibe el crecimiento de Helicobacter pylori en concentraciones elevadas.
En este trabajo introducimos en películas de quitosano-PVA un extracto hidroalcohólico, alcohólico y acuoso de sangre de grado y evaluamos in vitro las propiedades antimicrobianas de las películas obtenidas.
PARTE EXPERIMENTAL
Materiales
El quitosano proviene de Fluka (viscosidad >400mPa.s, 1% en ácido acético al 1%), mientras que el ácido acético glacial, agar EMB, agar Pseudomonas P, agar Baird Parker, agar Casoy, caldo Casoy y agar Muller Hinton, provienen de Merck. Las cepas bacterianas: Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 y Pseudomonas aeruginosa ATCC 27853 fueron adquiridas en el Instituto Nacional de Salud, Lima, Perú. El látex de sangre de grado (Croton lechleri) fue obtenido en la ciudad de Tingo María, Perú.
En la preparación de las soluciones hidroalcohólicas se utilizó etanol de 70° destilado previamente. Estas soluciones fueron al 10%.
La irradiación gamma de las muestras se realizó con un Gammacell (MSD Nordion) (15kGy/h).
Preparación de las películas de quitosano-PVA
Se prepararon soluciones de quitosano al 1% en ácido acético 0,1M y de PVA al 10 % en agua destilada a 80ºC. Se mezclaron estas soluciones en una proporción de 4:6 (quitosano/PVA), se dispensaron 20 mL de esta solución en placas Petri (125 mm de diámetro) y se empacaron en bolsas de polietileno para ser irradiadas a 15 kGy. Luego, las películas fueron enjuagadas con agua destilada y secadas a temperatura ambiente durante cuatro días.
Preparación de las películas de quitosano-PVA conteniendo sangre de grado
Se pesó 0,1g de sangre de grado en polvo, obtenido por secado a 40°C del látex de sangre de grado (Croton lechleri), y se disolvió en 10 mL de solución hidroalcohólica al 10% (alcohol de 70º en agua bidestilada). Se cortó la película de quitosano-PVA en cuadrados de 3 x 3 cm de lado y se introdujo en las soluciones de sangre de grado por espacio de 20 minutos. Finalmente, estas películas fueron secadas a temperatura ambiente.
Prueba de actividad antimicrobiana
Se realizó por el método de difusión en agar de Bauer-Kirby, siguiendo las recomendaciones del Comité Nacional de Control de Normas de Laboratorio Clínico (NCCLS).20 Se incubaron las placas con agar Muller Hinton a 37 ºC por 24h antes de su uso. El inóculo (preparado a una turbidez equivalente a 0,5 de la escala de Mac Farland) fue aplicado sobre la placa con la ayuda de una torunda estéril, cubriendo totalmente la superficie de la placa sin dejar una zona libre. Se dejó secar de 3 a 5 minutos antes de depositar las películas embebidas cortadas en discos de 8 mm de diámetro. Se colocaron los discos sobre el medio sembrado y se añadió por encima de las películas un poco de agua estéril, para evitar que se arruguen, y se incubaron a 37ºC por 24 horas.
Determinación de la concentración mínima inhibitoria
Las películas fueron embebidas en una solución hidroalcohólica de sangre de grado a diferentes concentraciones. Para ello se pesó 0,1 g de sangre de grado en polvo y se disolvió en 10mL de solución hidroalcohólica. Se realizaron diluciones de tal modo que se cuenten con concentraciones de 0,05; 0,025 y 0,0125g/10mL. Las películas se embebieron con estas soluciones y se dejaron secar por espacio de 2 a 3 días. Luego se cortaron discos y se procedió a realizar la prueba microbiológica por el método de disco difusión. Las placas fueron incubadas por 18 a 24 horas.
RESULTADOS Y DISCUSIÓN
Preparación de las películas
Las películas obtenidas después de la irradiación con rayos gamma son transparentes con una tonalidad amarilla, lo que contrasta con las películas incoloras obtenidas sin irradiación. Este cambio no se observa cuando se obtienen películas de PVA por radiación gamma, lo que sugiere que el color proviene de alguna modificación parcial de la estructura del quitosano. Sin embargo, estos cambios no producen modificaciones observables en el espectro IR.11
Estas películas fueron enjuagadas con agua destilada para eliminar los restos de polímero no entrecruzado y se secaron a temperatura ambiente. Las películas así obtenidas presentaron mayor resistencia mecánica con respecto a las películas no irradiadas, facilitando las manipulaciones de lavados y su embebido con las soluciones de sangre de grado.
Embebido de las películas con soluciones de sangre de grado
Las películas embebidas en solución hidroalcohólica de sangre de grado aumentaron considerablemente de tamaño, adquiriendo una tonalidad rojiza (Fig. 1a). Al cabo de cinco minutos de inmersión, la solución comenzó a volverse turbia, observándose partículas blancas muy finas. La presencia de estas partículas provoca que la absorbancia de la solución de sangre de grado resultante se incremente con el tiempo en lugar de disminuir, figura 2. Después de la inmersión y secado a temperatura ambiente, la textura del hidrogel fue lisa y brillante.
Las películas PVA-quitosano también fueron embebidas en alcohol de 70º. En este caso, las películas tomaron una coloración marrón blanquecina pero no se observó aumento de tamaño. La absorbancia de la solución alcohólica de sangre de grado resultante disminuye con el tiempo durante 5 minutos. Después de este lapso la absorbancia ya no disminuye más (Fig. 2b), indicando que la película utilizada ya se saturó. Luego del secado a temperatura ambiente, la película mostró una textura acartonada y sin brillo, figura 1b. Actividad antimicrobiana
Se evaluó la actividad antimicrobiana de 7 muestras por el método de disco difusión:
- película irradiada a 15 kGy sin embeber
- película sin irradiar y sin embeber
- película irradiada y embebida en solución hidroalcohólica
- película irradiada y embebida en solución alcohólica de 70º
- película irradiada y lavado a 40ºC por 20 minutos
- látex de sangre de grado
- Solución de desinfectante tego al 0,2%
Luego de la incubación, se observó actividad antimicrobiana del látex de la sangre de grado para la cepa de S. aureus. Se observa un halo grande con difusión de sus componentes en el medio de cultivo, figura 3a. En el caso de E. coli, figura 3b, y P. aeruginosa, se observa la difusión de los componentes pero no se observa halo de inhibición.
La película embebida en la solución hidroalcohólica mostró un halo de inhibición bien marcado frente a S. aureus, figura 4a. En cambio, la que fue embebida en solución alcohólica presentó un halo más pequeño, figura 4b. El caso de la película embebida en solución acuosa de sangre de grado, el halo observado no está bien marcado, figura 4c, observándose crecimiento de colonias sobre los bordes. Se utilizó un disco de oxacilina como control positivo y una película sin embeber como control negativo. La primera mostró un halo bien marcado mientras que la segunda no mostró ninguna actividad.
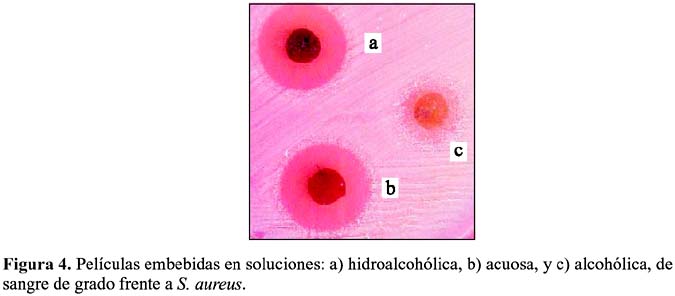
El hecho de que las películas embebidas con soluciones hidroalcohólicas de sangre de grado presenten la mejor actividad frente a S. aureus puede relacionarse con la mejor solubilidad, en comparación con las soluciones acuosas y alcohólicas, del polvo obtenido a partir del látex de la sangre de grado. Esto es una evidencia adicional de que todos los componentes del látex presentan sinergia para exhibir las propiedades microbiológicas observadas.
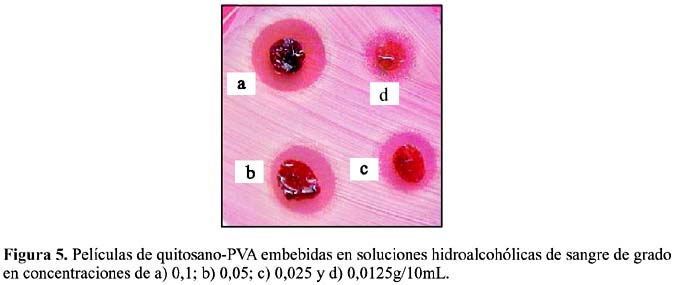
La prueba para la determinación de la concentración mínima inhibitoria de las películas embebidas en solución hidroalcohólica de sangre de grado mostró que la mínima concentración para inhibir la cepa de S. aureus es 0,025g/10mL, figura 5.
CONCLUSIONES
El látex de sangre de grado (Croton lechleri) presenta actividad antimicrobiana frente a la cepa de S. aureus. Los hidrogeles preparados en base a quitosano-PVA, entrecruzados con radiación gamma, y embebidos en solución hidroalcohólica y acuosa presentan actividad antimicrobiana frente a la cepa de S. aureus y no a las cepas de E. coli y P. aeruginosa. Los mejores resultados se obtuvieron con los hidrogeles embebidos con la solución hidroalcohólica de sangre de grado, lo cual está relacionado con la mejor solubilidad de los componentes del látex en este sistema de solventes. La concentración mínima inhibitoria frente a S. aureus es 0,025g/10mL.
AGRADECIMIENTOS
Al Ing. Juan Ruiz, Universidad Nacional de la Amazonia Peruana por la extracción, caracterización y donación del látex de sangre de grado utilizado en este estudio. Igualmente al Third World Academy of Science (TWAS) por el financiamiento parcial de este trabajo, que cubre un aspecto del proyecto de investigación: Leishmanicidal effects of Croton lechlery extract desorbed from a biopolymer.
REFERENCIAS
1. Yao Ch., Yao P., Wu H., Zha Z., Acceleration of wound healing in traumatic ulcers by absorbable collagen sponge containing recombinant basic fibroblast growth factor, Biomed. Mater. 2006; 1: 33-37.
2. Reimer K., Vogt P., Broegmann B., Hauser J., Rossbach O., Kramer A., Rudolph P., Bosse B., Schreier H., Fleischer W., An Innovative Topical Drug Formulation for Wound Healing and Infection Treatment: In vitro and in vivo Investigations of a Povidone-Iodine Liposome Hydrogel, Dermatology 2000; 201: 235-241.
3. Kili S., Tümurkaan N., Nsaldi S., Günay C., Üstek Z., Yilmaz B., Comparison Of The Effects Of Some Wound Healing Materials On Full Thickness Skin Wounds In Rabbits, Turk. J. Vet. Anim. Sci., 2002; 26: 263-272.
4. Kirker K., Luo Y., Nielson J., Shelby J, Prestwich G., Glycosaminoglycan hydrogel films as bio-interactive dressings for wound healing, Biomaterials, 2002¸23: 3661-3671.
5. Hubbell J., Hydrogel systems for barriers and local drug delivery in the control of wound healing, J. Control. Release, 1996; 39: 305-313.
6. Ishihara M., Nakanishi K., Ono K., Sato M., Kikuchi M., Saito Y., Yura H., Matsui T., Hattori H., Uenoyama M., Kurita A., Photocrosslinkable chitosan as a dressing for wound occlusion and accelerator in healing process, Biomaterials, 2002; 23: 833-840.
7. Bohl Masters K., Leibovich S., Belem P., West J., Poole-Warren L., Effects of nitric oxide releasing poly (vinyl alcohol) hydrogel dressings on dermal wound healing in diabetic mice, Wound Repair Regeneration, 2002; 10: 286.
8. Wang T., Turhan M., Gunasekaran S., Selected properties of pH-sensitive, biodegradable chitosan–poly (vinyl alcohol) hydrogel, Polym Int., 2004; 53: 911–918.
9. Khurma J., Rohindra D., Nand A., Synthesis and Properties of Hydrogels Based on Chitosan and Poly (Vinyl Alcohol) Crosslinked by Genipin, J. Macromol. Sci., A: Pure Appl. Chem., 2006; 43: 749-758.
10. Cascone M., Maltinti S., Hydrogels based on chitosan and dextran as potential drug delivery systems, J. Mater. Sci. Mater. Med., 1999; 10: 301-307.
11. Carhuapoma W., Santiago J., Preparación de hidrogeles de quitosano-PVA por radiación gamma, Rev. Soc. Quím. Perú, 2005; 71: 185-192.
12. Carhuapoma W., Santiago J., Caracterización de hidrogeles de quitosano-alcohol polivinílico obtenidos por radiación gamma, Rev. Iberoamer. Polím., 2005; 6: 333-346.
13. Rodas A., Ohnuki T., Mathor M., Lugao A., Irradiated PVAl membrane swelled with chitosan solution as dermal equivalent, Nuc. Instr. Meth. Phys. Res. B., 2005; 236: 536- 539.
14. Alemdaroglu C., Degim Z., Celebi N., Zor F., Öztürk S., Erdogan D., An investigation on burn wound healing in rats with chitosan gel formulation containing epidermal growth factor, Burns, 2006; 32: 319–327.
15. Koyano T., Minoura N., Nagura M., Kobayashi K., Attachment and growth of cultured fibroblast cells on PVA/chitosan-blended hydrogels, J. Biomed. Mater. Res., 1998; 39: 486 – 490.
16. Ran K., Chang Y., Preparation and characterization by radiation of poly (vinyl alcohol) and poly (N-vinylpyrrolidone) hydrogels containing aloe vera, J. Appl Polym. Sci., 2003; 90: 1477-1485.
17. Ubillús R., Jolad S., Bruening R., Kernan M., King S., Sesin D., SP-303, an antiviral oligomérica proanthocyanidin from the latex of Croton lechleri (sangre de drago), Phytomedicine, 1994; 1: 77-106.
18. Zapata R., Actividad antimicrobiana in vitro de la droga comercializada como sangre de grado. Tesis para optar el Título de Químico Farmacéutico. UNMSM. Lima, Perú, 1987.
19. Tamariz J., Capcha R., Palomino E., Aguilar J., Actividad antibacteriana de la sangre de grado (Croton lechleri) frente al Helicobacter pylori, Rev. Med. Hered., 2003; 81-88.
20. Performance standards of antimicrobial susceptibility testing. 2002; document N° NCCLS M100-S12, 1975.
















