Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.73 no.3 Lima July/set 2007
Empleo de arcillas modificadas para la adsorción de fenol presente en soluciones acuosas
Use of modified-clays for the adsorption of phenol from aqueous solutions
José C. Lazo1 , Abel E. Navarro2, María R. Sun-Kou1, Bertha P. Llanos3
1 Sección Química, Departamento de Ciencias, Pontificia Universidad Católica del Perú, Av. Universitaria 1801, Lima 32, Perú.
2 Chemistry Department, Graduate School of Arts and Science, New York University, New York, NY, 10003, US. E-mail: aen234@nyu.edu
3 Departamento de Química, Facultad de Ciencias y Filosofía Alberto Cazorla Tálleri, Universidad Peruana Cayetano Heredia, Av. Honorio Delgado 430, Lima 31, Perú.
RESUMEN
Se determinó el valor potencial de bentonitas modificadas con sales de amonio como adsorbentes de fenol presente en soluciones acuosas. Los resultados muestran que la adsorción está influenciada por el pH de la solución y por el tipo de sal de amonio con la que se ha intercambiado la arcilla, observando variados pH óptimos de acuerdo a la modificación de la bentonita. También se observó una mayor adsorción a mayores masas de bentonita como producto del aumento de centros de adsorción. Por otro lado, el efecto de la concentración de fenol y la masa de adsorbente muestran que las bentonitas modificadas con tetrametil amonio y benciltrimetil amonio presentan una posible adsorción por multicapas que necesita confirmarse mediante análisis estructurales, texturales e isotermas de adsorción.
Palabras clave: arcilla organofílica, fenol, pH, adsorción por multicapas.
ABSTRACT
The potential value of bentonites modified with ammonium salts as phenol adsorbents from aqueous solutions was determined. The results show a strong solution pH effect in the adsorption as well as a effect from the type of ammonium salt used for the modification, observing diverse optimum pH according to the chemical modification. A higher adsorption at higher bentonite dose was also observed as product of the increase in the number of adsorption sites. In the other hand, the phenol and adsorbent concentrations effect show that the modified bentonites with benzyltriethyl ammonium and tetramethyl ammonium present a possible multilayer adsorption that needs to be confirmed by means of structural and textural analysis and adsorption isotherms.
Keywords: Organophilic clay, phenol, pH, multilayer adsorption.
INTRODUCCIÓN
Los compuestos fenólicos son generados por la industria del petróleo y las industrias productoras de fenol1 y son considerados como contaminantes prioritarios debido a que son dañinos para la salud humana aun a bajas concentraciones2. El carbón activado es uno de los adsorbentes más efectivos para la eliminación de fenoles debido a que posee una gran área superficial por unidad de masa3,5. Sin embargo, debido a su alto costo, muchas investigaciones se centran en la búsqueda de nuevos adsorbentes de bajo costo y de rápido alcance, capaces de eliminar trazas de contaminantes orgánicos6 e inorgánicos7,8 de aguas residuales.
Recientemente, existe un creciente interés en el uso de arcillas naturales como caolinita, saponita y montmorillonita para la eliminación de metales pesados y contaminantes orgánicos presentes en soluciones acuosas9. La bentonita, es el nombre comercial de una arcilla perteneciente a la familia de las esmectitas con un alto contenido en montmorillonita y es utilizada principalmente en el blanqueamiento de aceites, pinturas y en algunos productos farmacéuticos. La abundancia de la bentonita en muchas partes del mundo y su bajo costo y sus propiedades de hidratación e intercambio iónico la convierten en un fuerte candidato para ser empleada como adsorbente en la eliminación de contaminantes10-12. Las bentonitas poseen una naturaleza hidrofílica, por lo que necesitan ser pre tratadas para incrementar su afinidad por adsorbatos hidrofóbicos. Para ello, se intercala la superficie laminar de la bentonita con moléculas orgánicas (sales de amonio cuaternario) a manera de una película superficial delgada, para incrementar las interacciones hidrofóbicas con moléculas poco polares en medio acuoso13. El objetivo del presente trabajo es investigar el valioso potencial de las arcillas del tipo bentonita, modificadas con sales de amonio, en la adsorción de fenol; así como establecer los efectos del pH y de la masa de adsorbente en el proceso de adsorción.
PARTE EXPERIMENTAL
Obtención y modificación de las arcillas tipo bentonita
Se trabajó con arcilla tipo bentonita extraída de canteras cercanas a la ciudad de Piura por la Compañía Agregados Calcáreos. Después de separar mediante sedimentación controlada, la fracción más pesada (constituida por impurezas principalmente), se intercaló una suspensión de 20 g de bentonita en 2 L de agua destilada con agitación constante por 2 h, agregándose un equivalente a 90 CIC (capacidad de intercambio iónico expresado en moles) de una determinada sal de amonio, manteniendo la mezcla en agitación durante 12 h a 25°C. Finalizado este proceso, se filtró y lavó con agua destilada, comprobándose la ausencia de cloruros o bromuros mediante la prueba con nitrato de plata. Finalmente, el producto fue secado, molido y tamizado, seleccionando el tamaño de partícula de malla número 100. Se codificó cada bentonita modificada o arcilla organofílica de acuerdo a la sal de amonio utilizada en su intercalación: B1: con tetrametil amonio, B2: con hexadeciltrimetil amonio y B3: con benciltrietil amonio.
Preparación y cuantificación de soluciones fenólicas
Se preparó una solución stock de fenol (MERCK, 99,9% pureza) de 1000 ppm en un litro de agua desionizada. Las soluciones para cada prueba de adsorción se prepararon por dilución del stock hasta obtener la concentración deseada. Se usó el método colorimétrico de Gales y Booth14 para determinar la concentración de fenol mediante el espectrofotómetro Perkin Elmer Lambda 2 a un ë=510 nm y trayecto óptico de 1 cm.
Pruebas de equilibrio
Se evaluó dos parámetros independientes en la adsorción de fenol: el efecto del pH y la masa de adsorbente. En todos los casos se tomaron por duplicado, 100 mL de la solución de fenol, se ajustó el pH con soluciones diluidas de NaOH y HCl y se mantuvo en agitación a 500 rpm durante 6 h a 25°C. Finalmente se filtró las soluciones y se determinó su concentración. La muestra control fue idéntica a las muestras descritas pero sin adsorbente.
Evaluación de los datos
La cantidad de fenol adsorbido por las arcillas fue expresado en porcentaje de adsorción mediante la ecuación
%ADS = ((Ci – Cf ) / Ci )*100,
donde Ci y Cf son la concentración inicial y en el equilibrio, respectivamente, del fenol expresada en mg/L.
RESULTADOS Y DISCUSIÓN
La figura 1 muestra el efecto del pH, observando distintos pH óptimos para cada bentonita dependiendo de su modificación, obteniendo valores de pH de 2 y 4 para las muestras B3 y B1, respectivamente, correspondientes a las arcillas intercaladas con sales de amonio de cadena corta, y un pH óptimo de 10 para las muestras B2, la cual fue intercalada con sal de amonio de cadena larga; alcanzando porcentajes de adsorción en el rango de 10-18% con las condiciones trabajadas. Rawajfih y Nsour15 obtuvieron resultados similares en la adsorción de clorofenoles mediante bentonitas modificadas, mientras que bentonitas sin modificar reportaron porcentajes más bajos16. La diferencia en pH óptimos podría deberse al tipo de interacción entre el fenol y la sal de amonio adherida a la superficie de la bentonita; por ejemplo, se postula que B2 tiene una mayor afinidad al ion fenóxido, el cual se encuentra en mayor concentración a valores altos de pH. Por otro lado, B3 tiende a unirse al fenol protonado (a valores de pH cercanos a 2) proponiéndose una interacción del tipo catión-ð y finalmente la bentonita B1, debido a que no posee fuertes interacciones hidrofóbicas ni impedimentos estéricos, retiene al fenol con mayor facilidad a pH intermedios
Las figuras 2 y 3 muestran el efecto de la masa de adsorbente en el porcentaje de adsorción a dos concentraciones iniciales de fenol; se observa en todos los casos una creciente retención de fenol a mayor masa de adsorbente en todos los casos debido a la mayor cantidad y acceso a los centros de adsorción en la superficie del adsorbente, alcanzando valores cercanos al 50%. Desde el punto de vista de la concentración de fenol, B2 presenta una mayor adsorción a menores concentraciones de fenol (50% con 100ppm de fenol versus 37% con 200ppm de fenol), esto denota una rápida saturación de la superficie de B2 en el rango de estas concentraciones. Por el contrario, B1 y B3 muestran mayor porcentaje de adsorción cuanto mayor es la concentración de fenol (20% para B1 y 10% para B3 con 100ppm de fenol versus 50% para B1 y 32% para B3 con 200ppm de fenol), que podría interpretarse mediante un mecanismo de adsorción multicapas, es decir, la formación de la primera capa en la superficie del adsorbente promueve que otras moléculas de fenol se adhieran, formando una segunda o tercera capa, debido a una fuerte y orientada interacción fenol-fenol. Como se mencionó anteriormente, la ausencia de impedimento estérico en B1 y la favorable interacción catión-ð presente en B3, podrían ser responsables de este mecanismo. Próximos estudios incluyen análisis estructurales y texturales e isotermas de adsorción para confirmar el mecanismo de adsorción y determinar otros parámetros óptimos que permitan maximizar el proceso de adsorción.
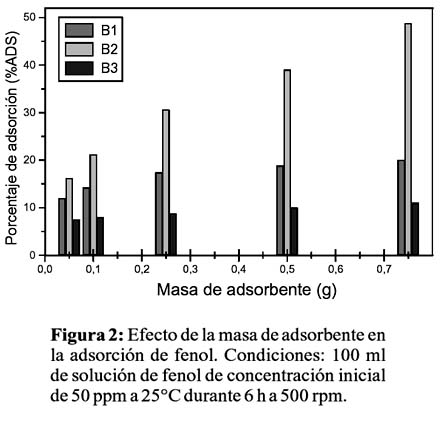
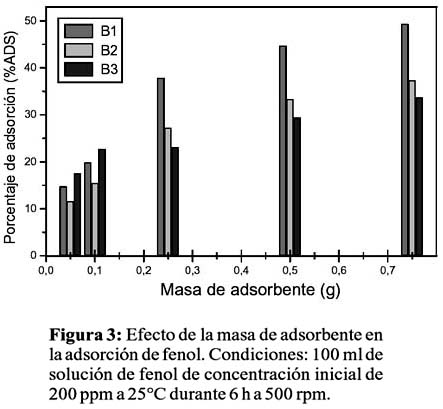
CONCLUSIONES
Los resultados de este estudio muestran que las arcillas organofílicas con sales de amino poseen una buena capacidad de adsorción para la retención de fenol presente en soluciones acuosas. El efecto del pH está influenciado por el tipo de sal de amonio empleado en la intercalación, obteniendo pH óptimos de 4, 10 y 2 para las arcillas modificadas B1, B2 y B3, respectivamente. Finalmente, el efecto de concentración de fenol y de la cantidad de adsorbente muestra una posible adsorción por multicapas que necesita confirmarse mediante análisis estructurales, texturales e isotermas de adsorción.
AGRADECIMIENTOS
Este estudio fue financiado por el proyecto 152-2006-CONCYTEC-OAJ concedido por el Consejo Nacional de Ciencias y Tecnología. Los autores deseamos agradecer a Norma Cuizano, a la Sección Química del Departamento de Ciencias de la PUCP y al Departamento de Química de la Facultad de Ciencias y Filosofía de la UPCH por el apoyo brindado en el desarrollo de este trabajo.
REFERENCIAS
1. Fang, H., Cheng, O. Water Res. 1997, 31, 2229-2242.
2. Dutta, N., Patil, G., Brothakur, S. Sep. Sci. Technol. 1992, 27, 1435.
3. Cooney, D., Xi, Z. AIChE Journal. 1994, 40, 361-364.
4. Mollah, A., Robinson, C. Water Res. 1996, 30, 2901-2907.
5. Kilduff, J., King, C. Ind. Eng. Chem. Res. 1997, 36, 1603-1613.
6. Thawornchaisit, U., Pakulanon, K. Bioresour. Technol., 2007, 98, 1, 140-144.
7. Ramos, K., Navarro, AE., Chang, L., Maldonado. Rev Soc Quím Perú., 2004, 70, 3, 136- 146.
8. Navarro, AE., Ramos, K., Campos, K., Maldonado, H. Rev. Iberoamer. Polím., 2006, 7, 2, 115-128.
9. Gutierrez, M., Fuents, H. Appl. Clay Sci., 1996, 11, 11-24.
10. Chegrouche, S., Mellah, A., Telmoune, S. Water Res., 1997, 31, 1733-1737.
11. Tuesta, E., Vivas, M., Sun-Kou, M., Gutarra, A. Rev. Soc. Quím. Perú., 2005, 71, 1, 26-36.
12. Sun-Kou, M., Sandoval, J., Terrones, C. Bol. Soc. Quím. Perú., 2000, LXVI, 4.
13. Groisman, L., Rav-Acha, C., Gerstl, Z. Appl. Clay Sci., 2004, 24, 159-166.
14. Gales, M., Booth, R. American Water Works Association, 1976, 68, 540.
15. Rawajfih, Z., Nsour, N. J. Colloid Interface Sci., 2006, 298, 1, 39-49.
16. Banat, F., Al-Bashir, B., Al-Asheh, S., Hayajneh, O. Environ. Pollut., 2000, 107, 391- 398.














